一种蛋白芯片及含其的检测模块的制作方法
本发明涉及一种蛋白芯片及含其的检测模块。
背景技术:
蛋白芯片是一种高通量的蛋白功能分析技术,可用于蛋白质表达谱分析,研究蛋白质与蛋白质的相互作用,甚至dna-蛋白质、rna-蛋白质的相互作用,筛选药物作用的蛋白靶点等。
蛋白芯片技术的研究对象是蛋白质,其原理是对固相载体进行特殊的化学处理,再将已知的蛋白分子产物固定其上,根据这些生物分子的特性,捕获能与之特异性结合的待测蛋白,经洗涤、纯化,再进行确认和生化分析;它为获得重要生命信息提供有力的技术支持。
目前蛋白芯片的载体有很多种,如玻璃片、硅片、金片等,其中玻璃由于具有廉价、表面光滑、性能稳定等诸多优点,成为现有技术中制备蛋白芯片的首选。但玻璃由于其二维结构的属性,导致其蛋白质包被量较少。
现有技术中蛋白芯片的另一常用载体则为试纸条,样品通过层析的方式在试纸条上爬行,试纸条的缺陷在于,其反应时间不可控,如较常用的sartorius品牌的cn140货号的试纸条,其层析速度为110-165s/4cm,且本底较严重,光学检测效果不佳。
硝酸纤维素膜(nitrocellulosefiltermembrane)又称为nc膜,其应用广泛,主要运用在体外诊断试剂条中。例如在胶体金试纸中,其用做c/t线的承载体,同时也是免疫反应的发生处。
目前nc膜也被应用于蛋白芯片上,该蛋白芯片法参照基因芯片制作方法制备而成。即在一个狭小的nc膜上用特殊的点样机喷上十几个乃至几十个蛋白点进行免疫分析。而由于蛋白的化学性质与dna不同,多种蛋白在一个狭小的nc膜上产生了空间相互作用,使得蛋白芯片产生了很严重的假阳性和假阴性结果。
技术实现要素:
本发明所要解决的技术问题是为了克服现有蛋白芯片的蛋白包被量少、反应时间不可控和假性结果严重的缺陷,而提供了一种蛋白质包被量高、可精准地控制反应时间、检测效果优异的蛋白芯片及含其的检测模块。
本发明通过下述技术方案来解决上述技术问题。
本发明提供一种蛋白芯片,其包括基体和设于所述基体的内部的蛋白承载膜,所述基体内具有微流控通道,所述蛋白承载膜设于所述微流控通道的流通路径上,并覆盖所述流通路径的整个横截面。
本发明中,所述基体的材质可为本领域常规,一般指不与待测样品发生反应的材质,较佳地为聚甲基丙烯酸甲酯(pmma)。
所述基体的结构可为一体或多层结构。在所述多层结构的各层之间的连接方式可为本领域常规,较佳地通过等离子键合、热压键合或粘合层胶粘的方式连接,例如双面胶胶粘。所述多层结构中的底层基体较佳地为黑色、不反光的基体材料。
本发明中,所述蛋白承载膜可为本领域常规的无背衬的蛋白承载膜,其为亲水、具有立体孔隙和可与待承载蛋白质相结合的蛋白质修饰基的膜层。其中,所述蛋白质修饰基可为本领域常规,一般指与胺反应的交联剂活性基团,较佳地为n-羟基琥珀酰亚胺酯(nhs酯)或酰亚胺酯。较佳地,所述蛋白承载膜为硝酸纤维素膜(nc膜)、聚偏氟乙烯膜(pvdf膜)或尼龙膜。所述硝酸纤维素膜的型号可选地为satoriuscn140。
较佳地,所述蛋白承载膜内填充有封闭材料,由所述封闭材料围合出所述蛋白承载膜内的所述微流控通道的结构,所述封闭材料封闭除所述微流控通道以外的区域的孔隙结构,降低样品流经蛋白承载膜时的残留,减少本底。其中,所述封闭材料可为疏水性填充材料或惰性蛋白质,较佳地为蜡或牛血清白蛋白(bsa)。
所述蛋白承载膜的形状可为本领域常规的片状,较佳地为圆形片状或方形片状。所述蛋白承载膜的个数可为一个或多个。所述蛋白承载膜为多个时,蛋白承载膜上的蛋白质修饰基可相同或不同。较佳地,多个蛋白承载膜设置在同一平面上,和/或以横向或纵向呈单列或平行多列的方式设置于基体中。较佳地,两相邻所述蛋白承载膜之间的所述微流控通道呈“s”形或“u”形。
本发明中,所述微流控通道可为本领域常规的用于处理或操纵微小流体的通道。所述微流控通道各处的内径可相同或不同。所述微流控通道的个数为一个或多个(如两个),较佳地与所述蛋白承载膜的列数相同。所述微流控通道可为直线、方形锯齿线、折线或弯曲线等形式。所述微流控通道的进样口和出样口设于基体表面,较佳地设于基体顶面。
所述微流控通道可以串联或并联的方式贯穿多个互不相连的蛋白承载膜。所述微流控通道较佳地以纵向或横向贯穿所述蛋白承载膜。较佳地,所述微流控通道及其进样口和出样口的设置可使得样品由同侧或异侧流经所述蛋白承载膜;更佳地由同侧流经所述蛋白承载膜;进一步更佳地按从上往下的方向流经所述蛋白承载膜。
本发明实例中,所述基体包括沿纵向层叠设置的若干基体层,所述微流控通道沿纵向或横向从所述蛋白承载膜穿至与所述蛋白承载膜相邻的所述基体层处。
进一步的,所述基体层上设有贯穿所述基体层的通道部,相邻的所述基体层的所述通道部之间相互连通以形成所述微流控通道。
进一步的,所述通道部包括纵向通道和/或纵向通道,所述纵向通道或横向通道与其所在的基体层相邻的基体层中的通道部连通。
本发明的蛋白芯片在使用时可配合稳定的外力,例如注射泵,通过该外力使样品的流速与所述蛋白承载膜的层析速度相同。
本发明还提供含如前所述的蛋白芯片的检测模块。所述检测模块较佳地为免疫检测模块或分子检测模块,更佳地为核酸检测模块。所述检测模块可较佳地为检测试纸,例如为核酸检测试纸。所述检测模块可较佳地还包括进样设备;更佳地,所述进样设备为注射泵。所述进样设备可控制反应时间,使所述蛋白承载膜各处的层析速度一致、各位点的检测时间可控。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:本发明的蛋白芯片和含其的检测模块蛋白质包被量高,可精准地控制蛋白质与样品的反应时间,使得操作可控,减少假性结果,并且,对同一样品可同时进行多个反应,且各反应互不干扰。本发明的蛋白芯片还可进一步提高光学检测效果、降低本底、减少待测样品的浪费。
附图说明
图1为本发明实施例1的蛋白芯片的剖面示意图。
图2为本发明实施例1的蛋白芯片的局部放大剖视图。
图3为本发明实施例1的蛋白芯片的各基体层的截面图。
图4为本发明实施例2的蛋白芯片的剖面示意图。
图5为本发明实施例2的蛋白芯片的第四基体层的截面图。
图6为本发明实施例3的蛋白芯片的剖面示意图。
图7为本发明实施例4的蛋白芯片的截面示意图。
图8为本发明实施例4放入蛋白芯片的如图7中的a-a方向的阶梯剖视图。
图9为本发明实施例6的蛋白芯片的俯视示意图。
附图标记说明:
基体1,第一基体层11,第二基体层12,第三基体层13,第四基体层14,第五基体层15,第六基体层16,第七基体层17
微流控通道2,第一通道21,第一进样通道211,第一出样通道212,第二通道22,第三通道23,第四通道24,第五通道25,第六通道26
蛋白承载膜3,蜡31
第一粘合层41,第二粘合层42,第三粘合层43
纵向方向b,横向方向c
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
下述实施例中,使用的蜡为商购自富士施乐的蜡打印机中的蜡;使用的双面胶商购自3m,型号为3m9495lse。使用的硝酸纤维素膜的型号为satoriuscn140。
实施例1
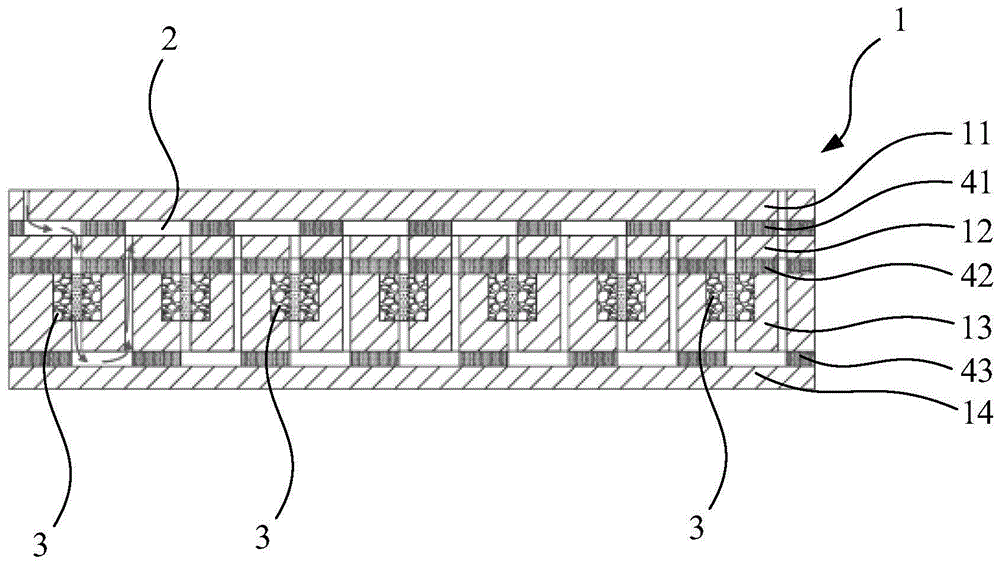
本实施例提供一种蛋白芯片,其剖面示意图如图1所示,蛋白芯片由基体1和设于基体1的内部的蛋白承载膜3组成,基体1内具有微流控通道2,蛋白承载膜3设于微流控通道2的流通路径上,并覆盖该流通路径的整个横截面。基体1为聚甲基丙烯酸甲酯(pmma)基体。本实施例中,蛋白承载膜3的数量为多个,沿横向分布在基体1内,蛋白承载膜3均为无背衬的硝酸纤维素膜(nc膜)。
其中,基体1包括由纵向方向b层叠设置的多个基体层,参见图1,从上至下依次为第一基体层11、第二基体层12、第三基体层13和第四基体层14,各基体层之间由粘合层胶粘,粘合层从上至下依次为第一粘合层41、第二粘合层42和第三粘合层43胶粘。蛋白承载膜3以横向呈单列的方式嵌于第三基体层13的上表面处。这些粘合层均为双面胶层。第四基体层14为黑色、不反光的pmma。
微流控通道2由若干通道部组成,通道部包括贯穿第一基体层11的第一通道21、贯穿第一粘合层41的第二通道22、贯穿第二基体层12的第三通道23、贯穿第二粘合层42的第四通道24、贯穿第三基体层13的第五通道25、贯穿第三粘合层43的第六通道26(参见图2),如此的结构设置,在各基体层和粘合层相互粘贴之后,在基体1内形成微流控通道2,使样品能够沿图1和图2中箭头所指的流动方向依次流经各蛋白承载膜3。其中,第一基体层11上的第一通道21的数量为两个,均为纵向通道,分别形成第一进样通道211和第一出样通道212,以供样品进出;其他通道按蛋白承载膜3相应的数量分别设置,以在基体1中形成完整的微流控通道2;各纵向通道分别与其所在的基体层相邻的基体层的通道部连通;各沿横向方向c的横向通道分别与其所在的基体层相邻的基体层的通道部连通。各基体层的截面图具体如图2所示。
该蛋白芯片,通过微流控通道2及其第一进样通道211和第一出样通道212的设置可使得样品从各蛋白承载膜3的相同一侧进入蛋白承载膜3,具体为按从上往下的方向流经蛋白承载膜3,对微流控通道2的如此流向设置可精准地使各蛋白承载膜3与样品的反应时间一致。
具体的,本实施例中,两相邻蛋白承载膜3之间的微流控通道2呈“s型”(参见图2),该“s型”的微流控通道2的两个横向通道分别为第二通道22和第六通道26,由纵向方向b依次相连的第三通道23、第四通道24和第五通道25连通,再由与第六通道26相邻的另一第五通道25与一侧的蛋白承载膜3连通、由与第二通道22相邻的另一第三通道23、及与该第三通道23相接的另一第四通道24与另一侧的蛋白承载膜连通。第一进样通道211依次通过第二通道22、第三通道23、第四通道24与蛋白承载膜3连通。第一出样通道212与蛋白承载膜3之间通过呈“j型”的微流控通道2连通(参见图1和图3)。
本实施例中,蛋白承载膜3嵌入第三基体层13的方式具体为将第三基体层13打磨出与蛋白承载膜3的厚度相同的凹槽后,将蛋白承载膜3放入凹槽中,再与其他基体层通过粘合层粘接固定。具体为:将蛋白质通过划膜或点样的方式包被在蛋白承载膜3(本实施例中为硝酸纤维素膜)上,在37℃烘干后清洗掉未结合的蛋白质,继续烘干后放入第三基体层13的凹槽中。
各基体层和粘合层在相互粘接之前的开孔方案如图3所示,通过在各基体层和粘合层上分别以激光雕刻等方式加工出对应的通道,使各基体层和粘合层在相互粘接后,组成完整的微流控通道2。
本实施例中,蛋白承载膜3内填充有封闭材料蜡31,由蜡31围合出蛋白承载膜3的微流控通道2的结构(参见图3),蜡31封闭除微流控通道2以外的区域的孔隙结构,降低样品流经蛋白承载膜3时的残留,减少本底。具体的,使用富士施乐蜡打印机打印蜡31,在设计打印的蜡的大小时需预留出蜡融化后向周围扩散的尺寸。蜡31打印完后加热使其融化,从而渗透入蛋白承载膜3的内部,封闭住无需结合蛋白的位点。
本实施例中提供蛋白芯片的使用方案:
将样品(本实施例中为血清,其蛋白缓冲液为1-100mm,ph7-7.5的磷酸缓冲盐溶液,即pbs)通过注射泵以与硝酸纤维素的层析速度相同的速度由第一进样通道211加样,样品经第二通道22、第三通道23和第四通道24流通至蛋白承载膜3,样品均从各蛋白承载膜3的相同一侧进入蛋白承载膜3,具体为按从上往下的方向流经蛋白承载膜3,使样品与蛋白承载膜3上包被的蛋白质修饰基充分接触;然后样品经在截面方向呈“s型”的微流控通道(参见图1),依次流经其余的各蛋白承载膜3,并同样与蛋白承载膜3上包被的蛋白质修饰基充分接触;最终样品经在截面方向呈“j型”的微流控通道和第一出样通道212流出。当然,本实施例中所提供的微流控通道2的延伸路径(“s型”和“j型”)仅为本实施例实现使样品流经各蛋白承载膜的较佳结构实施方案,在其他的实施例中,微流控通道2也可以沿着其他的路径方向延伸,以使样品依次流经各蛋白承载膜3。本实施例中所提供的蛋白承载膜3的个数在图1中仅为示意,具体可根据需要选择。本实施例中所提供的蛋白承载膜3的形状在图1~3中仅为示意,具体可根据需要选择,例如为圆形片状或方形片状。本实施例中的蛋白质修饰基可相同或不同。
本实施例还提供一种含本实施例的蛋白芯片的核酸检测模块:将标记了生物素的引物与标记了荧光素(如fitc)的引物与核酸样品一起扩增;在蛋白承载膜上修饰亲和素;将扩增后的样品通过泵施加力使其流经蛋白承载膜充分反应。
实施例2
本实施例还提供一种双微流控通道的蛋白芯片,其剖面示意图如图4所示,其结构与实施例1提供的蛋白芯片大致相同,在本实施例中,蛋白芯片也由基体1和设于基体1的内部的蛋白承载膜3组成,基体1内具有微流控通道2,蛋白承载膜3设于微流控通道2的流通路径上,并覆盖该流通路径的整个横截面,而不同之处在于,如图4所示,蛋白芯片的基体包括七个基体层。从上至下依次为第一基体层11、第二基体层12、第三基体层13和第四基体层14、第五基体层15、第六基体层16和第七基体层17,各基体层间不设有粘合层,以热压键合的方式连接,并以激光雕刻等方式加工出对应通道,蛋白芯片中有多个蛋白承载膜3,这些蛋白承载膜3以平行的双通道方式设置于第四基体层14中(参见图5)。如此的结构布局,使本实施例的蛋白芯片在使用时可同时检测多组样品。
此外,为降低各蛋白承载膜3之间的水平间距,两相邻蛋白承载膜3之间的微流控通道2呈“u型”,使得两相邻蛋白承载膜3之间不存在纵向延伸的通道。因此,在使用该蛋白芯片时,样品从蛋白承载膜3的相异侧进入蛋白承载膜3,具体为间隔地按从上往下的方向和从下往上的方向依次流经各蛋白承载膜3。本实施例中所提供的蛋白承载膜的个数在图4中仅为示意,具体可根据需要选择。本实施例中所提供的蛋白承载膜3的形状在图4中仅为示意,具体可根据需要选择,例如为圆形片状或方形片状。本实施例中的蛋白质修饰基可相同或不同。
实施例3
本实施例还提供一种蛋白芯片,其剖面示意图如图6所示,其结构与实施例2提供的蛋白芯片大致相同,两相邻蛋白承载膜3之间的微流控通道2呈“u型”,使得两相邻蛋白承载膜3之间不存在纵向延伸的通道。而不同之处在于,如图6所示,蛋白芯片的基体包括三个基体层,从上至下依次为第一基体层11、第二基体层12和第三基体层13,各基体层间不设有粘合层,而是以等离子键合的方式连接,第一基体层11和第二基体层12以激光雕刻等方式加工出对应通道,组成完整的微流控通道2。在蛋白芯片中有多个蛋白承载膜3,均嵌设于第二基体层12的内部。如此的蛋白芯片设计,简化了蛋白芯片的结构。本实施例中所提供的蛋白承载膜的个数在图6中仅为示意,具体可根据需要选择。本实施例中,蛋白承载膜3为聚偏氟乙烯膜,封闭材料为牛血清白蛋白。本实施例中所提供的蛋白承载膜3的形状在图6中仅为示意,具体可根据需要选择,例如为圆形片状或方形片状。本实施例中的蛋白质修饰基可相同或不同。
实施例4
本实施例还提供一种蛋白芯片,其结构与实施例3提供的蛋白芯片大致相同,如图7所示,蛋白芯片也由基体1和设于基体1的内部的蛋白承载膜3组成,基体1内具有微流控通道2,蛋白承载膜3设于微流控通道2的流通路径上,并覆盖该流通路径的整个横截面,而不同之处在于,如图8所示,本实施例的蛋白芯片共设有两个基体层,即第一基体层11和第二基体层12,两个基体层之间嵌有多个蛋白承载膜3,微流控通道2呈直线横向贯穿蛋白承载膜3,样品依次横向流经蛋白承载膜3。图8分别展示了图7中的蛋白承载膜3被蜡封闭的区域的剖视图(参见图8左侧的蛋白承载膜)和作为微流控通道的一部分的剖视图(参见图8右侧的蛋白承载膜)。本实施例中所提供的蛋白承载膜的个数在图7~8中仅为示意,具体可根据需要选择。本实施例中,蛋白承载膜3为尼龙膜。本实施例中所提供的蛋白承载膜3的形状在图7~8中仅为示意,具体可根据需要选择,例如为圆形片状或方形片状。本实施例中的蛋白质修饰基可相同或不同。
实施例5
本实施例还提供一种蛋白芯片,其结构与实施例4提供的蛋白芯片大致相同,蛋白芯片也由基体和设于基体的内部的蛋白承载膜组成,基体内具有微流控通道,蛋白承载膜设于微流控通道的流通路径上,并覆盖该流通路径的整个横截面,基体之间嵌设有多个蛋白承载膜,微流控通道呈直线横向贯穿蛋白承载膜,样品依次横向流经蛋白承载膜,不同之处在于,本实施例的蛋白芯片的基体为一体化基体,通过3d打印的方式加工出与实施例4相同的微流控通道。本实施例中所提供的蛋白承载膜的个数可根据需要选择。本实施例中所提供的蛋白承载膜的形状具体可根据需要选择,例如为圆形片状或方形片状。本实施例中的蛋白质修饰基可相同或不同。
实施例6
本实施例还提供一种蛋白芯片,其结构与实施例2提供的蛋白芯片大致相同,在本实施例中,蛋白芯片也为双微流控通道的蛋白芯片,而不同之处在于,如图9所示,双微流控通道以并联的方式连接,共用一个进样口,每一微流控通道设有独立的出样口。本实施例中所提供的蛋白承载膜的个数在图9中仅为示意,具体可根据需要选择。本实施例中所提供的蛋白承载膜的形状具体可根据需要选择,例如为圆形片状或方形片状。本实施例中的蛋白质修饰基可相同或不同。
- 还没有人留言评论。精彩留言会获得点赞!