一种La/Co@TiO2纳米球催化剂及其制备方法与应用
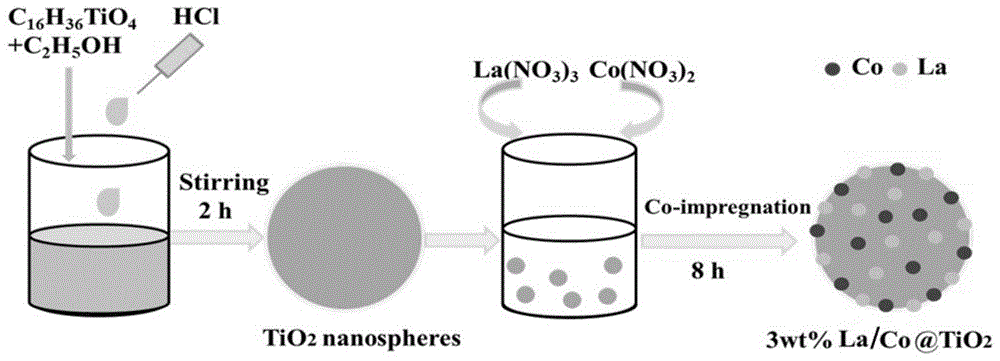
本发明涉及光催化剂技术领域,具体涉及一种la/co@tio2纳米球催化剂及其制备方法与应用。
背景技术:
有机废水对环境和人体健康存在着潜在危害,如何高效的净化有机废水成为环境领域的研究热点。传统的物理吸附、微生物降解和催化氧化技术无法完全消除废水中的有机物,然而,光催化技术在净化废水方面效果突出。众所周知,污水中存在大量分子氧氧化剂,但是,由于o2自旋禁止双电子还原,污水中大多数有机污染物不能被氧化。研究表明,光催化技术可以激发半导体表面的氧分子使其活化成为活性氧物质(ros),这些活性氧物质(o2-,·oh,1o2)可以在光照条件下与有效活性位点相结合直接攻击有机污染物达到净化有机废水的效果。光催化技术的关键是激发o2活性促进光生电子-空穴的转移,在光催化剂表面形成更多的表面氧空位(ovs)来提高光催化效率。
表面氧空位能够捕获光生电子的载流子体,扩大光吸收范围,加速o2在光催化剂表面的活化和吸附作用,但是过多的表面氧空位会导致光生电子-空穴的复合,降低光催化效率。tio2具有无毒,无污染,强氧化的优点,它被视为净化有机废水的最有吸引力的选择。然而,由于tio2自身固有缺陷导致光催化效率低和可见光活性差。为了克服上述缺点,科研人员通过改性tio2,包括金属和非金属掺杂表面改性和半导体复合等方法有效提高光激发载电子流的分离和抑制光生电子-空穴的复合解决上述难题。
双金属活性位点与表面氧空位相互协同作用提高光催化效率研究少之又少。目前,大部分光催化剂是以tio2为基础进行负载、改性及复合等方法制备,但是由于催化剂自身条件的限制,该类光催化剂易出现光生电子和自身空穴易发生复合,导致催化剂表面的活性位点丢失,进而降低光催化效率,阻碍了其进一步发展。因此对光催化剂进行改性来制备出高效率的光催化剂势在必行。
技术实现要素:
本发明的目的是提供一种la/co@tio2纳米球催化剂及其制备方法与应用,制备条件温和,操作过程简单,光催化降解效率高。
本发明的目的可以通过以下技术方案来实现:一种la/co@tio2纳米球催化剂的制备方法,采用溶胶-凝胶法制备出tio2纳米球溶胶溶液,洗涤、干燥和高温退火,得到tio2纳米球,然后将镧源和钴源通过共浸渍法负载到tio2上,煅烧后得到la/co@tio2纳米球催化剂。
过渡金属可以降低tio2的带隙值,扩展吸收边缘至可见光区,稀土元素具有特殊的4f电子轨道,可以捕获光生电子的载流子来提高光催化效率。过渡金属和稀土元素与tio2表面的氧结合形成金属氧化物作为助催化剂,既激活了o2活性,增加催化剂表面的氧空位,又加快了光生电子-空穴的分离和界面处的电荷转移。通过稀土元素改性可以促进tio2的能带边缘发生红移,从而提高光催化效率,la元素是光催化过程中最有效的稀土金属,la的掺杂可以提高有机化合物的光催化降解效率和吸附能力。此外,通过co改性的tio2具有能带低,光响应范围扩展到红外光区,光催化活性高等优点。
本发明以tio2纳米球为载体,具有高比表面积、高稳定性和大量表面氧空位等特点,其上可稳定负载稀土金属la和过渡金属co粒子,由于金属co/la和tio2表面的o分子结合生成氧化物,导致tio2表面会产生大量的氧空位。在可见光条件下金属co/la可快速传输电子(e-),同时tio2也会进行光激发电子快速传输产生大量的表面氧空位,环境中的氧分子在光生电子的条件下被活化成活性氧(o2-),同时h2o也会和空穴(h+)结合生成·oh,最终,(o2-)、(h+)和·oh共同去攻击有机污染物,这样金属co/la活性位点与氧空位之间的协同作用即克服了o2自身固有缺陷、单一催化剂催化效果不佳的问题,也降低了光生电子和空穴的复合率,增加了o2的活化,从而增强光敏性和光催化效率。
进一步地,具体包括以下步骤:
(1)将钛酸四丁酯与无水乙醇混合,逐滴滴加hcl溶液,室温搅拌,静置,离心洗涤,干燥过夜,在马弗炉中高温退火,制备出tio2纳米球催化剂;
(2)将步骤(1)制备的tio2和聚乙烯吡咯烷(pvp)酮混合,超声,依次加入六水合硝酸镧(la(no)3·6h2o)和六水合硝酸钴(co(no)3·6h2o),继续超声,将混合物转移到至水浴锅中,搅拌,冷却离心,最后在管式炉中高温退火,得到la/co@tio2纳米球催化剂。
本发明以六水合硝酸镧和六水合硝酸钴分别作为镧源和钴源,以聚乙烯吡咯烷为交联剂和分散剂,能够使溶液中金属更好地分散和更容易的锚定在tio2纳米球的表面。
优选地,步骤(1)所述的hcl溶液的浓度为0.2mol/l,钛酸四丁酯、无水乙醇和hcl溶液的体积比为1:20~30:15~25,优选为1:25:20。
本发明通过钛酸四丁酯、无水乙醇和hcl溶液的体积比的选择,使制备出的tio2纳米球具有高稳定性和高比表面积,通过hcl溶液浓度的选择,调节tio2纳米球的粒径大小;通过控制钛酸四丁酯和无水乙醇的量,调节tio2纳米球的稳定性和比表面积。
优选地,步骤(1)所述的搅拌时间为100~140min,室温静置22~26h,干燥温度为110~130℃,干燥时间为11~13h。
优选地,步骤(1)所述的高温退火在惰性气体保护下进行,退火温度为440~460℃,加热速度为4~6k·min-1,退火时间为3.5~4.5h。
优选地,步骤(2)所述的六水合硝酸镧、六水合硝酸钴、tio2和聚乙烯吡咯烷酮的质量比为3.1~9.2:4.9~14.7:100:100。水浴温度为70~75℃,搅拌时间为6~10h。六水合硝酸镧、六水合硝酸钴、tio2和聚乙烯吡咯烷酮的添加量使得镧元素、钴元素、tio2和聚乙烯吡咯烷酮的质量比为1~3:1~3:100:100。聚乙烯吡咯烷酮与tio2等质量添加,可以使tio2纳米球充分分散在溶剂中,并且能够使金属更好地锚定在tio2纳米球的表面。
优选地,步骤(2)所述的高温退火在惰性气体保护下进行,退火温度为350~750℃,加热速度为3~5k·min-1,退火时间为2~6h。高温退火过程会使金属更好地锚定在tio2纳米球的表面,能够制备出不同晶胞类型的tio2。退火温度优选为450℃,当退火温度过高会使金属活性位点发生烧结,从而影金属响活性位点在光照下与表面氧空位之间的协同作用,还会使制备的锐钛矿型tio2晶胞类型朝着金红石转变,从而降低光催化效率,当退火温度过低,会使部分金属不能完全负载或者负载不稳定,生成的锐钛矿晶胞类型也不能完全生长,在光照过程中会出现光生电子-空穴转移不规律的现状,从而降低光催化效率。
一种la/co@tio2纳米球催化剂,采用上述方法制备而成。
优选地,所述的催化剂中,la、co和tio2的质量比为1.5:1.5:100。即la和co的质量比为1:1,la、co的总质量为tio2的3%。tio2上la和co的负载量不宜过高或过低,过低影响催化效率,过高则会出现金属间的团聚,la和co的负载量相近时,可更好地发挥两者之间的协同作用,来提高光催化效率。
一种上述la/co@tio2纳米球催化剂的应用,将所述的la/co@tio2纳米球催化剂作为光催化剂,用于有机污染物的光催化降解反应。所述的有机污染物包括亚甲基蓝和甲基橙。
与现有技术相比,本发明具有以下优点:
1.本发明通过金属la/co活性位点与氧空位之间的协同作用使tio2表面缺陷增加,在可见光条件下金属co/la可快速传输电子(e-),同时tio2也会进行光激发电子快速传输同时产生大量的表面氧空位,环境中的氧分子在光生电子的条件下被活化成活性氧(o2-),同时h2o也会和空穴(h+)结合生成·oh,最终,(o2-)、(h+)和·oh共同去攻击有机污染物从而提高光催化效率;
2.与传统的tio2、co@tio2及la@tio2单一催化剂相比,本发明中的双金属la/co@tio2纳米球催化剂弥补了单一催化剂的不稳定性、活性位点少、表面氧空位少、光生电子和空穴复合等问题,显著提高了催化效率,拓展了双金属la/co@tio2纳米球催化剂在光催化领域的应用;
3.与现有技术中的tio2基光催化剂相比,本发明光催化效率高,在12min内即可实现有机污染物的完全催化降解;
4.本发明方法制备的纳米球催化剂颗粒分布均匀,在催化前后形貌不发生明显变化,晶胞类型不发生变化,催化剂催化后仍具有高稳定性,可循环利用性强;
5.本发明催化剂性能优异,在可见光区域有较高的光催化活性,具有较高的电荷载流子的分离和迁移效率;
6.本发明制备条件温和,操作过程简单,光催化降解效率高,所制备的双金属la/co@tio2纳米球催化剂具有大量的金属活性位点和表面氧空位(ovs),弥补了单一催化剂的不稳定性、金属活性位点少、活性氧活化率低以及光生电子和空穴复合问题,显著提高了催化效率,循环利用过程中降解能力基本保持不变,经济环保,可广泛应用于低浓度有机废水的降解回收利用,拓展双金属la/co@tio2纳米球催化剂在光催化领域的应用。
附图说明
图1为本发明一种双金属la/co@tio2纳米球催化剂的制备流程图;
图2中的a,b和c分别为tio2纳米球、3wt%co@tio2纳米球、3wt%la@tio2纳米球的透射电镜(tem)图;
图3中的a为新鲜双金属la/co@tio2纳米球催化剂透射电镜(tem)图、b为对应的haadf图,c为对应的晶胞图,d为对应的双金属元素co和la图;
图4为废旧的双金属3wt%la/co@tio2纳米球的tem图;
图5为双金属3wt%la/co@tio2纳米球的x射线能谱(eds)图;
图6中的a为不同催化剂的xrd图,b为3wt%la/co@tio2纳米球催化剂催化前后xrd对比图;
图7为不同催化剂的拉曼图;
图8为3wt%la/co@tio2纳米球催化剂催化前后的xps图;
图9为不同催化剂的紫外-可见漫反射图谱(uv-visdrs);
图10为不同催化剂在375nm处的光致发光图;
图11为不同催化剂的瞬态光电流图;
图12为不同催化剂的奈奎斯特(eis)图;
图13为不同催化剂的莫特-肖特基(ms)图;
图14为不同催化剂在可见光下对亚甲基蓝(10mg/l)的降解曲线和对应的拟一级动力学曲线图;
图15为不同催化剂在可见光下对甲基橙(10mg/l)的降解曲线和对应的拟一级动力学曲线图;
图16为一种la/co@tio2纳米球催化剂的工作原理图。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明。以下实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1
一种双金属la/co@tio2纳米球催化剂的制备方法,包括:
1)tio2纳米球制备:将2ml钛酸四丁酯与50ml无水乙醇混合,超声分散,然后逐滴滴加40mlhcl(0.2mol/l)溶液,室温搅拌2h,静置24h,离心洗涤,120℃干燥过夜,最后在氮气和氢气的氛围下,以5k·min-1的加热速度在马弗炉中450℃退火4h,制备出tio2纳米球催化剂。
2)双金属la/co@tio2制备:将上述制备的1.0gtio2和1.0g聚乙烯吡咯烷酮(pvp)粉末首先分散在150ml超纯水中,超声分散后,依次加入(la(no)3·6h2o)(48mg)和(co(no)3·6h2o)(72mg),继续超声10min,将混合物转移到72℃的水浴中,搅拌8h。冷却后离心,最后在氮气和氢气的氛围下,以3k·min-1的加热速度,将样品在450℃的管式炉中退火4h,得到3wt%la/co@tio2(co:la=1:1)。制备流程如图1所示。
实施例2~7和对比例1~3
实施例2~7和对比例1~3中部分反应条件如表1所示,其余同实施例1。
表1
对实施例1所制备的3wt%la/co@tio2,实施例6~7和对比例1~3所制备的2wt%la/co@tio2,1wt%la/co@tio2,3wt%co@tio2,3wt%la@tio2,tio2进行表征测试,具体如下:
(1)icp-oes分析:
表2不同催化剂icp-oes分析结果
由上表可知,实施例1制备的3wt%la/co@tio2中co和la的质量比相同,均为tio2的1.5%左右,co和la的总质量为tio2的3%左右,废旧的3wt%la/co@tio2与新鲜的3wt%la/co@tio2相比co和la的损耗不大,表明实施例1制备的3wt%la/co@tio2具有良好的稳定性。
(2)tem测试:
tio2纳米球、3wt%co@tio2纳米球、3wt%la@tio2纳米球的tem如图2中a,b,c所示,可以看出制备的tio2、3wt%co@tio2和3wt%la@tio2纳米球颗粒分布均匀,尺寸为20nm左右。
新鲜和废旧的双金属3wt%la/co@tio2纳米球的tem如图3中a和图4中a所示,可以看出催化前后催化剂的形貌没有发生明显的变化,依旧是分散均匀的球状颗粒,尺寸为20nm左右。从图3中b可以看出双金属3wt%la/co@tio2为球状结构,图3中c为晶胞结构,可以看出在tio2表面形成了金属氧化物(coo和la2o3),图3中d显示了金属co/la均匀的分散到tio2表面。
(3)eds元素分析:
图5中b为双金属3wt%la/co@tio2纳米球的eds图谱,可以清楚地看到金属co/la成功的负载到tio2表面。
(4)xrd测试:
图6中的a显示了未掺杂,co,la单掺杂和co,la共掺杂的tio2衍射图,位于2θ为25.4°,38.11°,48.43°,52.21°,55.38°和62.02°的峰分别对应于锐钛矿型(jcpds21-1272)tio2晶面(101),(104),(200),(105),(211)和(204)的特征峰。从图6中的b可以看出3wt%la/co@tio2催化前后晶胞类型没有发生变化,证明了催化剂催化后仍具有高稳定性。
(5)拉曼光谱分析:
图7显示了3wt%la/co@tio2,2wt%la/co@tio2,1wt%la/co@tio2,3wt%co@tio2,3wt%la@tio2和tio2在141cm-1,195cm-1,396cm-1,514cm-1和638cm-1处观察到eg,eg,b1g,a1g和eg振动模式为锐钛矿型tio2的特征峰,这与xrd结果一致。
(6)xps光谱分析:
图8显示了3wt%la/co@tio2纳米球催化前后的xps光谱,可以看出3wt%la/co@tio2催化前后元素的电子态没有发生变化,这一点和xrd一致,证明了催化剂的高稳定性。
(7)uv-visdrs光谱分析:
图9显示了uv-visdrs图,未掺杂和单掺杂催化剂在λ<400nm处有较强的吸收能力,然而3wt%la/co@tio2纳米球在λ>400nm有较强的吸收能力,表明3wt%la/co@tio2纳米球吸收峰发生了红移并延伸到可见光区,这归因于双金属co,la的协同作用。
(8)pl光谱分析:
图10显示了不同催化剂在激发波长为375nm的pl光谱图,可以看出所有的样品都具有相似的特征峰和曲线形状,表明金属co,la的掺杂没有引起新的pl信号,证明了co,la并没有进入tio2晶胞内,而是在表面形成coo和la2o3,这一点与xrd与xps结果一致。在tio2的掺杂剂体系中,激子pl光谱越弱,光致电子-空穴的分离率越高。由此可知,3wt%la/co@tio2纳米球低发射pl强度在可见光区域有较高的光催化活性。
(9)瞬态光电流测试:
图11为催化剂的光电流-时间曲线,与纯tio2,3wt%co@tio2和3wt%la@tio2相比,3wt%la/co@tio2的光电流响应明显增强,瞬态光电流曲线响应强度越高,代表电荷的分离效率越高,说明3wt%la/co@tio2具有较高的电荷载流子的分离和迁移效率。
(10)奈奎斯特测试:
图12为催化剂的eis奈奎斯特和等效电路图,其中rs和ret分别是电解液的电阻和界面电荷转移的电阻,3wt%la/co@tio2显示出较小的圆弧,说明3wt%la/co@tio2可以有效地从电极到电解质分子界面降低电荷转移的电阻,表明3wt%la/co@tio2有利于电荷的转移。
(11)莫特-肖特基测试:
图13为莫特-肖特基曲线,图中曲线的斜率为正值,可以确定3wt%la/co@tio2为n型半导体。根据莫特-肖特基曲线对催化剂载流子密度和平带电位进行估算,3wt%la/co@tio2(4.31×1022cm-3)的电荷密度远大于纯tio2(7.3×1021cm-3),表明前者载流子体的转移速率更快,所以光催化效率更高。
(12)光催化降解能力测试:
将实施例1制备的3wt%la/co@tio2,实施例6~7和对比例1~3所制备的2wt%la/co@tio2,1wt%la/co@tio2,3wt%co@tio2,3wt%la@tio2,tio2用于催化降解有机污染物亚甲基蓝和甲基橙,具体催化过程如下:
分别取20mg催化剂于两个150ml石英管中,向石英管中加入10mg/l亚甲基蓝和10mg/l甲基橙溶液,在黑暗条件下磁力搅拌下60min以达到吸附-解吸平衡,然后打开冷凝水循环系统和反应器,在500w汞灯条件下进行光催化降解,取样间隔4min,采用0.22μm针头过滤器过滤上清液,使用紫外分光光度计测量吸光度,并计算去除率,结果如图14和15所示。
图14为不同催化剂在可见光下对亚甲基蓝(10mg/l)的降解曲线和对应的拟一级动力学曲线图;
图15为不同催化剂在可见光下对甲基橙(10mg/l)的降解曲线和对应的拟一级动力学曲线图。
从图上可知,掺杂有co和/或la的tio2的光催化效率要显著优于tio2,且共掺杂有双金属co和la的tio2催化效率高于单掺杂的tio2,其中,3wt%la/co@tio2的催化效率最高,在12min内即可基本完成对有机污染物亚甲基蓝或甲基橙的催化降解。
双金属la/co@tio2的工作原理如图16所示,在可见光条件下金属co/la可快速传输电子(e-),同时tio2也会进行光激发电子快速传输产生大量的表面氧空位,环境中的氧分子在光生电子的条件下被活化成活性氧(o2-),同时h2o也会和空穴(h+)结合生成·oh,最终,(o2-)、(h+)和·oh共同去攻击有机污染物,这样金属co/la活性位点与氧空位之间的协同作用即克服了o2自身固有缺陷、单一催化剂催化效果不佳的问题,也降低了光生电子和空穴的复合率,增加了o2的活化,从而增强光敏性和光催化效率。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!