一种分子印迹及包覆聚合物、其制备方法及用途
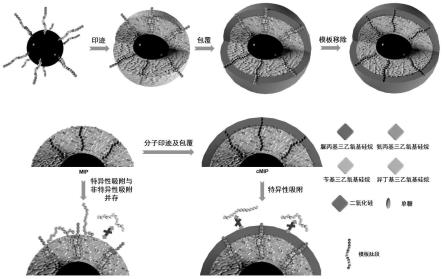
1.本发明属于仿生分子识别材料和分子印迹技术领域,涉及一种能专一识别特定目标物(例如蛋白质或多肽)的分子印迹及包覆聚合物,制备该分子印迹及包覆聚合物的可控、通用、便捷的方法,以及该分子印迹及包覆聚合物的用途。
背景技术:
2.抗体作为人体免疫系统中的最后一道防线,是生物体抵御病毒和微生物等有害物质入侵的重要武器,在生命科学研究领域中被广泛用于生物分子识别。然而,抗体存在着明显的局限性,其制备工艺复杂、成本高昂、筛选周期长,有时甚至无法得到。此外,抗体的稳定性和重复性也存在问题。因此,寻找抗体的替代物不仅具有重要科学意义,而且具有巨大的经济价值。
3.分子印迹聚合物(mips)[angew.chem.int.ed.engl.1972,11,341-345;nature1993,361,645-647]是在模板存在下通过共聚反应合成的具有抗体结合性能的化学合成受体。与抗体相比,分子印迹聚合物具有制备简单、成本低廉、结构稳定、耐受各种恶劣环境等优点。因此,已被广泛应用于分离、传感、蛋白质组学、生物成像、控制药物释放和纳米医学等领域。尽管分子印迹技术已取得显著的进步,但传统的分子印迹技术仍存在内在缺陷。为了获得对模板分子的高特异性和强亲和力,通常需要采用能与模板分子相互作用的多种功能单体与交联剂聚合构建印迹空腔,所得印迹空腔在形状、大小和相互作用位点等方面刚好和模板分子互补,从而得到能高特异性和强亲和力的结合空腔。然而本发明人发现,由于印迹空腔外的非印迹表面也是由与印迹空腔的种类和比例相同的单体和交联剂构建,因而存在显著的非特异相互作用位点,在实际使用过程中会导致明显的交叉反应性。由此,传统的分子印迹聚合物无法同时提供最佳的亲和力和最佳的特异性,而是在二者之间折中。
技术实现要素:
[0004]
针对现有分子印迹技术中存在的上述技术问题,本发明人通过研究开发了一种可控、通用、便捷的分子印迹及包覆聚合物的制备方法,其中利用可控印迹技术以非特异相互作用微弱聚合试剂(例如原硅酸四乙酯)作为包覆试剂对分子印迹材料(包括通过常规分子印迹技术得到的分子印迹聚合物)表面进行包覆并参与模板印迹,由此形成一层薄的包覆层降低了印迹材料表面非印迹区域的非特异吸附,从而使得到的分子印迹及包覆聚合物的非特异相互作用位点显著降低,并同时提高了对靶分子的特异性和亲和力两者。
[0005]
一方面,本发明提供了一种通过两次分子印迹制备分子印迹及包覆聚合物的方法,其中,所述方法包括:使经过第一次印迹后得到的分子印迹材料与生物兼容性好的聚合试剂接触,以在所述分子印迹材料的印迹层上进行第二次印迹,形成包覆层。
[0006]
另一方面,本发明提供了一种分子印迹及包覆聚合物,包括:
[0007]
印迹层,以及
[0008]
包覆层,其中,所述包覆层位于所述印迹层的外表面上。
[0009]
又一方面,本发明涉及上述的分子印迹及包覆聚合物在制备用于识别靶分子或靶细胞的制剂中的用途。
[0010]
本发明的上述制备方法涉及如下两次印迹:第一次定向印迹涉及利用与模板分子相互作用的单体硅烷化试剂和交联剂对模板分子进行印迹处理,用于构建良好的印迹空腔,从而获得强亲和力和高特异性;第二次定向印迹(即,包覆印迹)涉及利用非特异相互作用微弱聚合试剂在分子印迹层表面形成厚度可控的包覆薄层,用于覆盖印迹层外的非特异作用位点,从而进一步提高专一性(特异性),此外,由于包覆层引起印迹层对模板分子上更多氨基酸残基的空间匹配识别,也同时提高了亲和力。就这方面而言,目前尚未有类似文献和专利报道。
[0011]
本发明的上述制备方法不需要提供或制备目标蛋白的纯品,而只需要知道蛋白质的氨基酸结构序列信息,即可利用化学合成手段获得糖化表位模板,通过对该糖化表位模板进行两次印迹,可制备得到特异性更高、亲和力更强的分子印迹及包覆聚合物。该方法具有普适性强、模板可通过固相合成容易获得、且基底材料种类不受限制等优点,是一种通用性好、应用性强的分子印迹及包覆聚合物制备技术。通过本发明上述方法制备的分子印迹及包覆聚合物能够特异性识别、结合和富集目标蛋白质及其表位。其中的印迹模板为糖化表位,而非完整的目标蛋白。本发明采用蛋白表位糖化处理,突破了表位选取的局限性,而且拓宽了基底材料的种类,与现有的蛋白质印迹技术相比,首次针对目标蛋白的表位序列采用不同种类和比例的单体硅烷化试剂和交联剂进行第一次定向印迹,然后采用非特异相互作用微弱聚合试剂进行第二次定向印迹(又称包覆印迹),不仅显著提高了分子印迹材料的特异性,而且增强了亲和力。本发明所得的分子印迹及包覆聚合物可以识别蛋白质和多肽,不仅具有强的亲和力,而且具有高的专一性(特异性),从而可以在亲和分离、生化分析、靶向识别和生物成像等领域中展现出良好的应用潜力。
附图说明
[0012]
图1为本发明的示例性的制备分子印迹及包覆聚合物的方法的原理示意图。
[0013]
图2示出了β
2-微球蛋白(b2m)(a)、转铁蛋白(trf)(b)和转铁蛋白受体蛋白(tfr)(c)的c端糖化表位的化学结构,甲胎蛋白(afp)(d)和癌胚抗原(cea)的n端糖化表位(e)的化学结构,以及c肽(c-peptide)的c端糖化表位(f)和n端糖化表位(g)的化学结构。
[0014]
图3为采用不同基底材料的分子印迹及包覆聚合物的透射电子显微镜(tem)照片。其中a为实施例2中制备的分子印迹及包覆的磁纳米粒子的tem照片,b为实施例7中制备的分子印迹及包覆的银纳米粒子的tem照片,c为实施例9中制备的分子印迹及包覆的fitc掺杂的二氧化硅纳米粒子的tem照片。
[0015]
图4示出了硼酸功能化的磁纳米粒子对不同分析物的选择性,其中,分析物分别为腺苷和脱氧腺苷(a);b2m、trf和tfr的c端表位,afp和cea的n端表位以及它们相应的糖化表位(b)。
[0016]
图5示出了在最优印迹时间下采用不同比例的单体硅烷化试剂和交联剂制备的b2m的c端表位单次印迹的磁纳米粒子的最优印迹因子(a)和b2m的c端表位分子印迹及包覆的磁纳米粒子(b)的最优印迹因子。
[0017]
图6示出了在最优印迹时间下采用不同比例的单体硅烷化试剂和交联剂制备的b2m的c端表位单次印迹的磁纳米粒子(a)和b2m的c端表位分子印迹及包覆的磁纳米粒子(b)的亲和力。
[0018]
图7为b2m的c端表位分子印迹及包覆的磁纳米粒子在肽段水平(a)和蛋白水平(b)的选择性。
[0019]
图8为针对不同蛋白的c端表位,本发明的制备分子印迹及包覆聚合物的方法的通用性的考察结果,其中,分别示出由此制备的trf的c端表位分子印迹及包覆的磁纳米粒子的印迹条件优化结果(a)及其在肽段水平(c)和蛋白水平(e)的选择性;tfr的c端表位分子印迹及包覆的磁纳米粒子的印迹条件优化结果(b)及其在肽段水平(d)和蛋白水平(f)的选择性。
[0020]
图9为针对不同蛋白的n端表位,本发明的制备分子印迹及包覆聚合物的方法的通用性的考察结果,其中,分别示出由此制备的afp的n端表位分子印迹及包覆的磁纳米粒子的印迹条件优化结果(a)及其在肽段水平(c)和蛋白水平(e)的选择性;cea的n端表位分子印迹及包覆的磁纳米粒子的印迹条件优化结果(b)及其在肽段水平(d)和蛋白水平(f)的选择性。
[0021]
图10示出了采用tfr的c端表位分子印迹及包覆的fitc掺杂的二氧化硅纳米粒子和非印迹的fitc掺杂的二氧化硅纳米粒子分别对mcf-7、mcf-10a、hepg2和l-02细胞染色后进行共聚焦成像,其中纳米粒子的浓度为200μg/ml。
具体实施方式
[0022]
下面通过示例性的具体实施方式对本发明作进一步的详细说明,但是本发明的保护范围并不仅限于此。
[0023]
在一个实施方式中,本发明提供了一种通过两次分子印迹制备分子印迹及包覆聚合物的方法,其中,所述方法包括:使经过第一次印迹后得到的分子印迹材料与生物兼容性好的聚合试剂接触,以在所述分子印迹材料的印迹层上进行第二次印迹,形成包覆层。
[0024]
在一些优选的实施方式中,上述制备分子印迹及包覆聚合物的方法还包括:将印迹模板锚定至基底材料的表面上,然后加入一种或多种单体硅烷化试剂以及交联剂以在所述基底材料上进行所述第一次印迹,形成印迹层,得到包含所述印迹层的所述分子印迹材料。
[0025]
在一些优选的实施方式中,所述交联剂为原硅酸四乙酯或原硅酸四甲酯。
[0026]
在一些优选的实施方式中,所述聚合试剂为原硅酸四乙酯、原硅酸四甲酯或多巴胺。
[0027]
在一些优选的实施方式中,本发明提供了一种制备分子印迹及包覆聚合物的方法,包括:
[0028]
(1)选择目标蛋白的c端或n端多肽序列作为表位进行糖化,得到糖化表位作为所述印迹模板;
[0029]
(2)对基底材料进行功能化处理,得到硼酸功能化的基底材料;
[0030]
(3)将所述印迹模板锚定至所述硼酸功能化的基底材料的表面上,得到模板锚定的基底材料;
[0031]
(4)向所述模板锚定的基底材料中加入一种或多种单体硅烷化试剂以及交联剂以进行所述第一次印迹,形成印迹层,得到包含所述印迹层的第一次定向印迹的分子印迹材料;
[0032]
(5)使所述第一次定向印迹的分子印迹材料与所述聚合试剂接触,以在所述印迹层上进行所述第二次印迹,形成包覆层,得到包含所述包覆层的第二次定向印迹的分子印迹材料,其中,所述聚合试剂为原硅酸四乙酯、原硅酸四甲酯或多巴胺;
[0033]
(6)对所述第二次定向印迹的分子印迹材料进行洗脱来去除所述印迹模板,得到分子印迹及包覆聚合物。
[0034]
在一些优选的实施方式中,选择目标蛋白的c端或n端的9-15个氨基酸残基的多肽序列作为表位。在本文中,作为表位的多肽序列选择蛋白质最末端(c端和n端)的氨基酸残基组成的多肽序列可以避免表位序列本身为糖基化(翻译后修饰)的情况。
[0035]
在进一步优选的实施方式中,采用所述一种或多种单体硅烷化试剂以及交联剂对所述表位中的前6-12个氨基酸残基进行第一次印迹,得到所述第一次定向印迹的分子印迹材料;并且所述表位中的后3-6个氨基酸残基与所述聚合试剂反应以进行第二次定向印迹,得到所述第二次定向印迹的分子印迹材料。
[0036]
以选择目标蛋白的末端12个氨基酸残基构成的多肽作为特征表位为例,将其经过糖化处理后得到的糖化表位作为印迹模板,印迹模板通过硼亲和作用被锚定于硼酸功能化的基底材料的表面上,选择多种单体硅烷化试剂以及交联剂对表位多肽的前九个氨基酸残基进行第一次印迹,所得印迹层对表位多肽具有多重相互作用,产生强的亲和力,然后利用非特异相互作用微弱聚合试剂作为包覆试剂对印迹材料表面进行第二次定向印迹,由此形成的包覆层的厚度覆盖后三个氨基酸,除去模板分子后得到对靶分子具有增高的特异性和亲和力的分子印迹及包覆聚合物。
[0037]
在一些优选的实施方式中,通过固相合成得到所述目标蛋白的c端或n端的9-15个、优选12个氨基酸残基的多肽序列作为所述表位。
[0038]
在一些优选的实施方式中,选择目标蛋白的c端多肽序列作为所述表位,在所述多肽序列的末端连接赖氨酸的残基,然后所述赖氨酸的残基通过希夫碱反应与单糖结合进行所述糖化。在一些优选的实施方式中,选择目标蛋白的n端多肽序列作为表位,所述多肽序列的起始氨基酸的氨基通过希夫碱反应与单糖结合进行所述糖化。在进一步优选的实施方式中,所述单糖可选自果糖、葡萄糖、半乳糖、甘露糖、木糖或其任意混合物,但不限于此。
[0039]
为了保证糖化多肽表位与基底材料上的硼酸配基具有更强的作用力,优选地,选择与取代硼酸具有更强亲和力的果糖、葡萄糖或其混合物。
[0040]
在一些优选的实施方式中,所述目标蛋白可选自b2m、trf、tfr、afp、cea或c-peptide,但不限于此。
[0041]
在一些优选的实施方式中,所述基底材料包括但不限于磁性纳米材料、银纳米材料(优选具有拉曼报告分子的银纳米粒子)和荧光素掺杂的二氧化硅纳米材料(优选fitc掺杂的二氧化硅纳米粒子)等。优选地,所述拉曼报告分子包括但不限于对巯基苯胺(patp)、对硝基苯硫酚(ntp)、对巯基苯硼酸(mpba)等。
[0042]
在一些优选的实施方式中,所述基底材料为磁性纳米材料或银纳米材料,通过如下步骤对所述基底材料进行功能化处理:(i)使所述基底材料与氨水和teos在醇溶液、优选
乙醇溶液中反应,得到表面包硅的基底材料;(ii)使所述表面包硅的基底材料与aptes在醇溶液、优选乙醇溶液中反应,得到氨基功能化的基底材料;(iii)使所述氨基功能化的基底材料与取代硼酸和氰基硼氢化钠在醇溶液、优选甲醇或乙醇溶液中反应,得到所述硼酸功能化的基底材料。
[0043]
在一些优选的实施方式中,所述基底材料为荧光素掺杂的二氧化硅纳米材料,通过如下步骤对所述基底材料进行功能化处理:(i’)使所述荧光素掺杂的二氧化硅纳米材料与aptes在醇溶液、优选乙醇溶液中反应,得到氨基功能化的荧光素掺杂的二氧化硅纳米材料;(ii’)使所述氨基功能化的荧光素掺杂的二氧化硅纳米材料与取代硼酸和氰基硼氢化钠在醇溶液、优选甲醇或乙醇溶液中反应,得到所述硼酸功能化的荧光素掺杂的二氧化硅纳米材料。
[0044]
在进一步优选的实施方式中,所述氨水的浓度为25w/v%~28w/v%。
[0045]
在进一步优选的实施方式中,在步骤(i)中,所述醇溶液中含有0.7~1.4vol%的所述teos。
[0046]
在进一步优选的实施方式中,在步骤(ii)和(i’)中,所述醇溶液中含有0.5~3vol%的所述aptes。
[0047]
在进一步优选的实施方式中,所述取代硼酸可包括2,4-二氟-3-甲酰基苯硼酸(dffpba)、醛基苯硼酸、氨基苯硼酸、羧基苯硼酸、巯基苯硼酸或烯基苯硼酸,但不限于此。在进一步优选的实施方式中,在步骤(iii)和(ii’)中,所述醇溶液中含有0.05~5w/v%的所述取代硼酸。
[0048]
在进一步优选的实施方式中,在步骤(iii)和(ii’)中,所述醇溶液中含有0.05~1w/v%的所述氰基硼氢化钠。
[0049]
在一些优选的实施方式中,向ph值大于7的缓冲溶液中加入所述印迹模板和所述硼酸功能化的基底材料,经温育(例如在15~40℃下)后,得到模板锚定的基底材料。在进一步优选的实施方式中,所述缓冲溶液选自碳酸氢铵/氯化钠缓冲溶液、碳酸氢铵缓冲溶液或磷酸盐缓冲溶液,但不限于此。
[0050]
在一些优选的实施方式中,向分散有所述模板锚定的基底材料的含氨水的醇的溶液中加入水以及所述单体硅烷化试剂和交联剂的醇溶液、优选乙醇溶液进行所述第一次印迹,得到所述第一次定向印迹的分子印迹材料。本文中第一次印迹采用单体硅烷化试剂和交联剂进行聚合,从而可对表位序列提供多重相互作用。在更优选的实施方式中,氨水的浓度为25w/v%~28w/v%。在另外优选的实施方式中,单体硅烷化试剂可根据表位序列的氨基酸种类进行选择,包括但不限于aptes、uptes、bntes或ibtes等。在另外优选的实施方式中,交联剂可包括但不限于原硅酸四乙酯或原硅酸四甲酯。
[0051]
在一些优选的实施方式中,向分散有所述第一次定向印迹的分子印迹材料的含氨水的醇的溶液中加入所述聚合试剂的醇溶液、优选乙醇溶液进行所述第二次印迹,得到所述第二次印迹的分子印迹材料。在本文中,第二次印迹采用聚合试剂进行聚合,覆盖了第一次定向印迹时在印迹空腔外产生的非特异性吸附位点,显著提高了分子印迹材料的特异性,同时增强了亲和力。在进一步优选的实施方式中,所述氨水的浓度为25w/v%~28w/v%。
[0052]
在一些优选的实施方式中,采用包含乙腈、水和冰醋酸的洗脱溶液对所述第二次
印迹的分子印迹材料进行洗脱来去除所述印迹模板。优选地,所述洗脱溶液由体积比为(30-70):(69-29):1(例如50:49:1)的乙腈、水和冰醋酸组成。
[0053]
在本发明中,将目标蛋白的c端或n端的多肽片段作为表位,经过糖化处理后作为印迹模板,利用硼亲和作用将其锚定于硼酸功能化的基底材料上,采用不同种类和比例的单体硅烷化试剂以及交联剂进行第一次定向印迹,再采用非特异相互作用弱聚合试剂进行第二次定向印迹,所得的分子印迹及包覆聚合物能特异性识别目标蛋白及其表位。该技术不需要提供或制备目标蛋白质的纯品,且表位多肽片段经糖化处理后可满足任意序列的印迹,能适用于各种目标蛋白质,制备的分子印迹材料特异性更高、亲和力更强。在此仅作为示例,对本发明的代表性的制备分子印迹及包覆聚合物的方法描述如下:
[0054]
(1)表位序列的确定及糖化
[0055]
可通过本领域熟知的蛋白质数据库(如uniprot,protein date bank等)找出目标蛋白的氨基酸序列信息,选择目标蛋白的c端或n端多肽序列作为表位。同时,为了便于将作为表位的多肽序列(在本文中也称为“表位多肽”)锚定于基底材料,需要对表位多肽进行糖化。糖化处理如下:c端表位多肽的糖化过程为c端多肽末端先连接上赖氨酸的残基,然后赖氨酸的残基通过希夫碱反应与果糖或葡萄糖等单糖结合进行糖化;n端表位多肽的糖化过程为n端多肽起始氨基酸的氨基通过希夫碱反应与果糖或葡萄糖等单糖结合进行糖化;由此得到c端或n端的糖化多肽表位作为印迹模板(在本文中也称为“糖化表位模板”)。
[0056]
(2)基底材料的选择及硼酸功能化
[0057]
根据检测方法及用途的不同,可选择不同功能和种类的基底材料,其硼酸功能化过程为:将基底材料、氨水和teos在乙醇中搅拌反应,将得到的材料分散在乙醇中,然后向其中加入aptes,搅拌反应后得到氨基功能化的基底材料;将氨基功能化的基底材料、取代硼酸和氰基硼氢化钠在甲醇或乙醇中反应后,得到硼酸功能化的基底材料。
[0058]
(3)糖化表位模板在基底材料上的锚定
[0059]
向ph值大于7的缓冲溶液中加入硼酸功能化的基底材料和所述糖化表位模板,温育后,所述糖化表位模板锚定于硼酸功能化的基底材料的表面,得到模板锚定的基底材料。
[0060]
(4)第一次定向印迹
[0061]
所述模板锚定的基底材料、水、氨水与单体硅烷化试剂和交联剂在乙醇中进行第一次定向印迹后,得到第一次定向印迹的分子印迹材料。
[0062]
(5)第二次定向印迹(包覆印迹)
[0063]
所述第一次定向印迹的分子印迹材料、氨水与聚合试剂(如teos)在乙醇中进行第二次定向印迹后,得到第二次定向印迹的分子印迹材料。
[0064]
(6)糖化表位模板的去除
[0065]
将所述第二次定向印迹的分子印迹材料加入到洗脱溶液中进行洗脱,糖化表位模板被去除,得到分子印迹及包覆聚合物。
[0066]
在本发明中可采用各种不同的基底材料来制备分子印迹及包覆聚合物,仅作为示例,在下文中对采用不同的基底材料制备分子印迹及包覆聚合物的方法进行描述,糖化表位模板的制备如上文所示例的。
[0067]
以磁纳米粒子作为基底材料
[0068]
步骤1),磁纳米粒子的制备可参见以下方法:chem.sci.2013,4,4298-4303;
chem.eur.j.2006,12,6341-6347;
[0069]
步骤2),将氨水和teos加入到乙醇中,在20℃~60℃下搅拌5~60分钟,然后向其中加入磁纳米粒子的乙醇溶液,在20℃~60℃下继续搅拌反应5~60分钟后,得到表面包硅的磁纳米粒子;
[0070]
步骤3),将上述的表面包硅的磁纳米粒子分散在乙醇中,然后向其中加入aptes,在50~100℃下搅拌5~20小时后,得到氨基功能化的磁纳米粒子;
[0071]
步骤4),向步骤3)得到的氨基功能化的磁纳米粒子、取代硼酸的甲醇溶液中加入氰基硼氢化钠还原,在15℃~40℃(例如25℃)下反应12~36小时(例如24小时)后,得到硼酸功能化的磁纳米粒子;
[0072]
步骤5),将上述的硼酸功能化的磁纳米粒子分散于含有糖化表位模板的缓冲溶液(ph大于7)中,在15℃~40℃下温育0.5~4小时后,所述糖化表位模板锚定于硼酸功能化的磁纳米粒子表面,得到模板锚定的磁纳米粒子;
[0073]
步骤6),将步骤5)得到的模板锚定的磁纳米粒子分散于氨水的乙醇溶液中,向其中加入水,然后加入单体硅烷化试剂和交联剂的乙醇溶液,在15℃~40℃(例如25℃)下进行第一次定向印迹,磁分离后得到第一次定向印迹的磁纳米粒子;
[0074]
步骤7),将上述的第一次定向印迹的磁纳米粒子与氨水和聚合试剂在乙醇中在15℃~40℃(例如25℃)下进行第二次定向印迹5~30分钟(例如10分钟),磁分离后得到第二次印迹的磁纳米粒子;
[0075]
步骤8),将步骤7)得到的第二次印迹的磁纳米粒子加入到洗脱溶液(例如乙腈:水:冰醋酸=50:49:1,以v/v计)中去除模板,得到分子印迹及包覆聚合物。
[0076]
作为对照的非印迹的基于磁纳米粒子的聚合物(简称“非印迹聚合物”)的制备方法除了没有添加糖化表位模板以外,其它所有步骤与上述相同。
[0077]
以拉曼响应的银纳米粒子作为基底材料
[0078]
步骤1),银纳米粒子的制备可参见以下方法:j.phys.chem,1982,86(17),3391-3395;
[0079]
步骤2),向步骤1)得到的银纳米粒子溶液中加入拉曼报告分子的乙醇溶液,在15℃~40℃(例如25℃)下搅拌20~60分钟(例如40分钟);将所得的溶液分散在乙醇溶液中,搅拌5~30分钟(例如10分钟);随后滴加氨水,继续搅拌1~10分钟(例如5分钟);接着再加入teos的乙醇溶液,在室温下反应后离心,得到拉曼响应的表面包硅的银纳米粒子;所用的拉曼报告分子根据检测的需求进行选择,包括但不限于patp、ntp、mpba等;
[0080]
步骤3),将步骤2)得到的拉曼响应的表面包硅的银纳米粒子分散在乙醇中,然后向其中加入aptes,在15℃~40℃(例如25℃)下振摇0.5~5小时(例如1小时)后离心,得到氨基功能化的拉曼响应的银纳米粒子;
[0081]
步骤4),将步骤3)得到的氨基功能化的拉曼响应的银纳米粒子分散在乙醇中,然后加入取代硼酸和氰基硼氢化钠,在15℃~40℃(例如25℃)下反应12~36小时后离心,得到硼酸功能化的拉曼响应的银纳米粒子;
[0082]
步骤5),将步骤4)得到的硼酸功能化的拉曼响应的银纳米粒子分散在缓冲溶液中,然后加入糖化表位模板,在15℃~40℃(例如25℃)下振摇温育0.5~5小时后离心,得到模板锚定的拉曼响应的银纳米粒子;
[0083]
步骤6),将步骤5)得到的模板锚定的拉曼响应的银纳米粒子分散在含有氨水的乙醇溶液中,再加入水,搅拌1~10分钟(例如5分钟),然后加入含有单体硅烷化试剂和交联剂的乙醇溶液,在15℃~40℃(例如25℃)下搅拌进行第一次印迹后离心,得到第一次定向印迹的拉曼响应的银纳米粒子;
[0084]
步骤7),将上述的第一次定向印迹的拉曼响应的银纳米粒子、氨水和聚合试剂在乙醇溶液中搅拌进行第二次印迹后离心,得到第二次印迹的拉曼响应的银纳米粒子;
[0085]
步骤8),将步骤7)得到的第二次印迹的拉曼响应的银纳米粒子加入到洗脱溶液(例如乙腈:水:冰醋酸=50:49:1,以v/v计)中去除模板,然后离心,得到分子印迹及包覆聚合物。
[0086]
作为对照的非印迹的基于拉曼响应的银纳米粒子的聚合物(简称“非印迹聚合物”)的制备除了不添加糖化表位模板以外,其它所有步骤同上。
[0087]
以fitc掺杂的二氧化硅纳米粒子作为基底材料
[0088]
步骤1),fitc-aptes衍生物的制备可参见以下方法:j.am.chem.soc.1978,100,8050-8055;anal.bioanal.chem.2010,396,725-738;
[0089]
步骤2),将步骤1)得到的fitc-aptes衍生物的乙醇溶液与teos的乙醇溶液混合均匀,作为缩聚反应的前驱体备用。将无水乙醇、水和氨水混合均匀后,剧烈搅拌下缓慢升温至30℃~70℃(例如55℃)。然后加入所述前驱体,在30℃~70℃(例如55℃)下继续反应20~80分钟(例如50分钟)后离心,得到fitc掺杂的二氧化硅纳米粒子;
[0090]
步骤3),将步骤2)得到的fitc掺杂的二氧化硅纳米粒子分散在乙醇中,然后向其中加入aptes,在15℃~40℃(例如25℃)下振摇0.5~5小时(例如2小时)后离心,得到氨基功能化的fitc掺杂的二氧化硅纳米粒子;
[0091]
步骤4),将步骤3)得到的氨基功能化的fitc掺杂的二氧化硅纳米粒子分散在甲醇中,然后加入取代硼酸和氰基硼氢化钠,在15℃~40℃下振摇12~36小时后离心,得到硼酸功能化的fitc掺杂的二氧化硅纳米粒子;
[0092]
步骤5),将步骤4)得到的硼酸功能化的fitc掺杂的二氧化硅纳米粒子分散在缓冲溶液中,然后加入糖化表位模板,在15℃~40℃振摇0.5~5小时后离心,得到模板锚定的fitc掺杂的二氧化硅纳米粒子;
[0093]
步骤6),将步骤5)得到的模板锚定的fitc掺杂的二氧化硅纳米粒子分散在含有氨水的乙醇溶液中,再加入水,在15℃~40℃(例如25℃)下搅拌1~10分钟(例如5分钟),然后加入含有单体硅烷化试剂和交联剂的乙醇溶液,在15℃~40℃(例如25℃)下搅拌进行第一次印迹后离心,得到第一次定向印迹的fitc掺杂的二氧化硅纳米粒子;
[0094]
步骤7),将步骤6)得到的第一次定向印迹的fitc掺杂的二氧化硅纳米粒子、氨水和聚合试剂在乙醇中在15℃~40℃下振摇5~30分钟以进行第二次印迹后离心,得到第二次定向印迹的fitc掺杂的二氧化硅纳米粒子;
[0095]
步骤8),将步骤7)得到的第二次定向印迹的fitc掺杂的二氧化硅纳米粒子加入到洗脱溶液(例如乙腈:水:冰醋酸=50:49:1,以v/v计)中去除模板,然后离心,得到分子印迹及包覆聚合物。
[0096]
作为对照的非印迹的基于fitc掺杂的二氧化硅纳米粒子的聚合物(简称“非印迹聚合物”)的制备方法除了没有添加糖化表位模板以外,其它所有步骤同上。
[0097]
在一个实施方式中,本发明提供了一种分子印迹及包覆聚合物,包括:
[0098]
印迹层,以及
[0099]
包覆层,其中,所述包覆层位于所述印迹层的外表面上。
[0100]
在一些优选的实施方式中,所述聚合物还包括基底材料。在一些优选的实施方式中,所述印迹层包括位于所述基底材料上聚合的单体硅烷化试剂和交联剂。
[0101]
在一些优选的实施方式中,所述基底材料可包括但不限于磁性纳米材料、银纳米材料(优选具有拉曼报告分子的银纳米粒子)和荧光素掺杂的二氧化硅纳米材料(优选fitc掺杂的二氧化硅纳米粒子)等。更优选地,拉曼报告分子包括但不限于对巯基苯胺(patp)、对硝基苯硫酚(ntp)、对巯基苯硼酸(mpba)等。
[0102]
在一些优选的实施方式中,所述单体硅烷化试剂可包括但不限于氨丙基三乙氧基硅烷(aptes)、脲丙基三乙氧基硅烷(uptes)、苄基三乙氧基硅烷(bntes)和异丁基三乙氧基硅烷(ibtes)等。在一些优选的实施方式中,所述交联剂为原硅酸四乙酯或原硅酸四甲酯。在一些优选的实施方式中,所述包覆层由原硅酸四乙酯、原硅酸四甲酯或多巴胺形成。
[0103]
在一个实施方式中,本发明涉及上述的分子印迹及包覆聚合物在制备用于识别靶分子或靶细胞的制剂中的用途。在一些优选的实施方式中,所述制剂用于亲和纯化、生化分析、靶向识别(例如肿瘤细胞靶向识别)和成像分析中。在一些优选的实施方式中,所述靶分子包括但不限于b2m、trf、tfr、afp、cea或c-peptide等。在一些优选的实施方式中,所述靶细胞为肿瘤细胞等,包括但不限于乳腺癌细胞、肝癌细胞和肺癌细胞等。
[0104]
本发明的示例性的技术方案可通过如下编号段落中的内容进行说明,但本发明的保护范围并不限于此:
[0105]
1.一种通过两次分子印迹制备分子印迹及包覆聚合物的方法,其中,所述方法包括:使经过第一次印迹后得到的分子印迹材料与生物兼容性好的聚合试剂接触,以在所述分子印迹材料的印迹层上进行第二次印迹,形成包覆层。
[0106]
2.如段落1所述的方法,其中,所述方法还包括:将印迹模板锚定至基底材料的表面上,然后加入一种或多种单体硅烷化试剂以及交联剂以在所述基底材料上进行所述第一次印迹,形成印迹层,得到包含所述印迹层的所述分子印迹材料。
[0107]
3.如段落2所述的方法,其中,所述交联剂为原硅酸四乙酯或原硅酸四甲酯。
[0108]
4.如段落1-3中任一段所述的方法,其中,所述聚合试剂为原硅酸四乙酯、原硅酸四甲酯或多巴胺。
[0109]
5.如段落1-4中任一段所述的方法,其中,所述方法包括:
[0110]
(1)选择目标蛋白的c端或n端多肽序列作为表位进行糖化,得到糖化表位作为所述印迹模板;
[0111]
(2)对基底材料进行功能化处理,得到硼酸功能化的基底材料;
[0112]
(3)将所述印迹模板锚定至所述硼酸功能化的基底材料的表面上,得到模板锚定的基底材料;
[0113]
(4)向所述模板锚定的基底材料中加入一种或多种所述单体硅烷化试剂以及所述交联剂以进行所述第一次印迹,形成印迹层,得到包含所述印迹层的第一次定向印迹的分子印迹材料;
[0114]
(5)使所述第一次定向印迹的分子印迹材料与所述聚合试剂接触,以在所述印迹
层上进行所述第二次印迹,形成包覆层,得到包含所述包覆层的第二次定向印迹的分子印迹材料;
[0115]
(6)对所述第二次定向印迹的分子印迹材料进行洗脱来去除所述印迹模板,得到分子印迹及包覆聚合物。
[0116]
6.如段落5所述的方法,其中,选择所述目标蛋白的c端或n端的9-15个氨基酸残基的多肽序列作为所述表位。
[0117]
7.如段落5或6所述的方法,其中,采用所述一种或多种单体硅烷化试剂以及所述交联剂对所述表位中的前6-12个氨基酸残基进行所述第一次印迹,以得到所述第一次定向印迹的分子印迹材料;并且采用所述聚合试剂对所述表位中的后3-6个氨基酸残基进行所述第二次印迹,以得到所述第二次定向印迹的分子印迹材料。
[0118]
8.如段落5-7中任一段所述的方法,其中,通过固相合成得到所述目标蛋白的c端或n端的9-15个氨基酸残基的多肽序列作为所述表位。
[0119]
9.如段落5-8中任一段所述的方法,其中,选择所述目标蛋白的c端多肽序列作为所述表位,在所述多肽序列的末端连接赖氨酸的残基,然后所述赖氨酸的残基通过希夫碱反应与单糖结合进行所述糖化。
[0120]
10.如段落5-8中任一段所述的方法,其中,选择所述目标蛋白的n端多肽序列作为所述表位,所述多肽序列的起始氨基酸的氨基通过希夫碱反应与单糖结合进行所述糖化。
[0121]
11.如段落9或10所述的方法,其中,所述单糖选自果糖、葡萄糖、半乳糖、甘露糖、木糖或其任意混合物。
[0122]
12.如段落5-11中任一段所述的方法,其中,所述目标蛋白选自b2m、trf、tfr、afp、cea或c-peptide。
[0123]
13.如段落5-12中任一段所述的方法,其中,所述基底材料为磁性纳米材料、银纳米材料和荧光素掺杂的二氧化硅纳米材料。
[0124]
14.如段落5-13中任一段所述的方法,其中,所述基底材料为具有拉曼报告分子的银纳米粒子或fitc掺杂的二氧化硅纳米粒子。
[0125]
15.如段落5-14中任一段所述的方法,其中,所述拉曼报告分子为对巯基苯胺、对硝基苯硫酚或对巯基苯硼酸。
[0126]
16.如段落5-15中任一段所述的方法,其中,采用取代硼酸对所述基底材料进行功能化处理。
[0127]
17.如段落5-16中任一段所述的方法,其中,所述基底材料为磁性纳米材料或银纳米材料,通过如下步骤对所述基底材料进行功能化处理:(i)使所述基底材料与氨水和teos在醇溶液中反应,得到表面包硅的基底材料;(ii)使所述表面包硅的基底材料与aptes在醇溶液中反应,得到氨基功能化的基底材料;(iii)使所述氨基功能化的基底材料与取代硼酸和氰基硼氢化钠在醇溶液中反应,得到所述硼酸功能化的基底材料。
[0128]
18.如段落5-16中任一段所述的方法,其中,所述基底材料为荧光素掺杂的二氧化硅纳米材料,通过如下步骤对所述基底材料进行功能化处理:(i’)使所述荧光素掺杂的二氧化硅纳米材料与aptes在醇溶液中反应,得到氨基功能化的荧光素掺杂的二氧化硅纳米材料;(ii’)使所述氨基功能化的荧光素掺杂的二氧化硅纳米材料与取代硼酸和氰基硼氢化钠在醇溶液中反应,得到所述硼酸功能化的荧光素掺杂的二氧化硅纳米材料。
[0129]
19.如段落17或18所述的方法,其中,所述氨水的浓度为25w/v%~28w/v%。
[0130]
20.如段落17所述的方法,其中,在步骤(i)中,所述醇溶液中含有0.7~1.4vol%的所述teos。
[0131]
21.如段落17-20中任一段所述的方法,其中,在步骤(ii)和(i’)中,所述醇溶液中含有0.5~3vol%的所述aptes。
[0132]
22.如段落17-21中任一段所述的方法,其中,所述取代硼酸包括2,4-二氟-3-甲酰基苯硼酸、醛基苯硼酸、氨基苯硼酸、羧基苯硼酸、巯基苯硼酸或烯基苯硼酸。
[0133]
23.如段落17-22中任一段所述的方法,其中,在步骤(iii)和(ii’)中,所述醇溶液中含有0.05~5w/v%的所述取代硼酸。
[0134]
24.如段落17-23中任一段所述的方法,其中,在步骤(iii)和(ii’)中,所述醇溶液中含有0.05~1w/v%的所述氰基硼氢化钠。
[0135]
25.如段落5-24中任一段所述的方法,其中,向ph值大于7的缓冲溶液中加入所述印迹模板和所述硼酸功能化的基底材料,经温育后,得到模板锚定的基底材料。
[0136]
26.如段落25所述的方法,其中,所述缓冲溶液选自碳酸氢铵/氯化钠缓冲溶液、碳酸氢铵缓冲溶液或磷酸盐缓冲溶液。
[0137]
27.如段落5-26中任一段所述的方法,其中,向分散有所述模板锚定的基底材料的含氨水的醇的溶液中加入水以及所述单体硅烷化试剂和所述交联剂的醇溶液进行所述第一次印迹,得到所述第一次定向印迹的分子印迹材料。
[0138]
28.如段落27所述的方法,其中,所述氨水的浓度为25w/v%~28w/v%。
[0139]
29.如段落5-28中任一段所述的方法,其中,所述单体硅烷化试剂包括氨丙基三乙氧基硅烷、脲丙基三乙氧基硅烷、苄基三乙氧基硅烷和异丁基三乙氧基硅烷。
[0140]
30.如段落5-29中任一段所述的方法,其中,向分散有所述第一次定向印迹的分子印迹材料的含氨水的醇的溶液中加入所述聚合试剂的醇溶液进行所述第二次印迹,得到所述第二次定向印迹的分子印迹材料。
[0141]
31.如段落30所述的方法,其中,所述氨水的浓度为25w/v%~28w/v%。
[0142]
32.如段落5-31中任一段所述的方法,其中,采用包含乙腈、水和冰醋酸的洗脱溶液对所述第二次定向印迹的分子印迹材料进行洗脱来去除所述印迹模板。
[0143]
33.如段落5-32中任一段所述的方法,其中,所述洗脱溶液由体积比为(30-70):(69-29):1的乙腈、水和冰醋酸组成。
[0144]
34.一种分子印迹及包覆聚合物,包括:
[0145]
印迹层,以及
[0146]
包覆层,其中,所述包覆层位于所述印迹层的外表面上。
[0147]
35.如段落34所述的分子印迹及包覆聚合物,其中,所述聚合物还包括基底材料。
[0148]
36.如段落34或35所述的分子印迹及包覆聚合物,其中,所述印迹层包括位于所述基底材料上聚合的单体硅烷化试剂和交联剂。
[0149]
37.如段落35或36所述的分子印迹及包覆聚合物,其中,所述基底材料为磁性纳米材料、银纳米材料或荧光素掺杂的二氧化硅纳米材料。
[0150]
38.如段落35-37中任一段所述的分子印迹及包覆聚合物,其中,所述基底材料包括具有拉曼报告分子的银纳米粒子或fitc掺杂的二氧化硅纳米粒子。
[0151]
39.如段落38所述的分子印迹及包覆聚合物,其中,所述拉曼报告分子为对巯基苯胺、对硝基苯硫酚或对巯基苯硼酸。
[0152]
40.如段落36-39中任一段所述的分子印迹及包覆聚合物,其中,所述单体硅烷化试剂包括氨丙基三乙氧基硅烷、脲丙基三乙氧基硅烷、苄基三乙氧基硅烷和异丁基三乙氧基硅烷。
[0153]
41.如段落36-40中任一段所述的分子印迹及包覆聚合物,其中,所述交联剂为原硅酸四乙酯或原硅酸四甲酯。
[0154]
42.如段落34-41中任一段所述的分子印迹及包覆聚合物,其中,所述包覆层由原硅酸四乙酯、原硅酸四甲酯或多巴胺形成。
[0155]
43.段落34-42中任一段所述的分子印迹及包覆聚合物在制备用于识别靶分子或靶细胞的制剂中的用途。
[0156]
44.如段落43所述的用途,其中,所述制剂用于亲和纯化、生化分析、靶向识别和成像分析中。
[0157]
45.如段落43或44所述的用途,其中,所述靶分子包括b2m、trf、tfr、afp、cea或c-peptide。
[0158]
46.如段落43或44所述的用途,其中,所述靶细胞为肿瘤细胞。
[0159]
47.如段落46所述的用途,其中,所述肿瘤细胞为肺癌细胞、乳腺癌细胞或肝癌细胞。
[0160]
实施例
[0161]
下面通过实施例来进一步阐述本发明,但本发明的范围不限于此。除非另外说明,如下实施例中涉及各操作可按照本领域已知的技术进行(例如参见如下的记载:《分子印迹学-从基础到应用》,[日]小宫山真等著,吴世康、汪鹏飞译,科学出版社,2006年4月;《分子印迹技术及应用》,谭天伟编著,化学工业出版社,2010年7月;《分子印迹技术》,姜忠义、吴洪编著,化学工业出版社,2003年1月;《分子印迹技术与药物分析》,傅强等编著,西安交通大学出版社,2014年9月;《分子印迹聚合物功能材料》,田大听著,科学出版社,2017年3月)。除非另外说明,下述实施例中使用的试剂、材料和设备均为可商购的试剂、材料和设备。
[0162]
实施例1:糖化多肽表位的制备
[0163]
通过蛋白质数据库(如uniprot,protein date bank等)确定目标蛋白b2m、trf、tfr、afp、cea和c-peptide的氨基酸序列信息。
[0164]
对于b2m,选择其c端多肽序列sqpkivkwdrdm(seq id no.1)作为表位,通过固相合成直接合成在其末端连接有赖氨酸(k)的多肽序列sqpkivkwdrdmk(seq id no.2),然后在连接的k残基上通过希夫碱反应与果糖(fru)结合,得到果糖化的表位多肽sqpkivkwdrdmk-fru。
[0165]
对于trf,选择其c端多肽序列sslleactfrrp(seq id no.3)作为表位,通过固相合成直接合成在其末端连接有k的多肽序列sslleactfrrpk(seq id no.4),然后在连接的k残基上通过希夫碱反应与fru结合,得到果糖化的表位多肽sslleactfrrpk-fru。
[0166]
对于tfr,选择其c端多肽序列lsgdvwdidnef(seq id no.5)作为表位,通过固相合成直接合成在其末端连接有k的多肽序列lsgdvwdidnefk(seq id no.6),然后在连接的k的残基上通过希夫碱反应与fru结合,得到果糖化的表位多肽lsgdvwdidnefk-fru。
[0167]
对于afp,选择其n端多肽序列rtlhrneygias(seq id no.7)作为表位,通过固相合成直接合成多肽rtlhrneygias,然后在其起始氨基酸r的氨基上通过希夫碱反应与fru结合,得到果糖化的表位多肽fru-rtlhrneygias。
[0168]
对于cea,选择其n端多肽序列kltiestpfnva(seq id no.8)作为表位,通过固相合成直接合成多肽kltiestpfnva,然后在其起始氨基酸k的氨基上通过希夫碱反应与fru结合,得到果糖化的表位多肽fru-kltiestpfnva。
[0169]
对于c-peptide,选择其n端多肽序列eaedlqvgqvel(seq id no.9)作为表位,通过固相合成直接合成多肽eaedlqvgqvel,然后在其起始氨基酸e的氨基上通过希夫碱反应与fru结合,得到果糖化的表位多肽fru-eaedlqvgqvel;选择其c端多肽序列slqplalegslq(seq id no.10)作为表位,通过固相合成直接合成在其末端连接有k的多肽序列slqplalegslqk(seq id no.11),然后在连接的k残基上通过希夫碱反应与fru结合,得到果糖化的表位多肽slqplalegslqk-fru。
[0170]
图2中分别示出为b2m(a)、trf(b)和tfr(c)的c端糖化表位,afp(d)和cea(e)的n端糖化表位,以及c-peptide的c端糖化表位(f)和n端糖化表位(g)的化学结构。
[0171]
实施例2:分子印迹及包覆的磁纳米粒子的制备
[0172]
步骤1),磁纳米粒子的制备
[0173]
将2.0g六水合三氯化铁、13.0g 1,6-己二胺和4.0g无水醋酸钠加入到60ml乙二醇中,混匀后放入内衬聚四氟乙烯的反应釜中,在198℃下反应6小时后,得到的磁纳米粒子分别用水和乙醇各清洗三次,最后过夜干燥。
[0174]
步骤2),包覆二氧化硅的磁纳米粒子的硼酸功能化
[0175]
将7.5ml氨水(28%,w/v)和1.4ml teos加入到200ml无水乙醇中,在40℃下搅拌20分钟。将200mg磁纳米粒子超声分散到20ml无水乙醇中,然后加入到上述溶液中,在40℃下继续搅拌20分钟后,磁分离得到二氧化硅包覆的磁纳米粒子,分别用水和无水乙醇各清洗三次,最后过夜干燥。
[0176]
将二氧化硅包覆的磁纳米粒子超声分散到100ml无水乙醇中,然后向其中加入3ml aptes,在80℃下搅拌12小时。磁分离得到氨基功能化的二氧化硅包覆的磁纳米粒子,分别用水和无水乙醇各清洗三次,最后过夜干燥。
[0177]
将200mg氨基功能化的二氧化硅包覆的磁纳米粒子超声分散到80ml甲醇中,然后加入400mg dffpba和1w/v%氰基硼氢化钠,在25℃下搅拌24小时。磁分离得到硼酸功能化的磁纳米粒子,分别用水和无水乙醇各清洗三次后过夜干燥。
[0178]
步骤3),分子印迹及包覆的磁纳米粒子的制备
[0179]
2.0mg实施例1制备的b2m的c端糖化表位和c-peptide的c端糖化表位分别加入到2ml 50mm碳酸氢铵/500mm氯化钠缓冲溶液(ph 8.5)中,然后加入20mg硼酸功能化的磁纳米粒子并超声分散。在25℃下温育2小时后,磁分离得到糖化表位模板锚定的磁纳米粒子并用50mm碳酸氢铵缓冲溶液(ph 8.5)清洗三次。
[0180]
将上述模板锚定的磁纳米粒子超声分散到含有4.5ml氨水(28w/v%)的150ml无水乙醇中,然后加入10ml水,机械搅拌5分钟。将40ml单体硅烷化试剂和交联剂(其种类和摩尔比如图5所示)的乙醇溶液加入上述溶液中,在25℃下机械搅拌以进行第一次印迹,磁分离后得到第一次定向印迹的磁纳米粒子,用无水乙醇清洗三次。
[0181]
将第一次定向印迹的磁纳米粒子超声分散到含有2.8ml氨水(28w/v%)的160ml无水乙醇溶液中,然后加入40ml的10mm teos的无水乙醇溶液,在25℃下机械搅拌10分钟以进行第二次印迹。磁分离后得到第二次定向印迹的磁纳米粒子,用无水乙醇清洗三次,最后过夜干燥。
[0182]
将得到的第二次定向印迹的磁纳米粒子分散到2ml的洗脱溶液(乙腈:水:醋酸为50:49:1,以体积比计)中,在25℃下振摇20分钟,上述操作重复三次。除去糖化表位模板后,磁分离得到分子印迹及包覆的磁纳米粒子,分别用水和无水乙醇各清洗三次,最后过夜干燥。
[0183]
单次印迹的磁纳米粒子的制备过程除了将模板由b2m的c端糖化表位改为糖化的九肽表位sqpkivkwd(seq id no.12)、以及没有进行第二次定向印迹(即,将得到的第一次定向印迹的磁纳米粒子分散到2ml的洗脱溶液中)以外,其它所有步骤与上述相同。
[0184]
相应的非印迹的磁纳米粒子的制备过程除了没有加入相应的糖化表位模板以外,其它所有步骤与上述相同。
[0185]
如图5所示,制备上述的b2m的c端表位单次印迹的磁纳米粒子(即,分子印迹聚合物)时,在单体硅烷化试剂和交联剂的种类和摩尔比例为aptes/uptes/bntes/ibtes/teos=10:10:10:20:50、印迹时间为60分钟时,获得最优印迹因子(6.2);相比之下,制备上述的b2m的c端表位分子印迹及包覆的磁纳米粒子(即,分子印迹及包覆聚合物)时,在单体硅烷化试剂和交联剂的种类和摩尔比例为aptes/uptes/bntes/ibtes/teos=20:20:10:30:20、印迹时间为60分钟时,获得最优印迹因子(16.6),其远高于所述的单次印迹的磁纳米粒子,表明采用分子印迹及包覆策略能够显著消除非特异性吸附位点,从而提高所得到的分子印迹及包覆聚合物的特异性。
[0186]
实施例3:硼酸功能化的磁纳米粒子的选择性的表征
[0187]
分别将1.0mg/ml腺苷和脱氧腺苷溶解到200μl 50mm碳酸氢铵/500mm氯化钠缓冲溶液(ph 8.5)中,然后分别加入2.0mg实施例2得到的硼酸功能化的磁纳米粒子,并在25℃下孵育2小时。磁分离硼酸功能化的磁纳米粒子后,分别用200μl 50mm碳酸氢铵/500mm氯化钠缓冲溶液(ph 8.5)和50mm碳酸氢铵缓冲溶液(ph 8.5)各清洗三次,然后重新分散到20μl的100mm醋酸溶液中,振摇1小时。磁分离硼酸功能化的磁纳米粒子后得到洗脱液。通过在260nm处紫外测定洗脱液,得到硼酸功能化的磁纳米粒子对腺苷和脱氧腺苷的吸光度,如图4的(a)所示,表明硼酸功能化的磁纳米粒子对含有顺势二羟基的腺苷具有良好的选择性,而对不含顺势二羟基的脱氧腺苷没有硼亲和作用。
[0188]
为进一步证明硼酸功能化的磁纳米粒子的选择性,将实施例1中得到的b2m、trf和tfr的c端表位以及afp和cea的n端表位及它们相应的糖化表位作为分析物,除了用上述表位和糖化表位代替腺苷和脱氧腺苷并将洗脱液改为在214nm处测定紫外吸光度以外,其实验过程与上述相同,结果如图4的(b)所示,相对于相应的表位,硼酸功能化的磁纳米粒子对含顺势二羟基化合物(b2m、trf和tfr的c端糖化表位,afp和cea的n端糖化表位)表现出良好的选择性。
[0189]
实施例4:吸附等温线的测定
[0190]
将荧光素标记的b2m的c端十二肽(fitc-sqpkivkwdrdm)用磷酸盐缓冲溶液(10mm,ph 7.4)配制成浓度分别为10、102、103、104、105、106、107、108、109、10
10
pg/ml的标准溶液,分
别取200μl放入酶标板中,通过酶标仪检测其荧光强度。然后将2mg实施例2中制备的b2m的c端表位分子印迹及包覆的磁纳米粒子分别加入到1ml上述各浓度的标准溶液中,在25℃下振摇30分钟。磁分离磁纳米粒子后,取200μl上层溶液放入酶标板中,通过酶标仪检测其荧光强度。用上述b2m的c端表位分子印迹及包覆的磁纳米粒子萃取前标准溶液的荧光强度与萃取后上层溶液的荧光强度的差值对fitc-sqpkivkwdrdm的浓度对数进行拟合得到吸附等温线。
[0191]
对于b2m的c端表位单次印迹的磁纳米粒子的吸附等温线测定,除将上述b2m的c端表位分子印迹及包覆的磁纳米粒子改为所述单次印迹的磁纳米粒子、并将fitc-sqpkivkwdrdm改为fitc-kivkwdrdm以外,所有实验步骤同上。
[0192]
通过hill方程分别计算得出在最优印迹时间下以不同比例的单体硅烷化试剂和交联剂制备的b2m的c端表位单次印迹和分子印迹及包覆的磁纳米粒子的解离常数kd。结果如图6所示,在保证最优if值的前提下,b2m的c端表位单次印迹的磁纳米粒子的kd值只有10-7
m(a),而b2m的c端表位分子印迹及包覆的磁纳米粒子的kd值能够达到10-9
m(b),远远低于b2m的c端表位单次印迹的磁纳米粒子。这表明通过本发明的分子印迹及包覆策略,不仅显著提高了分子印迹材料的特异性,还极大增强了亲和力。
[0193]
实施例5:分子印迹及包覆的磁纳米粒子的选择性
[0194]
1)在肽段水平的选择性
[0195]
分别将实施例1中得到的b2m、trf和tfr的c端表位以及afp和cea的n端表位溶解到磷酸盐缓冲溶液(10mm,ph 7.4)中制备成0.1mg/ml的表位溶液。将2.0mg实施例2中制备的b2m的c端表位分子印迹及包覆的磁纳米粒子和非印迹的磁纳米粒子分别加入到200μl的表位溶液中,在25℃下温育30分钟。磁分离上述的各磁纳米粒子后,用200μl的磷酸盐缓冲溶液(10mm,ph 7.4)清洗三次。然后,将各磁纳米粒子重新分散至20μl洗脱溶液(乙腈:水:醋酸为50:49:1,以体积比计)中,在25℃下振摇10分钟。最后,磁分离各磁纳米粒子并收集洗脱液。
[0196]
通过uv分析在214nm处测定洗脱液,结果如图7的(a)所示,相对于非印迹的磁纳米粒子,所述b2m的c端表位分子印迹及包覆的磁纳米粒子对b2m的c端表位表现出优异的选择性。
[0197]
2)在蛋白水平的选择性
[0198]
分别将b2m、trf、tfr、afp和cea溶解到磷酸盐缓冲溶液(10mm,ph 7.4)中制备成0.1mg/ml的蛋白溶液。将2.0mg实施例2中制备的b2m的c端表位分子印迹及包覆的磁纳米粒子和非印迹的磁纳米粒子分别加入到200μl蛋白溶液中,在25℃下温育30分钟。磁分离上述的各磁纳米粒子后,用200μl磷酸盐缓冲溶液(10mm,ph 7.4)清洗三次。然后,将各磁纳米粒子重新分散至20μl洗脱溶液(乙腈:水:醋酸为50:49:1,以体积比计)中,在25℃下振摇10分钟。最后,磁分离各磁纳米粒子并收集洗脱液。
[0199]
通过uv分析在214nm处测定洗脱液,结果如图7的(b)所示,相对于非印迹的磁纳米粒子,所述b2m的c端表位分子印迹及包覆的磁纳米粒子对目标蛋白b2m表现出优异的选择性。
[0200]
实施例6:本发明的分子印迹及包覆方法的通用性
[0201]
接下来对trf和tfr的c端表位以及afp和cea的n端表位进行印迹及包覆。对于trf
和tfr的c端表位,采用的单体硅烷化试剂和交联剂aptes/uptes/bntes/ibtes/teos的摩尔比例为10:10:10:20:50、10:20:10:20:40、20:20:10:20:30、20:20:10:30:20和20:30:10:30:10时,对应的最优印迹时间分别为70min、60min、60min、60min和50min,可将这5种试剂的比例和相应的最优印迹时间作为目标蛋白c端表位的通用印迹条件。除了模板相应改为trf和tfr的c端糖化表位及采用上述比例的单体硅烷化试剂及交联剂和相应的最优印迹时间之外,其它所有制备过程同实施例2。
[0202]
通过uv分析在214nm处测定洗脱液,结果如图8所示,单体硅烷化试剂和交联剂aptes/uptes/bntes/ibtes/teos的摩尔比例为10:20:10:20:40、在60分钟的印迹时间下制备的trf的c端表位分子印迹及包覆的磁纳米粒子获得最高的if值(图8的a);单体硅烷化试剂和交联剂aptes/uptes/bntes/ibtes/teos的摩尔比例为20:20:10:30:20、在60分钟的印迹时间下制备的tfr的c端表位分子印迹及包覆的磁纳米粒子获得最高的if值(图8的b)。
[0203]
上述磁纳米粒子的选择性的表征按实施例5所述进行。结果表明所述trf的c端表位分子印迹及包覆的磁纳米粒子(图8的c、e)和tfr的c端表位分子印迹及包覆的磁纳米粒子(图8的d、f)在肽段和蛋白水平均表现出优异的特异性。
[0204]
对于afp和cea的n端表位,采用单体硅烷化试剂和交联剂aptes/uptes/bntes/ibtes/teos的摩尔比例为10:10:10:20:50、10:20:10:20:40、20:20:10:20:30、20:20:10:30:20和20:30:10:30:10,对应的最优印迹时间分别为60min、50min、50min、50min和40min。因此,可将这5种试剂的比例和相应的最优印迹时间作为印迹蛋白质n端表位的通用印迹条件。除了模板相应改为afp和cea的n端表位及采用上述比例的单体硅烷化试剂及交联剂和相应的最优印迹时间之外,其它所有制备过程同实施例2。
[0205]
通过uv分析在214nm处测定洗脱液,结果如图9所示,单体硅烷化试剂和交联剂aptes/uptes/bntes/ibtes/teos的摩尔比例为20:20:10:20:30、在50分钟的印迹时间下制备的afp的n端表位分子印迹及包覆的磁纳米粒子获得最高的if值(图9的a);单体硅烷化试剂和交联剂aptes/uptes/bntes/ibtes/teos的摩尔比例为10:20:10:20:40、在50分钟的印迹时间下制备的cea的n端表位分子印迹及包覆的磁纳米粒子获得最高的if值(图9的b)。
[0206]
上述磁纳米粒子的选择性的表征按实施例5所述进行。结果表明所述afp的n端表位分子印迹及包覆的磁纳米粒子(图9的c、e)和cea的n端表位分子印迹及包覆的磁纳米粒子(图9的d、f)在肽段和蛋白水平均表现出优异的特异性。
[0207]
与上述相应的非印迹的磁纳米粒子按照实施例2中所述制备。
[0208]
由该实施例的结果可以看出,本发明的制备分子印迹及包覆的聚合物的方法简单、通用性强、可容易地扩展到其它蛋白质的印迹。
[0209]
实施例7:分子印迹及包覆的拉曼响应的银纳米粒子的制备
[0210]
步骤1),拉曼响应的银纳米粒子的制备
[0211]
将36mg硝酸银溶解于200ml超纯水中,在持续搅拌下加热至沸腾,快速加入4ml新配制的柠檬酸三钠溶液(1%,w/v),继续搅拌并保持沸腾的状态约40分钟,然后自然冷却至室温,得到粒径约为55nm的银溶胶,于4℃下储存备用。
[0212]
采用patp作为拉曼报告分子,取10ml上述的银溶胶溶液,加入20μl 1mm的patp的乙醇溶液,室温下搅拌40分钟。将所得的溶液分散在40ml乙醇溶液中,搅拌10分钟使溶液混合均匀后,滴加0.7ml的氨水(28w/v%)并搅拌5分钟。接着再加入10ml的10mm teos的乙醇
peptide进行抓取,特异性进一步得到提高。形成“c端表位mip-c-peptide-n端表位mip”的三明治夹心结构后,通过便携式拉曼光谱仪对其进行高灵敏检测。
[0223]
基于双重表位特异性分子印迹及包覆聚合物的等离激元免疫夹心法检测人血清和尿液(分别来自2名健康受试者(简称“正常人”)、2名i型糖尿病患者和2名ii型糖尿病患者)中的c-peptide的步骤如下:(1)富集和标记。取50μl 10mg/ml的实施例2制备的分子印迹及包覆的磁纳米粒子的溶液(分散在10mm磷酸盐缓冲溶液中,ph 7.4)。接着向其中同时加入50μl的c-peptide标准溶液或待测样品(人血清和尿液)、以及30μl实施例7制备的分子印迹及包覆的拉曼响应的银纳米粒子的溶液(分散在10mm磷酸盐缓冲溶液中,ph 7.4),室温下振荡20分钟;(2)清洗。通过磁分离去除未结合在磁纳米粒子上的物质和拉曼响应的银纳米粒子,并将得到的磁纳米粒子用100μl磷酸盐缓冲液(10mm,ph 7.4)清洗3次;(3)检测。将得到的磁纳米粒子分散到10μl磷酸盐缓冲溶液(10mm,ph 7.4)中,得到三明治夹心结构的纳米复合物溶液。取1μl的三明治夹心结构的纳米复合物溶液点在光滑的铝箔纸包覆的玻璃片上,每个样品点5个液滴,室温下晾干后,采集每个液滴中心位置的拉曼光谱3次。
[0224]
同时,以购自上海酶联生物科技有限公司(中国)的elisa试剂盒为对照按产品说明书对相应的人血清和尿液进行检测。结果在下表1中示出。
[0225]
表1双重表位特异性分子印迹及包覆聚合物的等离激元免疫夹心法与商品化elisa试剂盒的对比*
[0226][0227]
*通常正常人血清中c-peptide的含量为0.78-3.1ng/ml。通常正常人尿液中c-peptide的含量为45-117μg/24h。
[0228]
实施例9:分子印迹及包覆的fitc掺杂的二氧化硅纳米粒子的制备
[0229]
步骤1),fitc掺杂的二氧化硅纳米粒子的制备
[0230]
将50μl aptes加入到10ml无水乙醇中,混合均匀后再加入10mg fitc,在25℃下避光振摇过夜,得到fitc-aptes衍生物的乙醇溶液。
[0231]
将制备的6.25ml的fitc-aptes衍生物的乙醇溶液与1.5ml的teos和20ml的无水乙醇混合均匀,作为缩聚反应的前驱体备用。在250ml的圆底烧瓶中分别加入200ml的无水乙醇、12.125ml的水和9.0ml的氨水(28w/v%),混合均匀后置于油浴中,剧烈搅拌下缓慢升温至55℃。然后加入所述的前驱体,在55℃下继续反应50分钟。将所得溶液在11000rpm下离心15min,得到fitc掺杂的二氧化硅纳米粒子,然后分别用无水乙醇和水各清洗两次。最后,将所述fitc掺杂的二氧化硅纳米粒子重新分散在20ml的无水乙醇中,在25℃下避光保存。
[0232]
步骤2),硼酸功能化的fitc掺杂的二氧化硅纳米粒子的制备
[0233]
将100μl的aptes加入到含上述fitc掺杂的二氧化硅纳米粒子的20ml无水乙醇中,在25℃下振摇2小时。将所得溶液在11000rpm下离心15min,得到氨基功能化的fitc掺杂的二氧化硅纳米粒子,然后分别用无水乙醇和水各清洗两次。最后,将氨基功能化的fitc掺杂的二氧化硅纳米粒子分散在20ml的甲醇中。
[0234]
以5mg/ml和1mg/ml的终浓度将dffpba和氰基硼氢化钠加入到所述氨基功能化的fitc掺杂的二氧化硅纳米粒子的甲醇溶液中,在25℃下振摇24小时。将所得溶液在8000rpm下离心10分钟,得到硼酸功能化的fitc掺杂的二氧化硅纳米粒子,然后分别用无水乙醇和水各清洗三次。最后,将硼酸功能化的fitc掺杂的二氧化硅纳米粒子分散在50mm碳酸氢铵/500mm氯化钠缓冲溶液(ph 8.5)中,在25℃下避光保存。
[0235]
步骤3),分子印迹及包覆的fitc掺杂的二氧化硅纳米粒子的制备
[0236]
将4mg的实施例1中制备的tfr的c端糖化表位模板加入到4ml含有1mg/ml硼酸功能化的fitc掺杂的二氧化硅纳米粒子的50mm碳酸氢铵/500mm氯化钠缓冲溶液(ph 8.5)中,在25℃下振摇2小时。将所得溶液在8000rpm下离心10分钟,得到模板锚定的fitc掺杂的二氧化硅纳米粒子,然后用50mm碳酸氢铵缓冲溶液(ph8.5)清洗三次。最后,在8000rpm下离心10分钟收集模板锚定的fitc掺杂的二氧化硅纳米粒子。
[0237]
将模板锚定的fitc掺杂的二氧化硅纳米粒子分散到含有0.45ml氨水(28w/v%)的15ml无水乙醇溶液中,再加入1ml水,在25℃下搅拌5分钟。然后将4ml含有单体硅烷化试剂和交联剂混合物(aptes、uptes、bntes、ibtes和teos的摩尔比为20:20:10:30:20)的无水乙醇溶液加入到上述混悬液中,在25℃下搅拌以进行第一次印迹。最后,在8000rpm下离心10分钟以收集得到的第一次定向印迹的fitc掺杂的二氧化硅纳米粒子。
[0238]
将第一次定向印迹的fitc掺杂的二氧化硅纳米粒子分散到16ml含有0.28ml氨水(28w/v%)的无水乙醇溶液中,然后加入含有10mm teos的4ml无水乙醇溶液,在25℃下振摇10分钟以进行第二次印迹。最后,在8000rpm下离心10分钟以收集得到的第二次定向印迹的fitc掺杂的二氧化硅纳米粒子。
[0239]
将第二次定向印迹的fitc掺杂的二氧化硅纳米粒子分散到20ml的洗脱溶液(乙腈:水:醋酸为50:49:1,以体积比计)中,在25℃下搅拌20分钟,将上述清洗过程重复三次。除去糖化表位模板后,在8000rpm下离心10分钟,得到分子印迹及包覆的fitc掺杂的二氧化硅纳米粒子,然后分别用无水乙醇和水各清洗三次。最后将分子印迹及包覆的fitc掺杂的二氧化硅纳米粒子重新分散在1
×
pbs缓冲溶液中。
[0240]
非印迹的fitc掺杂的二氧化硅纳米粒子的制备过程除了没有加入糖化表位模板以外,其它所有步骤同上。
[0241]
实施例10:细胞培养和成像
[0242]
将mcf-7细胞(购自atcc)在含有10%fbs的rpmi-1640培养基中培养2-3天(37℃,5%co2),将mcf-10a细胞在含10%fbs的rpmi-1640培养基中培养2-3天(37℃,5%co2),将hepg-2细胞(购自atcc)在含10%fbs的dmem培养基中培养2-3天(37℃,5%co2),将l-02细胞(购自atcc)在含有10%fbs的dmem培养基中培养2-3天(37℃,5%co2),每种细胞培养两份。去除培养基后,用1
×
pbs缓冲溶液清洗细胞两次。分别加入200μl含有200μg/ml的实施例9制备的tfr的c端表位分子印迹及包覆的fitc掺杂的二氧化硅纳米粒子和非印迹的fitc
掺杂的二氧化硅纳米粒子的1
×
pbs缓冲溶液缓冲溶液。将经过上述处理的培养皿放置在细胞培养箱(37℃,5%co2)中孵育30分钟后,向其中加入1
×
pbs缓冲溶液清洗三遍,除去未结合的纳米粒子。随后,向培养皿中加入100μl的dapi,染色10分钟后,用1
×
pbs缓冲溶液清洗两遍。最后,向培养皿中补充1ml的1
×
pbs缓冲溶液,在激光共聚焦荧光显微镜下进行细胞成像。
[0243]
通过上述细胞成像分析,如图10所示,tfr的c端表位分子印迹及包覆的fitc掺杂的二氧化硅纳米粒子对肿瘤细胞(乳腺癌细胞mcf-7和肝癌细胞hepg-2)显示出非常强的荧光信号;而对正常细胞(正常乳腺上皮细胞mcf-10a和正常肝细胞l-02)几乎没有荧光信号。同时,非印迹的fitc掺杂的二氧化硅纳米粒子对肿瘤细胞和正常细胞均没有明显的荧光信号。以上结果表明,采用本发明的方法制备的tfr的c端表位分子印迹及包覆的fitc掺杂的二氧化硅纳米粒子通过选择性结合肿瘤细胞表面高表达的tfr,能够显著区分肿瘤细胞与正常细胞。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1