一种无机结构硅钨系多金属氧酸盐掺杂三氧化二铁复合纳米催化材料及其制备和应用的制作方法
1.本发明涉及一种无机结构硅钨系多金属氧酸盐掺杂三氧化二铁复合纳米催化材料及其制备和应用。
背景技术:
2.变电站作为电力传输过程中的重要部分,广泛分布于城市及乡村等电力系统重要节点。有人值守型变电站,在日常的运行及生产生活过程中,会有污水产生,污水中所含污染物一般较为复杂,随意排放必将影响到变电站周边生态环境。因此,妥善的处理变电站污水是“碳达峰、碳中和”不可避免的问题之一。
3.目前,对于废水的处理,主要是采用沉降、吸附、过滤等传统手段,就变电站而言,传统处理手段笨拙,且占地面积大、使用效率低、仅适用于大量废水处理。对于变电站这种废水产量小,位置偏僻的情况不能完全适用。因此开发出一种适用于变电站的污水处理方式极其重要。
4.多金属氧酸盐(poms)作为一种发展了一百多年的无机材料,已经在很多领域被广泛应用。近年来,随着光催化领域研究的深入,多金属氧酸盐在太阳光利用方面也取得了一定的进展。但纯多金属氧酸盐用于光催化时,由于带隙宽度等因素影响,导致其光生空穴和光生电子猝灭速度过快,影响催化效率。在降解难降解有机物时,存在降解效率低的问题。
技术实现要素:
5.本发明的目的是为了解决目前多金属氧酸盐催化降解难以降解的有机物时催化效率低的问题,提出一种无机结构硅钨系多金属氧酸盐掺杂三氧化二铁复合纳米催化材料及其制备和应用。
6.本发明一种无机结构硅钨系多金属氧酸盐掺杂三氧化二铁复合纳米催化材料由多金属氧酸盐co2co4(siw
10
o
37
)2和纳米材料α
‑
fe2o3组成。
7.一种无机结构硅钨系多金属氧酸盐掺杂三氧化二铁复合纳米催化材料的制备方法为:一、将γ
‑
siw
10
加入水中,溶解后得到溶液a,然后向溶液a中加入co(no3)2,调节ph 值,充分反应后,离心分离,将固相物用乙醇洗样,得到多金属氧酸盐co2co4(siw
10
o
37
)2;二、将多金属氧酸盐co2co4(siw
10
o
37
)2与α
‑
fe2o3溶解于水中,然后进行蒸发结晶,得到无机结构硅钨系多金属氧酸盐掺杂三氧化二铁复合纳米催化材料 co2co4(siw
10
o
37
)2/fe2o3。
8.一种无机结构硅钨系多金
‑
属氧酸盐掺杂三氧化二铁复合纳米催化材料应用于光催化降解水中有机污染物。
9.甲基橙作为一种常见的有机化合物,其具有的n=n双键和双苯环为其提供了独特的稳定结构,在光催化中一般较难分解。因此以甲基橙作为光催化底物,既可以有效的检测复合材料的光催化性能,又便于跟踪监测。本发明将采用甲基橙作为光催化基底进行实验。本发明在多金属氧酸盐中引入环状fe2o3,合成复合材料。通过二者的协同作用,可以有效的
为活化后,y为活化前;
26.图13为实施例5复合材料co2co4(siw
10
o
37
)2/fe2o3活化前后循环实验数据图;
27.图14为实施例5复合材料co2co4(siw
10
o
37
)2/fe2o3循环实验后的sem图;
28.图15为复合材料co2co4(siw
10
o
37
)2/fe2o3循环伏安测试图;
29.图16为复合材料co2co4(siw
10
o
37
)2/fe2o3光催化机制测试;
30.图17为制备的制备的α
‑
fe2o3电镜图。
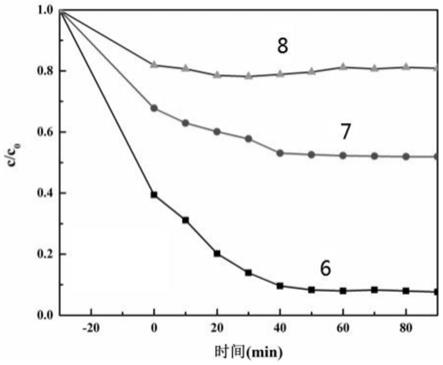
具体实施方式
31.具体实施方式一:本实施方式一种无机结构硅钨系多金属氧酸盐掺杂三氧化二铁复合纳米催化材料由多金属氧酸盐co2co4(siw
10
o
37
)2和纳米材料α
‑
fe2o3组成。
32.本实施方式通过共晶的方法合成复合材料co2co4(siw
10
o
37
)2/fe2o3的合成,表征及其对甲基橙溶液的降解。探索了不同合成ph条件对多金属氧酸盐和复合材料的影响,确定了复合材料最佳的合成条件。光催化实验结果表明,该复合材料在ph为1,甲基橙的浓度为10mg/l时对目标染料呈现出最佳的催化效果,在光催化反应后,甲基橙降解率可达 76.2%。通过对其光催化机理的研究表明,复合材料co2co4(siw
10
o
37
)2/fe2o3在光催化降解甲基橙的反应中,活性物种为光生空穴。复合催化剂经三次循环实验仍有较高的催化活性,证明其具有良好的稳定性。
33.具体实施方式二:本实施方式一种无机结构硅钨系多金属氧酸盐掺杂三氧化二铁复合纳米催化材料的制备方法为:一、将γ
‑
siw
10
加入水中,溶解后得到溶液a,然后向溶液 a中加入co(no3)2,调节ph值,充分反应后,离心分离,将固相物用乙醇洗样,得到多金属氧酸盐co2co4(siw
10
o
37
)2;二、将多金属氧酸盐co2co4(siw
10
o
37
)2与α
‑
fe2o3溶解于水中,然后进行蒸发结晶,得到无机结构硅钨系多金属氧酸盐掺杂三氧化二铁复合纳米催化材料co2co4(siw
10
o
37
)2/fe2o3。
34.具体实施方式三:本实施方与具体实施方式二不同的是:溶液a中γ
‑
siw
10
的含量为 0.05g/ml。其他与具体实施方式二相同。
35.具体实施方式四:本实施方式与具体实施方式二或三不同的是:co(no3)2与γ
‑
siw
10
加入量的比例为1.2mmol:0.5g。其他与具体实施方式二或三相同。
36.具体实施方式五:本实施方式与具体实施方式二至四之一不同的是:用naoh调节 ph至8
‑
9。其他与具体实施方式二至四之一相同。
37.具体实施方式六:本实施方式与具体实施方式二至五之一不同的是:α
‑
fe2o3和多金属氧酸盐co2co4(siw
10
o
37
)2的质量比为(0.01
‑
0.08):1。其他与具体实施方式二至五之一相同。
38.具体实施方式七:本实施方式与具体实施方式二至六之一不同的是:使用鼓风干燥箱进行蒸发结晶,温度为50℃,时间为12h。其他与具体实施方式二至六之一相同。
39.具体实施方式八:本实施方式一种无机结构硅钨系多金
‑
属氧酸盐掺杂三氧化二铁复合纳米催化材料应用于光催化降解水中有机污染物。
40.具体实施方式九:本实施方式与具体实施方式八不同的是:有机污染物为甲基橙。其他与具体实施方式八相同。
41.具体实施方式十:本实施方式与具体实施方式八或九不同的是:在ph值为1的条件
下进行光催化降解,无机结构硅钨系多金属氧酸盐掺杂三氧化二铁复合纳米催化材料与甲基橙的质量比为1:100。其他与具体实施方式八或九相同。
42.为验证本发明的有益效果进行了以下实验:
43.实施例1:
44.co2co4(siw
10
o
37
)2的合成,具体步骤如下:
45.将合成后的γ
‑
siw
10
0.5g,溶于10ml水中,加入co(no3)21.2mmol,充分搅拌,待co(no3)2完全溶解后加入的氢氧化钠溶液,调节ph值,室温搅拌24小时后,离心分离固体产物,即为co2co4(siw
10
o
37
)2。
46.本实施例分别在ph8、9、10、11、12下合成co2co4(siw
10
o
37
)2。本实施例通过红外光谱表征,得到在不同ph条件下合成的co2co4(siw
10
o
37
)2的红外光谱图,如附图1所示。
47.通过附图1分析,993cm
‑1处为si
‑
o
a
键的伸缩振动峰,950cm
‑1处为w=o
d
键的伸缩振动峰,894cm
‑1和796cm
‑1为w
‑
o
b
‑
w的伸缩振动峰,697cm
‑1为w
‑
o
c
‑
w的弯曲振动峰。通过对比,该多金属氧酸盐为夹心型杂多酸。该结构多金属氧酸盐中心由co4o2组成, 4个co分别和两个o桥连后,再通过co
‑
o
‑
si键和co
‑
o
‑
w键与siw
10
连接形成夹心型杂多酸co2co4(siw
10
o
37
)2。通过不同ph条件下合成的多金属氧酸盐对比可知,ph为8、 9和10时,杂多酸出峰完全一致,可以成功合成,而在ph为11和12时,其峰型出现变化,这证明在ph值较高的条件下co2co4(siw
10
o
37
)2结构发生改变。
48.本实施例通过紫外
‑
可见光谱图表征,得到不同ph条件下co2co4(siw
10
o
37
)2的紫外
‑ꢀ
可见光谱图,如附图2所示。
49.通过附图2分析,在低于400nm处为siw
10
的特征吸收峰,其吸收范围集中在紫外光区,400
‑
650nm为co元素的特征吸收峰,随着钴元素含量的增加,吸收峰也逐渐变宽,本实验中合成的多金属氧酸盐,夹心位置为4个co原子,另两个co原子作为抗衡离子存在,因此其吸收峰较宽。由图2可知,在ph为8和9条件下合成的co2co4(siw
10
o
37
)2峰型一致,在ph为10和11条件下,峰型部分出现改变,这可能是因为较高的ph值对杂多酸产生的影响。而当ph值达到12时,杂多酸的紫外
‑
可见光谱出峰几乎消失,这说明该条件下合成的co2co4(siw
10
o
37
)2结构发生改变。
50.实施例2:
51.co2co4(siw
10
o
37
)2/fe2o3的合成,具体步骤如下:
52.将实施例1在ph为8的条件下合成的co2co4(siw
10
o
37
)2与α
‑
fe2o3重新溶于水中,充分混合后蒸发结晶,得到黑色固体,即为复合材料co2co4(siw
10
o
37
)2/fe2o3。其中 co2co4(siw
10
o
37
)2与α
‑
fe2o3质量比为1:0.01;1:0.03、1:0.05和1:0.08,质量比为1: 0.01时合成的复合材料co2co4(siw
10
o
37
)2/fe2o3命名为复合材料a,质量比为1:0.03合成的复合材料co2co4(siw
10
o
37
)2/fe2o3命名为复合材料b,质量比为1:0.05合成的复合材料co2co4(siw
10
o
37
)2/fe2o3命名为复合材料c,质量比为1:0.08合成的复合材料 co2co4(siw
10
o
37
)2/fe2o3命名为复合材料d。
53.将复合材料b的红外光谱图与co2co4(siw
10
o
37
)2进行对比(图3),证明在复合材料合成过程中多金属氧酸盐未被破坏。复合材料b的uv
‑
vis图(图4)中可以看出,由于杂多酸的光响应范围主要在300nm以下,所以该复合材料在可见光区紫外吸收主要为 fe2o3,但相对强度有所提高,尤其在600nm
‑
700nm区间吸收强度提高较为明显。因此,该复合材料对太
(0.0057s
‑1)和k3(0.0011s
‑1),因此,进一步证明该光催化剂在催化10mg/l甲基橙溶液时效果最优。
63.实施例5:
64.复合材料co2co4(siw
10
o
37
)2/fe2o3活化前后红外光谱图及循环实验。
65.本实施例将实施例4用来催化降解10mg/l甲基橙的复合材料 co2co4(siw
10
o
37
)2/fe2o3进行回收,回收后进行活化,复合材料活化方式为将使用后的材料分别用水和无水乙醇清洗两次,再用紫外灯照射0.5h,活化后烘干待用。甲基橙浓度 10mg/l
66.图12为复合材料co2co4(siw
10
o
37
)2/fe2o3活化前后复合材料红外光谱图,如图可知,复合材料循环后,其红外光谱图与原本材料相同。复合材料co2co4(siw
10
o
37
)2/fe2o3活化前后循环实验数据图如图13所示,复合材料循环实验数据,可以看出第一次实验过程中,光催化速率呈现一定程度的下降趋势,终分解结果为75.7%,将进行过第一次循环试验的复合材料进行再回收,活化,进行二次循环实验,二次循环实验的最终分解结果为 73.1%,略低于第一次的催化过程,这是因为在二次循环过程中,光催化剂通过活化后,会产生少量团聚现象,因此在整个光催化过程中,吸附阶段的吸附率会略有升高,而由于少量催化剂结构的变化,光催化的效果会有略有下降。将进行过第二次循环试验的复合材料进行再回收,活化,进行三次循环实验,在第三次循环的最终分解结果为69.4%,且第三次循环过程中催化剂的吸附能力明显高于第二次循环实验的吸附能力,这主要是因为复合材料的团聚程度相比第二次略微增加,因此其吸附效果要明显高于前两组对比实验。
67.图14为复合材料co2co4(siw
10
o
37
)2/fe2o3循环实验后的sem图,由图14可以看出复合材料在循环后有轻微的破损,证明循环实验降解率下降是因为复合材料结构轻微变化产生的。
68.实施例6:
69.复合材料co2co4(siw
10
o
37
)2/fe2o3光催化机制实验
70.图15为复合材料循环伏安测试图,图中第一个氧化还原峰即为lumo能级。同时,根据紫外光谱经k
‑
m方程得到多金属氧酸盐带隙宽度为1.99ev,fe2o3的带隙为2.02 ev。由图16复合材料的光催化机理图可知,多金属氧酸盐和fe2o3在光照射下,分别发生电子跃迁而产生光生电子和光生空穴。进入多酸lumo能级的光生电子与fe2o3上价带能级的空穴发生复合而猝灭。由于多酸lumo能级的光生电子与fe2o3上价带能级的空穴的复合,显著提高了复合材料的光生电子和空穴分离效率,从而提升了复合材料的光催化性能。
71.上述实施例中α
‑
fe2o3的制备方法为:
72.称取fecl32.67 mmol,溶解于10ml水中,加入nah2po4使溶液中的磷酸根为0.18 mmol/l,待完全溶解后,加入na2so4,并保持nah2po4与na2so4的摩尔比例为1:3.1。充分反应后,溶液呈亮黄色,将溶液转移至反应釜中,在220度条件下反应48小时,得到红色悬浊液,将溶液离心分离并用去离子水和乙醇交替洗样后,将沉淀放入50℃烘箱中烘干,得到红色固体即为α
‑
fe2o3。制备的α
‑
fe2o3电镜图如图15所示,由图15可知,制备的α
‑
fe2o3为环状结构。
73.γ
‑
siw
10
合成方法为:
74.(1)β2‑
siw
11
合成
75.称取硅酸钠1.4212g,溶于10ml水中,记为a液,待用。称取18.14285g钨酸钠溶解于
30ml水中,记为b液,然后加入4mol/lhcl 16.5ml(hcl溶液在10min内滴加完成),对b液进行酸化,向酸化的b液中加入a液并逐滴滴加盐酸至ph为5
‑
6,在该ph值下反应100min,然后加入9gkcl,反应15min后产生白色固体沉淀,离心分离白色固体沉淀物,并用1mol/lkcl溶液洗涤样品,得到β2‑
siw
11
。
76.(2)γ
‑
siw
10
合成
77.将步骤(1)制备的β2‑
siw
11
溶解于85ml水中,加入2mol/lk2co3溶液至ph为9.23,在该ph值下反应16min,反应结束后加入20g kcl,搅拌15min,大量白色固体沉淀产生。离心分离洗样后,放入50度烘箱内干燥,收集粉末,得到γ
‑
siw
10
。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1