一种纳米酶的制备方法及其应用
1.本发明涉及纳米材料领域,特别涉及一种纳米酶的制备方法及其应用。
背景技术:
2.汞离子具有高毒性,可通过食品和水污染对人体造成严重损害,即使在超低浓度下,汞及其化合物也对人类健康有各种各样的危害。人体内积累的汞离子很难通过自身的新陈代谢排出。微量汞离子可对肝脏、肾脏和其他器官造成毒性,导致口腔炎症、手颤抖、神经系统紊乱和慢性汞中毒。因此快速、灵敏检测汞离子至关重要。
3.传统的汞离子检测方法有原子吸收光谱法、电感耦合等离子体质谱法、原子荧光光谱法等,由于笨重和昂贵的设备以及繁琐的样品制备步骤,这些方法大多局限于设备齐全的实验室,使其无法用于现场分析应用。
技术实现要素:
4.本发明的主要目的是提出一种纳米酶的制备方法及其应用,旨在提供一种抗干扰性强的纳米酶,该纳米酶能够应用于汞离子的快速检测。
5.为实现上述目的,本发明提出一种纳米酶的制备方法及其应用,所述纳米酶的制备包括以下步骤:
6.以阳离子表面活性剂为模板,加入硅源、催化剂、结构导向剂和有机溶剂,反应得到硅球;
7.将所述硅球进行氨基化处理得到氨基化硅球;
8.将所述氨基化硅球分散在水中,加入金的分散液,搅拌,得到硅球-纳米金复合物;
9.将所述硅球-纳米金复合物分散在水中,加入含铂的溶液和柠檬酸钠溶液,搅拌后加入硼氢化钠溶液,搅拌反应得到金-铂-硅基纳米酶。可选地,以阳离子表面活性剂为模板,加入硅源、催化剂和结构导向剂,反应得到硅球的步骤中:
10.所述阳离子表面活性剂包括十六烷基三甲基溴化铵;和/或,
11.所述硅源包括正硅酸乙酯;和/或,
12.所述催化剂包括三乙醇胺;和/或,
13.所述结构导向剂包括水杨酸钠。
14.可选地,以阳离子表面活性剂为模板,加入硅源、催化剂和结构导向剂,反应得到硅球的步骤包括:
15.将三乙醇胺加入水中,在80℃下搅拌30-60min,得到溶液a;
16.将十六烷基三甲基溴化铵和水杨酸钠加入所述溶液a中,恒温搅拌1h,得到溶液b;
17.将正硅酸乙酯加入到所述溶液b中,恒温搅拌,反应12-15h,得到反应溶液c;
18.将所述反应溶液c离心洗涤去除多余反应物,得到沉淀物,在沉淀物分散于盐酸和甲醇混合溶液,在60℃下搅拌6-10h,得到溶液d;
19.将所述溶液d离心洗涤去除多余反应物,得到沉淀物,将所得沉淀物重新分散于乙
铂-硅基纳米酶的zeta电位图;
39.图8为本发明实施例1制备的金-铂-硅基纳米酶的tem图以及金、铂、硅、汞以及氧元素的元素mapping图;
40.图9为本发明实施例1制备的负金-铂-硅基纳米酶与汞离子以及系列干扰离子反应的紫外吸光度图与显色图。
41.图10为本发明实施例1制备的负金-铂-硅基纳米酶应用于汞离子检测,其紫外吸光度与浓度的线性关系图。
42.本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
具体实施方式
43.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
44.需要说明,若本发明实施例中有涉及方向性指示(诸如上、下、左、右、前、后、外、内
……
),则该方向性指示仅用于解释在某一特定姿态(如附图所示)下各部件之间的相对位置关系、运动情况等,如果该特定姿态发生改变时,则该方向性指示也相应地随之改变。
45.另外,若本发明实施例中有涉及“第一”、“第二”等的描述,则该“第一”、“第二”等的描述仅用于描述目的,而不能理解为指示或暗示其相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。另外,全文中出现的“和/或”的含义,包括三个并列的方案,以“a和/或b”为例,包括a方案、或b方案、或a和b同时满足的方案。另外,各个实施例之间的技术方案可以相互结合,但是必须是以本领域普通技术人员能够实现为基础,当技术方案的结合出现相互矛盾或无法实现时应当认为这种技术方案的结合不存在,也不在本发明要求的保护范围之内。
46.汞离子具有高毒性,可通过食品和水污染对人体造成严重损害,即使在超低浓度下,汞及其化合物也对人类健康有各种各样的危害。人体内积累的汞离子很难通过自身的新陈代谢排出。微量汞离子可对肝脏、肾脏和其他器官造成毒性,导致口腔炎症、手颤抖、神经系统紊乱和慢性汞中毒。因此快速、灵敏检测汞离子至关重要。
47.传统的汞离子检测方法有原子吸收光谱法、电感耦合等离子体质谱法、原子荧光光谱法等,由于笨重和昂贵的设备以及繁琐的样品制备步骤,这些方法大多局限于设备齐全的实验室,使其无法用于现场分析应用。
48.本发明的技术方案中,纳米酶主要是以纳米硅为载体,通过静电作用负载纳米金颗粒和纳米铂颗粒,制备出金-铂-硅基纳米酶,所述的纳米酶对汞离子有特异性识别作用,可以用于汞离子的定性检测,能快速识别是否有汞离子存在,在制备的纳米酶中加入一定量的汞离子,通过紫外分光光度法检测吸光度,可以构建汞离子标准曲线,便于后期用于检测汞离子的含量,此种方法便捷可靠,可用于现场分析,在环境检测、疾病诊断等领域具有广阔的应用前景。
49.鉴于此,本发明提出一种纳米酶的制备方法及其应用,旨在提供一种快速、高灵敏度的汞离子检测方法,本发明附图中,图1为本发明提出的纳米酶的制备方法的一实施例的
流程示意图。
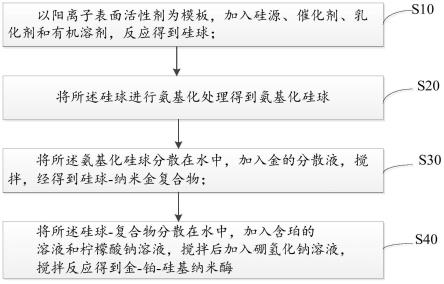
50.参阅图1,所述纳米酶的制备方法包括以下步骤:
51.步骤s10,以阳离子表面活性剂为模板,加入硅源、催化剂、结构导向剂和有机溶剂,反应得到硅球。
52.在本实施例中,制备纳米酶的第一步是制备硅球,硅球可以采用多种方法制备,保证制备的硅球具有一定大小的空腔,可供其他离子附着即可。
53.在一实施例中,所述硅球是以阳离子表面活性剂十六烷基三甲基溴化铵(ctac)为模板,正硅酸乙酯(teos)为硅源,三乙醇胺(tea)为催化剂,水杨酸钠为结构导向剂,配合有机溶剂,采用一锅双相连续生长的方法,获得了具有分代和中心径向介孔通道的三维树枝状硅球,本发明方案制备的纳米硅球稳定性高,孔道大,有较广的内表面,在提高纳米粒子的负载量上有突出的优势。
54.以阳离子表面活性剂为模板,加入硅源、催化剂和结构导向剂,反应得到硅球的步骤包括:
55.将三乙醇胺加入水中,在80℃下搅拌30-60min,得到溶液a;
56.将十六烷基三甲基溴化铵和水杨酸钠加入所述溶液a中,恒温搅拌1h,得到溶液b;
57.将正硅酸乙酯加入到所述溶液b中,恒温搅拌,反应12-15h,得到反应溶液c;
58.将所述反应溶液c离心洗涤去除多余反应物,得到沉淀物,在沉淀物分散于盐酸和甲醇混合溶液,在60℃下搅拌6-10h,得到溶液d;
59.将所述溶液d离心洗涤去除多余反应物,得到沉淀物,将所得沉淀物重新分散于乙醇中置于低于室温条件下备用,得到硅球。
60.将三乙醇胺加入水中,搅拌时间为30-60min,例如可以是30min、40min、50min、60min,优选搅拌时间为30min,保证三乙醇胺在水中均匀分散;十六烷基三甲基溴化铵和水杨酸钠在80℃下搅拌1h,保证试剂混合完全,十六烷基三甲基溴化铵作为介孔模板起到调节孔径的作用,水杨酸钠作为结构导向剂,有扩孔的作用,十六烷基三甲基溴化铵和水杨酸钠共同作用,为制备粒径均匀合适的纳米硅做好准备;加入正硅酸乙酯为做硅源,恒温搅拌反应12-15h,例如可以是12h、13h、14h、15h,优选的搅拌时间为12h,得到的纳米硅球稳定性较好,并且大小符合要求;采用盐酸和甲醇混合溶液,在60℃条件下搅拌6-10h,例如可以是6h、7h、8h、9h、10h,优选搅拌时间为6h,充分搅拌是为了完全去除纳米硅球孔径内部和外部的反应物;搅拌后的溶液进一步进行多次离心洗涤,去除多余的酸,利于得到高纯度的纳米硅球,不影响后面的处理过程。
61.步骤s20,将所述硅球进行氨基化处理得到氨基化硅球。
62.为使纳米硅球吸附效果稳定,包裹性好,避免金属纳米颗粒的泄露,需要对硅球进行氨基化,在本发明的一实施例中,在硅球中加入(3-氨丙基)三甲氧基硅烷,在室温下搅拌、离心、乙醇洗涤沉淀后分散于乙醇中,制备得到氨基化的硅球,研究表明,本发明制备的氨基化硅球在分散液中分散稳定,吸附性较好。
63.所述硅源与(3-氨丙基)三甲氧基硅烷的体积比为1:(24-28),在所述硅球中加入(3-氨丙基)三甲氧基硅烷纯样,使硅球表面被氨基化,(3-氨丙基)三甲氧基硅烷量过多,会导致(3-氨丙基)三甲氧基硅烷浪费,(3-氨丙基)三甲氧基硅烷过少,会导致硅球表面没有充分氨基化,为增加后期吸附金属离子更高效,保证合适的体积比,利于反应的顺利进行,
优选地,所述硅源与(3-氨丙基)三甲氧基硅烷的体积比为1:25,反应完全,加入的试剂几乎没有浪费。
64.在硅球中加入(3-氨丙基)三甲氧基硅烷,在室温下搅拌、离心、乙醇洗涤沉淀后分散于乙醇中,制备得到氨基化的硅球的步骤中,所述搅拌时间为5-7h,例如可以是5h、6h、7h,优选地搅拌时间为6h;所述离心的转速为5000-9000rpm,可以是5000rpm、6000rpm、7000rpm、8000rpm、9000rpm,优选转速为8000rpm;所述离心时间为4-10min,例如可以是4min、5min、6min、7min、8min、9min、10min,优选地离心时间为5min,所述硅球制备氨基化硅球的过程中,充分搅拌,确保硅球充分氨基化,通过离心过程,保证氨基化的硅球被完全分离出来;多次洗涤,去除多余的反应物,制备的氨基化硅球纯度较高,不含杂质。
65.步骤s30,将所述氨基化硅球分散在水中,加入金的分散液,搅拌,得到硅球-纳米金复合物。
66.采用的烷基硅烷介质能包硅,防止金属纳米颗粒的脱落的原理,将所述氨基化硅球分散在水中,加入金的分散液,搅拌,得到硅球-纳米金复合物的步骤中,每2ml硅源反应制备得到的氨基化硅球中加入(120-122)nmol金,优选地,每2ml硅源反应制备得到的氨基化硅球中加入120.8nmol金,搅拌得到红色的硅球-纳米金复合物,氨基化硅球充分吸附足量的金,保证加入的金不损耗,氨基化的硅球与金纳米粒子之间的静电作用,将金纳米粒子吸附到硅球表面,而且基本不改变硅球的大小使得反应后的硅球-纳米金性能更稳定。
67.步骤s40,将所述硅球-纳米金复合物分散在水中,加入含铂的溶液和柠檬酸钠溶液,搅拌后加入硼氢化钠溶液,搅拌反应得到金-铂-硅基纳米酶。
68.为使纳米硅球能特异性识别汞离子,需要对硅球-纳米金复合物做进一步的修饰。在本发明的一实施例中,将硅球-纳米金复合物剧烈搅拌的情况下,加入h2ptcl6溶液与柠檬酸钠溶液,搅拌之后加入冰浴备用的nabh4溶液,继续搅拌,之后静置,待溶液从棕色变为黑色,离心并用超纯水洗涤三次,最终分散于超纯水中,即得到纳米酶。nabh4溶液可以很好的还原h2ptcl6溶液而得到铂,反应易操作,可控性很好,采用快速加入冰浴之后的nabh4溶液,保证nabh4性能不至于失活,柠檬酸钠溶液用作保护剂,保证制备的纳米金属粒子大小稳定,反应转化率高,可操作性强,制备出来的纳米酶性质稳定,不易受到影响;含铂量与金-纳米硅复合物的比例为每2ml硅源反应制备得到的硅球-纳米金复合物对应添加(8-9)mmol铂,金-纳米硅复合物能尽可能的吸附铂,保证得到的金-铂-硅基纳米酶性能稳定,纯度较高,吸附位点多。
69.再者,本发明还提出一种上述制备方法制备得到的纳米酶的应用,所述纳米酶应用于汞离子的检测。
70.具体来说,所述纳米酶具有优异的物理性能,可以特异性识别汞离子,能够用于检测汞离子。
71.具体地,使用上述纳米酶检测汞离子的方法如下:
72.1、制备纳米酶;
73.2、配制醋酸缓冲溶液、双氧水(h2o2)溶液、3,3',5,5'-四甲基联苯胺(tmb)溶液;
74.3、将配制好的醋酸酸缓冲溶液、双氧水溶液(h2o2)和纳米酶加入酶标板中,加入汞离子标准溶液,最后加入tmb溶液,静置20min至显色完全,放入紫外分光光度计中,在650nm波长下检测对应的吸光度;以汞离子的浓度为横坐标,紫外吸光度为纵坐标,进行线性拟
合,得到标准曲线和标准曲线方程;
75.4.将配置好的醋酸缓冲溶液,双氧水溶液(h2o2)和纳米酶加入酶标板中,加入待测样品,最后加入tmb溶液,静置20min至显色完全,放入紫外分光光度计中,在650nm波长下检测对应的吸光度;
76.5、将未知溶液的吸光度带入对应的标准曲线方程,折算出未知溶液的汞离子浓度。
77.以下结合具体实施例和附图对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅仅用以解释本发明,并不用于限定本发明。
78.实施例1
79.(1)枝状硅球的合成:
80.首先将0.068g三乙醇胺(triethanolamine,tea)加入到25ml水中,80℃搅拌30min,随后加入0.380g十六氨基三甲基溴化铵(cetyltrimethylammonium bromide,ctab)和0.168g水杨酸钠(sodium salicylate),继续恒温搅拌1小时;随后向上述反应液中加入4ml正硅酸乙酯(tetraethyl orthosilicate,teos)(teos要在1min内快速加入),80℃继续搅拌12h。最后得到的溶液使用乙醇离心洗涤至少三次,以去除多余的反应试剂。将最后一次离心所得的沉淀物分散于30ml盐酸和30ml甲醇的混合溶液中,在60℃下连续搅拌6h,随后将反应液离心洗涤,所得沉淀物重新分散到100ml乙醇中置于低于室温条件下备用。
81.(2)取400μl步骤(1)合成好的硅球,向其中加入400μl的(3-氨丙基)三甲氧基硅烷(aptes),于室温下搅拌6h。将搅拌后的溶液在8000rpm的条件下,离心5min,用乙醇洗涤离心后的下层沉淀,重复洗涤三次。最终分散于10ml的乙醇中,制备得氨基化的硅球。
82.(3)取600μl步骤(2)配制好的氨基化的硅球,离心,用超纯水洗涤1次,吹干多余的乙醇,洗涤后超声分散于2ml超纯水中,转移至西林瓶中。向西林瓶中加入5ml11.6nmol/l的au的水分散液,室温下搅拌10min,得到红色的硅球纳米金复合物,离心并用超纯水洗涤3次备用,超声分散于2ml超纯水中,再转移至干净的西林瓶中备用。
83.(4)配制nabh4水溶液(0.1mol/l),冰浴备用。将步骤(3)的硅球与纳米金复合物于室温下剧烈搅拌,向上述西林瓶中的溶液加入0.2ml h2ptcl6水溶液(19.3mmol/l)与1ml1%(wt)柠檬酸钠水溶液,搅拌15min,最后快速加入1ml配制好的冰浴备用的nabh4水溶液,继续搅拌15min。静置1h,待溶液从棕色变为黑色,离心并用超纯水洗涤,重复3次,最终分散于2ml的超纯水中,即得制备好的纳米酶。
84.实施例2
85.首先将0.068g三乙醇胺(triethanolamine,tea)加入到25ml水中,80℃搅拌60min,随后加入0.380g十六氨基三甲基溴化铵(cetyltrimethylammonium bromide,ctab)和0.168g水杨酸钠(sodium salicylate),继续恒温搅拌1小时;随后向上述反应液中加入4ml正硅酸乙酯(tetraethyl orthosilicate,teos)(teos要在1min内快速加入),80℃继续搅拌15h。最后得到的溶液使用乙醇离心洗涤至少三次,以去除多余的反应试剂。将最后一次离心所得的沉淀物分散于30ml盐酸和30ml甲醇的混合溶液中,在60℃下连续搅拌10h,随后将反应液离心洗涤,所得沉淀物重新分散到100ml乙醇中,置于低于室温条件下备用。
86.(2)取400μl步骤(1)合成好的硅球,向其中加入448μl的(3-氨丙基)三甲氧基硅烷(aptes),于室温下搅拌6h。将搅拌后的溶液在9000rpm的条件下,离心4min,用乙醇洗涤离
心后的下层沉淀,重复洗涤三次。最终分散于10ml的乙醇中,制备得氨基化的硅球。
87.(3)取600μl步骤(2)配制好的氨基化的硅球,离心,用超纯水洗涤1次,吹干多余的乙醇,洗涤后超声分散于2ml超纯水中,转移至西林瓶中。向西林瓶中加入5.05ml11.6nmol/l的au的水分散液,室温下搅拌10min,得到红色的硅球纳米金复合物,离心并用超纯水洗涤3次备用,超声分散于2ml超纯水中,再转移至干净的西林瓶中备用。
88.(4)配制nabh4水溶液(0.1mol/l),冰浴备用。将步骤(3)的硅球与纳米金复合物于室温下剧烈搅拌,向上述西林瓶中的溶液加入0.22ml h2ptcl6水溶液(19.3mmol/l)与1ml1%(wt)柠檬酸钠水溶液,搅拌15min,最后快速加入1ml配制好的冰浴备用的nabh4水溶液,继续搅拌15min。静置1h,待溶液从棕色变为黑色,离心并用超纯水洗涤,重复3次,最终分散于2ml的超纯水中,即得制备好的纳米酶。
89.实施例3
90.首先将0.068g三乙醇胺(triethanolamine,tea)加入到25ml水中,80℃搅拌40min,随后加入0.380g十六氨基三甲基溴化铵(cetyltrimethylammonium bromide,ctab)和0.168g水杨酸钠(sodium salicylate),继续恒温搅拌1小时;随后向上述反应液中加入4ml正硅酸乙酯(tetraethyl orthosilicate,teos)(teos要在1min内快速加入),80℃继续搅拌14h。最后得到的溶液使用乙醇离心洗涤至少三次,以去除多余的反应试剂。将最后一次离心所得的沉淀物分散于30ml盐酸和30ml甲醇的混合溶液中,在60℃下连续搅拌9h,随后将反应液离心洗涤,所得沉淀物重新分散到100ml乙醇中,置于低于室温条件下备用。
91.(2)取400μl步骤(1)合成好的硅球,向其中加入390μl的(3-氨丙基)三甲氧基硅烷(aptes),于室温下搅拌7h。将搅拌后的溶液在7000rpm的条件下,离心8min,用乙醇洗涤离心后的下层沉淀,重复洗涤三次。最终分散于10ml的乙醇中,制备得氨基化的硅球。
92.(3)取600μl步骤(2)配制好的氨基化的硅球,离心,用超纯水洗涤1次,吹干多余的乙醇,洗涤后超声分散于2ml超纯水中,转移至西林瓶中。向西林瓶中加入5.01ml11.6nmol/l的au的水分散液,室温下搅拌10min,得到红色的硅球纳米金复合物,离心并用超纯水洗涤3次备用,超声分散于2ml超纯水中,再转移至干净的西林瓶中备用。
93.(4)配制nabh4水溶液(0.1mol/l),冰浴备用。将步骤(3)的硅球与纳米金复合物于室温下剧烈搅拌,向上述西林瓶中的溶液加入0.21ml h2ptcl6水溶液(19.3mmol/l)与1ml1%(wt)柠檬酸钠水溶液,搅拌15min,最后快速加入1ml配制好的冰浴备用的nabh4水溶液,继续搅拌15min。静置1h,待溶液从棕色变为黑色,离心并用超纯水洗涤,重复3次,最终分散于2ml的超纯水中,即得制备好的纳米酶。
94.实施例4
95.首先将0.068g三乙醇胺(triethanolamine,tea)加入到25ml水中,80℃搅拌50min,随后加入0.380g十六氨基三甲基溴化铵(cetyltrimethylammonium bromide,ctab)和0.168g水杨酸钠(sodium salicylate),继续恒温搅拌1小时;随后向上述反应液中加入4ml正硅酸乙酯(tetraethyl orthosilicate,teos)(teos要在1min内快速加入),80℃继续搅拌13h。最后得到的溶液使用乙醇离心洗涤至少三次,以去除多余的反应试剂。将最后一次离心所得的沉淀物分散于30ml盐酸和30ml甲醇的混合溶液中,在60℃下连续搅拌8h,随后将反应液离心洗涤,所得沉淀物重新分散到100ml乙醇中,置于低于室温条件下备用。
96.(2)取400μl步骤(1)合成好的硅球,向其中加入420μl的(3-氨丙基)三甲氧基硅烷
(aptes),于室温下搅拌6h。将搅拌后的溶液在5000rpm的条件下,离心10min,用乙醇洗涤离心后的下层沉淀,重复洗涤三次。最终分散于10ml的乙醇中,制备得氨基化的硅球。
97.(3)取600μl步骤(2)配制好的氨基化的硅球,离心,用超纯水洗涤1次,吹干多余的乙醇,洗涤后超声分散于2ml超纯水中,转移至西林瓶中。向西林瓶中加入4.97ml11.6nmol/l的au的水分散液,室温下搅拌10min,得到红色的硅球纳米金复合物,离心并用超纯水洗涤3次备用,超声分散于2ml超纯水中,再转移至干净的西林瓶中备用。
98.(4)配制nabh4水溶液(0.1mol/l),冰浴备用。将步骤(3)的硅球与纳米金复合物于室温下剧烈搅拌,向上述西林瓶中的溶液加入0.20ml h2ptcl6水溶液(19.3mmol/l)与1ml1%(wt)柠檬酸钠水溶液,搅拌15min,最后快速加入1ml配制好的冰浴备用的nabh4水溶液,继续搅拌15min。静置1h,待溶液从棕色变为黑色,离心并用超纯水洗涤,重复3次,最终分散于2ml的超纯水中,即得制备好的纳米酶。
99.性能检测
100.1、对实施例1步骤1中制备的枝状硅球进行扫描电镜分析,结果见图2,由图2可以看出,实施例1步骤1中制备的硅球具有一定大小的空腔,可以供其他离子附着。
101.2、对实施例1步骤3中制备得到的金-纳米硅球复合物粒子进行扫描电镜分析,结果见图3,由图3可以看出,通过氨基化硅球与金纳米粒子之间的静电作用,将金纳米离子吸附到硅球表面,且基本不改变硅球的大小。
102.3、对实施例1步骤4中制备得到的纳米酶进行扫描电镜分析,结果见图4,硅球表面通过静电作用负载了金纳米粒子与铂纳米粒子,形成最终的金-铂-硅基纳米酶材料,电镜图说明纳米粒子成功负载到硅球上且基本不改变样品尺寸。
103.4、对实施1中步骤1得到的硅球进行tem分析和元素mapping分析,对实施例1中步骤3和步骤4得到的金-纳米硅球复合物粒子和金-铂-硅基纳米酶粒子的元素mapping分析,结果见图5,结果表明,硅球以硅元素为基本骨架,通过对金与铂元素的mapping可知加入的两个元素成功负载到了硅球表面,纳米酶合成成功。
104.5、对实施例1中步骤1得到的硅球、步骤2得到的氨基化硅球、步骤3得到的金-纳米硅球复合物、步骤4得到的负载金与铂纳米粒子的金-铂-硅基纳米酶、金离子进行紫外分析,其结果见图6,结果表明,负载金后的硅球呈现金的特征峰,负载过铂后特征峰消失,金被铂覆盖,金-铂-硅基纳米酶合成成功。
105.6、对实施例1中步骤1得到的硅球、步骤2得到的氨基化硅球、步骤3得到的硅球-纳米金复合物、步骤4得到的金-铂-硅基纳米酶、金离子进行zeta电位检测,其结果见图7,结果表明,合成过程中各步骤的产物所带电荷不同,通过静电作用结合,对合成原理进行了解释。
106.7、对实施例1中步骤4制备得到的金-铂-硅基纳米酶进行tem检测,同时针对金、铂、硅、汞以及氧元素的mapping分析,其结果见图8,结果表明,在纳米酶制备成功的基础上,汞离子与纳米酶相互作用而负载到纳米酶表面。
107.8、对实施例1步骤4制备得到的金-铂-硅基纳米酶与汞离子以及序列干扰离子反应的紫外吸光度分析与颜色对比,其结果见图9,结果表明制备的材料对于汞离子的检测具有特异性,不受其他干扰离子的影响,性能稳定。
108.应用实施例
109.取实施例1制得的纳米酶,检测其对汞离子的检测灵敏度,检测方法如下:
110.(1)、配制200mmol/l的ph=5的醋酸缓冲溶液,60mmol/l的h2o2,100mmol/l的tmb溶液;
111.(2)、配制2.5
×
10-10
mol/l、2.5
×
10-9
mol/l、2.5
×
10-8
mol/l、2.5
×
10-7
mol/l、2.5
×
10-6
mol/l、2.5
×
10-5
mol/l的汞离子标准溶液;
112.(3)、依次取10μl的醋酸缓冲溶液,6.67μl的h2o2溶液至酶标板中,再向其中加入5μl实施例1中制备好的纳米酶,得到溶液x。
113.(4)、取步骤(2)中2.5
×
10-10
mol/l、2.5
×
10-9
mol/l、2.5
×
10-8
mol/l、2.5
×
10-7
mol/l、2.5
×
10-6
mol/l、2.5
×
10-5
mol/l的汞离子标准溶液10μl,分别与步骤(3)溶液x混合得到混合溶液1、混合溶液2、混合溶液3、混合溶液4、混合溶液5和混合溶液6,对上述混合溶液中加入0.4μl tmb溶液,静置20min至显色反应完全,观察并记录颜色的变化。
114.(5)、对步骤(4)中静置好的溶液进行紫外吸光度检测分析,记录在650nm处的吸光度并记录实验数据。
115.(6)、根据步骤(5)中的吸光度数据和对应的汞离子标准浓度线性拟合,获得汞离子含量换算公式y=kx+b,其中y为混合溶液1,混合溶液2,混合溶液3,混合溶液4,混合溶液5,混合溶液6的紫外吸光度,x为汞离子浓度,其中k值为斜率,b为常数,其结果见图10。
116.由以上结果可知,混合溶液中加入tmb溶液,静置20min之后,溶液的颜色由深蓝色变为浅蓝色,即使是少量的汞离子,也能产生明显的比色变化,容易被肉眼分辨出来。tmb体系的光谱,汞离子浓度从2.5
×
10-10
mol/l增加到2.5
×
10-5
mol/l时,tmb体系在650nm处的吸光度逐渐降低。650nm处对汞离子的吸光度在2.5
×
10-10
mol/l~2.5
×
10-5
mol/l范围内呈线性关系,相关系数为0.9659,汞离子的检测限(信噪比=3)为5pmol/l。说明纳米酶对于汞离子定性检测具有高灵敏性,同时构建了汞离子浓度与吸光度的关系,对于后期检测汞离子浓度提供了很大的便利。
117.以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1