无源微流控微反应器以及微流控芯片
1.本发明涉及微流控技术领域,特别是涉及一种无源微流控微反应器以及微流控芯片。
背景技术:
2.微流控技术凭借其集成化、自动化程度高、通量大、样本需求量少等优势被广泛应用,尤其在生物分析、化学反应、药物合成等方面具有巨大应用潜力。微流控芯片中生化过程的实现主要依赖于流体控制,且以完成两种或多种流体的混合为基础。因此,实现流体在微观尺度的快速混合在微流控分析领域至关重要。然而,由于微流道中流体仅能进行低雷诺数的单轴层流流动,流体混合主要依靠分子间单纯的扩散作用,混合速度慢、时间长且均一性差。
3.为了提高微流控系统中流体的混合效率,依赖外加压力场、超声场、电场和磁场等增加流体扰动的有源微反应器相继被开发,该类有源微反应器需要持续的能量输入,耗能大、成本高、散热困难且难以集成,不适于长期、高通量、大规模的应用。为了解决这一问题,借助特殊微流道结构增大流体对流接触面积、加快分子扩散速率的无源微反应器应运而生。例如,通过设计交错人字形混合器在微流道中引入横向流的无源微反应器,通过设计多层结构在微流道压力驱动流以外产生混沌流的无源微反应器,上述反应器加工难度大、成本高。又例如,通过引入迪恩漩涡增加流体扰动的无源微反应器,依赖于迪恩流的回流无源微反应器等,该类微反应器垂直壁面所受压强较大,能够承受的流体流速和通量有限,在实际应用中使用范围受限。
技术实现要素:
4.基于此,有必要针对现有微流控微反应器耗能大、成本高、加工复杂、通量低等问题,提供一种无源微流控微反应器。本发明的无源微流控微反应器结构简单、加工简便、通量大且尺寸范围大、应用范围广,符合微型全分析系统的集成要求。
5.一种无源微流控微反应器,包括入口区、过渡区、混合区以及采集区,所述入口区、所述过渡区、所述混合区以及所述采集区顺序连通,所述混合区包括相互连通的对流混合腔室与涡旋混合流道,所述对流混合腔室至少部分内壁呈弧形结构,所述涡旋混合流道至少部分内壁呈弧形结构。
6.在其中一些实施例中,所述入口区包括加样腔室以及与所述加样腔室连通的加样通道,所述加样通道还与所述过渡区连通。
7.在其中一些实施例中,所述加样腔室为圆柱形槽,所述加样腔室的内径为0.8~80mm,所述加样腔室的深度为0.5~50mm;
8.和/或,所述加样通道的长度为2~200mm,所述加样通道的深度为0.5~50mm;
9.和/或,所述加样通道内的流体流速控制为0.01~500ml/min。
10.在其中一些实施例中,所述过渡区的长度为3~300mm;
11.和/或,所述过渡区的宽度为0.3~30mm;
12.和/或,所述过渡区的高度为0.5~50mm。
13.在其中一些实施例中,所述对流混合腔室的数量与所述涡旋混合流道的数量均为多个,所述对流混合腔室与所述涡旋混合流道交替排列。
14.在其中一些实施例中,多个所述对流混合腔室与多个所述涡旋混合流道呈单行排列或者呈多行且迂回状分布,当多个所述对流混合腔室与多个所述涡旋混合流道呈多行分布时,,相邻的行之间通过所述涡旋混合流道连通。
15.在其中一些实施例中,所述涡旋混合流道呈圆弧形流道,每一行中的所述涡旋混合流道的内侧壁呈直径4.5~450mm的100
°
~120
°
圆弧状,外侧壁呈直径4.8~480mm的100
°
~120
°
圆弧状,所述涡旋混合流道的宽度为0.3~30mm,深度为0.5~50mm;
16.相邻的行之间的所述涡旋混合流道的内侧壁呈直径4.2~420mm的120
°
~150
°
圆弧状,外侧壁呈直径4.5~450mm的120
°
~150
°
圆弧状,所述涡旋混合流道的宽度为0.3~30mm,深度为0.5~50mm。
17.在其中一些实施例中,所述混合区首尾分别设置为所述对流混合腔室和所述涡旋混合流道,所述混合区通过首端的所述对流混合腔室与所述过渡区连通,所述混合区通过尾端的所述涡旋混合流道与所述采集区连通。
18.在其中一些实施例中,所述对流混合腔室的内侧壁包括多个不同半径的圆弧面组成,使得所述对流混合腔室的横向截面由一侧至相对的另一侧收窄,且所述对流混合腔室尺寸较小的一端用于进液,所述对流混合腔室尺寸较大的一端用于出液。
19.在其中一些实施例中,所述对流混合腔室的内侧壁包括第一圆弧面、第二圆弧面以及第三圆弧面,所述第一圆弧面的半径为0.3~30mm,所述第二圆弧面的半径为4~400mm,所述第三圆弧面的半径为1.5~150mm。
20.在其中一些实施例中,所述对流混合腔室设置有扰流件,所述扰流件至少部分外侧壁呈弧形结构。
21.在其中一些实施例中,所述扰流件连接于所述对流混合腔室的底壁,所述扰流件的外侧壁对流混合腔室的内侧壁之间具有间隔,所述扰流件的横向截面尺寸沿着液流方向逐渐增大;
22.和/或,所述扰流件在所述对流混合腔室的位置可调。
23.在其中一些实施例中,所述扰流件尺寸较大的一端的外侧壁的半径为10~1000mm,所述扰流件尺寸较小的一端的外侧壁的半径为1.3~130mm,所述扰流件尺寸较大的一端与所述扰流件尺寸较小的一端之间的外侧壁呈平面状。
24.在其中一些实施例中,所述采集区包括流体观察腔室、流体收集腔室以及收集流道,所述流体观察腔室与所述流体收集腔室连通,所述流体观察腔室还通过所述收集流道与所述混合区连通。
25.在其中一些实施例中,所述收集流道的内侧壁为直径为4.5~450mm的45
°
~60
°
圆弧状,外侧壁为直径为5~500mm,45
°
~60
°
圆弧状,所述收集流道的宽度为0.3~30mm,所述收集流道的高度为0.5~50mm;
26.和/或,所述流体观察腔室呈圆柱形槽,所述流体观察腔室的内径为1.5~150mm;
27.和/或,所述流体收集腔室呈圆柱形槽,所述流体收集腔室的内径为0.8~80mm。
28.在其中一些实施例中,所述无源微流控微反应器采用注塑工艺或3d打印工艺制备一体式结构或采用微加工工艺或机加工工艺制备分体式结构。
29.在其中一些实施例中,当所述无源微流控微反应器为一体式结构时,,所述无源微流控微反应器的基板制备材料包括丙烯腈-丁二烯-苯乙烯共聚物、聚酰胺、尼龙、聚对苯二甲酸丁二醇酯、聚乙醚以及聚甲基丙烯酸甲酯中的一种或几种。
30.在其中一些实施例中,当所述无源微流控微反应器为分体式结构时,所述无源微流控微反应器包括上层盖板以及下层底板,所述上层盖板上通过模具注塑、3d打印、机加工或软光刻工艺形成,所述上层盖板与所述下层底板连接以封闭所述上层盖板的各个流道和腔室。
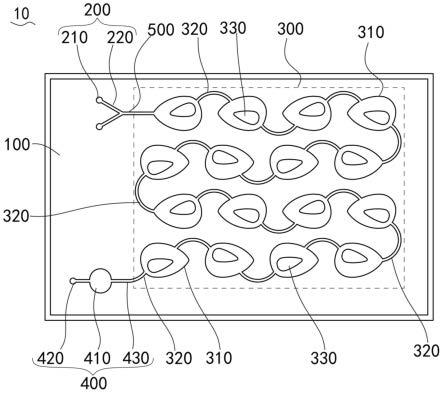
31.在其中一些实施例中,所述上层盖板的制备材料为聚二甲基硅氧烷、聚苯乙烯、塑料、纤维素、聚丙烯酰胺、聚乙烯聚丙烯、交联葡聚糖、玻璃、硅胶、硅片以及琼脂糖凝胶中的一种或多种;
32.和/或,所述下层底板的制备材料为硅片、玻璃、聚苯乙烯硬质材料或聚对苯二甲酸乙二醇酯、聚氨酯以及聚酰亚胺中的一种或多种。上述的无源微流控微反应器,结构简单、加工简便、通量大且尺寸范围大、应用范围广,符合微型全分析系统的集成要求,能够低成本、高通量地实现微观尺度上流体的高效混合。本发明的无源微流控微反应器以微流控技术为基础,通过对流混合腔室至少部分内侧壁呈弧形结构以及涡旋混合流道至少部分呈弧形结构的设置,对流体产生非线性离心力,促进流体对流界面的拉伸和折叠、增大流体接触面积,实现单相或多相流体在微观尺度上快速、高效混合。本发明的无源微流控微反应器通过其优异的混合特性可以应用于mof合成、纳米颗粒制备、液滴生产等领域,能够单独使用完成样本前处理、促发化学反应过程或完成生物样本分析,也能够与微流控系统集成,以辅助核酸和蛋白质提取与纯化、药物递送、细胞分选、高通量药物筛选等应用。
33.本发明的另一目的还在于提供一种微流控芯片。
34.一种微流控芯片,包括芯片主体以及设置在所述芯片主体上无源微流控微反应器。
35.本发明的微流控芯片集成了无源微反应器,使其能够广泛应用于核酸和蛋白质分离与纯化、纳米颗粒和液滴合成、药物递送、细胞分选、高通量药物筛选等领域,便于构建适合用户使用的微型全分析系统。
附图说明
36.为了更清楚地说明本技术实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单的介绍。显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对本领域技术人员来说,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
37.为了更完整地理解本技术及其有益效果,下面将结合附图来进行说明。其中,在下面的描述中相同的附图标号表示相同部分。
38.图1为本发明一实施例所述的无源微流控微反应器示意图;
39.图2为本发明一实施例无源微流控微反应器在待混合流体高流速下的comsol仿真图;
40.图3为两流体在本发明一实施例无源微流控微反应器中混合效率图;
41.图4为本发明一实施例无源微流控微反应器制备的脂质纳米颗粒负染后在透射电镜下的实物图;
42.图5为本发明一实施例无源微流控微反应器在不同流速比、浓度比条件下制备的脂质纳米颗粒粒径对比图;
43.图6为本发明一实施例无源微流控微反应器制备的脂质纳米颗粒载药系统对蛋白质的包载效率折线图。
44.附图标记说明
45.10、无源微流控微反应器;100、基板;200、入口区;210、加样腔室;220、加样通道;300、混合区;310、对流混合腔室;320、涡旋混合流道;330、扰流件;400、采集区;410、流体观察腔室;420、流体收集腔室;430、收集流道;500、过渡区。
具体实施方式
46.为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施例的限制。
47.在本发明的描述中,需要理解的是,术语“中心”、“纵向”、“横向”、“长度”、“宽度”、“厚度”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”、“内”、“外”、“顺时针”、“逆时针”、“轴向”、“径向”、“周向”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。
48.此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。在本发明的描述中,“多个”的含义是至少两个,例如两个,三个等,除非另有明确具体的限定。
49.在本发明中,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”、“固定”等术语应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或成一体;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通或两个元件的相互作用关系,除非另有明确的限定。对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本发明中的具体含义。
50.在本发明中,除非另有明确的规定和限定,第一特征在第二特征“上”或“下”可以是第一和第二特征直接接触,或第一和第二特征通过中间媒介间接接触。而且,第一特征在第二特征“之上”、“上方”和“上面”可是第一特征在第二特征正上方或斜上方,或仅仅表示第一特征水平高度高于第二特征。第一特征在第二特征“之下”、“下方”和“下面”可以是第一特征在第二特征正下方或斜下方,或仅仅表示第一特征水平高度小于第二特征。
51.需要说明的是,当元件被称为“固定于”或“设置于”另一个元件,它可以直接在另一个元件上或者也可以存在居中的元件。当一个元件被认为是“连接”另一个元件,它可以是直接连接到另一个元件或者可能同时存在居中元件。本文所使用的术语“垂直的”、“水平的”、“上”、“下”、“左”、“右”以及类似的表述只是为了说明的目的,并不表示是唯一的实施
方式。
52.在本发明的描述中,若干的含义是一个以上,多个的含义是两个以上,大于、小于、超过等理解为不包括本数,以上、以下、以内等理解为包括本数。如果有描述到第一、第二只是用于区分技术特征为目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量或者隐含指明所指示的技术特征的先后关系。
53.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
54.本技术实施例提供一种无源微流控微反应器10,以解决现有微流控微反应器耗能大、成本高、加工复杂、通量低等问题。以下将结合附图对进行说明。
55.本技术实施例提供的无源微流控微反应器10,示例性的,请参阅图1所示,图1为本技术实施例提供的无源微流控微反应器10的结构示意图。本技术的无源微流控微反应器10能够用于单独使用完成样本前处理、促发化学反应过程或完成生物样本分析,且也能够与微流控系统集成,以辅助核酸和蛋白质提取与纯化、细胞分选、高通量药物筛选等应用。
56.为了更清楚的说明无源微流控微反应器10的结构,以下将结合附图对无源微流控微反应器10进行介绍。
57.示例性的,请参阅图1所示,示例性的,一种无源微流控微反应器10,包括设置在基板100上的入口区200、过渡区500、混合区300以及采集区400。
58.请参阅图1所示,入口区200、过渡区500、混合区300以及采集区400顺序连通。混合区300包括对流混合腔室310与涡旋混合流道320。对流混合腔室310与涡旋混合流道320连通,需要说明的是,对流混合腔室310与涡旋混合流道320连通时,对流混合腔室310与涡旋混合流道320的顺序可以根据需要进行设置。对流混合腔室310至少部分内壁呈弧形结构,其中,上述的内壁包括侧壁与底壁。涡旋混合流道320至少部分内壁呈弧形结构。对流混合腔室310至少部分内壁呈弧形结构、涡旋混合流道320至少部分内壁呈弧形结构的设置,使混合流体产生非线性的离心力,在该区域形成以迪恩流和戈特勒涡为主的二次流,增大流体扰动,从而提高分子扩散效率。
59.在其中一些实施例中,过渡区500由一段水平直管道构成,汇聚来自入口区200的两种或多种流体,增大流体流速并将其输送进入混合区300。在一个具体示例中,过渡区500为直线型流道,不难理解,在其他实施例中,过过渡区500还可以是曲线型流道或者迂回型流道等。过渡区500连接混合区300的对流混合腔室310。
60.在其中一些实施例中,对流混合腔室310的底壁呈平面状,对流混合腔室310的至少部分内侧壁呈弧形结构。
61.在其中一些实施例中,请参阅图1所示,入口区200包括加样腔室210以及与加样腔室210连通的加样通道220。加样通道220还与混合区300连通。具体地,加样腔室210、加样通道220通过过渡区500与混合区300连通。
62.在其中一些实施例中,请参阅图1所示,加样腔室210的数量、加样通道220的数量均可以是多个,其中加样腔室210通过对应的加样通道220连通混合区300。加样腔室210可借助但不限于固定在注射器针头位置的微橡胶管道注入待混合流体。
63.加样腔室210内添加的内容物包括蛋白质、多肽、核酸、多糖、缓冲液、洗涤液、化学试剂或小分子等实验样本,包含细胞、细胞组分、磁珠等的悬浮液,包括血液、唾液、汗液、尿液等的体液。
64.在其中一些实施例中,加样腔室210为圆柱形槽,加样腔室210的内径为0.8~80mm,加样腔室210的深度为0.5~50mm。优选地,加样腔室210的内径为5~50mm,加样腔室210的深度为5~30mm。进一步优选地,加样腔室210的内径为10~30mm,加样腔室210的深度为10~20mm。例如,在其中一个具体示例中,加样腔室210的内径为0.8mm;在另一个具体示例中,加样腔室210的内径为80mm;不难理解,在其他实施例中,加样腔室210的内径还可以为1mm、5mm、8mm、10mm、15mm、20mm、24mm、30mm、36mm、40mm、47mm、52mm、60mm、65mm、70mm、75mm或者其他数值。例如,在其中一个具体示例中,加样腔室210的深度为0.5mm;在另一个具体示例中,加样腔室210的深度为50mm;不难理解,在其他实施例中,加样腔室210的深度还可以为1mm、5mm、8mm、10mm、15mm、20mm、24mm、30mm、36mm、40mm、47mm或者其他数值。
65.在其中一些实施例中,加样通道220的长度为2~200mm,加样通道220的深度为0.5~50mm。优选地,加样通道220的长度为10~100mm,加样通道220的深度为5~30mm。进一步优选地,加样通道220的长度为20~50mm,加样通道220的深度为10~20mm。例如,在其中一个具体示例中,加样通道220的长度为2mm,在另一个具体示例中,加样通道220的长度为100mm,不难理解,在其他示例中,加样通道220的长度还可以为5mm、8mm、10mm、15mm、20mm、24mm、30mm、36mm、40mm、47mm、52mm、60mm、65mm、70mm、80mm、90mm、100mm、105mm、108mm、110mm、115mm、120mm、125mm、130mm、136mm、140mm、145mm、155mm、160mm、165mm、170mm、180mm、190mm或者其他数值。例如,在其中一个具体示例中,加样通道220的深度为0.5mm;在另一个具体示例中,加样通道220的深度为50mm;不难理解,在其他实施例中,加样通道220的深度还可以为1mm、5mm、8mm、10mm、15mm、20mm、24mm、30mm、36mm、40mm、47mm或者其他数值。
66.在其中一些实施例中,加样通道220内的流体流速控制为0.01~500ml/min。优选地,加样通道220内的流体流速控制为0.1~200ml/min。更优选地,加样通道220内的流体流速控制为1~100ml/min。加样通道220内的流体流速应与无源微流控微反应器10的尺寸匹配,保证内部流道侧壁压力、腔室侧壁压力均不超过3mpa。进一步优选地,加样通道220内的流体流速控制为10~100ml/min。例如,在其中一个具体示例中,加样通道220内的流体流速控制为0.01ml/min。在另一个具体示例中,加样通道220内的流体流速控制为500ml/min。不难理解,在其他实施例中,加样通道220内的流体流速控制还可以为1ml/min、10ml/min、50ml/min、100ml/min、150ml/min、200ml/min、250ml/min、300ml/min、350ml/min、400ml/min、450ml/min或者其他数值。
67.在其中一些实施例中,过渡区500的长度为3~300mm。优选地,过渡区500的长度为10~200mm。更优选地,过渡区500的长度为50~100mm。例如,在其中一个具体示例中,过渡区500的长度为3mm、10mm、50mm、80mm、100mm、150mm、200mm、250mm或者其他数值。
68.在其中一些实施例中,过渡区500的宽度为0.3~30mm。优选地,过渡区500的宽度为1~10mm。例如,在其中一个具体示例中,过渡区500的宽度为0.3mm、1mm、5mm、10mm、15mm、20mm、25mm或者其他数值。
69.在其中一些实施例中,过渡区500的高度为0.5~50mm。优选地,过渡区500的高度
为1~20mm。例如,在其中一个具体示例中,过渡区500的高度为0.5mm、1mm、5mm、10mm、15mm、20mm、25mm、30mm、35mm、40mm、45mm或者其他数值。
70.在其中一些实施例中,对流混合腔室310的数量为多个。涡旋混合流道320的数量为多个。对流混合腔室310与涡旋混合流道320交替排列。对流混合腔室310的数量、涡旋混合流道320的数量可以根据实际需要进行设置。
71.在其中一些实施例中,多个对流混合腔室310与多个涡旋混合流道320呈多行且迂回状分布。相邻的行之间通过涡旋混合流道320连通。多个对流混合腔室310与多个涡旋混合流道320的排列方式也可以根据实际需要进行设置。
72.在其中一些实施例中,涡旋混合流道320呈圆弧形流道,每一行中的涡旋混合流道320的内侧壁呈直径4.5~450mm的100
°
~120
°
圆弧状,外侧壁呈直径4.8~480mm的100
°‑
120
°
圆弧状,涡旋混合流道320的宽度为0.3~30mm,深度为0.5~50mm。
73.相邻的行之间的涡旋混合流道320的内侧壁呈直径4.2~420mm的120
°
~150
°
圆弧状,外侧壁呈直径4.5~450mm的120
°
~150
°
圆弧状,涡旋混合流道320的宽度为0.3~30mm,深度为0.5~50mm。
74.不难理解,在其他实施例中,涡旋混合流道320还可以是完成成迂回状结构。
75.在其中一些实施例中,参见图1所示,混合区300首尾依次设置为对流混合腔室310和涡旋混合流道320。混合区300通过首端的对流混合腔室310与过渡区500连通。混合区300通过尾端的涡旋混合流道320与采集区400连通。尾端的涡旋混合流道320的长度可以适当的减小,以适配采集区400即可。
76.在其中一些实施例中,对流混合腔室310的内侧壁包括多个不同半径的圆弧面组成,使得对流混合腔室310的横向截面呈由一侧至相对的另一侧收窄的水滴状,且对流混合腔室310尺寸较小的一端用于进液,对流混合腔室310尺寸较大的一端用于出液,参见图1所示角度,对流混合腔室310左侧位置尺寸较小的一端用于进液,对流混合腔室310右侧位置尺寸较大的一端用于出液。
77.在其中一些实施例中,对流混合腔室310的内侧壁包括第一圆弧面、第二圆弧面以及第三圆弧面。第一圆弧面的半径为0.3~30mm,第二圆弧面的半径为4~400mm,第三圆弧面的半径为1.5~150mm。例如,参见图1所示,第一圆弧面的半径为30mm,第二圆弧面的半径为100mm,第三圆弧面的半径为80mm,使得对流混合腔室310的水平截面呈水滴状结构。
78.在其中一些实施例中,对流混合腔室310设置有扰流件330,扰流件330至少部分外侧壁呈弧形结构。扰流件330能够将两相或多相流体分成两股流体,并使得流体在与涡旋混合流道320连接位置再次碰撞汇聚,实现流体的对流混合、分流混合和二次碰撞后对流混合,增大流体流动过程中的接触面积,提高流体混合效率。
79.在其中一些实施例中,扰流件330连接于对流混合腔室310的底壁,扰流件330的外侧壁对流混合腔室310的内侧壁之间具有间隔,扰流件330的横向截面尺寸沿着液流方向逐渐增大。
80.在其中一些实施例中,扰流件330在对流混合腔室310的位置可调。
81.在其中一些实施例中,扰流件330尺寸较大的一端的外侧壁的半径为10~1000mm,扰流件330尺寸较小的一端的外侧壁的半径为1.3~130mm,扰流件330尺寸较大的一端与扰流件330尺寸较小的一端之间的外侧壁呈平面状。例如,参见图1所示,扰流件330尺寸较大
的一端的外侧壁的半径为80mm,扰流件330尺寸较小的一端的外侧壁的半径为15mm,扰流件330尺寸较大的一端与扰流件330尺寸较小的一端之间的外侧壁呈平面状,使得扰流件330的水平截面呈水滴状。扰流件330的设置方向与对流混合腔室310一致,参见图1所示,也即,扰流件330的尺寸较小的一端与对流混合腔室310尺寸较小的一端同向,扰流件330的尺寸较大的一端与对流混合腔室310尺寸较大的一端同向。
82.在其中一些实施例中,采集区400包括流体观察腔室410、流体收集腔室420以及收集流道430。流体观察腔室410与流体收集腔室420连通,流体观察腔室410还通过收集流道430与混合区300连通,具体地,流体观察腔室410还通过收集流道430与混合区300的尾端的涡旋混合流道320连通。
83.在其中一些实施例中,收集流道430的内侧壁为直径为4.5-450mm的45
°
~60
°
圆弧状。外侧壁为直径为5~500mm,45
°
~60
°
圆弧状。收集流道430的宽度为0.3~30mm,收集流道430的高度为0.5~50mm。
84.在其中一些实施例中,流体观察腔室410呈圆柱形槽,流体观察腔室410的内径为1.5~150mm。例如,在其中一个具体示例中,流体观察腔室410的内径为1.5mm、10mm、20mm、30mm、40mm、50mm、60mm、70mm、80mm、90mm、100mm、110mm、120mm、130mm、140mm、150mm或者其他数值。
85.在其中一些实施例中,流体收集腔室420呈圆柱形槽,流体收集腔室420的内径为0.8~80mm。例如,在其中一个具体示例中,流体收集腔室420的内径为0.8mm、5mm、10mm、20mm、30mm、40mm、50mm、60mm、70mm、80mm或者其他数值。
86.在其中一些实施例中,基板100采用注塑工艺或3d打印工艺制备使得无源微流控微反应器10呈一体式结构。当无源微流控微反应器10为一体式结构时,基板100的制备材料包括丙烯腈-丁二烯-苯乙烯共聚物(abs)、聚酰胺(pa)、尼龙、聚对苯二甲酸丁二醇酯(pbt)、聚乙醚(pei)以及聚甲基丙烯酸甲酯(pmma)中的一种或几种。
87.在其中一些实施例中,基板100采用微加工工艺或机加工工艺制备使得无源微流控微反应器10呈分体式结构。当无源微流控微反应器10呈分体式结构时,基板100包括上层盖板以及下层底板。上层盖板与下层底板连接。上层盖板上通过模具注塑、3d打印、机加工或软光刻工艺形成流道和腔室(此时流道和腔室为非封闭状态),模具可以通过机械加工、3d打印或者激光雕刻方法形成。再通过下层底板封闭上层盖板以得到封闭的流道和腔室,以形成入口区200、混合区300、过渡区500以及采集区400等。
88.在其中一些实施例中,上层盖板的制备材料为聚二甲基硅氧烷(pdms)、聚苯乙烯(ps)、塑料、纤维素、聚丙烯酰胺(pam)、聚乙烯聚丙烯(pp)、交联葡聚糖、玻璃、硅胶、硅片以及琼脂糖凝胶中的一种或多种。
89.在其中一些实施例中,下层底板的制备材料为硅片、玻璃、聚苯乙烯(ps)等硬质材料或聚对苯二甲酸乙二醇酯(pet)、聚氨酯(tpu)以及聚酰亚胺(pi)中的一种或多种。
90.在其中一些实施例中,上述的无源微流控微反应器10可使用但不限于氧气等离子体清洗、紫外光接枝、嵌段聚合物修饰等方法进行材料表面改性,改善无源微流控微反应器10的亲疏水性。
91.上述的无源微流控微反应器10,结构简单、加工简便、通量大且尺寸范围大、应用范围广,符合微型全分析系统的集成要求,能够低成本、高通量地实现微观尺度上流体的高
效混合。本发明的无源微流控微反应器10以微流控技术为基础,通过对流混合腔室310至少部分内侧壁呈弧形结构以及涡旋混合流道320至少部分呈弧形结构的设置,对流体产生非线性离心力,促进流体对流界面的拉伸和折叠、增大流体接触面积,实现单相或多相流体在微观尺度上快速、高效混合。本发明的无源微流控微反应器10通过其优异的混合特性可以应用于mof合成、纳米颗粒制备、液滴生产等领域,能够单独使用完成样本前处理、促发化学反应过程或完成生物样本分析,也能够与微流控系统集成,以辅助核酸和蛋白质提取与纯化、细胞分选、高通量药物筛选等应用。
92.本发明的另一目的还在于提供一种微流控芯片。
93.一种微流控芯片,包括芯片主体以及设置在芯片主体上无源微流控微反应器10。
94.本发明的微流控芯片集成了无源微反应器,使其能够广泛应用于核酸和蛋白质分离与纯化、纳米颗粒和液滴合成、细胞分选、高通量药物筛选等领域,便于构建适合用户使用的微型全分析系统。
95.实施例1
96.本实施例提供了一种无源微流控微反应器10。
97.参见图1所示,本实施例的无源微流控微反应器10的基板100总尺寸为长5cm,宽3cm,高2mm。无源微流控微反应器10,包括设置在基板100上的入口区200、混合区300以及采集区400。
98.入口区200、混合区300以及采集区400顺序连通。混合区300包括对流混合腔室310与涡旋混合流道320。对流混合腔室310与涡旋混合流道320连通。涡旋混合流道320内侧壁呈弧形结构。对流混合腔室310的底壁呈平面状,对流混合腔室310的内侧壁呈弧形结构。
99.入口区200包括加样腔室210以及与加样腔室210连通的加样通道220,加样腔室210、加样通道220以及混合区300依次顺序连通。加样腔室210的数量、加样通道220的数量为两个,其中加样腔室210通过对应的加样通道220连通混合区300。加样腔室210为圆柱形槽,加样腔室210的内径为0.8mm,加样腔室210的深度为0.5mm。加样通道220的长度为2mm。
100.基板100上设置有过渡区500,过渡区500位于入口区200与混合区300之间,过渡区500用于连通入口区200与混合区300。过渡区500的长度为3mm,过渡区500的宽度为0.3mm,过渡区500的高度为0.5mm。
101.对流混合腔室310的数量为16个。涡旋混合流道320的数量为16个。对流混合腔室310与涡旋混合流道320交替排列。多个对流混合腔室310与多个涡旋混合流道320呈四行且迂回状分布。相邻的行之间通过涡旋混合流道320连通。混合区300首尾分别设置为对流混合腔室310和涡旋混合流道320。混合区300通过首端的对流混合腔室310与入口区200连通。混合区300通过尾端的涡旋混合流道320与采集区400连通。
102.对流混合腔室310的内侧壁包括第一圆弧面、第二圆弧面以及第三圆弧面。第一圆弧面的半径为0.3mm,第二圆弧面的半径为4mm,第三圆弧面的半径为1.5mm,使得对流混合腔室310的水平截面呈水滴状结构。第一圆弧面、第二圆弧面上预留0.3mm宽度的开口与对应的涡旋混合流道320衔接。
103.对流混合腔室310的底壁设置有扰流件330,扰流件330外侧壁呈弧形结构。扰流件330的外侧壁对流混合腔室310的内侧壁之间具有间隔,扰流件330的横向截面尺寸沿着液流方向逐渐增大。扰流件330尺寸较大的一端的外侧壁的半径为10mm,扰流件330尺寸较小
的一端的外侧壁的半径为1.3mm,扰流件330尺寸较大的一端与扰流件330尺寸较小的一端之间的外侧壁呈长度为0.2mm的平面状。扰流件330的设置方向与对流混合腔室310一致,参见图1所示,也即,扰流件330的尺寸较小的一端与对流混合腔室310尺寸较小的一端同向,扰流件330的尺寸较大的一端与对流混合腔室310尺寸较大的一端同向。扰流件330的高度为0.5mm。
104.涡旋混合流道320呈圆弧形流道,每一行中的涡旋混合流道320的内侧壁呈直径4.5mm的104
°
圆弧状,外侧壁呈直径4.8mm的106
°
圆弧状,涡旋混合流道320的宽度为0.3mm,深度为0.5mm。相邻的行之间的涡旋混合流道320的内侧壁呈直径4.2mm的134
°
圆弧状,外侧壁呈直径4.5mm的134
°
圆弧状,涡旋混合流道320的宽度为0.3mm,深度为0.5mm。
105.在其中一些实施例中,对流混合腔室310的内侧壁包括多个不同半径的圆弧面组成,使得对流混合腔室310的横向截面呈由一侧至相对的另一侧收窄的水滴状,且对流混合腔室310尺寸较小的一端用于进液,对流混合腔室310尺寸较大的一端用于出液,参见图1所示角度,对流混合腔室310左侧位置尺寸较小的一端用于进液,对流混合腔室310右侧位置尺寸较大的一端用于出液。
106.采集区400包括流体观察腔室410、流体收集腔室420以及收集流道430。流体观察腔室410与流体收集腔室420连通,流体观察腔室410还通过收集流道430与混合区300连通,具体地,流体观察腔室410通过收集流道430与混合区300的尾端的涡旋混合流道320连通。流体观察腔室410与流体收集腔室420之间通过长度3.5mm的水平流道连通,该水平流道的高度为0.5mm。
107.流体观察腔室410呈圆柱形槽,流体观察腔室410的内径为1.5mm。流体收集腔室420呈圆柱形槽,流体收集腔室420的内径为0.8mm。收集流道430的内侧壁为直径为4.5mm的45
°
圆弧状。外侧壁为直径为5mm,45
°
圆弧状。收集流道430的宽度为0.3mm,收集流道430的高度为0.5mm。
108.本实施例的无源微流控微反应器10在待混合流体高流速下的comsol仿真图,如图2所示,两相流体以超过1ml/min的较高流速进入微反应器时,经历5个混对流混合腔室310后流体完全混合。
109.本实施例的基板100采用分体式制备。基板100包括上层盖板以及下层底板。上层盖板与下层底板连接。上层盖板上通过机械加工、3d打印或者激光雕刻方法打印模具,清洗后保证模具表面洁净平整。随后,将pdms、固化剂、用于表面修饰的f108嵌段聚合物混合搅拌后抽真空排气泡,将上述pdms混合物均匀倾倒在模具表面,80℃固化后剥离、打孔、清洗,得到上层盖板,上层盖板具有流道和腔室(此时流道和腔室为非封闭状态)。对用作下层盖板的玻璃片进行清洗,将上层盖板与下层底板正面向上进行氧气等离子体清洗处理,活化后将上层盖板与下层底板层快速键合,55℃固定一段时间后得到具有入口区200、混合区300、过渡区500以及采集区400的无源微流控微反应器10。
110.实施例2
111.本实施例提供了一种无源微流控微反应器10的应用。
112.本实施例采用实施例1的无源微流控微反应器10,包括如下步骤:
113.在无源微流控微反应器10入口区200分别连接两个固定在注射器针头位置的微橡胶管道,注射器中填充待混合流体,流体流速由注射泵控制。
114.使用不同颜色染料对无源微流控微反应器10进行混合验证。两个与入口区200连通的注射器分别包含两种不同颜色的染料,具体为亮蓝素蓝色染料溶液和柠檬黄黄色染料溶液,两流体进入无源微流控微反应器10的速率均为0.5ml/min。两流体在无源微流控微反应器10中混合效率如图3所示,低流速的两相流体在经过12个对流混合腔室310后实现了完全混合,在采集区400能够观察和收集到均质的绿色染料。
115.实施例3
116.本实施例提供了一种无源微流控微反应器10的应用。
117.本实施例采用实施例1的无源微流控微反应器10,包括如下步骤:
118.无源微流控微反应器10实现了纯水相和包含脂质的有机相的高效快速混合,使得脂质分子在浓度快速降低的有机相中自组装在采集区得到粒径均一稳定的脂质纳米颗粒。无源微流控微反应器10两个与入口区200连通的注射器分别填充水相和有机相。其中水相为无杂质的超纯水,有机相为包含1%卵磷脂和0.1%胆固醇的乙醇溶液。
119.水相进入无源微流控微反应器10入口区200的流速为0.9ml/min,有机相进入入口区200的流速为0.3ml/min,控制两相流体的流速比为3:1,总流速为1.2ml/min。
120.两相流体在无源微流控微反应器10中快速混合,有机相浓度急剧下降,使得脂质分子快速自组装,亲水的头部基团包裹疏水的尾部碳链组装成球状脂质纳米颗粒。两相流体在无源微流控微反应器10中混合速率和混合均一性对于脂质纳米颗粒自组装粒径影响较大,当两相流快速混合形成均质液时,脂质纳米颗粒自组装速率较为一致,通过无源微流控微反应器10所得的脂质纳米颗粒粒径尤其均匀。
121.通过无源微流控微反应器10制备的脂质纳米颗粒负染后在透射电镜下的实物图如图4所示,脂质纳米颗粒性状一致、粒径均匀、分散效果良好,证明两相流进入无源微流控微反应器10后迅速混合,有机相不存在浓度梯度。
122.使用动态光散射方法对无源微流控微反应器10在不同流速比、浓度比条件下制备的脂质纳米颗粒粒径进行统计,统计结果如图5所示(图5中,横坐标为流速比,纵坐标为脂质纳米颗粒粒径)。随着两相流流速比、脂质浓度比的变化,所述无源微流控微反应器10可以均匀制备粒径横跨20-200nm的脂质纳米颗粒,可根据实际应用需要选择对应的两相流流速、脂质纳米颗粒浓度比,得到大小均一、尺寸理想的脂质纳米颗粒。
123.实施例4
124.本实施例提供了一种无源微流控微反应器10的应用。
125.本实施例采用实施例1的无源微流控微反应器10,包括如下步骤:
126.无源微流控微反应器10实现了用于蛋白质包载的脂质纳米载药系统。所述两个与入口区200连通的注射器分别填充水相和有机相。其中水相为溶解了不同浓度牛血清蛋白(bsa)的磷酸缓冲液(pbs),bsa蛋白原液为2mg/ml,实验所使用的蛋白溶液均为使用pbs稀释的原液,浓度梯度横跨0.1-2mg/ml。有机相为包含1%卵磷脂和0.1%胆固醇的乙醇溶液。
127.水相进入无源微流控微反应器10入口区200的流速为0.9ml/min,有机相进入入口区200的流速为0.3ml/min,控制两相流体的流速比为3:1,总流速为1.2ml/min。
128.使用bca蛋白定量发计算未被包裹的bsa浓度,评估无源微流控微反应器10制备的脂质纳米颗粒载药系统对蛋白质的包载效率,载药效率折线图如图6所示(图6中,纵坐标为包载效率,横坐标为蛋白质含量),脂质纳米颗粒载药效率高达88.2%,证明在脂质纳米颗
粒自组装过程中bsa蛋白均匀分布在溶剂中,能够被随机组装的脂质纳米颗粒载药系统无差别包载,进一步证明了进入无源微流控微反应器10的两相流体混合速度快、效率高。
129.无源微流控微反应器10实现了用于核酸包载的脂质纳米载药系统。所述两个与入口区200连通的注射器分别填充水相和有机相。其中水相为浓度为670μg/ml的mirna溶液(54μm),depc水为mirna溶液溶剂。有机相为包含1%卵磷脂和0.1%胆固醇的乙醇溶液。
130.水相进入无源微流控微反应器10入口区200的流速为0.9ml/min,有机相进入入口区200的流速为0.3ml/min,控制两相流体的流速比为3:1,总流速为1.2ml/min。
131.综上所示,本发明所述的无源微流控微反应器10在能够高效快速实现低雷诺数层流流体的均匀混合,对于构建面向核酸和蛋白质分析、细胞分选、高通量药物筛选、纳米药物递送系统制备等微流控系统具有良好的通用性。
132.在上述实施例中,对各个实施例的描述都各有侧重,某个实施例中没有详述的部分,可以参见其他实施例的相关描述。
133.以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
134.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1