一种固相微萃取探针、制备方法及其在生物胺检测中的应用
1.本发明属于生物胺检测技术领域,具体涉及一种固相微萃取探针的制备方法及其在生物胺检测中的应用。
背景技术:
2.生物胺(biogenic amines,bas)是一类具有生物活性的含氮有机小分子化合物的总称,主要是由相应的氨基酸通过微生物的脱羧作用形成或由醛、酮类物质,在氨基酸转氨酶作用下进一步产生。食品中存在的生物胺主要包括色胺(try)、苯乙胺(phe)、腐胺(put)、尸胺(cad)、组胺(his)、酪胺(tyr)、亚精胺(spd)和精胺(spm),在发酵,熏制类的肉制品中广泛存在。人体自身可以合成一些微量的生物胺,满足机体基本的新陈代谢,而过量摄入生物胺后,会引起呼吸困难、痉挛、头痛等一系列中毒症状,严重危害了人体健康。而发展能够有效萃取出样品中的生物胺的样品前处理技术,对相关研究的开展至关重要。
3.固相微萃取技术(solid phase microextraction,spme)是将少量吸附材料通过物理或化学的方法固定于金属棒或光纤等材质表面制备成萃取探针再将萃取探针暴露于样品体系中,对待测物进行萃取、富集、进样和解吸的一种适用于实验室和现场样品检测的新型前处理技术。该技术的使用可以简化复杂的样品前处理过程,简化操作步骤、节约试剂消耗,提升分析效率。并且该技术可以与色谱、质谱等多种高效分析检测仪器联用,实现定量分析。萃取涂层是spme的核心,不同涂层材料对不同性质的目标分析物有着不同的作用。
4.常用的商用探针价格昂贵,均价在1000元左右每支,对生物胺的萃取性能不理想,机械性能差,容易损坏。因此,开发一种对生物胺具有较好萃取性能,机械性能好,造价低廉的探针在分析检测中至关重要。
技术实现要素:
5.本发明所要解决的第一个技术问题是针对现有技术的现状,提供一种机械性能较好、对生物胺萃取性能较强的固相微萃取探针。
6.本发明所要解决的第二个技术问题是针对现有技术的现状,提供一种固相微萃取探针的制备方法。
7.本发明所要解决的第三个技术问题是针对现有技术的现状,提供一种固相微萃取探针在生物胺检测中的应用。
8.本发明解决上述第一个技术问题所采用的技术方案为:一种固相微萃取探针,包括金属棒和涂覆于金属棒上的表面涂层,其特征在于:
9.所述表面涂层由mcm-t-h材料和聚丙烯腈组成。
10.本发明解决上述第二个技术问题所采用的技术方案为:一种制备如上述的微萃取探针的制备方法,其特征在于:
11.所述mcm-t-h材料采用如下方法制得:
12.步骤s1、mcm-41合成:取1.25g的十六烷基三甲基溴化铵与490ml质量百分比为
14%的氨水溶液混合、于60℃下均匀搅拌,然后逐滴滴加10ml硅酸四乙酯到上述混合溶液中直至产生白色浆状物;反应2h后冷却、过滤并用去离子水清洗多次;最终产物再高温煅烧12h去除十六烷基三甲基溴化铵即得到mcm-41;
13.步骤s2、mcm-t合成:取上述合成的mcm-41材料1g置于容器中,加入50ml 甲苯以及50μl的钛酸异丙酯,摇晃均匀,通入氮气,在氮气保护的氛围下加热,升温至80℃,冷凝回流2h,离心后,得到的固体用甲苯与水反复清洗后,在80℃真空干燥条件下干燥过夜;
14.步骤s3、mcm-t-h合成:取0.5g上述合成的mcm-t,与100ml质量百分比2.5%的十二烷基硫酸钠水溶液混合搅拌1h,过滤后,将白色沉淀物放置在真空干燥箱中干燥过夜,然后将材料置于200℃的马弗炉中煅烧30min,冷却至室温后,用无水乙醇清洗,抽滤得到样品,真空干燥后研磨,保存。
15.mcm-t-h涂层的制备方法可以有多种,优选地,还包括
16.步骤a:用丙酮和乙醇反复清洗金属棒表面,去除表面油污及杂质;然后,将金属棒置于浓盐酸中腐蚀5min,形成粗糙的表面,然后用去离子水清洗,并干燥,备用;将100mg聚丙烯腈与2ml n,n-二甲基甲酰胺混合,在80℃条件下加热,辅助磁力搅拌,使聚丙烯腈完全溶解并与n,n-二甲基甲酰胺混合均匀;
17.步骤b:然后加入20mg的mcm-t-h材料混合并搅拌过夜得到含mcm-t-h的涂覆液;将步骤a最终得到的空白金属棒缓慢浸入涂覆液中并取出,然后将其置于100℃的干燥箱中干燥5min,去除表面有机溶剂,然后再次浸入涂覆液并干燥,重复多次。
18.通过添加聚丙烯腈,一方面作为粘附剂,将mcm-t-h和金属棒相连;另一方面增加了探针的机械性能,探针不容易损坏。
19.优选地,在所述步骤a中,所述金属棒直径为320μm,金属棒长度为7~10cm;
20.在所述步骤b中,所述金属棒在涂覆液中的浸渍提拉次数为15次。
21.优选地,所述表面涂层长度为0.8~1.2cm,厚度为4μm。
22.本发明解决上述第三个技术问题所采用的技术方案为:如上述的固相微萃取探针在生物胺检测中的应用。
23.生物胺的检测方式有多种,优选地,所述生物胺检测采用气相色谱-质谱检测。
24.为了去除固相微萃取探针上的挥发性成分(例如去除n,n-二甲基甲酰胺),并提高表面涂层与金属棒之间的牢固性,所述气相色谱检测前,将所述固相微萃取探针置于气相色谱-质谱仪进样口250℃条件下老化1h。这样,可以防止实验时挥发性成分对实验结果造成干扰,亦可以延长探针的使用寿命。
25.检测的条件具体是,所述气相色谱的检测条件包括:
26.进样口温度250℃;进样量1μl;氦气为载气;流速1ml min-1
;不分流模式;
27.根据以下温度程序:初始温度50min,以50℃min-1
的速率升至100℃,在100℃下保持1.2min,再以10℃min-1
速率加到160℃,最后再以25℃min-1
速率加到280℃,并保持12min;总运行时间为25min;
28.所述质谱的检测条件包括:辅助加热器的温度为280℃,离子源温度230℃,四级杆温度150℃,采集类型为扫描模式。
29.与现有技术相比,本发明的优点在于:本发明制备的固相微萃取探针,采用功能化的有序介孔硅材料mcm-t-h涂覆,mcm-t-h由基础材料mcm-41逐步修饰制得, mcm-41是一种
被广泛认可的介孔硅材料,该材料具有较大的孔体积和比表面积,其结构表面富含羟基,具有天然的酸性,与碱性的生物胺具有较好的亲和力,通过钛酸异丙酯(ttip)的修饰(即ti加入介孔二氧化硅mcm-41后),增强了材料的酸性,从而增强了材料对生物胺的吸附亲和性;十二烷基硫酸钠(sds)的修饰,亦提高了材料疏水性,使得疏水表面不易被水分子干扰,从而有更多的吸附位点可以吸附生物胺;聚丙烯腈的添加进一步提高表面涂层的机械稳定性及热稳定性,对应地,使制备的探针不容易损坏及能更好地通过热解吸法与气相色谱-质谱联用。
30.该固相微萃取探针的制备方法简单,造价便宜,与市售商品化的探针相比,本发明制备的探针对生物胺具有更好的萃取效率和机械稳定性,结合gc-ms能够对苯乙胺、腐胺、尸胺、组胺、色胺、酪胺进行定量分析。
附图说明
31.图1为固相微萃取探针制备方法及固相微萃取法检测生物胺的原理示意图;
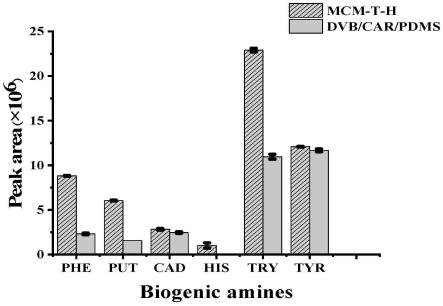
32.图2为本发明实施例的固相微萃取探针与商品化的dvb/car/pdms探针对生物胺的萃取效率对比图;
33.图3为应用实施例1的固相微萃取探针用于7天内青占鱼肉样品中生物胺浓度变化情况的分析检测;
34.图4为应用实施例1的固相微萃取探针用于7天内猪肉样品中生物胺浓度变化情况的分析检测;
35.图5中a),c)为空白金属棒的扫描电镜图;b),d)为涂覆有mcm-t-h的金属棒的扫描电镜图;
36.图6为涂覆mcm-t-h的金属棒截面;
37.图7为本发明实施例的mcm-t-h的扫描电子显微镜图;
38.图8为本发明实施例的mcm-t-h的透视电子显微镜图;
39.图9为不同浓度的十六烷基三甲基溴化铵(ctab)、钛酸异丙酯(ttip)和十二烷基硫酸钠(sds)的添加量的优化实验图。
具体实施方式
40.以下结合附图实施例对本发明作进一步详细描述。
41.实施例1
42.本发明实施例的固相微萃取探针包括金属棒和涂覆于金属棒上的表面涂层,表面涂层由mcm-t-h材料和聚丙烯腈组成。
43.上述的固相微萃取探针的制备方法,如下。
44.上述mcm-t-h材料采用如下方法制得:
45.步骤s1、mcm-41合成:取1.25g的十六烷基三甲基溴化铵(即模板分子,记作 ctab)与490ml质量百分比为14%的氨水溶液混合、于60℃下均匀搅拌,然后逐滴滴加硅酸四乙酯(约加入10ml)到上述混合溶液中直至产生白色浆状物;反应2h 后冷却、过滤并用去离子水清洗多次;最终产物再高温煅烧12h去除十六烷基三甲基溴化铵(即去除模板分子)即得到mcm-41;
46.步骤s2、mcm-t合成:取上述合成的mcm-41材料1g置于容器中,加入50ml 甲苯以及50μl的钛酸异丙酯(ttip),摇晃均匀,通入氮气,在氮气保护的氛围下加热,升温至80℃,冷凝回流2h,离心后,得到的固体用甲苯与水反复清洗后,在80℃真空干燥条件下干燥过夜;
47.步骤s3、mcm-t-h合成:取0.5g上述合成的mcm-t,与100ml质量百分比2.5%的十二烷基硫酸钠(sds)水溶液混合搅拌1h,过滤后,将白色沉淀物(即mcm-t-h) 放置于真空干燥箱中干燥过夜,然后将材料置于200℃的马弗炉中煅烧30min,冷却至室温后,用无水乙醇清洗,抽滤得到样品,真空干燥后研磨,保存。所得mcm-t-h的 sem图及tem图如图7,图8所示,mcm-t-h直径为200-400nm,介孔孔径约为2.5 nm,修饰层厚度约为8.8nm。
48.制备方法还包括步骤a:用丙酮和乙醇反复清洗金属棒(金属棒可以采用不锈钢材质,也可以采用其它金属材质)表面,去除表面油污及杂质;然后,将金属棒置于浓盐酸中腐蚀5min,形成粗糙的表面,然后用去离子水清洗,并干燥,备用;用聚丙烯腈(polyacrylonitrile,pan)作为粘附剂制备mcm-t-h涂层,具体是将100mg聚丙烯腈与2 ml n,n-二甲基甲酰胺(dmf)混合,在80℃条件下加热,辅助磁力搅拌,使pan完全溶解并与dmf混合均匀;金属棒直径为320μm(图5),金属棒长度为7~10cm,例如金属棒长度可以为7cm、8cm、10cm。
49.步骤b:然后加入20mg的mcm-t-h材料混合并搅拌过夜得到含mcm-t-h的涂覆液;将空白金属棒缓慢浸入涂覆液中并取出,然后将其置于100℃的干燥箱中干燥5 min,去除表面有机溶剂,然后再次浸入涂覆液并干燥,重复多次,优选地,在涂覆液中的浸渍提拉次数为15次,如图1所示。最终,表面涂层长度为0.8~1.2cm,例如可以是0.8cm、1.0cm和1.2cm,厚度为4μm(如图6所示)。
50.本实施例还提供上述的固相微萃取探针在生物胺检测中的应用。生物胺检测采用气相色谱-质谱(gc-ms)检测。
51.实施例2
52.为了对实施例1中的固相微萃取探针与商品化的萃取探针的生物胺富集性能进行比较。气相色谱检测前,将固相微萃取探针置于gc-ms仪进样口250℃条件下老化1h(即加热1h)。取10ml浓度为5mg l-1
,ph=11的生物胺标准样品混合溶液于20ml顶空瓶中,加入10ul氯甲酸异丁酯(即衍生试剂),将上述的固相微萃取探针或商品化的二乙烯基苯/carboxen/聚二甲基硅氧烷(dvb/car/pdms)探针(购自supelco,bellefonte, usa)置于溶液中,辅助磁力搅拌器以1250r min-1
的搅拌速率吸附30min,反应在常温下进行。反应结束后小心地取出固相微萃取探针,使用热解吸法,将探针置于gc-ms 进样口解吸5min,使衍生化的生物胺得以从固相微萃取探针上分离,即gc-ms加热固相微萃取探针,涂层中的材料即mcm-t-h可以吸附生物胺衍生物,在250℃的gc-ms 进样口挥发,并进入gc-ms,具体如图1所示。
53.gc-ms的型号为agilent 8890-5977b,(购自agilent technologies inc.,usa)。色谱柱选择hp-5ms(30m
×
250μm
×
0.25μm,购自agilent technologies,inc.,usa)。气相色谱的检测条件包括:进样口温度250℃,进样量1μl;氦气为载气;流速1ml min-1
;不分流模式;根据以下温度程序:初始温度50min,以50℃/min的速率升至100℃,在100℃下保持1.2min,再以10℃min-1
速率加到160℃,最后再以25℃min-1
速率加到280℃,并保持12min。总运行时间为25min。质谱的检测条件:辅助加热器的温度为280℃,离子源温度230℃,四级杆温度150℃,采集类型为扫描模式。
54.实验结果如图2所示,结果表明本发明实施例1制得的固相微萃取探针对六种生物胺的萃取性能均高于商业化的dvb/car/pdms萃取探针。
55.实施例3:使用本发明的固相微萃取探针制作6种生物胺的标准曲线
56.生物胺标准储备溶液的配制:准确称取各种生物胺标准品适量,分别置于50ml小烧杯中,用0.1mol l-1
的盐酸溶液溶解后转移至50ml容量瓶中,定容至刻度,混匀,配制成浓度为1000mg l-1
(以各种生物胺单体计)的标准储备溶液,置-20℃冰箱储存。
57.生物胺标准混合使用液的配制:分别吸取0.25ml各生物胺单组分标准储备溶液,置于同一个50ml容量瓶中,用纯水稀释至刻度,混匀,配制成生物胺标准混合使用液 (5mg l-1
)。
58.生物胺标准系列溶液的配制:分别吸取0.10ml、1.00ml、2.50ml、5.00ml、7.50 ml、10.00ml生物胺标准混合使用液(5mg l-1
),置于50ml容量瓶中,用纯水稀释至刻度,混匀,使浓度分别为10μg l-1
、100μg l-1
、250μg l-1
、500μg l-1
、750μg l-1
、 1000μg l-1
,并调节生物胺标准系列溶液的ph=11,临用现配。
59.取10ml ph=11的生物胺标准系列溶液于20ml顶空瓶中,加入10μl氯甲酸异丁酯,将本发明的固相微萃取探针置于溶液中,辅助磁力搅拌器以1250r min-1
的搅拌速率吸附30min,反应在常温下进行。反应结束后小心地取出固相微萃取探针,使用热解吸法,将探针放入gc-ms进样口,解吸时间为5min,所得的样品待gc-ms检测。gc-ms 条件同实施例2。
60.在本发明优化的测定条件下,使用采用实施例1制备方法得到的固相微萃取探针测定样品中的六种生物胺,并对线性相关系数,检出限,定量限,相对标准偏差,线性范围进行了考察。
61.结果如表1所示。使用本发明的方法对六种生物胺进行检测,其中苯乙胺,尸胺、色胺、酪胺的线性范围均为10~1000μg l-1
,腐胺和组胺的线性范围均为100~1000μg l-1
,且线性良好,线性相关系数r2为0.9933~1,相对标准偏差为0.18~10.65%,检出限为 1.05~26.79μg l-1
,定量限为3.48~89.29%,日内重现性和日间重现性分别为0.59~6.69%, 1.61~9.76%。以上数据均说明该检测方法具有较好的精密度,稳定性和重现性,表明了其用于食品样品分析的可行性。
62.表1
[0063][0064]
实施例4:固相微萃取探在针对猪肉样品及青占鱼肉样品中生物胺分析检测的应用
[0065]
将猪肉样品与青占鱼样品置于常温条件下保存7天,每天分别称取10g肉样,精确至0.01g,置于50ml离心管中,加入20ml 5%的三氯乙酸溶液,均质2min,4℃离心取上清
(10000r min-1
,10min)转移至50ml容量瓶中,沉淀用上述方法再提取一次。合并上清液,用5%的三氯乙酸溶液定容至刻度,置于黑暗环境下-20℃冰箱保存。
[0066]
用2mol l-1
naoh溶液调节待测样品的ph=11,取10ml ph=11的肉样待测样品于 20ml顶空瓶中,加入10ul氯甲酸异丁酯(即衍生试剂),将本发明的固相微萃取探针置于溶液中,辅助磁力搅拌器以1250r min-1
的搅拌速率吸附30min,反应在常温下进行。反应结束后小心地取出固相微萃取探针,使用热解吸法,将探针放入gc-ms进样口,解吸时间为5min,所得的样品待gc-ms检测(如图1所示)。如果测得的生物胺的浓度超过线性范围,则用ph=11的水溶液适当稀释样品浓度后重新分析样品。 gc-ms条件同实施例1。
[0067]
实验结果如图3,图4所示,实验结果表明采用本发明的固相微萃取探针可以成功在青占鱼样品中测得的6中生物胺(图3),在猪肉样品中测得4种生物胺(图4)。相较于青占鱼样品,猪肉样品中生物胺含量较低,且因为个别生物胺浓度较低,未达到该方法的定量限,故只从猪肉样品中测得4中生物胺。
[0068]
且对常温保存的青占鱼样品及猪肉样品的第三天,与第六天样品进行加标回收实验,结果如表2,表3所示,青占鱼常温保存的第三天样品中检测到苯乙胺的浓度12.99 mg kg-1
,腐胺浓度77.76mg kg-1
,尸胺浓度352.33mg kg-1
,组胺浓度224.48mg kg-1
,色胺浓度8.19mg kg-1
,酪胺浓度56.57mg kg-1
,青占鱼常温保存的第三天样品中加标回收率为83.60%~118.78%。青占鱼常温保存的第六天样品中检测到苯乙胺的浓度167.45 mg kg-1
,腐胺浓度450.55mg kg-1
,尸胺浓度405.96mg kg-1
,组胺浓度136.40mg kg-1
,色胺浓度41.94mg kg-1
,酪胺浓度249.68mg kg-1
,青占鱼常温保存的第六天样品中加标回收率为74.55%~102.18%。该发明能成功从青占鱼样品中测得6种生物胺,且加标回收率良好。猪肉常温保存的第三天样品中检测到苯乙胺的浓度0.19mg kg-1
,腐胺浓度 4.19mg kg-1
,尸胺浓度2.45mg kg-1
,酪胺浓度3.35mg kg-1
,猪肉常温保存的第三天样品中加标回收率为78.48%~111.84%。参见表3,猪肉常温保存的第六天样品中检测到苯乙胺的浓度0.77mg kg-1
,腐胺浓度5.12mg kg-1
,尸胺浓度9.48mg kg-1
,酪胺浓度3.35 mg kg-1
,猪肉常温保存的第六天样品中加标回收率为85.36%~122.76%。该发明加标回收率良好。
[0069]
以上实验均能说明本发明能成功对样品中含有的生物胺进行定量检测,且具有良好的回收率。
[0070]
表2
[0071]
[0072][0073]
表3
[0074][0075]
对比例:
[0076]
mcm-41是一种具有独特六面体结构的非晶态介孔二氧化硅材料,如图7所示。中孔尺寸可以通过调节十六烷基三甲基溴化铵(ctab)的用量来调节,因此合成mcm-41 需要优化ctab的添加量,使材料具有合适的中孔孔径用以萃取生物胺(bas,包括苯乙胺phe,腐胺put,尸胺cad,组胺his,色胺try,酪胺tyr))。ttip的修饰可以提高材料的酸性,从而提高材料对生物胺的亲和力,但是,修饰过量的ttip后,在另一方面也会堵塞中孔孔径,从而使萃取效率降低,因此优化ttip的添加量亦十分必要。同理,过量的sds修饰也会减小孔径尺寸,选择合适的sds修饰浓度十分必要,故亦对sds的浓度进行了优化实验。
[0077]
按照实施例1中制备方法制备mcm-41,并改变十六烷基三甲基溴化铵(ctab)的添加量,使ctab质量占液体体积的量(记作w/v)分别为0.05%w/v,0.10%w/v, 0.25%w/v,0.50%w/v,0.75%w/v,1.00%w/v(即490ml质量百分比为14%的氨水溶液加入ctab的质量分别为0.25g,0.5g、1.25g、2.5g、3.75g、5g)。实验结果如图9a所示。峰面积越高,萃取效率越好。总的来说,ctab的加入量对mcm-41 的萃取效率影响不大。当ctab添加量为0.25%时,mcm-41对phe、put、try和 tyr的萃取效率最佳。在此条件下,mcm-41具有更高的比表面、更
大的孔体积和合适的介孔孔径(表4,表面积:893.33m
2 g-1
;孔径:2.37nm;总孔隙体积为0.73cm
3 g-1
) 时,bas具有较大的萃取优势。因此,选择0.25%w/v的ctab(即实施例1中的1.25 g ctab与490ml质量百分比为14%的氨水溶液混合)作为合成mcm-41的最佳添加量。
[0078]
mcm-t合成方法同实施例1,分别取实施例1合成的mcm-41材料1g置于容器中,加入50ml甲苯以及不同体积的钛酸异丙酯(ttip),摇晃均匀,通入氮气,在氮气保护的氛围下加热,升温至80℃,冷凝回流2h,离心后,得到的固体用甲苯与水反复清洗后,在80℃真空干燥条件下干燥过夜。其中,每克mcm-41中,加入的ttip体积分别为0ml,0.05ml,0.1ml,0.5ml,5ml。
[0079]
当ttip的加入量为0.05ml g-1
时,酸化mcm-41(即mcm-t)对除his以外的 5种bas均表现出良好的萃取效果(图9b)。峰面积越高,萃取效率越好。与mcm-41 相比(即ttip的添加量为0%的那组样品相比),mcm-t对bas的萃取效率更高,说明ti改性后mcm-t对bas的化学亲和作用增强。如我们所料,表面接枝ti后,降低了mcm-41的孔径和孔体积(表4,mcm-t的孔径、孔体积和比表面积分别为2.22nm、 0.50cm
3 g-1
和587.44m
2 g-1
),但却提高了mcm-t对bas的萃取效率,故确定每克 mcm-41中ttip的加入量为0.05ml。
[0080]
mcm-t-h合成方法同上述实施例1中步骤s3:分别取0.5g实施例1中合成的 mcm-t,与100ml不同质量百分比的十二烷基硫酸钠(sds)水溶液混合搅拌1h,过滤后,样品放置于真空干燥箱中干燥过夜,然后将材料置于200℃的马弗炉中煅烧30min,冷却至室温后,用无水乙醇清洗,抽滤得到样品,真空干燥后研磨,保存。sds的质量百分比分别为0%,0.1%,0.25%,0.5%,0.75%,1%,2.5%,5%,7.5%,10%。
[0081]
由于生物胺(bas)是极性的,不挥发。因此,在样品预处理过程中,必须对溶解于水中的bas进行衍生化处理,使其生成具有弱极性,易挥发的生物胺衍生化产物。在此过程中,水分子对亲水吸附剂萃取bas有明显干扰,因此,提高材料的疏水性是必要的。实验结果如图9c所示,当sds修饰浓度为2.5%时,mcm-t-h对bas的萃取效率最高,通过优化sds的浓度,最终确定了其最佳修饰浓度为2.5%。修饰sds的mcm-t-h,对生物胺萃取效率优于未修饰sds的mcm-t(即与sds的修饰量为0%的那组样品相比),也进一步说明了疏水改性的重要性。十二烷基硫酸钠(sds)改性为颗粒创造了疏水表面,并提高了mcm-t-h对bas的萃取效率。如表4所示,优化后制备的mcm-t-h 的孔径、孔体积和比表面积分别为1.87nm、0.47cm
3 g-1
和604.52m
2 g-1
。
[0082]
表4
[0083]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1