癌症标志物定量检测的微流控芯片及检测方法
1.本发明属于癌症标志物定量检测的技术领域,具体涉及癌症标志物定量检测的微流控芯片。
背景技术:
2.癌症标志物的检测被明确用于癌症的辅助诊断、治疗监测以及预后评估,对减少癌症死亡人数具有重要意义。微流控芯片由于具有体积小、试剂消耗量小、反应空间密闭等特点,已被诸多学者作为癌症标志物的检测载体。适配体作为癌症标志物一种新型的识别分子,相对抗体而言其生产成本更低、制备条件更简单,同时具抗体的高灵敏度、高特异性优点。目前,现有基于微流控芯片和适配体的癌症标志物检测,但其检测方法往往需要通过多次实验来获得癌症标志物浓度的标准曲线,多次实验间的不一致性操作会导致标准曲线具有误差,以致于真实样本的定量检测不准确,影响疾病的诊断、治疗。
技术实现要素:
3.本发明的目的之一在于:针对现有技术的不足,提供癌症标志物定量检测的微流控芯片,适用于多种癌症标志物的高灵敏度、高特异性、快速定量检测。
4.为了实现上述目的,本发明采用如下技术方案:
5.癌症标志物定量检测的微流控芯片,包括衬底和芯片层,所述衬底位于所述芯片层的正上方,所述衬底通过印章的印制形成有图案化适配体阵列,所述图案化适配体阵列的适配体一端修饰为荧光基团,当适配体与癌症标志物发生特异性结合时,适配体结构及荧光强度发生改变。本发明中的微流控芯片由改进的树形通道结构和直线通道结构构成,可形成癌症标志物浓度梯度,仅通过一次实验即可获得癌症标志物浓度与荧光强度的标准曲线。进一步通过分析加入样本后的荧光强度得到样本中癌症标志物的浓度,实现癌症标志物的定量检测。
6.优选的,所述衬底为玻璃,所述芯片层为pdms,所述衬底和所述芯片层通过键合方式形成微流控芯片,所述键合方式为氧等离子体表面处理。
7.优选的,所述印章为pdms印章,所述pdms印章为间隔设置的矩形凸起,在玻璃表面形成图案化3-氨丙基三乙氧基硅烷(aptes)阵列后,所述衬底和所述芯片层通过键合方式形成微流控芯片。
8.优选的,所述芯片层通过微加工形成内部通道,所述内部通道包括树形通道和直线通道,抛弃传统树形通道的直角结构及拐角极大的弯曲结构,所述树形通道为弧形结构及平滑的正余弦弯曲结构,用于层层稀释癌症标志物,形成癌症标志物的浓度梯度,所述直线通道用于固定图案化适配体阵列来捕获树形通道形成的不同浓度的癌症标志物。
9.本发明的目的之二在于提供癌症标志物定量检测方法,包括:
10.将甲氧基聚乙二醇硅烷(mpeg-silane)、活性酯聚乙二醇生物素(nhs-peg-biotin)、链霉亲和素(streptavidin)及癌症标志物的适配体依次注入键合好的微流控芯
片中使得其内部形成图案化适配体阵列;
11.其中,图案化适配体阵列中适配体结构为发卡结构,发卡结构的下端为寡核苷酸直链。此外,适配体5’端修饰为生物素(biotin),3’端修饰为一种荧光基团,包括但不限于6-羧基荧光素(fam)、6-羧基四甲基若丹明(tamra)等。
12.优选的,还包括:
13.将淬灭剂注入到微流控芯片中,获得后续癌症标志物的荧光检测结果。其中,灭剂为5’端修饰有淬灭基团的寡核苷酸直链,其通过碱基互补配对与发卡结构下端结合,使得适配体3’端的荧光基团发生淬灭。
14.优选的,还包括:
15.将癌症标志物标准品注入微流控芯片中,适配体和癌症标志物标准品发生特异性结合,适配体结构由发卡结构变为任意的螺线圈结构,使得淬灭基团和荧光基团的距离变远,超过淬灭基团的作用范围,荧光强度增强,通过荧光显微镜获取图案化荧光图像,并使用图像处理软件得到图案化荧光图像的荧光强度,最终通过计算取得癌症标志物浓度与荧光强度的标准曲线;
16.将获得的标准曲线用于样本中癌症标志物的浓度检测,通过分析加入样本后的荧光强度得到样本中癌症标志物的浓度,对癌症标志物进行定量检测。
17.本发明的有益效果在于,本发明的pdms印章设计简单,可重复用于形成图案化适配体阵列,且适用于其它生物分子的阵列化;微流控芯片结构中改进的树形结构可形成癌症标志物稳定的浓度梯度,也可独立用于形成其它物质的浓度梯度;本发明仅通过一次实验即可获得癌症标志物浓度与荧光强度的标准曲线。加入样本后可通过分析荧光强度得到样本中癌症标志物浓度,实现癌症标志物的定量检测。本发明的微流控芯片及检测方法具有通用性,可适用于多种癌症标志物的高灵敏度、高特异性、快速定量检测。
附图说明
18.下面将参考附图来描述本发明示例性实施例的特征、优点和技术效果。
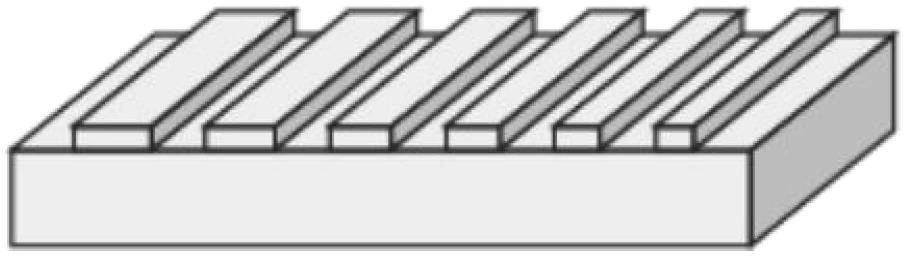
19.图1为本发明的pdms印章示意图。
20.图2为本发明形成图案化3-氨丙基三乙氧基硅烷(aptes)阵列,键合玻璃和芯片层的示意图。
21.图3为本发明形成图案化3-氨丙基三乙氧基硅烷(aptes)阵列,键合玻璃和芯片层的流程图。
22.图4为本发明的芯片层结构示意图。
23.图5为本发明的cea适配体序列及淬灭剂序列。
24.图6为本发明向微流控芯片中注入cea适配体后的图案化荧光图像。
具体实施例
25.如在说明书及权利要求当中使用了某些词汇来指称特定组件。本领域技术人员应可理解,硬件制造商可能会用不同名词来称呼同一个组件。本说明书及权利要求并不以名称的差异来作为区分组件的方式,而是以组件在功能上的差异来作为区分的准则。如在通篇说明书及权利要求当中所提及的“包含”为一开放式用语,故应解释成“包含但不限定
于”。“大致”是指在可接受的误差范围内,本领域技术人员能够在一定误差范围内解决技术问题,基本达到技术效果。
26.以下结合附图1~6对本发明作进一步详细说明,但不作为对本发明的限定。
27.癌症标志物定量检测的微流控芯片,包括衬底和芯片层,衬底位于芯片层的正上方,衬底通过印章的印制形成有图案化适配体阵列,图案化适配体阵列的适配体一端修饰为荧光基团,当适配体与癌症标志物发生特异性结合时,适配体结构及荧光强度发生改变。本发明中的微流控芯片由改进的树形通道结构和直线通道结构构成,可形成癌症标志物浓度梯度,仅通过一次实验即可获得癌症标志物浓度与荧光强度的标准曲线。进一步通过分析加入样本后的荧光强度得到样本中癌症标志物的浓度,实现癌症标志物的定量检测。
28.在根据本发明的癌症标志物定量检测的微流控芯片中,衬底为玻璃,芯片层为pdms,衬底和芯片层通过键合方式形成微流控芯片,键合方式为氧等离子体表面处理。
29.在根据本发明的癌症标志物定量检测的微流控芯片中,印章为pdms印章,pdms印章为间隔设置的矩形凸起,在玻璃表面形成图案化3-氨丙基三乙氧基硅烷(aptes)阵列后,衬底和芯片层通过键合方式形成微流控芯片。
30.在根据本发明的癌症标志物定量检测的微流控芯片中,芯片层通过微加工形成内部通道,内部通道包括树形通道和直线通道,树形通道为弧形结构及平滑的正余弦弯曲结构,用于层层稀释癌症标志物,形成癌症标志物的浓度梯度,直线通道用于固定图案化适配体阵列来捕获树形通道形成的不同浓度的癌症标志物。
31.癌症标志物定量检测方法,包括:
32.将甲氧基聚乙二醇硅烷(mpeg-silane)、活性酯聚乙二醇生物素(nhs-peg-biotin)、链霉亲和素(streptavidin)及癌症标志物的适配体依次注入键合好的微流控芯片中使得其内部形成图案化适配体阵列;
33.其中,图案化适配体阵列中适配体结构为发卡结构,发卡结构的下端为寡核苷酸直链。此外,适配体5’端修饰为生物素(biotin),3’端修饰为一种荧光基团,包括但不限于6-羧基荧光素(fam)、6-羧基四甲基若丹明(tamra)等。
34.还包括:
35.将淬灭剂注入到微流控芯片中,获得后续癌症标志物的荧光检测结果。其中,灭剂为5’端修饰有淬灭基团的寡核苷酸直链,其通过碱基互补配对与发卡结构下端结合,使得适配体3’端的荧光基团发生淬灭。
36.还包括:
37.将癌症标志物标准品注入微流控芯片中,适配体和癌症标志物标准品发生特异性结合,适配体结构由发卡结构变为任意的螺线圈结构,使得淬灭基团和荧光基团的距离变远,超过淬灭基团的作用范围,荧光强度增强,通过荧光显微镜获取图案化荧光图像,并使用图像处理软件得到图案化荧光图像的荧光强度,最终通过计算取得癌症标志物浓度与荧光强度的标准曲线;
38.将获得的标准曲线用于样本中癌症标志物的浓度检测,通过分析加入样本后的荧光强度得到样本中癌症标志物的浓度,对癌症标志物进行定量检测。
39.实施例1
40.基于图案化适配体阵列的癌胚抗原定量检测微流控芯片的制备,包括:
41.(1)制备pdms印章,将pdms印章设计为等间隔不等宽度的矩形凸起,如图1所示,pdms印章尺寸非固定化,可视具体情况进行调整;
42.(2)用pdms印章在玻璃上形成图案化3-氨丙基三乙氧基硅烷(aptes)阵列,并将玻璃和芯片层进行键合,示意图和流程图,如图2、图3所示,其中,芯片层的结构如图4所示,
①
、
②
为注入口,
③
出液口;
43.(3)修饰微流控芯片,向微流控芯片中按顺序以10μl/min的流速注入甲氧基聚乙二醇硅烷(mpeg-silane)、活性酯聚乙二醇生物素(nhs-peg-biotin)、链霉亲和素(streptavidin)、5’端修饰生物素(biotin)3’端修饰tamra的cea适配体以及5’端修饰bhq2的淬灭剂。反应时间分别为2h、过夜、30min、30min、30min;
44.cea适配体序列及淬灭剂序列,如图5所示,淬灭剂序列a*与cea适配体序列中的a段序列互补配对,以淬灭cea适配体3’端荧光基团;cea适配体序列中的b段序列与b*段序列以形成cea适配体的发卡结构;cea适配体序列中的c段序列为cea识别序列,用于识别、捕获cea;
45.注入cea适配体后的图案化荧光图像,如图6所示,图中白色虚线为通道边界。
46.实施例2
47.基于图案化适配体阵列的癌胚抗原定量检测方法
48.(1)将cea标准品用缓冲液(加了0.1%(w/v)bas的1xpbs缓冲液)稀释为1μg/ml,并用过
①
口以10μl/min流速注入到微流控芯片中。同时,
②
口以同样的流速注入1xpbs缓冲液,1μg/ml的cea标准品与1xpbs缓冲液经过改进的树状结构的层层稀释后,获得cea标准品的浓度梯度。各浓度cea标准品经过图案化适配体阵列后被适配体特异性捕获,利用尼康ti2-e形成图案化荧光图像,利用imagej软件获取图案化荧光图像的荧光强度,通过计算最终得到标准品cea浓度和荧光强度的标准曲线。
49.(2)将获得的标准曲线应用于大肠癌血清样本中cea的浓度检测,通过分析加入样本后的荧光强度得到样本中cea的浓度,实现大肠癌血清样本中cea的定量检测,根据定量检测得到的cea浓度对大肠癌的分期进行评估。
50.根据上述说明书的揭示和教导,本发明所属领域的技术人员还能够对上述实施例进行变更和修改。因此,本发明并不局限于上述的具体实施例,凡是本领域技术人员在本发明的基础上所作出的任何显而易见的改进、替换或变型均属于本发明的保护范围。此外,尽管本说明书中使用了一些特定的术语,但这些术语只是为了方便说明,并不对本发明构成任何限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1