微粒分选装置和延迟时间确定方法与流程
本发明涉及微粒分选装置(微颗粒分选装置,微粒子分选装置,microparticlesortingapparatus)以及微粒分选装置中的延迟时间确定方法。更具体地,本发明涉及自动确定延迟时间的微粒分选装置等。
背景技术:
在相关领域中,存在光学检测、电检测或者磁检测诸如细胞的微粒的特性,然后分离和收集仅具有预定特性的微粒的微粒分选装置(例如,流式细胞仪)。首先,在流式细胞仪中的细胞分离中,从在流式细胞中形成的孔来产生液滴流股(包含细胞和鞘液的样品液体的层流),通过对孔施加振动,液体流股被制成液滴,并将电荷施加至液滴。此外,从孔排出的包含细胞的液滴的移动方向受电控制,并将具有期望特性的靶细胞以及其他非靶细胞收集在不同的收集容器中。例如,作为微芯片型流式细胞仪,日本未审查专利申请公开第2010-190680号公开了“微粒分选装置,包括:微芯片,安装在包含微粒流的液体所经过的流路上,以及排出经过流路流动至芯片外部的空间的液体的孔上;振动元件,用于将孔中的液体制成液滴并将其排出;充电装置,用于对排出的液滴施加电荷;光学检测装置,用于检测流过流路的微粒的光学特性;电极对(electrodecouple),被安装为彼此相对以夹住移动的液滴;以及两个以上的容器,其收集在相对电极之间流动的液滴”。此外,日本未审查专利申请公开(PCT申请的翻译)第2007-532874号公开了一种方法,其中通过在液滴从流体分离的位置(以下,称为分离点(break-offpoint))中设置辅助照明和检测单元,对能够确认液滴是否已经被分选入预期的流路中的流式细胞仪的操作进行控制。以这种方式,通过确定分离点,可以确定从作为细胞等的微粒被检测时直到包含细胞等的液滴达到分离点为止的延迟时间,并且可以基于延迟时间对包含被检测的微粒的液滴施加电荷。
技术实现要素:
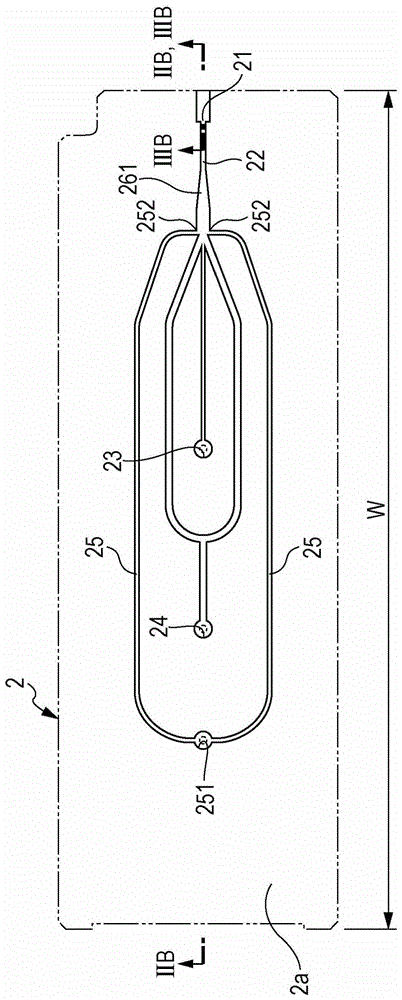
然而,分离点(断开点,中断点,break-offpoint)根据液滴等的排出条件而波动,因此延迟时间也波动。此外,仅通过确定分离点,难以充分确定准确的定时,以对包含微粒的液滴施加电荷。因此,将适当的电荷施加至包含微粒的液滴,但最终,已主要采用该方法,其中,通过观察在制备时施加电荷的液滴,使用者视觉辨别液滴是否分配至期望的收集容器。这样的方法需要使用者具有熟练的技术,并存在可靠性和稳定性的问题。因此,期望提供一种能够自动地、简单地以及准确地对液滴施加电荷的微粒分选装置。根据本发明的实施方式,提供了一种微粒分选装置,包括:检测单元,检测流经流路的微粒;成像装置,对包括从设置在流路的边缘部分(端部)上的孔排出的微粒的液滴进行成像;充电单元,对液滴施加电荷;以及控制单元,确定延迟时间,作为从微粒被检测单元检测的时间,到通过成像装置所成像的图像信息中的标准区域内预先设置的亮点的数量达到最大值的时间,在由检测单元检测微粒之后,一旦延迟时间流逝,可以使得充电单元对微粒施加电荷。根据该微粒分选装置,可以基于标准区域范围内亮点的数量来自动地确定延迟时间,而不要求使用者实施设置。在该微粒分选装置中,成像装置可以在多个不同时间,对多个液滴的图像进行成像,并且控制单元使用从微粒被检测单元检测的时间,到通过比较由成像装置所成像的多个液滴的图像信息而计算的标准区域内亮点的数量达到最大值的时间作为临时延时时间来初步确定延迟时间。在该微粒分选装置中,从微粒被检测单元检测的时间起,一旦临时延迟时间流逝,在短于各个液滴的排出间隔时间内,成像装置可以将多个液滴的图像进行成像,并且通过参考涉及相对于所述图像信息中所述液滴的排出方向的邻近所述标准区域的两个比较区域中的至少一个中的亮点数量的邻近信息,所述控制单元可以更新所述临时延迟时间并确定所述延迟时间。在该微粒分选装置中,在所述两个比较区域中,第一比较区域和第二比较区域可以在所述液滴的排出方向上按顺序进行设置,并且所述控制单元可以计算在所述亮点的数量朝着在所述第二比较区域中所述亮点的数量达到最大值的时间增加的过程中,在所述第二比较区域中所述亮点的数量达到最大值的预定百分比的时间,并且可以将该时间确定为所述标准区域内的所述亮点的数量达到最大值的时间。在该微粒分选装置中,在两个比较区域中,第一比较区域和第二比较区域可以在所述液滴的排出方向按顺序进行设置,并且所述控制单元可以计算在所述亮点的数量从在所述第一比较区域中所述亮点的数量达到最大值的时间起减少的过程中,在所述第一比较区域中所述亮点的数量达到最大值的预定百分比的第一时间,可以计算在所述亮点的数量朝着在所述第二比较区域中所述亮点的数量达到最大值的时间增加的过程中,在所述第二比较区域中所述亮点的数量达到最大值的预定百分比的第二时间,并且可以将所述标准区域内的所述亮点的数量达到最大值的该时间确定为(所述第一时间+所述第二时间)/2。在该微粒分选装置中,所述控制单元可以调整所述液滴的排出频率,并将所述液滴的最佳排出频率确定为在所述液滴的排出方向上所述液滴开始形成的分离点最靠近所述孔的排出频率。此外,该微粒分选装置可进一步包括被设置成彼此相对以夹置(插入,放入)由所述成像装置所成像的所述液滴的一对偏转板,所述一对偏转板利用在所述偏转板与所述电荷之间起作用的电力来改变所述液滴的前进方向。此外,所述微粒分选装置是微芯片型流式细胞仪,其中,在所述微芯片中设置所述孔和所述流路。此外,在这里的术语“延迟时间”是指从微粒被检测单元检测的时间,到由包含微粒的流体形成液滴时的延迟时间。换言之,“延迟时间”是指从微粒被检测单元检测的时间,到包含微粒的液滴具有施加至其上的电荷时的必需时间。在本发明中,这是指从微粒被检测单元检测的时间,到通过成像装置所成像的图像信息中的在标准区域内预先设置的亮点的数量达到最大值的时间的持续时间。此外,术语“临时延迟时间”是指直到确定延迟时间为止的临时延迟时间。更具体地,“临时延迟时间”是指从微粒被检测单元检测时的时间,到通过比较成像装置所成像的液滴的多个图像信息项而计算的标准区域内亮点的数量达到最大值的时间。此外,成像装置的实例包括液滴照相机等。此外,根据本发明的另一实施方式,提供了一种延迟时间确定方法,包括使微粒分选装置检测流经流路的微粒;使微粒分选装置对从设置在所述流路的边缘部分(端部)上的孔排出的包含所述微粒的液滴进行成像;以及使微粒分选装置确定从所述微粒被检测到的时间起,直到在被成像的液滴的图像信息中,在标准区域中预先设置的亮点的数量达到最大值的时间作为延迟时间。此外,在本方法中,该方法还可以包括在多个时间对多个液滴中的每一个的图像进行成像;使用从所述微粒被检测到的时间,到通过比较被成像的所述多个液滴的所述图像信息而计算的所述标准区域内的所述亮点的数量达到最大值的时间的时间段作为临时延迟时间,来初步确定所述延迟时间。此外,在本方法中,方法还可以包括从所述微粒被检测到的时间起,一旦所述临时延迟时间流逝,在短于每个所述液滴的排出间隔时间的时间内,对所述多个液滴的图像进行成像;以及通过参考涉及相对于所述图像信息中所述液滴的排出方向邻近所述标准区域的两个比较区域中的至少一个中的亮点数量的邻近信息,更新所述临时延迟时间并确定所述延迟时间。此外,在本方法中,方法还可以包括在两个比较区域中,第一比较区域和第二比较区域在所述液滴的排出方向上按顺序进行设置,计算在所述亮点的数量朝着在所述第二比较区域中所述亮点的数量达到最大值的时间增加的过程中,在所述第二比较区域中所述亮点的数量达到最大值的预定百分比的时间的第一时间,并且将在所述标准区域内的所述亮点的数量达到最大值的时间确定为第二时间。此外,在本方法中,方法还可以包括在两个比较区域中,第一比较区域和第二比较区域在所述液滴的排出方向按顺序进行设置,计算在所述亮点的数量从在所述第一比较区域中所述亮点的数量达到最大值的时间起减少的过程中,在所述第一比较区域中所述亮点的数量达到最大值的预定百分比的时间,计算在所述第二比较区域中所述亮点的数量朝着所述亮点的数量达到最大值的时间增加的过程中,所述第二比较区域中的所述亮点的数量达到最大值的预定百分比的时间,并且可以将所述标准区域内的所述亮点的数量达到最大值的该时间确定为(第一时间+第二时间)/2。在本发明中,术语“微粒(微粒子,微颗粒)”广泛地包括有机物相关微粒,诸如细胞、微生物以及脂质体,或者诸如乳胶粒子、凝胶粒子以及用于工业用途的粒子的合成粒子。有机物相关微粒包括各种类型的细胞所包含的染色体、脂质体、线粒体、细胞器等。细胞包括动物细胞(造血细胞等)以及植物细胞。微生物包括诸如大肠杆菌的细菌、诸如烟草斑纹病毒的病毒、以及诸如酵母的真菌。此外,对于有机物相关微粒,也可以包括核酸和蛋白质以及诸如其复合物的有机物相关聚合物。此外,用于工业用途的粒子也可包括例如有机聚合材料或无机聚合材料、金属等。有机聚合材料包括聚苯乙烯、苯乙烯二乙烯基苯、聚甲基丙烯酸甲酯等。无机聚合物材料包括玻璃、硅石、磁性材料等。金属包括金属胶体、铝等。对于这些微粒的形状正常是基本上球形,然而,它们也可以是非球形,并且不特别限制其尺寸、质量等。期望提供一种能够自动地、简单地以及准确地对液滴施加电荷的微粒分选装置。附图说明图1是示意图,其用于示出根据本发明实施方式的被配置为微芯片型流式细胞仪的微粒分选装置(流式细胞仪)的分选系统的构造;图2A和2B是用于示出可安装在流式细胞仪中的微芯片的实例的示意图;图3A至3C是用于示出微芯片的孔的构造的示意图;图4是用于示出在流式细胞仪中确定延迟时间的方法的流程图;图5A至5D是说明图,其是示出了由流式细胞仪的液滴照相机所成像的液滴的图像的实例的照片,用于示出临时延迟时间的确定步骤;图6A至6C是用于示出流式细胞仪中延迟时间的确定步骤的说明图;图7A至7C是说明图,其是示出了由流式细胞仪的液滴照相机所成像的液滴图像的实例的照片,用于示出延迟时间的确定步骤;图8是作为照片的说明图,其中水平轴是相位,而垂直轴是由流式细胞仪的液滴照相机所成像的液滴的图像的亮点数量,用于示出延迟时间确定步骤(第一延迟时间的确定方法)的实例;图9是作为照片的说明图,其中水平轴是相位,而垂直轴是由流式细胞仪的液滴照相机所成像的液滴图像的亮点数量,用于示出延迟时间确定步骤(第一延迟时间的确定方法)的实例;图10是作为照片的说明图,其中水平轴是相位,而垂直轴是由流式细胞仪的液滴照相机所成像的液滴图像的亮点数量,用于示出延迟时间确定步骤(第二延迟时间的确定方法)的实例;图11是作为照片的说明图,其中水平轴是相位,而垂直轴是由流式细胞仪的液滴照相机所成像的液滴图像的亮点数量,用于示出延迟时间确定步骤(第二延迟时间的确定方法)的实例;以及图12是用于示出在流式细胞仪中分选微粒(微粒分选步骤)的方法的流程图。具体实施方式在下文中,将参考附图来提供用于实现本发明的有利的实施方式的描述。此外,下述实施方式代表了本发明的代表性实施方式的实例,且不应根据该实例来狭义地解释本发明的范围。本描述将以如下顺序给出。1.根据本发明的微粒分选装置的装置构造1-1充电单元1-2微芯片1-3检测单元1-4液滴照相机1-5偏转板1-6收集容器1-7控制单元或类似物2.根据本发明的微粒分选装置中的延迟时间确定方法2-1微粒检测步骤S12-2液滴排出步骤S22-3液滴成像步骤S32-4排出频率确定步骤S42-5临时延迟时间确定步骤S52-6延迟时间确定步骤S62-6-1第一延迟时间确定方法2-6-2第二延迟时间确定方法2-7微粒分选步骤S72-7-1微粒检测步骤S712-7-2液滴排出以及电荷施加步骤S721.根据本发明的微粒分选装置的装置构造图1是示意图,其用于示出根据本发明实施方式的被配置为微芯片型的流式细胞仪的微粒分选装置1(在下文中,也称为“流式细胞仪1”)的构造。1-1充电单元流式细胞仪1设置有充电单元11,其对来自在微芯片2上形成的孔21所排出的液滴施加电荷。由电连接至充电单元11并插入设置在微芯片2上的样品入口23中的电极12来实施液滴的充电。此外,将足够的电极12插入到微芯片2上的位置,使得与流路中向下泵送的样品流体或鞘液电接触。在流式细胞仪1中,在由下述检测单元3检测样品流体中所包含的微粒之后,一旦延迟时间流逝,充电单元11可以将包含微粒的液滴进行充电。这里,术语“延迟时间”是指从微粒被检测单元3检测的时间,到由包含微粒的液体形成液滴时的延迟时间。换言之,“延迟时间”是指微粒被检测单元3检测的时间,到包含微粒的液滴具有由充电单元11向其施加电荷时的必需时间。在本发明中,术语“延迟时间”是指从微粒被检测单元3检测的时间,到通过下述液滴照相机4所成像的图像信息中、在标准区域内预先设置的亮点的数量达到最大值的时间的持续时间。1-2微芯片图2A和2B以及图3A至3C示出了可安装在流式细胞仪1中的微芯片2的实例。图2A示出了上表面的示意图,并且图2B示出了对应于图2A中的线IIB-IIB的截面示意图。此外,图3A至3C示意性地示出了微芯片2的孔21的构造,图3A示出了上表面示意图,图3B示出了截面示意图,并且图3C示出了前表面示意图。图3B对应于沿着图2A中的线IIIB-IIIB的横截面。微芯片2由粘合在一起以形成样品流路22的基板层2a和基板层2b形成。通过使用金属模具注射成型热塑性树脂,可以从基板层2a和基板层2b来进行样品流路22的形成。对于热塑性树脂,可以采用通常在相关领域中作为微芯片材料使用的塑料,诸如聚碳酸酯、聚甲基丙烯酸甲酯树脂(PMMA)、环状聚烯烃、聚乙烯、聚苯乙烯、聚丙烯以及聚甲基二硅氮烷(PDMS)。将样品流体从流体递送连接器部分引入至样品入口23,与从流体递送连接器部分引入至鞘入口24的鞘液合并,并通过样品流路22进行递送。将鞘液从鞘入口24引入,在分成两个方向并进行递送后,在鞘液与从样品入口23引入的样品流体合并的合并部分中,将鞘液与样品流体合并,使得从两个方向放入样品流体。因此,在合并部分中,在鞘液层流的中央,形成了放置样品层流的三维层流。参考数字25表示当在样品流路22中发生堵塞或气泡时,用于对样品流路22施加负压的抽吸流路,其暂时地发生来回流动,以便解决堵塞或气泡。在抽吸流路的一端,形成了经由液体递送连接器部分连接至诸如真空泵的负压源的抽吸出口251,而另一端连接至连通孔252中的样品流路22。在三维层流中,层流宽度在所形成的限制器部分261(参考图2A和2B)以及限制器部分262(参考图3A-3C)中被限制,使得其垂直截面的表面积在有关流体递送方向上逐渐变小,或在流体递送方向中从上游到下游的阶段中逐渐变小。此后,三维层流从设置在流路的一侧上的孔21变成液流(流体流股)(参考图1),并排出。在图1中,由Y轴正方向来表示来自孔21的液流(流体流股)的排出方向。与样品流路22的孔21的连接部分是直线地形成的平平直部27。该平直部27起作用,使得来自孔21的液流在Y轴正方向上以直线喷出。通过芯片激励单元对孔21所施加的振动,从孔21喷出的液流转变成液滴。孔21在基板层2a和基板层2b的端面方向上是打开的,并在其开口位置和基板层端面之间设置槽口部分211。通过在孔21的开口部分和基板端面之间的基板层2a和基板层2b进行开槽来形成该槽口部分211,使得槽口部分211的直径L大于孔21的开口直径l(参考图3C)。期望形成槽口部分211的直径L大于孔21的开口直径l两倍以上,使得不堵塞从孔21排出的液滴的移动。1-3检测单元图1中的参考数字3表示检测单元,其通过从光源31发出的激光L1的照射,来检测从诸如细胞的微粒发出的测量目标的光。该检测单元3进行样品流路22的限制器部分261(参考图2A和图2B)以及限制器部分262(参考图3A到图3C)之间细胞的特性检测。该特性检测不特别限制,然而,例如,在使用光学检测的情况下,在三维层流的中央,由于样品流路22中以单行布置的、与所递送的流体细胞有关的激光L1的照射(参考图1),由细胞发出的散射光和荧光被检测单元3检测。对于光的照射和检测,除了激光源外,也可构造将激光会聚并照射在细胞上的照射系统,诸如聚光透镜、二向色镜或通带滤光片。例如,检测系统通过诸如PMT(光电倍增管)、或CCD或者CMOS装置的区域成像装置来构造。由检测单元3的检测系统所检测的测量目标光是来自由于测量光的照射细胞所发出的光,例如,可以是诸如前散射光、侧散射光、瑞利散射、或米氏散射的散射光、荧光等。这些测量目标光被转换成电信号,输出至控制单元7,并利用在细胞的光学特性辨别中。此外,检测单元3也可以磁检测或电检测细胞的特性。在这种情况下,微粒在微芯片2的样品流路22中被彼此相对地设置,并测量电极之间的电阻值、电容值、电感值、阻抗、电场变化值,或磁场中的磁化强度、变化等。1-4液滴照相机图1中的参考数字4表示本发明的成像装置的实例,其为用于将来自微芯片2的孔21所排出的液滴D成像的液滴照相机,诸如CCD照相机、CMOS传感器等。设计液滴照相机4,使得可以进行被成像的液滴D的图像的聚焦调整。在流式细胞仪1中,通过从光源41所发出的激光L2,来照射包含诸如细胞的微粒的液滴,并且在液滴D通过液滴照相机4进行成像的同时,微粒被激发,由此设计流式细胞仪1,使得使用者能够从显示单元确认液滴中包含微粒。此外,在流式细胞仪1中,由于微芯片被新的微芯片替换,或外部环境(温度等)变化,因此存在有必要改变液滴信息参数(鞘压、液滴频率、压电驱动压力等)的情况。在这种情况下,在微粒被检测单元3检测后,有必要调整该时间,直到电荷施加至包含微粒的液滴为止(在下文中,该时间也称为延迟时间)。液滴照相机起作用以便将液滴D成像,并且也可以使得下述控制单元7确定延迟时间。更具体地,设计液滴照相机,使得可以在多个不同时间,将液滴D的多个图像进行成像,使得下述的控制单元7可初步确定临时延迟时间作为延迟时间。此外,术语“临时延迟时间”是指从微粒被检测单元3检测的时间,到通过液滴照相机4所成像的液滴图像信息的多个项进行比较而计算出的标准区域内亮点数量达到最大值的时间的持续时间。此外,术语“多个不同时间”是指,例如各个时间、振动元件13施加至孔21的振动频率的倒数的时间之间的间隔时间(换言之,每个液滴D的排出间隔时间)。此外,为了使控制单元7能够更新临时延迟时间并确定延迟时间,液滴照相机4被设计成能够从微粒被检测单元3检测的时间起,在临时延迟时间流逝后,在预定时间内将液滴D的多个图像进行成像。此外,术语“预定时间”指的是短于每个液滴D的排出间隔时间的时间。此外,液滴照相机4被设计成沿Y轴的正方向或负方向可移动,以便控制单元7可确定下述的液滴D的最佳排出频率。此外,由液滴照相机4所成像的图像显示在诸如显示器的显示单元上,并且也用来允许使用者确定孔21中液滴D的信息状态(液滴的尺寸、形状、间隔等)。1-5偏转板图1中的参考数字51和52表示设置成彼此相对以夹置从孔21喷出并由液滴照相机4所成像的液滴D的一对偏转板。偏转板51和52被构造成包含电极,其利用施加至液滴的电荷上的电力来控制从孔21排出的液滴的移动方向。此外,利用施加至液滴D的电荷上的电力,偏转板51和52也控制从孔21喷出的液滴D的轨迹。在图1中,通过X轴方向来表示偏转板51和52的相对方向。1-6收集容器在流式细胞仪1中,通过在偏转板51和52的相对方向上(X轴方向)成一行来设置多个收集容器611、612、62或63之一来接收液滴D。收集容器611、612、62或63也可为通常用于实验的塑料管或玻璃管。收集容器611、612、62或63的数量不特别限制,然而,在这里,示出了设置四个的情况。根据偏转板51和52之间存在或不存在、或可替换的电力量级,从孔21排出的液滴D被导入并收集在四个收集容器611、612、62或63之一中。收集容器611、612、62以及63以可交换的方式设置在用作收集容器(未示出)的容器中。用作收集容器(未示出)的该容器被设置在Z轴滑台(未示出)上,其被构造成可在垂直于来自孔21的液滴D的排出方向(Y轴方向),并垂直于偏转板51和52的相对方向(X轴方向)的方向(Z轴方向)上移动。1-7控制单元或类似物除了上述的构造外,流式细胞仪1还设置有用于由检测单元3检测的细胞等的特性鉴别的数据分析单元、用于容纳样品流体以及鞘液的槽部分、用于控制上述各个构造的控制单元7等,其设置有普通流式细胞仪。控制单元7可由普通计算机来构造,其设置有CPU、存储器、硬盘等,并且在该硬盘上存储OS,执行与下述延迟时间确定方法相关的各个步骤的程序等。2.根据本发明的微粒分选装置中的延迟时间确定方法2-1微粒检测步骤S1图4是用于示出在流式细胞仪1中延迟时间确定步骤的流程图。该延迟时间确定步骤包括“微粒检测步骤S1”、“液滴排出步骤S2”、“液滴成像步骤S3”、“排出频率确定步骤S4”、“临时延迟时间确定步骤S5”、以及“延迟时间确定步骤S6”的过程。此外,“微粒分选步骤S7”的过程也可在上述延迟时间确定步骤之后执行。下面将提供各个过程的描述。首先,在微粒检测步骤S1中,控制单元7将信号输出至流体递送连接器部分,并开始样品流体以及鞘液的流体递送。此外,检测单元3通过例如激光L的照射来检测在样品流路22的样品中所包含的微粒。此外,本步骤S1以及下述步骤S2到步骤S6是校准过程,用于确定从检测单元3检测靶细胞等时直到充电单元11对包含细胞等的液滴施加电荷为止的延迟时间。因此,优选使用校准珠(诸如用于工业用途的、形状等明确的颗粒)预先作为微粒。2-2液滴排出步骤S2在液滴排出步骤S2中,振动元件13对孔21施加振动,液滴D从孔21排出,液滴D收集在废液入口中,并可以进行液体的处置(参照图4)。2-3液滴成像步骤S3在液滴成像步骤S3中,控制单元7将信号输出至液滴照相机4,并且,接收到信号的液滴照相机4将对被排出以及被激光L激发的液滴D成像(参照图4)。在相同于或短于下述液滴时钟的时间间隔的时间间隔,液滴照相机4可以对图像进行成像。此时,例如,控制单元7可将信号输出至液滴照相机4,并使得接收到信号的液滴照相机4在X轴方向上或Y轴方向上移动。此外,在通过液滴照相机4的液滴D的图像的成像中,控制单元可以进行在Z轴方向上的聚焦调整。例如,控制单元可以进行聚焦调整,直到由液滴照相机4所成像的图像中的对比率落在预定范围内。2-4排出频率确定步骤S4在排出频率确定步骤S4中,控制单元7将液滴照相机4移动至预定位置,并基于由液滴照相机4所成像的图像信息来调整液滴D的排出频率(参照图4)。不特别限制上述预定位置,然而,根据排出条件,诸如孔径和驱动压力,它可以是预先所设置的位置。此外,控制单元7将液滴D的最佳排出频率确定为在液滴D开始在Y轴方向上(在下文中,称为分离点)形成的位置最接近孔21的排出频率。此外,本步骤S4也可在下述步骤S5后执行。以这种方式,在流式细胞仪1中,因为该最佳排出频率是基于分离点由控制单元7来确定的,所以可以解决使用者手动设置液滴频率的困难。2-5临时延迟时间确定步骤S5在临时延迟时间确定步骤S5中,从微粒被检测单元3检测的时间,通过比较由液滴照相机4所成像的液滴D的多项图像信息,信息控制单元7确定液滴D的临时延迟时间(参照图4)。术语“临时延迟时间”在这里是指被本步骤S5临时当作延迟时间的时间,其为直到通过下述延迟时间步骤S6确定延迟时间为止的时间。更具体地,该术语“临时延迟时间”是指从微粒被检测单元3检测的时间,到下述的标准区域内亮点的数量达到最大值的时间的持续时间,其通过比较在多个不同时间、由液滴照相机4所成像的液滴D的多项图像信息来计算出的。此外,不特别限制术语“多个不同时间”,然而,例如,指各个时间、振动元件13施加至孔21的振动频率的倒数的时间之间的间隔时间(换言之,指各个液滴D的排出间隔时间,并在下文中称为“液滴时钟”)。图5A-5D是照片,其示出了由流式细胞仪1的液滴照相机4所成像的液滴图像的实例,并表示在不同时间成像的图像(参照图5A-5D)。更具体地,图5A-5D是摄影图,其在微粒被检测单元3检测的时间(T0),当所检测微粒包含在由液滴照相机4所成像的液滴D中时,用于示出设置为第一液滴的液滴。此外,各个摄影图也可为其中多个所成像的图像整合在一起的图。在图5A-5D中,术语“部分1”指在图像P中预先设置的标准区域。控制单元7将液滴照相机4在液滴时钟的间隔时间所成像的液滴D的多个图像进行比较,并初步确定从T0直到“部分1”内的亮点数量达到最大值时为止的时间,作为临时延迟时间。此外,术语“亮点”指的是像素,其在液滴照相机4所成像的液滴D的图像中具有高于预定阀值的亮度,并且是由激光L2所照射的激发的液滴D中包含的微粒的图像信息项。作为本发明的实例,在图5A-5D中,术语“亮点”是指当排出第30个到第33个液滴时,通过液滴照相机4成像的图像,当在T0从孔21排出的并由液滴照相机4成像时的液滴D设定为第一液滴。例如,第30个液滴是由N=30表示的摄影图(参照图5A)。在图5A至5D中所示的实例中,基于“部分1”内亮点B的数量达到最大值的N=32的图像信息(参照图5C),控制单元7能够辨别在第32液滴中包含微粒。换言之,控制单元7将液滴照相机4在液滴时钟的间隔时间所成像的液滴D的多个图像进行比较,并能够初步确定从微粒被检测的时间,直到排出第32液滴的时间为止的延迟时间,作为临时延迟时间。以此方式,在流式细胞仪1中,通过比较“部分1”范围内与多个不同时间有关的图像信息中亮点数量,可以初步确定临时延迟时间作为延迟时间。因此,可以简单地并准确地对液滴施加电荷,而无需使用者的复杂操作。2-6延迟时间确定步骤S6在图4中所示的延迟时间确定步骤S6中,首先,在临时延迟时间自T0流逝后,在短于液滴时钟的时间内,基于由液滴照相机4所成像的液滴D的多个图像,控制单元7参考了下述的邻近信息。此外,控制单元7更新临时延迟时间,其通过上述的临时延迟时间确定步骤S5来初步确定,并通过参考邻近信息,可更精确地确定延迟时间。下面参照图6A到图11来描述该方法。此外,邻近信息是与液滴的排出方向有关的两个比较区域(邻近标准区域)中有关亮点数量的信息。图6A至6C示意性地示出了从微粒被检测单元3检测时,到由液滴照相机4将包含微粒的液滴D成像的变迁。图6A示出了液滴时钟(DropletCLK)的曲线图。这里,图6B示出了流经微芯片2的流路并由检测单元3检测的微粒A1和A2。此外,图6C示出了各自包含微粒A1和A2的液滴D1和D2。在图6A至6C所示的实例中,即使微粒A1和A2包含在相同的液滴时钟内,但相位仅通过(φ2-φ1)改变(参照图6B)。因此,在微粒A1和A2包含在不同的液滴D1和D2中的情况下,当延迟时间设置成临时延迟时间时,存在电荷施加至所期望液滴的定时发生偏离的情况(参照图6C)。因此,为了更精确地确定当施加电荷至液滴时的定时,有必要将延迟时间调整至短于液滴时钟的间隔时间(在下文中称为相位)。图7A至7C示出了在与同一液滴时钟有关的不同相位上的由液滴照相机4成像的图像。更具体地,图7A至7C示出了在与同一液滴时钟有关的各个相位(图7APHY=0,图7BPHY=90,图7CPHY=270)上由液滴照相机4成像的微粒的图像。在同一液滴时钟的时间被分成360相位的相位中,以时间序列顺序,图7A至7C分别示出了与第0相位((图7APHY=0)、第90相位(图7BPHY=90)以及第270相位(图7CPHY=270)相关的图像。如参照图6A至6C所示出的,因为存在在同一液滴时钟内,不同的液滴D1和D2包含微粒A1和A2的情况,所以,在图7A所示的实例中,使用控制单元7,也可以检测在邻近标准区域(部分1)的比较区域(部分0)中的亮点B。换言之,控制单元7辨别在比较区域(部分0)内存在微粒。此外,在图7C所示的实例中,在邻近标准区域(部分1)的其他比较区域(部分2)中,也检测到亮点B。换言之,控制单元7辨别在比较区域(部分2)内存在微粒。在本步骤S6中,这使得可以用于控制单元7来辨别相位偏差(延迟相位),以更新临时延迟时间,并确定延迟时间。更具体地,通过参考图像信息中与液滴D的排出方向有关的两个比较区域中的一个比较区域中、有关亮点B数量的邻近信息,控制单元7更新临时延迟时间并确定延迟时间。参照图8至图11,将提供如下第一延迟时间确定方法以及第二延迟时间确定方法的详细描述,作为特定的延迟时间确定方法。此外,这里,提供了在两个区域(“部分1”以及“部分0”或“部分2”的两个区域)中检测亮点B的实例的描述。然而,即使在“部分1”、“部分0”以及“部分2”的三个区域中检测亮点B的情况下,也可以以相同方式确定延迟时间,如同下述中第一延迟时间确定方法或第二延迟时间确定方法一样。2-6-1第一延迟时间确定方法首先,参照图8和图9,将提供第一延迟时间确定方法的描述,其中,该延迟时间是通过参照两个比较区域的仅“部分2(S2)”的亮点来确定的。图8和图9是曲线图,其中,水平轴是相位值,而垂直轴是由流式细胞仪1的液滴照相机4所成像的液滴图像的亮点数量。更具体地,如图8中所示,在曲线图中,示出了在“部分0(S0)”、“部分1(S1)”以及“部分2(S2)”的三个区域中的亮点数量。首先,与“部分1(S1)”有关,控制单元7计算两个比较区域(其定位在液滴排出方向的正方向侧)的“部分2(S2)”中亮点数量的最大值(参照图9,(1a))。接着,在亮点的数量朝“部分2(S2)”中的最大值增加的过程中,控制单元7计算亮点的数量达到上述最大值的10%的时间(参照图9中的点(1b)以及点(1c))。最后,控制单元7设置亮点的数量达到最大值的10%的时间,作为在标准区域内达到最大数量的亮点的时间,并确定延迟时间。换言之,基于相位值,控制单元7计算出与点(1b)以及点(1c)有关的相位值,并确定延迟时间。根据以上,在流式细胞仪1中,通过参考关于图像信息中设置在与液滴D的排出方向有关的邻近标准区域的两个比较区域的液滴排出方向的正方向侧的比较区域中的亮点数量的邻近信息,控制单元7计算延迟时间。以这种方式,在流式细胞仪1中,可以精确地且自动地对液滴施加电荷,而不担心在同步液滴和电荷信号之间将发生相移。此外,作为本步骤S6的实例的第一延迟时间确定方法有利地用于在微芯片2中进行样品中所包含的微粒的检测以及在空气中进行对液滴D施加电荷的情况下。换言之,在微芯片2内部和在空气中之间的样品速度发生变化,因此,在有必要调整对样品施加电荷的定时的情况下,对使用第一延迟时间确定方法来确定延迟时间尤其有效。此外,提供了一种情况的描述,其中,在第一延迟时间确定方法中,基于在比较区域中亮点数量达到最大值的10%的值,控制单元7计算相位值,然而,本发明不限于该实例。例如,通过计算亮点最大数量的X%(例如,X是诸如5或20的任意值),控制单元7也可以确定适当的延迟时间。2-6-2第二延迟时间确定方法接着,参照图10和图11,将提供第二延迟时间确定方法的描述,其中,该延迟时间是通过参照两个比较区域的部分0(S0)和部分2(S2)的亮点来确定的。图10和图11是曲线图,其中,水平轴是相位值,而垂直轴是由流式细胞仪1的液滴照相机4所成像的液滴图像的亮点数量。更具体地,在如图10中所示的曲线图中,示出了在部分0(S0)、部分1(S1)以及部分2(S2)的三个区域中的亮点数量。首先,与部分1(S1)有关,控制单元7计算两个比较区域(其设置在液滴排出方向的负方向侧)的部分0(S0)中亮点数量的最大值以及亮点数量的最小值的平均值(参照图11,(2a))。换言之,如图11中所示,当最小值为0时,控制单元7计算在部分0(S0)中亮点数量的最大值乘以1/2的值(在下文中,称为部分0(S0)中的中间值)。接着,以与部分0(S0)的情况相同的方式,与部分1(S1)有关,控制单元7计算两个比较区域(其定位在液滴排出方向的正方向侧)的部分1(S1)中亮点数量的最大值以及亮点数量的最小值的平均值(参照图11,(2b))。换言之,如图11中所示,当最小值为0时,控制单元7计算在部分2(S2)中亮点数量的最大值乘以1/2的值(在下文中,称为部分2中的中间值)。接着,在亮点数量从部分0(S0)中的最大值减少的过程中,控制单元7计算在达到亮点最大数量的1/2时的第一时间。换言之,控制单元7采取在部分0中的中间值,计算曲线图的水平轴上的平行直线,以及计算在部分0(S0)标绘的直线交叉点的点的相位值(参考图11中的点(2c))。接着,在亮点数量朝部分2(S2)中的最大值增加的过程中,控制单元7计算在达到亮点最大数量的1/2时的第二时间。换言之,以与部分0(S0)的情况相同的方式,控制单元7采取在部分0中的中间值,计算曲线图的水平轴上的平行直线,以及计算在部分0(S0)标绘的直线交叉点的点的相位值(参考图11中的点(2d))。最后,基于第一时间和第二时间,控制单元7确定延迟时间为(第一时间+第二时间)/2。换言之,控制单元7计算与点(2c)以及点(2d)有关的相位值的中间点(参照图11中的点(2e)),并确定具有设定为标准区域内亮点最大数量的中间点的相位值。根据以上,在流式细胞仪1中,控制单元7通过参考与相对于所述图像信息中所述液滴的排出方向邻近所述标准区域的两个比较区域中的亮点数量有关的邻近信息,来计算延迟时间。以此方式,在流式细胞仪1中,可以精确地且自动地对液滴施加电荷,而不担心在同步液滴和电荷信号之间将发生相移。此外,作为本步骤S6的实例的第二延迟时间确定方法有利地用于样品在空气中的情况,从检测到样品中所包含微粒的位置,直到对微粒实施电荷施加的位置(在计算S0值以及S2值的点)。此外,提供了一种情况的描述,其中,在第二延迟时间确定方法中,控制单元7计算相位值作为中间值,其具有在比较区域中亮点的数量达到最大值的1/2的值,然而,本发明不限于该实例。例如,通过计算中间值作为比较区域中亮点的最大数量的X%(例如,X是诸如90或80的任意值)的值的1/Y(例如,Y是诸如2、3或4的任意值),控制单元7也可以确定延迟时间。2-7微粒分选步骤S7图12是流程图,其用于示出在流式细胞仪1中分选诸如细胞的微粒的步骤S7。在微粒分选步骤S7中,基于在上述步骤S1至S6中确定的延迟时间,流式细胞仪1进行包含诸如细胞的微粒的分选。轨迹方向确定步骤包括“微粒检测步骤S71”以及“液滴排出以及电荷施加步骤S72”的过程。如下将提供各个过程的描述。2-7-1微粒检测步骤S71首先,在本步骤S71中,检测单元3检测微粒。以与上述步骤S1中的方法相同的方式,可以进行该检测方法。2-7-2液滴排出和电荷施加步骤S72接着,在本步骤S72中,从诸如细胞的微粒被检测单元3检测的时间起,一旦所确定的延迟时间流逝,控制单元7将信号输出至充电单元11,用于对包含微粒的液滴进行电荷施加(参照图12)。此外,充电单元11对液滴施加电荷。以此方式,在流式细胞仪1中,可以精确地且自动地对诸如细胞的所期望微粒施加电荷。此外,在流式细胞仪1中,在已确定了延迟时间的状态中,可以施加电荷。因此,在诸如细胞的微粒被检测单元3检测后,一旦临时延迟时间流逝,通过只使用激光L2照射液滴D,可以精确地确认,当减少激光的使用量时液滴D包含微粒。根据本发明的微粒分选装置和延迟时间确定方法也可采用以下构造。(1)一种微粒分选装置,包括:检测单元,检测流经流路的微粒;成像装置,对包含从设置在所述流路的端部上的孔排出的所述微粒的液滴进行成像;充电单元,对所述液滴施加电荷;以及控制单元,所述控制单元确定从所述微粒被所述检测单元检测到的时间到由所述成像装置所成像的图像信息的在标准区域中预先设置的亮点的数目达到最大值的时间作为延迟时间,在所述微粒被所述检测单元检测之后,一旦所述延迟时间流逝,可以使得所述充电单元将电荷施加至所述微粒。(2)根据(1)的微粒分选装置,其中,所述成像装置在多个不同的时间对多个所述液滴的图像进行成像,并且其中,所述控制单元使用从所述微粒被所述检测单元检测到的时间,到通过比较由所述成像装置所成像的多个液滴的所述图像信息而计算的所述标准区域内的亮点数量达到最大值的时间作为临时延迟时间来初步确定所述延迟时间。(3)根据(2)的微粒分选装置,其中,从所述微粒被所述检测单元检测到的时间起,一旦所述临时延迟时间流逝,所述成像装置在短于每个所述液滴的排出间隔时间的时间内,对所述多个液滴的所述图像进行成像,并且其中,通过参考与相对于所述图像信息中所述液滴的排出方向邻近所述标准区域的两个比较区域中的至少一个中的亮点数量有关的邻近信息,所述控制单元更新所述临时延迟时间并确定所述延迟时间。(4)根据(3)的微粒分选装置,其中在所述两个比较区域中,第一比较区域和第二比较区域在所述液滴的排出方向上按顺序进行设置,并且其中,所述控制单元计算在所述亮点的数量朝着在所述第二比较区域中所述亮点的数量达到最大值的时间增加的过程中,在所述第二比较区域中所述亮点的数量达到最大值的预定百分比的时间,并且将所述时间确定为所述标准区域内的所述亮点的数量达到最大值的时间。(5)根据(3)或(4)的微粒分选装置,其中在所述两个比较区域中,第一比较区域和第二比较区域在所述液滴的排出方向上按顺序进行设置,其中,所述控制单元计算在所述亮点的数量从在所述第一比较区域中所述亮点的数量达到最大值的时间起减少的过程中,在所述第一比较区域中所述亮点的数量达到最大值的预定百分比的第一时间,计算在所述亮点的数量朝着在所述第二比较区域中所述亮点的数量达到最大值的时间增加的过程中,在所述第二比较区域中所述亮点的数量达到最大值的预定百分比的第二时间,以及将所述标准区域内的所述亮点的数量达到最大值的所述时间确定为(所述第一时间+所述第二时间)/2。(6)根据(1)到(5)中的任一个的微粒分选装置,其中,所述控制单元调整所述液滴的排出频率,并将所述液滴的最佳排出频率确定为在所述液滴的排出方向上所述液滴开始形成的分离点最靠近所述孔的排出频率。(7)根据(1)到(6)中的任一个的微粒分选装置,进一步包括设置成彼此相对以夹置由所述成像装置所成像的所述液滴的一对偏转板,所述一对偏转板利用在所述偏转板与所述电荷之间起作用的电力来改变所述液滴的前进方向。(8)根据(1)到(7)中的任一个的微粒分选装置,其中,所述微粒分选装置是微芯片型流式细胞仪,其中,在所述微芯片中设置所述孔和所述流路。(9)一种在微粒分选装置中的延迟时间确定方法,包括:使微粒分选装置检测流经流路的微粒;使微粒分选装置对包含从设置在所述流路的端部上的孔排出的所述微粒的液滴进行成像;以及使微粒分选装置确定从所述微粒被检测到的时间直到在被成像的液滴的图像信息中的在标准区域中预先设置的亮点的数量达到最大值的时间作为延迟时间。(10)根据(9)的延迟时间确定方法,进一步在多个时间对多个所述液滴的所述图像进行成像;以及使用从所述微粒被检测到的时间直到通过比较被成像的所述多个液滴的所述图像信息而计算的所述标准区域内的所述亮点的数量达到最大值的时间的时间段作为临时延迟时间,来初步确定所述延迟时间。(11)根据(10)的延迟时间确定方法,进一步包括从所述微粒被检测到的时间起,一旦所述临时延迟时间流逝,在短于每个所述液滴的排出间隔时间的时间内,对所述多个液滴的图像进行成像;以及通过参考与相对于所述图像信息中所述液滴的排出方向邻近所述标准区域的两个比较区域中的至少一个中的亮点的数量有关的邻近信息,更新所述临时延迟时间并确定所述延迟时间。(12)根据(10)的延迟时间确定方法,其中,在所述两个比较区域中,第一比较区域和第二比较区域在所述液滴的排出方向上按顺序进行设置,所述方法进一步包括:计算在所述亮点的数量朝着在所述第二比较区域中所述亮点的数量达到最大值的时间增加的过程中,在所述第二比较区域中所述亮点的数量达到最大值的预定百分比的时间;以及将所述时间确定为所述标准区域内所述亮点的数量达到最大值的时间。(13)根据(11)或(12)的延迟时间确定方法,其中,在所述两个比较区域中,第一比较区域和第二比较区域在所述液滴的排出方向上按顺序进行设置,所述方法进一步包括:计算在所述亮点的数量从在所述第一比较区域中所述亮点的数量达到最大值的时间起减少的过程中,在所述第一比较区域中所述亮点的数量达到所述最大值的预定百分比的第一时间;计算在所述亮点的数量朝着在所述第二比较区域中所述亮点的数量达到最大值的时间增加的过程中,在所述第二比较区域中所述亮点的数量达到所述最大值的预定百分比的第二时间;以及将所述标准区域内的所述亮点的数量达到最大值的所述时间确定为(所述第一时间+所述第二时间)/2。本发明包含与于2012年3月30日向日本专利局提交的日本优先权专利申请JP2012-080192中所公开的主题,将其全部内容结合于此作为参考。本领域的技术人员应当理解,根据设计要求和其他因素,可以进行各种修改、组合、子组合和变形,只要它们在所附权利要求或其等同物的范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1