一种两亲性分子层的制备方法及装置与流程
本发明涉及两亲性分子膜领域,具体涉及一种两亲性分子层的制备方法及装置。
背景技术:
1、纳米孔蛋白需要在一个磷脂或是高分子形成的薄膜,如两亲性分子层(也即两亲性分子膜)上实现稳定得嵌入才可以使待检测的dna序列通过,以达到检测dna序列的目的。然而,目前的一些用于制备两亲性分子层的制备装置与相应的方法在应用上仍存在一些问题。
2、现有的成膜方法主要有折叠双层形成法(montal&mueller的方法),浸尖法,涂布法,膜片钳法和油包水微滴界面法等等。以上方法如折叠双层法、浸尖法、涂布双层法等,往往初次所形成的膜较厚,需要进行薄化处理,例如通过有机溶剂挥发,或通过物理涂抹铺展,或通过空气气压挤压等。薄化处理对于膜厚的控制十分重要,但是操作过程复杂,且薄化步骤难以控制(例如,难以保证物理涂抹过程中能够均匀铺展)。而微滴界面法则往往需要逐个形成微滴,并且需要对微滴的体积、位置等进行控制,操作具有一定难度,且当需要形成多个两亲性分子层时,需要首先形成多个微滴,操作繁琐。同时,现有的成膜方法通常都涉及到对制备装置的预处理,如氟等离子体处理,硅烷化处理等等,这些预处理操作都需要用的高危化学品,并需要在建设成本高昂,维护费用高昂的实验室内进行。对操作人员的生命安全和周围环境存在潜在威胁。此外,预处理还需要对所使用到的涂料用量进行精确计算,涂料过多过少都会影响试验效果。而两亲性分子膜的制备装置通常都是小型芯片,其内部结构(如微孔等)尺寸微小,因此所选的涂料用量也非常少,在微小的结构上涂抹极少量的涂料在操作上并不简单,因此,在涂抹过程中也难以避免出现涂抹过多、过少的问题。
3、例如,如申请号为201480056839.5的中国发明专利,该发明公开了一种用于生物芯片,且该发明还公开了该生物芯片的成膜方法,成膜方法包括步骤:将包含脂质分子(也即两亲性分子)的液体加入芯片表面,然后通过气泡隔开所述液体,使得脂质分子分布在芯片表面上,并且通过气泡使得脂质变薄。但是气泡生成往往需要手动操作控制(如通过移液枪制备出气泡),这个过程难以进行自动化控制,而手动操作难以控制气泡的大小,且难以保证气泡的形态稳定,因此该方法的重复性也较差。并且也该方法也需要进行预处理。
4、再例如,申请号为cn200880126160.3的中国发明,该发明公开了一种形成分隔两个体积的水溶液的层的方法,该方法通过使包含两亲性分子的水溶液流过主体以覆盖凹槽(也即微孔),使得水溶液可以跨越凹槽形成两亲性分子,虽然使得水溶液流过凹槽以形成两亲性分子这一技术容易实现,但是所制备的膜较厚,需要后续进行薄化处理,且该方法也涉及到预处理步骤。
5、此外,市面上现有的制备装置也存在一些问题,例如,现有的一些制备装置为了实现量产,并保证槽体(即用于添加溶液样品的流道)的一致性(即减少生产误差),往往选用铸造工艺(即通过模具)来制作槽体,因此,为了能够满足更多的实验需求,通常将槽体内部结构设置得较大,由此,当一些实验仅需要少量溶液样品时,将会对样品造成不必要的浪费。而如果要避免样品的浪费,则需要针对不同实验需求(不同的测序试验需要不同体积大小的槽体)制备不同尺寸的样品槽,由此需要针对不同尺寸的样品槽制备出相应的模具(也即每次生产都需要开模),这在工业生产过程中成本较高。
技术实现思路
1、为了部分地解决或部分缓解上述技术问题,本发明提供了一种两亲性分子层的制备方法,包括:
2、s1提供用于制备两亲性分子层的制备装置,所述制备装置内设有用于为所述两亲性分子层提供成长平台的至少一个微孔,以及能够使得溶液流经所述微孔的第一通道和第二通道,且所述微孔的第一端和第二端分别与所述第一通道和所述第二通道连通,其中,所述第一通道的横截面呈方形或类方形设置;
3、s2向所述第二通道内加入第一极性溶液,使得所述第一极性溶液进入至少一个所述微孔内;
4、s3依次向所述第一通道内加入膜溶液和第二极性溶液,使得所述膜溶液在所述第一通道内形成弯月面;
5、s4基于预设速度向所述第一通道内加入第二极性溶液,使得所述第二极性溶液推动所述膜溶液移动并流经所述微孔,所述膜溶液在所述微孔处形成两亲性分子层;
6、其中,所述第一通道内表面的接触角为大约65°-大约120°。
7、在一些实施例中,所述膜溶液包括:非极性溶液,以及两亲性分子。
8、在一些实施例中,所述两亲性分子可选地包括:磷脂,或高分子,或磷脂和高分子的混合物。
9、在一些实施例中,所述第一极性溶液包括:电解质,和/或聚电解质。
10、在一些实施例中,所述第一极性溶液包括:氧化还原对,和/或可以被部分氧化或还原以提供氧化还原对的氧化还原对的组合。
11、在一些实施例中,所述第一极性溶液包括:交联的琼脂糖凝胶,和/或交联的海藻酸钠凝胶。
12、在一些实施例中,所述第一极性溶液包括:用于调节ph的缓冲剂。
13、在一些实施例中,所述第二极性溶液包括:电解质,和/或聚电解质。
14、在一些实施例中,所述第二极性溶液包括:氧化还原对,和/或可以被部分氧化或还原以提供氧化还原对的氧化还原对的组合。
15、在一些实施例中,所述第二极性溶液包括:交联的琼脂糖凝胶,和/或交联的海藻酸钠凝胶。
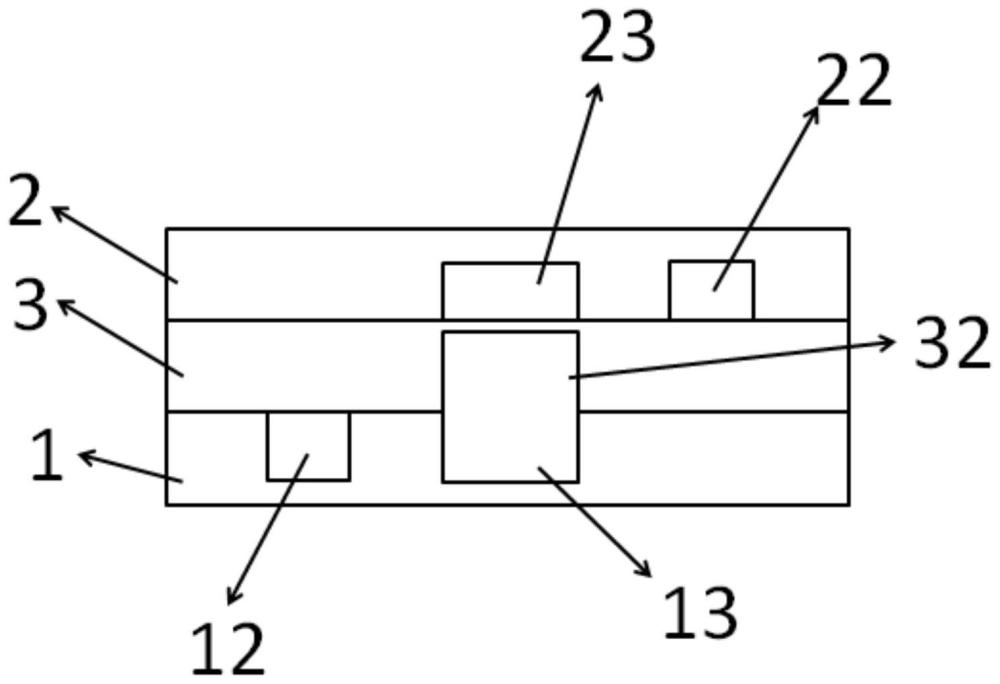
16、在一些实施例中,所述第二极性溶液包括:用于调节ph的缓冲剂。
17、在一些实施例中,在s3中,所述第二极性溶液的注入速度为大约5μl/min到大约10μl/min;
18、在一些实施例中,,在s4中,所述第二极性溶液的所述预设速度为大约10μl/min到大约20μl/min。
19、在一些实施例中,该方法还包括步骤:
20、分别向所述第一通道和所述第二通道插入第一电极和第二电极,并向第一通道和/或第二通道内加入蛋白溶液,所述蛋白溶液包括:纳米孔蛋白;
21、通过第一、第二电极施加电压向所述两亲性分子层插入纳米孔蛋白。
22、本发明还提供了一种两亲性分子层的制备装置,包括:用于为所述两亲性分子层提供成长平台的微孔,以及能够使得溶液流经所述微孔的第一通道和第二通道,且所述微孔的第一端和第二端分别与所述第一通道和所述第二通道连通;
23、其中,所述第一通道的横截面呈方形或类方形设置,且所述第一通道的内表面材料可选地为:聚甲醛、聚四氟乙烯、聚甲基丙烯酸甲酯、环氧树脂、聚碳酸酯。
24、在一些实施例中,所述第一通道包括:第一流道,所述制备装置包括:
25、第一结构层,所述第一流道设置在所述第一结构层的第一表面,且所述第一流道的两端分别设有第一开口和第二开口,其中,所述第一开口用于加样,所述第二开口用于出样;
26、第二结构层,所述第二通道设置在所述第二结构层的第一表面上,且所述第二通道上设有第三开口,所述第三开口用于加样;
27、第三结构层,至少一个所述微孔设置所述第三结构层上;
28、其中,第一、三、二结构层依次紧密连接,使得所述第一流道与所述第二结构层的第一表面相配合形成供溶液流动的第一通道,所述微孔的第一端和第二端分别与所述第一通道和所述第二通道连通。
29、在一些实施例中,所述第三结构层的第一表面上还设有凹槽,所述微孔设置在所述凹槽上,当第一、三结构层紧密连接时,所述凹槽与所述第一流道相配合共同构成可供溶液流动的第一通道。
30、在一些实施例中,所述微孔的内径在100微米到200微米之间。
31、在一些实施例中,所述第一开口和/或所述第二开口呈上大下小的设置。
32、有益技术效果:
33、本发明提供了一种用于制备两亲性分子层(或两亲性分子膜,也简称“膜”)的制备方法(即成膜方法)及制备装置。具体地,本发明提出了一种新的成膜方法,即使得膜溶液在第一通道内形成弯月面,并通过极性溶液(如第二极性溶液)推动弯月面,从而使得弯月面能够在第一通道内移动并经过微孔,然后在相应的微孔上形成两亲性分子层(膜)。
34、具体地,本发明提出的制备装置选用了具有一定疏水性的材料,即该制备装置内的第一通道内表面的材料的接触角为大约65°-120°,使得加入到第一通道内的膜溶液能够在第一通道内表面、极性溶液(第二极性溶液)以及第一通道内的空气的共同作用下,形成弯月面。其中,第一通道的横截面优选地呈方形或类方形的设置,此时,第一通道对膜溶液(或者说膜溶液所形成的弯月面)的移动会产生一定的阻力,使得膜溶液在第一通道内的移动速度不会过快,且膜溶液上各个位置的移动速度相对均匀(或者说,各个位置的流动速度的差别对弯月面的稳定性影响不大),使得弯月面能够在移动过程中能够保持稳定的形态。
35、通过极性溶液推动弯月面(即膜溶液)在微孔处成膜的成膜方式,可以对膜溶液的移动速率进行较为精准的控制(例如,通过移液枪或注射泵等对极性溶液的注入速度进行控制,从而对膜溶液的移动速度进行控制),从而使得膜溶液在微孔处的停留时间可控,避免膜溶液在微孔区域停留过久而形成厚的膜,或者在微孔区域移动过快而没有成功形成膜。因此,本发明能够通过对膜溶液的移动速度进行较为精准的控制,从而直接制成膜厚符合使用要求的两亲性分子层,而无需在成膜后对膜进行薄化处理(如高压击穿,多次成膜)。换句话说,本发明的成膜方法可控性较好(如相较于现有技术的气泡挤压的方式),可以一次成膜。
36、因此,在实际应用场景中,当膜溶液的浓度、移动速度等参数选定后(如通过预实验,或通过工作人员的操作经验确定),可以基于相同的实验条件和参数进行多次实验,且多次实验所得结果(如成膜情况)差别很小,也即是本方法的重复性较好。换句话说,本发明所提供的方法可以避免或减少工作人员的手动操作对实验操作的影响,以避免或减少操作过程中的不可控因素(即本方法可控性更好),从而具有较好的可重复性。
37、并且,由于制备装置的第一通道内表面以及微孔内表面选用了具有一定疏水性的材料(如聚甲醛),本发明提出的成膜方法无需进行预处理,成膜方法更加简单,且操作过程中对工作人员的安全性更有保障(不涉及到危险物品的操作与使用)。
38、进一步地,对极性溶液的注入速度的控制可以通过注射泵(或其他能够控制溶液注入速度的装置)来实现,且注射泵可以通过电子设备(如计算机等)进行自动化控制(即本发明所提出的成膜方法可以实现自动化控制),从而可以进一步地减少工作人员的手动操作步骤,相应地也避免了工作人员手动操作可能造成的误差,以进一步地保证了成膜的稳定性与均一性。
39、本发明所提供成膜方法以及装置能够应用于实验室中的多种检测需求(如适用于科研单位、商业检测公司等不同的应用场景),进一步地,本发明所提出的成膜方法以及装置优选地适用于数据量少的应用场景(例如,一次性只需要形成少量甚至一个两亲性分子层的试验研发阶段)。
40、可以理解的是,本发明所提供的方法及装置可以与现有的自动化控制相配合,以实现流程的自动化,从而进一步地对操作流程进行精准控制,以提高实验结果的准确性和可靠性。但是,当对数据量需求较少时(如仅需要一个或少个两亲性分子层时),自动化操作的使用成本相对较高。此时,综合考虑时间与成本,手动操作更加适用于实际需求。而本发明所提供的方法流程简单,可以通过控制膜溶液的移动速度一次成膜(具有较好的可控性),且无需对装置进行预处理,也无需对膜进行薄化处理,既降低了操作难度,也减少了成膜耗时。因此,即使通过工作人员手动操作全程,也能制备到厚度适宜的薄膜,并且能够达到与自动化控制相同或相近的技术效果。
41、进一步地,与现有技术不同的是,本发明的制备装置在微孔的两端均设有用于通入溶液的通道(也即第一通道和第二通道)。因此,本发明的制备装置可以在微孔的两侧灵活的插入电极,而无需在微孔处预设电极(现有技术中,需要在小型的芯片上加工设置电极,生产工艺较为复杂),制备装置的生产工艺更简单,生产成本更低。同时,在微孔的两端分别设有第一通道和第二通道,更利于对装置内部(如微孔)以及电极进行清洁,例如,分别向第一通道、第二通道通入清洁液即能实现对微孔的第一端与第二端的清洁,从而实现对装置内部的清洁维护,提高装置的使用寿命(同时避免清洁不全面影响后续实验)。
- 还没有人留言评论。精彩留言会获得点赞!