在电极表面附近产生pH/离子浓度梯度以调节生物分子相互作用的方法与流程
本申请要求2012年7月6日申请的美国申请系列号13/543,300的权益,通过引用将这个申请的内容并入本文。
发明领域
本发明涉及使用生物传感器对生物分子的诊断方法及改良这种生物传感器的方法。此外,本发明涉及在电极表面附近产生pH浓度梯度以调节这种生物传感器中生物分子相互作用的方法。
发明背景
近年来,越来越感兴趣于预测医疗、预防医疗及特别是个体化医疗,这需要具有更高保真度如灵敏性和特异性的诊断检测。多重测量平台(Multiplexed measurement platforms)例如目前用于研究中的蛋白质阵列属于不久的将来具有发展前途的诊断技术。这些检测中的样品可以是人类体液如血液、血清、唾液、生物细胞、尿液,或者其它生物分子,也可以是消费品如牛奶、婴儿食物或者水。在这个领域内,越来越需要低成本多重检测以检测生物分子如核酸、蛋白质以及小分子。实现这种检测中的灵敏性和特异性是个有难度的挑战。将这些检测与集成电子产品组合及使用CMOS技术已经提供了解决其中一些挑战的方案。
在检测测定中的两个主要限制包括灵敏性和交叉反应性。这两个因素影响最小可检测浓度并因此影响诊断误差率。这种检测中的灵敏性通常受到标记检测准确度、探针-分析物对(例如抗体-抗原对)的缔合系数及表面上探针分子(例如探针抗体)的有效浓度的限制(如图1所示)。生物学样品中的其它分子通过与探针分子(例如初级抗体)结合或者通过分析物与检测位点表面的物理吸附也可影响最小可检测浓度(如图2所示)。检测剂(例如二级抗体)也可以物理吸附于表面,导致背景信号的增加(如图2所示)。解决交叉反应性和背景问题在新检测的开发中要花费大量时间并增加了整体检测的成本和复杂性。测定典型地通过寻找最佳试剂和条件以及通过产生最特异性的探针分子(例如抗体)而优化。这样导致较长的开发时间、在一些情况中的检测不可行性以及较高的生产成本。例如,典型的ELISA测定的开发需要一些科学家工作一年以上以发现正确的抗体作为所述测定开发的一部分。蛋白质的交叉反应性可能是这种尝试失败的根源。
提供多位点检测平台的生物传感器被认为是提供了解决上述测定开发中的一些限制的方案。公开的美国专利申请US 2011/0091870描述了具有多个位点的这种生物传感器,其可以进行不同的反应条件以调节生物分子分析物(例如蛋白质)与探针分子的结合。例如,在具有四个位点的生物传感器中检测的信号也可具有几种成分,例如四种。这四项(terms)可相应于感兴趣的生物标记的浓度、样品中与初级抗体(探针分子)位点非特异性结合并且阻止所述生物标记结合的干扰分析物的浓度、样品中形成夹心并产生错误信号的干扰分析物的浓度,以及最终样品中与表面物理吸附并产生错误信号的干扰分析物的浓度。各项(term)与结合效率因子αij也成比例,所述结合效率因子是分子亲和性及其它测定条件例如质量转运(mass transport)的函数。通过控制在单独每个位点的条件,不同位点具有不同的效率因子。在每个位点的信号的精确测量导致多个方程和多个未知数,例如,
其中Can相应于靶向的生物分子分析物浓度,Cj1、Cj2、Cj3相应于引起背景信号中不同各项(terms)的那些分子的总浓度。
在这种生物传感器作为感兴趣的生物分子分析物的检测系统的性能中,重要的是在不同位点的测定条件的精确和准确控制以产生结合效率因子的较大改变。因此,需要可以与基于CMOS、电极阵列或者TFT的设置(setup)易于集成的方法,以产生在具有多个检测位点的阵列的生物传感器中的检测位点之间结合效率的较大改变。
发明概述
本发明提供了这样的方法,其可以与例如基于CMOS、电极阵列或者TFT的生物传感器集成,以产生在具有多个检测位点阵列的生物传感器中的检测位点之间结合效率的较大改变。具体而言,本发明提供了调节这种生物传感器的电极表面附近pH或离子浓度的方法,以调节探针生物分子与感兴趣的生物分子分析物之间的生物分子相互作用。
在一个实施方案中,本发明提供了一种调节生物传感器中pH或离子浓度的方法,所述方法包括:
a)提供包含检测位点的多位点阵列的生物传感器,检测位点中与生物分子分析物相互作用的条件可以独立地变化,每个检测位点包含在水性溶液中的支持物,所述支持物包含一或多个电极或者包含电磁铁、及其上具有一或多个固定化探针的生物分子界面层;
b)在所述水性溶液中加入电化学活性剂、酶、酶底物、缓冲抑制剂,或者其组合;及
c)使所述电化学活性剂、酶、酶底物或者其组合在水性溶液中反应,以产生H+离子或OH-离子,或者用缓冲抑制剂增加H+离子或OH-离子的扩散,或者用缓冲抑制剂抑制H+离子或OH-离子与缓冲盐之间的相互作用。
在另一个实施方案中,本发明提供了一种调节生物传感器中pH和离子浓度的方法,所述方法包括:
a)提供包含检测位点的多位点阵列的生物传感器,检测位点中与生物分子分析物相互作用的条件可以独立地变化,每个检测位点均包含在水性溶液中的支持物,所述支持物包含一或多个电极或者包含电磁铁、及其上具有一或多个固定化探针的生物分子界面层;
b)在所述水性溶液中加入电化学活性剂;及
c)氧化或还原所述电化学活性剂。
在另一个实施方案中,本发明提供了一种调节生物传感器中pH或离子浓度的方法,所述方法包括:
a)提供包含检测位点的多位点阵列的生物传感器,检测位点中与生物分子分析物相互作用的条件可以独立地变化,每个检测位点均包含在水性溶液中的支持物,所述支持物包含一或多个电极或者包含电磁铁、及其上具有一或多个固定化探针和一或多个固定化酶的生物分子界面层;
b)在所述水性溶液中加入酶底物;及
c)酶促氧化或还原所述酶底物。
在再一个实施方案中,本发明提供了一种调节生物传感器中pH或离子浓度的方法,所述方法包括:
a)提供包含检测位点的多位点阵列的生物传感器,检测位点中与生物分析分析物相互作用的条件可以独立地变化,每个检测位点包含在水性溶液中的一个电磁铁及具有一或多个固定化探针的生物分子界面层;
b)在所述水性溶液中加入固定化在微粒或纳米粒子上的一或多种酶;
c)在所述水性溶液中加入酶底物;及
d)酶促氧化或还原所述酶底物。
在另一个实施方案中,本发明提供了一种调节生物传感器中pH或离子浓度的方法,所述方法包括:
a)提供包含检测位点的多位点阵列的生物传感器,检测位点中与生物分子分析物相互作用的条件可以独立地变化,每个检测位点包含在水性溶液中的支持物,所述支持物包含一或多个电极或包含电磁铁、及具有一或多个固定化探针的生物分子界面层;
b)在所述水性溶液中加入酶;及
c)使所述酶在电极表面反应。
在另一个实施方案中,本发明提供了一种调节生物传感器中pH或离子浓度的方法,所述方法包括:
a)提供包含检测位点的多位点阵列的生物传感器,检测位点中与生物分子分析物相互作用的条件可以独立地变化,每个检测位点包含在水性溶液中的支持物,所述支持物包含一或多个电极或者包含电磁铁、及具有一或多个固定化探针的生物分子界面层;
b)在所述水性溶液中加入缓冲抑制剂;及
c)抑制H+离子或OH-离子的扩散或者抑制H+离子或OH-离子与缓冲盐之间的相互作用。
在再一个实施方案中,本发明提供了一种用于检测生物分子分析物的生物传感器,其包含检测位点的多位点阵列,检测位点中与生物分子分析物相互作用的条件可以独立地变化,每个检测位点包含:
a)在水性溶液环境中的支持物;
b)一或多个电极;及
c)具有一或多个固定化探针及一或多个固定化酶的生物分子界面层。
在另一个实施方案中,本发明提供了一种检测生物学样品中生物分子分析物的方法,所述方法包括:
a)提供包含检测位点的多位点阵列的生物传感器,检测位点中与生物分子分析物相互作用的条件可以独立地变化,每个检测位点包含在水性溶液中的支持物,所述水性溶液包含水可混溶的有机共溶剂如乙腈、二甲亚砜(DMSO)、二甲基甲酰胺(DMF)以及N,N-二甲基乙酰胺(DMAc),以促进电化学活性剂的溶解,所述支持物包含一或多个电极或者包含电磁铁、及其上具有一或多个固定化探针的生物分子界面层;
b)在每个检测位点向水性溶液中加入电化学活性剂、酶、酶底物、缓冲抑制剂或者其组合;
c)使所述电化学活性剂、酶、酶底物或者其组合在水性溶液中反应以产生H+离子或OH-离子,或者用缓冲抑制剂增加H+离子或OH-离子的扩散,或者用缓冲抑制剂抑制H+离子或OH-离子与缓冲盐之间的相互作用;
d)在每个检测位点加入生物学样品;及
e)检测每个检测位点中的生物分子分析物,
其中在步骤b)中加入的量及在步骤c)中的反应在检测位点的亚阵列中的检测位点之间是变化的,以获得其中在检测位点中在电极表面附近的pH或离子浓度是变化的检测位点组。
附图简述
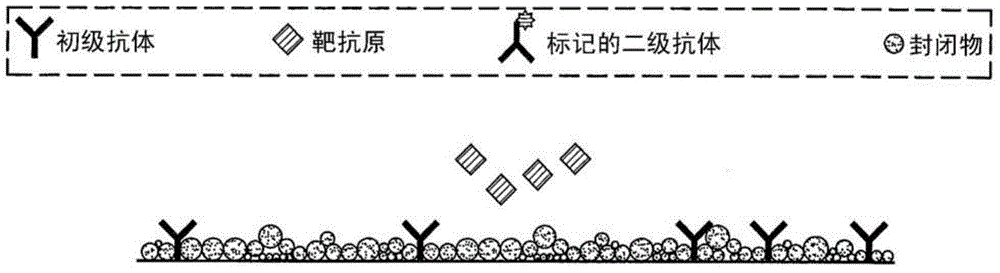
图1:例证了典型和熟知的ELISA测定的步骤:a)将样品导入封闭的表面(blocked surface)上的固定化初级抗体并保温,b)洗涤样品,及c)加入标记的二抗。标记的数目与靶抗原的浓度成正比。
图2:例证了不希望的交叉反应性。除了感兴趣的抗原(菱形所示)之外的分子可以结合初级抗体或者表面,要么产生不正确的信号要么阻止抗原形成夹心。
图3:例证了多位点传感器及检测信号中的成分。在图下方的两个示意图相应于两个位点。
图4:例证了多位点传感器中传感器检测位点的组成。
图5:使用电化学方法的电极表面上pH变化的示意图。
图6:当使用磁性微粒/纳米粒子使其与蛋白质表面接近时通过酶反应导致的pH变化示意图。
图7:A)在仅PBS中的氧化铟锡电极(ITO)的循环伏安图。其中可发生pH变化的区域是其中相对于Ag/AgCl参比电极的析氧超过1V的区域。B)在ITO电极中检测的抗坏血酸氧化的循环伏安法研究。目前大约0.25V的增加表示ITO电极氧化的开始。
图8:A)在磷酸盐缓冲液中在表面上施加1V。在施加1V之前和之后的阻抗变化表示电极中PEG的变化或除去。B)抗坏血酸在ITO-PEG表面在0.5V和0.75V的氧化。在抗坏血酸氧化期间阻抗无改变表示PEG层不经历任何变化。
发明详述
为了改变生物传感器中检测位点的多位点阵列中pH或离子浓度梯度,本发明提供了一种调节生物传感器中pH或离子浓度的方法,所述方法包括:
a)提供包含检测位点的多位点阵列的生物传感器,检测位点中与生物分子分析物相互作用的条件可独立地变化,每个检测位点包含在水性溶液中的支持物,所述支持物包含一或多个电极或者包含电磁铁、及其上具有一或多个固定化探针的生物分子界面层;
b)在所述水性溶液中加入电化学活性剂、酶、酶底物、缓冲抑制剂或者其组合;及
c)使所述电化学活性剂、酶、酶底物或者其组合在所述水性溶液中反应,以产生H+离子或OH-离子,或者用缓冲剂增加H+离子或OH-离子的扩散,或者用缓冲抑制剂抑制H+离子或OH-离子与缓冲盐之间的相互作用。
在上述方法中,在多位点阵列生物传感器中的各个检测位点可以获得局部pH或离子浓度梯度。在生物传感器的多位点阵列的亚组中,电极、特别是生物分子界面层中(生物分子)探针附近的局部pH和/或离子浓度梯度的变化,使得可以调节(生物分子)探针与来自生物学样品的待检测的分析物的结合效率。感兴趣的分析物当与(生物分子)探针结合时,随后可以使用检测剂如标记的二抗进行检测,多位点阵列亚组中结合效率的调节提供了一种精确确定这种感兴趣的分析物的方法。
生物传感器优选包含如在US 2011/0091870中描述的检测位点的多位点阵列。这种多位点阵列优选包括检测位点的许多不同的亚阵列/亚组。每个检测位点表示对来自生物学样品的(生物分子)分析物进行分析的一个位点,通过使用(生物分子)探针检测所述(生物分子)分析物而进行。每个亚阵列/亚组的每个检测位点中的分析条件可以变化以获得不同信号的集合,这样获得多个方程和多个未知项(unknowns),从中可以确定所述(生物分子)分析物的浓度,以获得所述(生物分子)分析物的精确测量。
在所获得的变化信号中的多个未知项均包含项(term),其与结合效率因子αij及在检测位点检测的生物学样品中各个分子结合浓度成比例。具有多个未知项的多个方程可以如下所示:
其中Can相应于靶向的生物分子分析物浓度,Cj1、Cj2、Cj3相应于导致背景信号中不同各项(terms)的那些分子的总浓度,从这种多个方程的集合,可以确定靶向生物分子分析物的浓度。
亚阵列/亚组的数目以及每个亚阵列/亚组内检测位点的数目可以变化,根据需要获得这种分析物的精确测量。一些这样的分析条件包括如温度、剪切力和压力等参数。例如,在其中生物分子探针与生物学样品中感兴趣的分析物相互作用的水性溶液的温度可以使用在检测位点的电磁加热而改变。所述生物分子探针与感兴趣的分析物之间相互作用的另一个重要条件是pH或离子浓度。本发明所述方法在生物分子探针的局部环境中调节这个pH或离子浓度,以影响生物分子探针附近的结合效率。
多位点阵列的亚阵列/亚组中每个检测位点均包含支持物,其上放置了一或多个电极,及在固体表面上固定或结合了生物分子探针(如图3和4所示)。生物分子探针与固体表面或支持物的固定有助于降低所述分析方法需要的探针数量,并且也确定了检测区域的位置以进行精确测量。生物分子探针因此附着于支持物和/或电极的固体表面,如那些二氧化硅、玻璃、金属以及半导体材料(如图4所示)。
分子生物探针附着于或固定化在生物分子界面层内的支持物和/或电极上(如图4所示)。所述生物分子层包括一层固定化聚合物,优选硅烷固定化聚乙二醇(PEG)。表面固定的聚乙二醇(PEG)可用于防止生物分子分析物与表面的非特异性吸附。至少一部分表面固定的PEG可包含末端官能团如能缀合的N-羟基琥珀酰亚胺(NHS)酯、马来酰亚胺、炔烃、叠氮化物、抗生蛋白链菌素或生物素。生物分子探针可以通过与表面固定的PEG缀合而固定。重要的是用于改变pH的所述方法不削弱例如固体支持物表面上PEG或者使生物分子探针与PEG缀合的接头的共价结合(如图5所示)。如本文所述调节pH或离子浓度的方法看可保护这些表面化学作用,同时实现生物分子探针的环境中pH/离子浓度的改变。
合适的生物分子探针可以是感兴趣的分析物具有特异性亲和性的碳水化合物、蛋白质、糖蛋白、糖缀合物、核酸、细胞或配体。这种探针可例如是抗体、抗体片段、肽、寡核苷酸、DNA寡核苷酸、RNA寡核苷酸、脂质、凝集素,其与细胞、糖、激动剂或拮抗剂表面上的糖蛋白和糖脂结合。在特定的实施例中,生物分子探针是蛋白质抗体,其与例如存在于生物学样品中的抗原相互作用,所述抗原是感兴趣的生物分子分析物。
在本文描述的分析方法中,生物学样品中的感兴趣的分析物可例如是蛋白质,如抗原或酶或肽、完整细胞、细胞膜成分、核酸如DNA或RNA,或者DNA寡核苷酸,或者RNA寡核苷酸。
电极可以是适用于生物传感器中的任何电极,例如氧化铟锡(ITO)、金或银电极。在优选的实施方案中,本文所述方法中生物传感器中的电极是氧化铟锡(ITO)电极。
根据本发明一个实施方案的使用生物传感器检测生物学样品中生物分子分析物的分析方法是包括如下步骤的方法:
a)提供包含检测位点的多位点阵列的生物传感器,检测位点中与生物分子分析物相互作用的条件可独立地变化,每个检测位点包含在水性溶液中的支持物,所述支持物包含一或多个电极或者包含电磁铁、及其上具有一或多个固定化检测剂的生物分子界面层;
b)在所述水性溶液中的每个检测位点加入一种电化学活性剂、酶、酶底物、缓冲抑制剂或者其组合;
c)使所述电化学活性剂、酶、酶底物或者其组合在所述水性溶液反应,以产生H+离子或OH-离子,或者使用缓冲抑制剂增加H+离子或OH-离子的扩散,或者使用缓冲抑制剂抑制H+离子或OH-离子与缓冲盐之间的相互作用;
d)在每个检测位点加入生物学样品;及
e)检测每个检测位点中所述生物分子分析物,
其中在步骤b)中加入的量及在步骤c)中的反应在检测位点的亚组阵列中的检测位点之间是变化的,以获得其中在检测位点中电极表面附近的pH或离子浓度是变化的检测位点组。所述水性溶液包含水可混溶的有机共溶剂,例如乙腈、二甲亚砜(DMSO)、二甲基甲酰胺(DMF)及N,N-二甲基乙酰胺(DMAc),以促进电化学活性剂的溶解。水可混溶的有机溶剂的量可以是相对于水性溶液中水的0.1-80%v/v,优选0.1-10%v/v,最优选1.0-5.0%v/v。因此本发明的分析方法在每个检测位点亚组中获得在生物分子探针附近亚组中检测位点的pH或离子浓度梯度。所述生物学样品中分析物及任何其它分子的结合效率因此在每个亚组的每个检测位点组中受到不同影响。
生物分子分析物可以使用任何合适的方法检测。已知的这种分析物的检测方法包括发光法、荧光法、比色方法、电化学方法、阻抗测量或者磁性诱导测量。在各种这样的方法中,分析物结合未固定的生物分子探针,及特异性结合分析物的检测剂如二级标记的探针结合固定化探针被导入。这种检测剂或二级标记的探针产生可检测信号如发光或荧光(如图5和6所示)。
在这种分析方法中,未固定的生物分子探针周围的溶液的pH已知很大程度地影响探针与分析物之间的结合/活性。周围蛋白质其它离子的浓度也明显影响所述结合/活性。本发明提供了调节在表面附近固定化的生物分子探针附近的pH和/或离子浓度的方法。这些固体表面附近pH的调节也影响分析物与除了生物分子探针之外的其它分子的非特异性结合及生物学样品溶液中其它分子与生物分子探针或分析物的相互作用。然而pH或离子浓度的调节应不削弱任何表面化学作用如在生物传感器中在多位点阵列的检测位点中生物分子探针固定化在其固体支持物上。如本文所述调节pH或离子浓度的方法可保护这些表面化学作用,同时实现生物分子探针环境中pH/离子浓度的改变。
当实施本文所述的方法时,表面化学作用相容性是应注意的重要的考虑事项。pH变化是通过氢离子或氢氧根离子浓度的改变而导致的。如图5所示,在电极-液体、电极-交联剂、交联剂-蛋白质及蛋白质-蛋白质界面发生的各种化学反应也可以成为在固体表面附近发生的pH变化到达其上方的蛋白质的阻碍。其可简单地作为离子的扩散屏障并阻碍在生物分子探针和分析物周围的pH变化。本文所述的调节pH或离子浓度的这些方法有助于使得氢离子或氢氧根离子浓度的改变最大化,以便其可以克服由表面化学作用带来的任何扩散屏障。
另一重要方面是溶液与固体界面接触的缓冲能力。所述缓冲作用可以足够大,在界面的pH变化从未达到远离其固定的生物分子探针。所述举例可以基于在固体界面上方沉积的生物分子界面层而变化。这种生物分子界面层可具有300nm或更小的厚度,优选在1-150nm之间,甚至更优选在5-100nm之间。如此在固体界面与生物分子界面层内的生物分子探针之间的距离可以在0.1-300nm范围。在所述溶液中或者在所述表面上使用缓冲抑制剂扩大电极界面上pH变化以达到成对的相互作用的探针-分析物,可有助于调节在生物分子探针附近的pH或离子浓度。
下文是调节在固体-液体界面的pH/离子浓度的方法的实施例。这些包括:1)通过在所述溶液中加入电化学活性物质在电极表面经电化学产生离子,基于电化学氧化/还原产生感兴趣的离子(例如H+、Mg+、OH-);2)使酶接近感兴趣的位点,从与酶反应的酶底物中释放这种感兴趣的离子;3)导入缓冲抑制剂,例如通过混合选择性降低溶液(例如磷酸盐溶液)中离子扩散速度的聚合物。美国专利No.7,948,015描述了这种抑制剂的应用,其中感兴趣的是测量小的局部pH变化(例如在DNA测序中)。然而,在局部调节pH的方法中,可以使用相似的抑制剂以扩大进一步远离电极-液体界面的局部pH变化;4)由于静电力,电极表面附近的先前存在的离子重新分布。
在如本文所述调节生物传感器中pH或离子浓度的方法的一个实施方案中,将一种电化学活性剂加入水性溶液中多位点阵列中的检测位点,其中所述检测位点具有包含生物分子探针或检测剂及使电化学活性剂氧化或还原的生物分子界面层。可以加入的所述电化学活性剂的浓度为1nM-100mM,优选浓度为10nM-10mM,更优选浓度为100nM-5mM。所述电化学活性剂可以被电氧化或者电还原,电极电压为-2V至+2V(vs.Ag/AgCl参比电极)。优选电极电压为-1V至+1V,更优选电极电压为-0.5V至+0.5V。
合适的电化学活性剂包括盐酸多巴胺、抗坏血酸、苯酚及衍生物、苯醌及衍生物,例如2,5-二羟基-1,4-苯醌,2,3,5,6-四羟基-1,4-苯醌和2,6-二氯醌-4-氯亚胺;萘醌及衍生物,例如羟基-1,4-萘醌,5,8-二羟基-1,4-萘醌及1,4-萘醌-2-磺酸钾;及9,10-蒽醌及衍生物,例如蒽醌-2-羧酸钠,9,10-蒽醌-2,6-二磺酸钾。
在生物传感器中调节pH或离子浓度的方法的另一个实施方案中,将酶固定化在还具有一或多个固定的生物分子探针的生物分子界面层。然后将酶底物加入水性溶液中的多位点阵列中检测位点,其中检测位点具有生物分子界面层及酶促氧化所述酶底物。
在调节pH或离子浓度的方法的另一个实施方案中,所述方法包括:
a)提供包含在水性溶液中的电磁铁及具有一或多个固定化检测剂的生物分子界面层的生物传感器;
b)在所述水性溶液中加入固定化在磁性微粒或纳米粒子上的一或多种酶;
c)在所述水性溶液中加入酶底物;及
d)酶促氧化所述酶底物。
固定化在生物分子界面层中或者固定化在磁性微粒或纳米粒子上的合适的酶包括例如氧化酶、尿素酶或者脱氢酶。这种固定化氧化酶是例如葡萄糖氧化酶,酶底物是葡萄糖。固定化酶和加入的酶底物的量在每个多位点阵列的亚组中的不同检测位点可以不同,以在这种多位点阵列的亚组中提供pH或离子浓度梯度。
或者,所述酶不固定化在固体表面上(如在上述方法中是固定化在生物分子界面层或者固定化在微粒或纳米粒子上),而是加入水性溶液中多位点阵列的亚组的检测位点。通过电解,所述酶经历在电极表面的氧化还原反应并干扰局部pH。
在每个这些实施方案中,pH或离子浓度可以通过在水性溶液中加入缓冲抑制剂而进一步调节。这种加入缓冲抑制剂有助于产生的感兴趣的离子扩散至生物分子探针或检测剂的位置或者抑制这种产生的离子与缓冲盐相互作用。或者,在如本文所述调节生物传感器中pH或离子浓度的方法中,缓冲抑制剂在不存在电化学活性剂或固定化酶的条件下加入多位点阵列的亚组的检测位点的水性溶液中。在这种实施方案中,缓冲抑制剂加入水性溶液中,促进在检测位点中电极产生的H+离子或OH-离子的扩散,或者抑制H+离子或OH-离子与缓冲盐之间的相互作用。
合适的缓冲抑制剂包括可溶的聚合物,选自聚(盐酸烯丙胺)、聚(二烯丙基二甲基氯化铵)、聚(乙烯吡咯烷酮)、聚(乙烯亚胺)、聚(乙烯胺)、聚(4-乙烯吡啶)及三(2-羧乙基)膦盐酸盐。加入的缓冲抑制剂的量在多位点阵列的每个亚组的不同检测位点可以是不同的,以提供在这种多位点阵列的亚组中pH或离子浓度梯度。
下文是例证具体方法的实施例,其不以任何方式限制本发明。所述实施例可以在在本文描述范围内根据现有知识修改。
实施例
在电极表面H+或OH-离子的电化学产生
使用的电极材料:电极材料是氧化铟锡。这是一种半导体表面,在水性溶液中具有极大电位窗。
物质的电-氧化以产生H+离子
在电极表面抗坏血酸的氧化产生H+离子,并改变电极表面pH至更酸性状态:
AH2→A+2H++2e-,
其中AH2是抗坏血酸(C6H6O6)(如图5所示)。其氧化的电极电位对于氧化铟锡材料与Ag/AgCl参比电极相比低于0.5V(如图7所示)。这种电位对于在水性溶液中析氧反应所需的电压低。较高的电极电位(例如在仅磷酸盐缓冲液中对于ITO电极>1V)可破坏PEG层(如图8所示)。抗坏血酸也作为牺牲物质(sacrificial species)以防止表面化学作用的电化学降解。
物质的电-还原作用以产生OH-离子
苯醌(C6H4O2)在-0.1V还原为氢醌(C6H6O2)可产生OH-离子
BQ+2e-+2H2O→HQ+2OH-
这种还原反应提高电极界面的pH。
在上述实施例中,产生的H+或OH-离子的量依赖于溶液中存在的物质的浓度(nM-mM范围)、应用的电位(-2V至+2V)、波形类型(脉冲、恒定、锯齿、正弦、在不同频率的方形波及工作周期(duty cycles))及物质的扩散(可以由于溶液中的添加剂而变化)。这些参数可以优化以在多位点生物传感器中存在的每个电极元件获得不同pH。
使用酶反应改变pH
酶如氧化酶、尿素酶或者脱氢酶已知在所述反应期间消耗或者产生氢。例如:
β-d-葡萄糖+O2→d-葡萄糖-δ-内酯+H2O2
d-葡萄糖-δ-内酯+H2O→d-葡糖酸盐+H+
葡萄糖在存在葡萄糖氧化酶的条件下氧化可以产生H+离子,其用于改变感兴趣的蛋白质附近的pH。
在生物分子界面层酶与生物分子探针一起的共固定化
所述酶当在表面上与蛋白质共固定化使其紧密接触时,由此通过酶反应产生的H+导致可影响蛋白质结合(例如抗原-抗体结合及非特异性结合)的局部pH变化。
将酶附着于磁性微粒/纳米粒子
将蛋白质附着于电磁铁上固体表面的微粒/纳米粒子腔。将所述酶单独附着于溶液中的磁性微粒/纳米粒子。控制装配/置于下面的电磁铁可以控制局部pH值。然后所述酶反应通过导入相应酶底物而触发(如图6所示)。或者,使用电化学活性酶。所述pH变化位于腔内,蛋白质相互作用被调节。
- 还没有人留言评论。精彩留言会获得点赞!