同步检测百草枯和敌草快的超分子传感器阵列及方法与流程
本发明总体涉及农药检测领域,具体涉及一种超分子荧光传感器阵列的制备及其应用于同步鉴定分析百草枯和敌草快。
背景技术:
根据农业部、工业和信息化部、国家质量监督检验检疫总局公告,自2014年7月1日起,撤销百草枯水剂登记和生产许可、停止生产;2016年7月1日停止水剂在国内销售和使用。而敌草快是全球仅次于草甘膦和百草枯的第三大灭生性除草剂。但是相比于百草枯,敌草快成本较高而且杀草谱有限。因此,部分厂家为了追求利润,会把百草枯产品作为敌草快或者是在敌草快产品中违规添加百草枯在国内市场上销售。这种行为不仅扰乱市场秩序,而且会给人民生命安全、环境安全和农产品质量安全带来极大的隐患。所以对这两种结构非常相似的季铵盐农药进行快速准确鉴定分析是非常重要的。
目前,对于这两种农药的分析方法有仪器分析(液相色谱、毛细管电泳等)、化学传感器法(比色传感器、荧光传感器)等。然而,仪器分析法需要将样品采集回实验室后,使用昂贵的仪器进行鉴定分析,花费的时间及成本较昂贵,尤其是对于普通群众来说,并没有条件使用复杂精密的仪器;而对于化学传感器法,大部分传感器只能对于其中一种分析物有响应或对两种都有响应但无法区分两种分析物。
技术实现要素:
本发明的目的是为了克服上述现有技术中的某些或某个缺陷,提供一种超分子荧光传感器阵列,并将其应用于同步鉴定分析百草枯和敌草快。
根据本发明的第一方面,提供一种同步检测百草枯和敌草快的超分子传感器阵列,所述传感器阵列包括探针1、2、3,探针1是由藏红T(Safranine T,ST)和羧甲基-β-环糊精(Carboxymethyl-β-Cyclodextrin,CM-β-CD)配置而成的溶液;探针2是由亚甲基蓝(Methylene blue,MB)和CM-β-CD配置而成的溶液;探针3是由苏木精(Hematoxylin,HT)和CM-β-CD配置而成的溶液。
在一具体实施例中,其中探针1中ST与CM-β-CD的摩尔比范围为1:1.5至1:2,探针2中MB与CM-β-CD的摩尔比范围为1:1.5至1:2,探针3中HT与CM-β-CD的摩尔比范围为2:1至1:1。
根据本发明的第二方面,提供一种同步检测百草枯和敌草快的方法,包括以下步骤:
(1)提供如权利要求1或2所述的超分子传感器阵列;
(2)配制一系列浓度的百草枯标准水溶液和敌草快标准水溶液,或者配制一系列浓度的百草枯和敌草快混合的标准水溶液,每一标准水溶液分成三份,分别加入探针1、2、3,采用荧光分光光度计对每份溶液进行荧光检测;将检测得到的数据通过软件进行分析,建立标准模型;
(3)提供待检测样品液,分成三份,将探针1、2、3分别加入到一份样品液中,采用荧光分光光度计对每份样品液进行荧光检测,将检测值输入到标准模型中,得出检测结果。
在上述方法中,探针1和2优选在碱性溶液中进行检测。进一步优选情况下,碱性溶液的pH值为11-12。在碱性条件下,目标物与超分子传感器反应更加完全,使结果更加准确。
在一具体实施例中,上述步骤(2)中,将检测得到的数据通过SPSS软件进行主成分分析,建立主成分分析标准模型,从而可以对含有百草枯或敌草快的样品液进行定性分析。
在另一具体实施例中,上述步骤(2)中,将检测得到的数据通过SPSS软件进行线性判别分析,建立线性判别分析标准模型,从而可以对含有百草枯或敌草快的样品液进行半定量分析。
在又一具体实施例中,上述步骤(2)中,将检测得到的数据通过MATLAB软件建立支撑向量机回归标准模型,从而可以对含有百草枯和/或敌草快的样品液进行定量分析。
本发明首次制备了新型的超分子荧光传感器阵列,结合荧光分光光度计能同时对两种季铵盐除草剂百草枯和敌草快进行定性定量分析检测,方法简单、结果准确。
附图说明
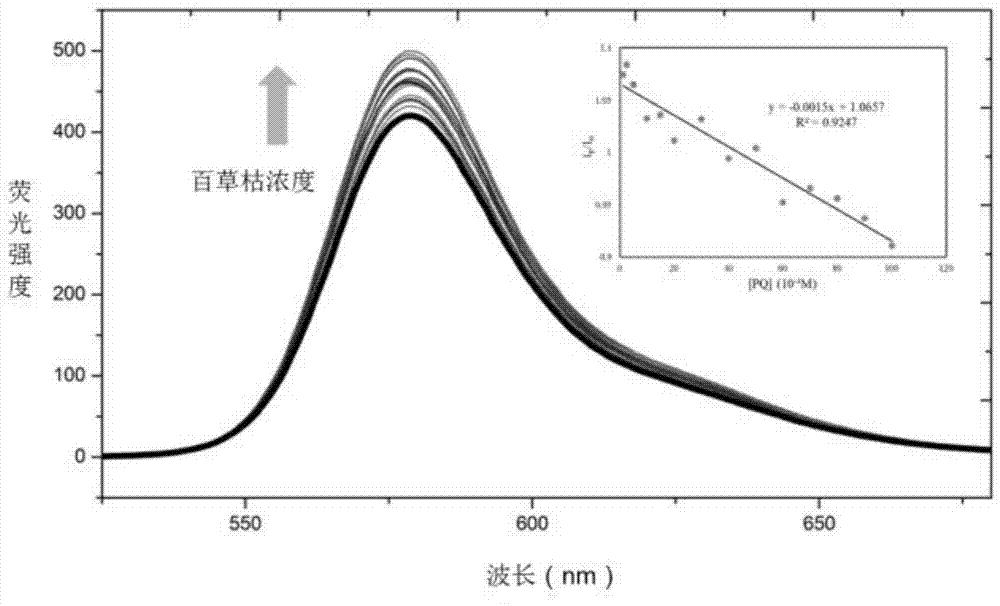
图1是探针1中加入不同浓度的百草枯的荧光光谱。
图2是探针1中加入不同浓度的敌草快的荧光光谱。
图3是探针2中加入不同浓度的百草枯的荧光光谱。
图4是探针2中加入不同浓度的敌草快的荧光光谱。
图5是探针3中加入不同浓度的百草枯的荧光光谱。
图6是探针3中加入不同浓度的敌草快的荧光光谱。
图7为超分子传感器阵列对低浓度百草枯和敌草快溶液的荧光信号主成分分析得分图。
图8为超分子传感器阵列对高浓度百草枯和敌草快溶液的荧光信号主成分分析得分图。
图9为超分子传感器阵列对不同浓度的百草枯和敌草快溶液的荧光信号线性判别分析得分图。
图10为百草枯的实际浓度和预测浓度的线性拟合图(实心点为训练数据,空心点为预测数据)。
图11为敌草快的实际浓度和预测浓度的线性拟合图(实心点为训练数据,空心点为预测数据)。
具体实施方式
本发明提供了一种用于鉴定检测百草枯和敌草快的超分子荧光传感器阵列及其应用方法,下面结合具体实施方式对本发明做进一步说明。
一、仪器与试剂
瓦里安Cary Eclipse荧光分光光度计。
藏红T(ST)、亚甲基蓝(MB)和苏木精(HT),均购买于阿拉丁;羧甲基-β-环糊精购买于山东滨州智源生物科技有限公司;百草枯和敌草快标样,均购买于农业部环境保护科研监测所,用时用超纯水稀释成所需浓度的工作溶液。
二、超分子荧光传感器阵列的设计及识别机理
相比于单个化学传感器,传感器阵列是将不同的传感器进行组合使用的一种方式。传感器阵列中使用的探针需要有广谱响应的探针(对分析物均有响应)以及特异性的探针(对某些分析物有响应),然后将得到的多维信号进行处理,即能对一些结构非常相似的分析物进行同时定性定量分析。
因为超分子传感器制备方法简单,成本较低,所以选定羧甲基-β-环糊精作为主体分子,筛选不同的染料分子(藏红T、亚甲基蓝、苏木精、结晶紫等)作为客体分子来制备对目标化合物具有响应的探针。结果发现,只有藏红T、亚甲基蓝和苏木精符合要求。因此,所述的传感器阵列中,探针1、2和3均为羧甲基-β-环糊精和藏红T、亚甲基蓝和苏木精三种染料分子通过主客体作用形成的超分子荧光探针。图1-6分别为三种探针加入不同浓度的百草枯和敌草快后的光谱图。通过以上光谱分析,发明人推断:探针1对百草枯的识别机理为百草枯通过竞争作用将荧光分子ST从羧甲基-β-环糊精的空腔中替换出来,使体系的荧光发生改变;而对敌草快的识别机理则为敌草快对荧光分子有淬灭作用,使体系的荧光发生改变。探针2的机理和探针1类似。探针3对于两种分析物的荧光响应相似,因此属于广谱性探针。所以,探针1和探针2对于百草枯和敌草快的识别机理不同,因此属于特异性探针;而探针3对两种化合物识别信号相似,属于广谱性探针。将这三种探针进行组合成为传感器阵列就可以同时对两种分析物进行定性定量的分析。
三、超分子荧光传感器阵列的制备
取0.0088g ST置于25mL容量瓶得到0.001mol/L的ST溶液,0.0093g MB置于25mL容量瓶得到0.001mol/L的MB溶液,0.0076g HT置于25mL容量瓶得到0.001mol/L的HT溶液,0.0850g CM-β-CD置于50mL容量瓶得到0.001mol/L的CM-β-CD溶液。取125μL的ST溶液和250μL的CM-β-CD溶液置于1mL离心管,混合均匀即为探针1;取125μL的MB溶液和250μL的CM-β-CD溶液置于1mL离心管,混合均匀即为探针2;取125μL的HT溶液和125μL的CM-β-CD溶液置于1mL离心管,混合均匀即为探针3。这三种探针组成了本发明的超分子(比色荧光)传感器阵列。
四、通过超分子传感器阵列的荧光信号定性区分百草枯和敌草快
取三组10mL离心管(每组10个重复),分别加入2125μL超纯水、碱性(pH=12)的百草枯标准溶液(2.4×10-4mol/L)和敌草快标准溶液(2.4×10-4mol/L),然后都加入探针1(375μL)。混合均匀后,静置20min。使用荧光分光光度计测定这三组离心管中溶液在发射波长为579nm处的荧光吸收值(激发波长为354nm)。
取三组10mL离心管(每组10个重复),分别加入2125μL超纯水、碱性(pH=12)的百草枯标准溶液(2.4×10-4mol/L)和敌草快标准溶液(2.4×10-4mol/L),然后都加入探针2(375μL)。混合均匀后,静置20min。使用荧光分光光度计测定这三组离心管中溶液在发射波长为697nm处的荧光吸收值(激发波长为638nm)。
取三组10mL离心管(每组10个重复),分别加入2125μL超纯水、普通(未调pH)的百草枯标准溶液(2.4×10-4mol/L)和敌草快标准溶液(2.4×10-4mol/L),然后都加入探针3(250μL)和超纯水(125μL)。混合均匀后,静置20min。使用荧光分光光度计测定这三组离心管中溶液在发射波长为329nm和342nm处的荧光吸收值(激发波长均为232nm)。
将上述得到的数据通过SPSS软件进行主成分分析(Principle Component Analysis,PCA),结果如图7;同上述操作,将超分子比色荧光传感器阵列同时应用于高浓度(百草枯和敌草快浓度都为2.4×10-3mol/L)的水样,结果如图8。以图7为例,图中圆点表示超分子荧光传感器阵列加入百草枯标准溶液后的荧光信号经过主成分分析后,在得分图上以一个点来表示(10个点代表10个重复);而方块点则代表超分子荧光传感器阵列加入敌草快标准溶液后的荧光信号。所以在该得分图上,圆点和方块点能够得到很好地区分就代表该超分子比色荧光传感器能够对两种除草剂进行准确地鉴定。
参见以上步骤,配制一系列浓度从低到高的百草枯标准水溶液和敌草快标准水溶液,通过以上步骤建立主成分分析标准模型。在检测某一样品液时,将样品液分成三份,参照以上步骤将探针1、2、3分别加入到一份样品液中,采用荧光分光光度计对每份样品液进行荧光吸收值检测,将检测值输入到主成分分析标准模型中,得出鉴定结果。
五、基于超分子传感器阵列荧光信号对百草枯和敌草快进行半定量分析
将三种探针分别加入一系列浓度的百草枯和敌草快标准溶液中,分别测量溶液的荧光信号,然后通过数据处理后得到两种化合物的线性曲线,从而进行半定量分析。具体做法如下:
取11组10mL离心管(每组10个重复,一组为空白,五组为百草枯水样,五组为敌草快水样),分别加入2125μL超纯水和一系列浓度的碱性(pH=12)的百草枯以及敌草快溶液(1.2×10-5、6.0×10-5、1.2×10-4、6.0×10-4、1.2×10-3mol/L),然后都加入探针1(375μL)。混合均匀后,静置20min。使用荧光分光光度计测定这11组离心管中溶液在发射波长为579nm处的荧光吸收值(激发波长为354nm)。
取11组10mL离心管(每组10个重复,一组为空白,五组为百草枯水样,五组为敌草快水样),分别加入2125μL超纯水和一系列浓度的碱性(pH=12)的百草枯以及敌草快溶液(1.2×10-5、6.0×10-5、1.2×10-4、6.0×10-4、1.2×10-3mol/L),然后都加入探针2(375μL)。混合均匀后,静置20min。使用荧光分光光度计测定这11组离心管中溶液在发射波长为697nm处的荧光吸收值(激发波长为638nm)。
取11组10mL离心管(每组10个重复,一组为空白,五组为百草枯水样,五组为敌草快水样),分别加入2125μL超纯水和一系列浓度普通(未调pH)的百草枯以及敌草快溶液(1.2×10-5、6.0×10-5、1.2×10-4、6.0×10-4、1.2×10-3mol/L),然后都加入探针3(250μL)和超纯水(125μL)。混合均匀后,静置20min。使用荧光分光光度计测定这11组离心管中溶液在发射波长为329nm和342nm处的荧光吸收值(激发波长均为232nm)。
将上述得到的数据通过SPSS软件进行线性判别分析(Linear Discriminant Analysis,LDA),结果如图9。如图9所示,空心点代表超分子荧光传感器阵列加入百草枯溶液后的荧光信号经过LDA处理后,在得分图上以一个点来表示(10个点代表10个重复);实心点代表超分子荧光传感器阵列加入敌草快溶液后的荧光信号经过LDA处理后,在得分图上以一个点来表示(10个点代表10个重复)。因此,图中两条实现就分别代表百草枯和敌草快的线性曲线。在该得分图上,不仅实心点和空心点能够进行很好地区分,不同形状的点代表不同的浓度,也能进行很好地区分,因此,根据这两条线性曲线可以对百草枯和敌草快溶液进行半定量分析。
通过以上步骤建立线性判别分析标准模型。在检测某一样品液时,将样品液分成三份,参照以上步骤将探针1、2、3分别加入到一份样品液中,采用荧光分光光度计对每份样品液进行荧光吸收值检测,将检测值输入到线性判别分析标准模型中,得出检测结果。
六、基于超分子传感器阵列荧光信号对百草枯和敌草快进行定量分析
因为在实际情况中,样本中可能同时存在百草枯和敌草快。因此为了得到更准确的定量结果,将三种探针分别加入一系列浓度的百草枯和敌草快混合溶液中,分别测量溶液的荧光信号,通过建立模型,可以通过向模型输入未知样品的荧光信号预测出水溶液中的百草枯和敌草快的准确浓度从而进行定量分析。具体做法如下:
首先选取5组一系列浓度的百草枯(PQ)和敌草快(DQ)混合溶液作为训练数据来建立模型。
取6组10mL离心管(每组10个重复,一组为空白,五组为样品),分别加入2125μL超纯水和一系列浓度的碱性(pH=12)的百草枯和敌草快混合溶液(9.5×10-6mol/L PQ+6.0×10-6mol/L DQ、7.4×10-5mol/L PQ+6.0×10-5mol/L DQ、1.2×10-4mol/L PQ+9.5×10-5mol/L DQ、2.4×10-4mol/LPQ+1.8×10-4mol/L DQ、3.6×10-4mol/L PQ+2.4×10-4mol/L DQ),然后都加入探针1(375μL)。混合均匀后,静置20min。使用荧光分光光度计测定这6组离心管中溶液在发射波长为579nm处的荧光吸收值(激发波长为354nm)。
取6组10mL离心管(每组10个重复,一组为空白,五组为样品),分别加入2125μL超纯水和一系列浓度的碱性(pH=12)的百草枯和敌草快混合溶液(9.5×10-6mol/L PQ+6.0×10-6mol/L DQ、7.4×10-5mol/L PQ+6.0×10-5mol/L DQ、1.2×10-4mol/L PQ+9.5×10-5mol/L DQ、2.4×10-4mol/LPQ+1.8×10-4mol/L DQ、3.6×10-4mol/L PQ+2.4×10-4mol/L DQ),然后都加入探针2(375μL)。混合均匀后,静置20min。使用荧光分光光度计测定这6组离心管中溶液在发射波长为697nm处的荧光吸收值(激发波长为638nm)。
取6组10mL离心管(每组10个重复,一组为空白,五组为样品),分别加入2125μL超纯水和一系列浓度的普通(未调pH)的百草枯和敌草快混合溶液(9.5×10-6mol/L PQ+6.0×10-6mol/L DQ、7.4×10-5mol/L PQ+6.0×10-5mol/L DQ、1.2×10-4mol/L PQ+9.5×10-5mol/L DQ、2.4×10-4mol/LPQ+1.8×10-4mol/L DQ、3.6×10-4mol/L PQ+2.4×10-4mol/L DQ),然后都加入探针3(250μL)和超纯水(125μL)。混合均匀后,静置20min。使用荧光分光光度计测定这6组离心管中溶液在发射波长为329nm和342nm处的荧光吸收值(激发波长均为232nm)。
上述得到的荧光信号作为训练数据集合,通过MATLAB软件建立支撑向量机(Support Vector Machine,SVM)回归模型。
选取另外2组浓度的百草枯和敌草快混合溶液作为未知样品,测试模型的预测能力。
取3组10mL离心管(每组10个重复,一组为空白,两组为样品),分别加入2125μL超纯水和一系列浓度的碱性(pH=12)的百草枯和敌草快混合溶液(3.7×10-5mol/L PQ+2.4×10-5mol/L DQ、1.5×10-4mol/L PQ+1.2×10-4mol/L DQ),然后都加入探针1(375μL)。混合均匀后,静置20min。使用荧光分光光度计测定这三组离心管中溶液在发射波长为579nm处的荧光吸收值(激发波长为354nm)。
取3组10mL离心管(每组10个重复,一组为空白,两组为样品),分别加入2125μL超纯水和一系列浓度的碱性(pH=12)的百草枯和敌草快混合溶液(3.7×10-5mol/L PQ+2.4×10-5mol/L DQ、1.5×10-4mol/L PQ+1.2×10-4mol/L DQ),然后都加入探针2(375μL)。混合均匀后,静置20min。使用荧光分光光度计测定这三组离心管中溶液在发射波长为697nm处的荧光吸收值(激发波长为638nm)。
取3组10mL离心管(每组10个重复,一组为空白,两组为样品),分别加入2125μL超纯水和一系列浓度的普通(未调pH)的百草枯和敌草快混合溶液(3.7×10-5mol/L PQ+2.4×10-5mol/L DQ、1.5×10-4mol/L PQ+1.2×10-4mol/L DQ),然后都加入探针3(250μL)和超纯水(125μL)。混合均匀后,静置20min。使用荧光分光光度计测定这三组离心管中溶液在发射波长为329nm和342nm处的荧光吸收值(激发波长均为232nm)。
上述得到的荧光信号作为测试数据来测试模型的预测能力。将实际浓度和模型预测出来的浓度做线性拟合,百草枯和敌草快的结果如图10和图11所示。以图10为例,图中五个实心点为训练集数据,横坐标代表实际溶液中百草枯的浓度,而纵坐标则是通过其荧光信号输入模型得出的预测百草枯浓度。而2个空心点则为测试数据,从线性拟合结果可以看出,模型预测出的结果和实际结果基本相同。
因此,对于定量分析未知样品的流程为:向样品中加入所述的超分子荧光传感器阵列(3种探针),分别测量不同发射波长的荧光值。将这些荧光信号输入至建立的SVM模型即可以得出该未知样品中两种农药的实际浓度。
本领域技术人员应该理解,上文所述具体实施方式仅为了更好地理解本发明,并不用于对本发明进行限制,本发明的保护范围应以权利要求书的限定为准。
- 还没有人留言评论。精彩留言会获得点赞!