癌症检测方法与流程
本公开涉及确定受试者是否患有癌症的方法。更具体地,本公开涉及当细胞形态的病理学评估关于癌症为阴性时确定受试者是否患有癌症的方法。
发明背景
癌症的发生和进展给社会带来了巨大的情感和经济负担。
病理学检查(细胞学和组织学)被用于诊断许多癌症。然而,癌症的临床诊断可能是困难的过程,特别是在癌症发展的早期阶段。例如,低级癌症病理学可能具有较差的灵敏度,导致非结论性的或不准确的发现。
在膀胱癌中,膀胱镜检查和尿细胞学检查是膀胱癌诊断和随访的最重要手段。然而,膀胱镜检查结合活检和组织学评估通常被视为诊断的金标准。因此,细胞学检查结果往往需要经由膀胱镜检查结合活检来确认。
膀胱镜检查的缺点是其需要侵袭性手术。除了侵袭性和昂贵之外,经由膀胱镜检查获得活检可能对患者具有潜在的不利后果。鉴于这些限制,很难通过膀胱镜检查多次从大量个体获得患者样品。
在乳腺癌中,乳房摄影术和组织学活检通常被用作一线诊断工具。在乳腺癌免疫组织化学生物标记物的鉴别中也投入了大量的努力。然而,大多数尚未证明具有显著价值,并且只有少数(例如雌激素受体、孕激素受体和her2/neu表达)被视为病理学检查的有用辅助物(leong和zhuang,2011)。
因此,业界需要一种能够提供更准确、早期和经济上可行的癌症诊断的方法。此类方法可帮助临床医师以降低的成本实现早期诊断。
在侵袭和转移之前癌症的早期诊断通常与改良的预后相关。因此,提供一种能够在早期较可靠地检测癌症的方法是社会和经济上的当务之急,因此可在疾病负担较轻的时候施用抗癌疗法。
技术实现要素:
本发明人已经发现,当细胞形态的病理学评估关于癌症为阴性时,他们能够确定受试者是否患有癌症。具体地,本发明人已经发现,他们能够经由病理学评估来检测形态学正常的细胞中的癌症。因此,可设想本公开的方法可用作关于癌症阴性的病理学评估程序的自反测试。因此,在第一方面,本公开涉及当对从受试者获得的样品进行的细胞形态的病理学评估关于癌症为阴性时鉴别所述样品中恶性细胞的方法,所述方法包括:使来自样品的细胞与抗端粒酶抗体接触,并且对细胞进行病理学评估以检测抗体与临床相关细胞的结合,其中抗体与临床相关细胞的结合指示存在恶性细胞。
在上述方面的实施方案中,抗体不与临床相关细胞结合指示样品中不存在恶性细胞。
在另一方面中,本发明涉及一种当对从受试者获得的样品进行的细胞形态的病理学评估关于癌症为阴性时确定受试者是否患有癌症的方法,所述方法包括:
i)使从受试者获得的样品与抗端粒酶抗体接触;
ii)对样品进行病理学评估以检测抗体与样品中临床相关细胞的结合;
其中抗体与样品中一个或多个临床相关细胞的结合指示受试者患有癌症。
当使用本公开的方法确定癌症时,该确定对于明确诊断可能是结论性的,也可能不是结论性的,在该明确诊断之后,治疗医师将确定治疗过程。确定患有癌症的受试者的癌症状态的明确诊断在准许的情况下可通过(例如)成像技术(包括pet、mri、超声波、ct、pet/ct)来验证或确认。在上述方面的一个实施例中,当确定癌症是膀胱癌时,可使用经由膀胱镜检查结合活检或上尿路成像的进一步研究来获得癌症状态的明确诊断。
本公开还可用作一线辅助测试,以在单一程序中更准确地确定恶性细胞的存在。因此,在另一方面中,本公开涉及确定受试者是否患有癌症的方法,所述方法包括:
i)对从受试者获得的样品进行细胞形态的病理学评估,以确定样品中一个或多个临床相关细胞的形态;
ii)使来自受试者的样品与抗端粒酶抗体接触,并对样品进行病理学评估以检测抗体与样品中临床相关细胞的结合;
其中当细胞形态的评估关于癌症为阴性时,抗体与一个或多个临床相关细胞的结合指示受试者患有癌症。
在上述方面的一个实施方案中,抗体与样品中至少约5%的临床相关细胞的结合指示受试者患有癌症。此外,用于确定细胞形态的病理学评估和用于检测抗体与临床相关细胞的结合的病理学评估可在相同的细胞上同时进行。
在一个实施方案中,抗体不与临床相关细胞结合指示受试者未患癌症。
在一个实施方案中,当细胞形态的病理学评估为正常、恶变前、化生或发育不良时,可使用本公开的方法来检测癌症。在各个实施例中,当细胞形态的病理学评估正常时,可使用本公开的方法来检测癌症。在各个实施例中,当细胞形态的病理学评估为恶变前、化生或发育不良时,可使用本公开的方法来检测癌症。例如,可使用本公开的方法来检测形态正常细胞中的癌症。例如,可使用本公开的方法来检测恶变前、化生和/或发育不良细胞中的癌症。
如本领域技术人员将理解的,病理学评估涉及结合组织样品中个别细胞的周围环境对其进行评估。因此,在进行本方法时,对细胞进行病理学评估以检测抗端粒酶抗体与临床相关细胞的结合。端粒酶的病理学评估允许已知为非癌性或与所研究癌症不相关的端粒酶染色细胞类型基于其形态而被排除在评估之外。例如,本公开的方法包括将非临床相关细胞排除在病理学评估之外。
被排除的细胞被认为与确定受试者是否患有癌症临床不相关。被排除的细胞将取决于被检测的癌症。更特定地,熟练技术人员将知道样品中与具体癌症相关的细胞类型。被排除的细胞的实例包括但不一定限于以下各项中的一种或多种或全部:t细胞、b细胞、嗜中性粒细胞、巨噬细胞、粒细胞、树突细胞、肥大细胞、记忆细胞、浆细胞、嗜酸性粒细胞、精囊腺细胞以及精子和鳞状细胞。例如,当使用本公开的方法评估膀胱癌时,将排除上文所列示的细胞。
在另一实施例中,本公开的方法还包括当检测到抗体与临床相关细胞结合时对癌症受试者开处方治疗。
在另一实施例中,抗端粒酶抗体是单克隆、多克隆、双特异性、嵌合、重组、抗个体基因型、人源化、单链抗体分子或其抗原结合片段。
适用于本公开的抗体的实例包括但不限于scd-a7、2d8、c-12、h-231、抗端粒酶催化亚单元、10e9-2、2c4和tel336-10。在一个实施方案中,抗体是scd-a7或其端粒酶结合片段。
在一个实施方案中,病理学评估是细胞学评估。在此实施方案中,样品可以是流体样品。例如,流体样品可选自由以下各项组成的组:尿液、膀胱冲洗液、膀胱擦洗液、血液、痰、脑脊液、胸腔积液、细针吸出物、细胞悬液。在这些实施例中,癌症可选自由以下各项组成的组:膀胱癌、甲状腺癌、乳腺癌、子宫颈癌。例如,本公开的方法可用于检测膀胱癌。
在一个实施方案中,病理学评估是组织学评估。在此实施方案中,样品可以是组织样品。例如,组织样品可选自由以下各项组成的组:膀胱、胰腺、肝脏、胆囊、甲状腺、卵巢、淋巴结、乳房、子宫颈、肺、胆道树、胰腺、肺、肾、前列腺、结肠、胃、食道和脑。在这些实施例中,癌症可选自由以下各项组成的组:膀胱癌、胰腺癌、肝癌、胆囊癌、甲状腺癌、乳腺癌、肺癌、间皮瘤、子宫颈癌、卵巢癌、肾癌、前列腺癌、结直肠癌、胃癌、食道癌、脑癌。
在一个实施方案中,癌症可以是可能存在可引起癌症的阴性病理学评估的临床相关细胞的任何癌症。例如,本公开的方法可用于检测膀胱癌。
在一个实施例中,本公开的方法可用于检测原位癌。例如,本公开的方法可用于检测原位膀胱癌。例如,本公开的方法可用于检测导管原位癌。
本公开的范围不限于本文所述的特定实施方案,这些特定实施方案仅用于举例说明的目的。功能等同的产品、组合物和方法显然在如本文所述的本公开的范围内。
在整个说明书中,除非另有特别说明或上下文另有要求,否则对单个步骤、物质组合物、步骤组或物质组合物组的引用应视为涵盖那些步骤、物质组合物、步骤组或物质组合物组中的一个和复数个(即,一个或多个)。
下文将通过以下非限制性实施例并且参考附图来描述本公开。
附图简述
图1:在样品wh11-107中未观察到细胞染色(临床阴性;图1a)。使用抗htert(克隆2c4)抗体在临床阳性样品wh11-122中显示的端粒酶免疫染色和其临床相关性的第一证据(图1b)。在最佳抗体浓度下,在40-75%的所存在尿路上皮细胞中观察到阳性细胞核染色。
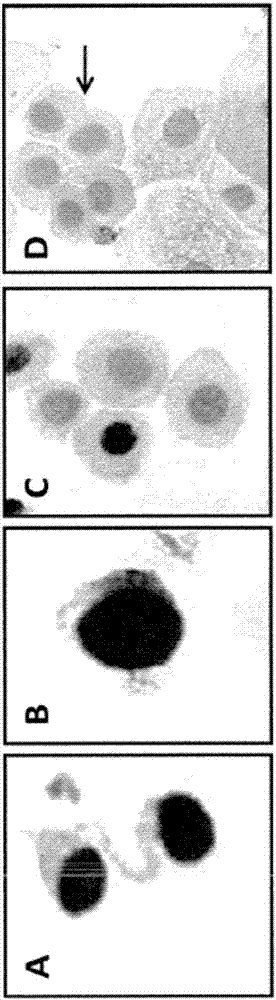
图2:在高级别(a组和b组)和低级别(c组和d组)临床样品中观察到的阳性和阴性细胞类型。通过端粒酶免疫染色进行的细胞核染色呈阳性的非典型尿路上皮细胞(a组和b组)。通过端粒酶免疫染色进行的细胞核染色呈阳性的细胞学上外观正常的尿路上皮细胞(c组),以及同一样品内未染色的细胞学上外观正常的尿路上皮细胞(d组,插入箭头)。
图3:来自低级别(g1)膀胱癌患者的临床样品关于端粒酶htert蛋白染色的细胞。a组:鳞状细胞(不是来自膀胱);b组:正常膀胱细胞(和棕色小血细胞);c组:关于锡耶纳测试呈阳性的外观正常的膀胱细胞;d组:关于端粒酶免疫染色呈阳性的细胞学上异常的膀胱细胞。
发明详述
一般技术和定义
除非另有特别定义,否则本文所使用的所有技术和科学术语都应被视为具有与本领域普通技术人员通常理解的相同的含义(例如,在癌症诊断、病理学、细胞学、组织学、免疫组织化学、蛋白质化学、抗体、生物化学和分子生物学中)。
除非另有指示,否则本公开中提到的免疫分析、样品制备和免疫学技术是本领域技术人员熟知的标准程序。这些技术在以下文献中有描述和解释:例如perbal(1984)、sambrook等(1989)、brown(1991)、glover和hames(1995和1996)、ausubel等(1988)、harlow和lane(1988)、coligan等(1994)。
术语“和/或”(例如“x和/或y”)应被理解为意指“x和y”或“x或y”,并且应视为为两种含义或任一含义提供明确的支持。
除非有相反的说明,否则如本文所用术语“约”是指指定值的+/-10%,更优选+/-5%,更优选+/-1%,更优选+/-0.5%。
在整个此说明书中,词语“包含(comprise)”或诸如“包含(comprises或comprising)”等变化形式将被理解为暗示包括所述要素、整数或步骤或要素、整数或步骤的组,但不排除任何其它要素、整数或步骤、或要素、整数或步骤的组。
病理学评估
“病理学评估”在本公开的上下文中用于指尝试通过视觉评估样品中的细胞来鉴别样品中恶性细胞的评估。如本领域技术人员所明了,病理学评估本身不是测试,而是基于具体样品或样品集的病理会诊。病理学评估程序是复杂的并且需要在样品收集方面的专业知识和护理以提供正确的评估。
在膀胱癌的情况下,病理学评估可与膀胱镜检查同时使用或作为膀胱镜检查的反射,用于检测复发或诊断膀胱癌。
在乳腺癌的情况下,病理学评估可与乳房摄影术、超声波和其它成像技术一起使用或作为所述技术的反射,用于检测复发或诊断乳腺癌。
在食道癌的情况下,病理学评估可与内窥镜检查一起使用或作为内窥镜检查的反射,用于检测复发或诊断食道癌。
本公开涉及“细胞形态的病理学评估”和“检测抗端粒酶抗体与临床相关细胞结合的病理学评估”。在一个实施例中,这些评估是分开进行的。在另一实施例中,这些评估是依序或同时进行的。在另一实施例中,这些评估是在相同细胞上依序或同时进行的。
“细胞形态的病理学评估”尝试通过视觉评估临床相关细胞的细胞形态来鉴别样品中的恶性细胞。在本公开的上下文中,细胞形态的病理学评估是指作为护理标准的一部分并且与进一步研究一起使用或作为进一步研究的反射用于检测复发或诊断癌症的程序。
“检测抗端粒酶抗体与临床相关细胞结合的病理学评估”尝试通过评估抗端粒酶抗体与临床相关细胞的结合来识别样品中的恶性细胞。
病理学评估程序的实例包括“细胞学评估”和“组织学评估”。下文将进一步讨论这些程序。
细胞学评估
癌症诊断中细胞形态的“细胞学评估”尝试基于个别细胞的形态学特征来鉴别恶性细胞。在进行细胞形态的细胞学评估时,细胞样品通常固定至载玻片,并且在显微镜下观察以视觉评估形态和细胞特征。例如,从细针吸出物获得的乳房或甲状腺上皮细胞、从尿液样品获得的膀胱尿路上皮细胞或从巴氏测试(papanicolaoutest)(子宫颈涂片)获得的子宫颈上皮细胞可固定至载玻片并且经由细胞学进行视觉评估。下文讨论适合于细胞学评估的细胞样品的各种其它实施例。
在视觉评估载玻片之前,可对样品进行染色以帮助可视化细胞和细胞组分(例如细胞核)的形态学变化。例示性染色包括苏木精和伊红染色或巴氏染色(pap染色)。
组织学评估
癌症诊断中细胞形态的“组织学评估”尝试基于细胞的形态学特征和组织架构来鉴别组织样品中的恶性细胞。
术语“组织学评估”在本公开的上下文中用于指组织的评估,具体地包含组织和其周围环境的细胞的评估。
在进行细胞形态的组织学评估时,通常将组织样品固定、切片并且安装在载玻片上,之后在显微镜下进行观察,以视觉评估组织形态、架构和细胞特征。例如,可从受试者获得膀胱活检、乳房核心活检或食道活检,将其固定、切片并且安装在载玻片上,之后在显微镜下视觉评估。下文讨论适合于组织学评估的组织的各种其它实施例。
在视觉评估载玻片上的组织切片之前,可对组织进行染色以帮助可视化细胞、细胞组分(例如细胞核)的形态学变化和表征驻留细胞类型。例示性染色包括苏木精和伊红染色、巴氏(pap)染色和阿利辛蓝过碘酸-雪夫(alcianblueperiodicacid-schiff)染色。
关于癌症阴性的细胞形态的病理学评估
本公开的方法涉及当对从受试者获得的细胞样品进行的细胞形态的病理学评估关于癌症为阴性时确定受试者是否患有癌症。术语“关于癌症阴性”在本公开的上下文中用于指样品关于癌症阴性的明确的病理学判定。设想各种病理学判定都可被视为“关于癌症阴性”。在一个实施例中,具有“正常”形态的细胞被视为关于癌症阴性。在一个实施例中,本公开的方法涉及当对从受试者获得的细胞样品进行的细胞形态的病理学评估报告为形态学正常时确定受试者是否患有癌症。换句话说,在一个实施例中,本公开的方法涉及检测形态学上正常的细胞是否是癌性的。
在另一实施例中,具有“恶变前”形态的细胞被视为关于癌症阴性。恶变前形态学是指样品具有癌性表型的某些特点但关于癌症保持阴性,因为所述样品尚未(并且在某些情况下可能永远不会)进展至恶性表型。例如,具有化生和发育不良形态的细胞可被视为恶变前的。具有恶变前形态的例示性病理包括口腔上皮病变、巴瑞特氏食道症(barrett’soesophagus)、胃肠化生和前列腺结节性增生。在一个实施例中,本公开的方法涉及当对从受试者获得的细胞样品进行的细胞形态的病理学评估被报告为恶变前病理学时确定受试者是否患有癌症。
在另一实施例中,具有“化生”形态的细胞被视为关于癌症阴性。化生形态或化生的特征在于用另一种分化的细胞类型置换一种分化的细胞类型。例如,当正常上皮内衬的区域转变为以存在“肠”杯状细胞为特征的化生上皮时,肠化生可发生在食道或胃上皮中。在一个实施例中,本公开的方法涉及当对从受试者获得的细胞样品进行的细胞形态的病理学评估被报告为化生时确定受试者是否患有癌症。例如,细胞形态的病理学评估可报告为肠化生。在食道或胃活检的情况下,细胞形态的病理学评估可报告为具有肠化生的柱状上皮。
在另一实施例中,具有“发育不良”形态的细胞被视为关于癌症阴性。发育不良的例示性特征包括红细胞大小不等、异形红细胞症、色素过多症和有丝分裂中细胞数量异常。发育不良通常被视为最早的恶变前病变形式,病理学家可经由病理学评估来识别该形式。发育不良可被描述为低级别发育不良或高级别发育不良。低级别发育不良转变为高级别发育不良并且最终转变为癌症的风险较低,而高级别发育不良代表朝向恶性转变的更高级进展。在一个实施例中,本公开的方法涉及当对从受试者获得的细胞样品进行的细胞形态的病理学评估被报告为发育不良时确定受试者是否患有癌症。在另一实施例中,本公开的方法涉及当对从受试者获得的细胞样品进行的细胞形态的病理学评估被报告为低级别发育不良时确定受试者是否患有癌症。在另一实施例中,本发明的方法涉及当对从受试者获得的细胞样品进行的细胞形态的病理学评估被报告为高级别发育不良时确定受试者是否患有癌症。
为了避免疑问,本公开不涵盖当对从受试者获得的细胞样品进行的细胞形态的病理学评估关于癌症是非结论性的时确定受试者是否患有癌症。此类病理学评估不能提供样品关于癌症为阴性的明确判定。例如,本公开的方法不涵盖当对从受试者获得的细胞样品进行的细胞形态的病理学评估被报告为关于癌症“非典型”或“不确定”时确定受试者是否患有癌症。
确定受试者是否患有癌症
现已发现,关于癌症为阴性的病理学评估可通过使用端粒酶免疫染色测试和进一步的病理学评估以检测抗端粒酶抗体与临床相关细胞的结合来确定临床状态。
在一个实施例中,可将从流体样品中分离的细胞固定至载玻片并且进行细胞学评估以检测抗端粒酶抗体与临床相关细胞的结合。例如,可经由细胞学评估在从尿液样品获得的个别膀胱尿路上皮细胞中检测抗端粒酶抗体的结合。例如,抗端粒酶抗体的结合可通过细胞学评估在从细针吸取物样品获得的个别毛囊细胞中检测。这些例示性方法的优点在于可在个别临床相关细胞中检测抗端粒酶抗体的结合。
在另一实施例中,可将组织样品固定、切片并且安装在载玻片上,并且进行组织学评估以检测抗端粒酶抗体与临床相关细胞的结合。例如,可经由组织学评估在经由活检获得的膀胱壁组织样品中的膀胱尿路上皮细胞中检测抗端粒酶抗体的结合。例如,可经由组织学评估在经由核心活检获得的乳房组织样品中的乳房上皮细胞中检测抗端粒酶抗体的结合。这些例示性方法的优点在于,可在个别临床相关细胞或细胞群中检测抗端粒酶抗体的结合,同时还可检查周围组织架构。
检测抗端粒酶抗体的结合
本发明人已经发现,抗端粒酶抗体与来自受试者的样品中的一个或多个临床相关细胞的结合指示受试者患有癌症。如本领域技术人员将理解的,癌症的指示还指示样品中存在恶性细胞。
端粒酶是一种维持染色体末端端粒长度的天然存在的酶。在人类中,端粒酶在人类干细胞、生殖系细胞和恶性细胞中过度表达。端粒酶的功能是在每条染色体的末端合成新的单链ttaggg重复序列。在正常细胞中,端粒酶通过允许细胞增殖起保护作用,从而防止端粒缩短和避免细胞衰老(bodnar等,1998)。相比之下,尽管具有相同的作用模式,端粒酶也可在恶性或可能变成恶性的细胞中展现促癌性质。在不存在衰老的情况下,细胞(肿瘤)无限期地复制,从而引入和传播突变(blackburn等,2005)。端粒酶的这种促癌性质有助于细胞的不朽和癌症的发展。所述端粒酶与癌症的关联是显而易见的,因为观察到其存在是几乎所有肿瘤细胞的共同特征。
为了检测端粒酶,将来自受试者的细胞样品与结合端粒酶的抗体(也称作抗端粒酶抗体)接触。认为诸如“接触”、“暴露”或“应用”等术语是可在本公开的上下文中互换使用的术语。术语接触要求使抗端粒酶抗体与样品接触以检测样品中的一个或多个细胞中是否存在端粒酶。抗体与端粒酶的结合指示细胞中存在端粒酶。此外,样品中存在端粒酶也可称作端粒酶阳性或关于端粒酶阳性。经由病理学评估检测抗体与端粒酶的结合。例如,可使用光学显微镜来检测临床相关细胞中抗体于端粒酶的结合。
在本公开的方法中检测抗端粒酶抗体与临床相关细胞的结合可通过本领域已知的任何抗体/抗原结合检测技术来实现,其中可经由病理学评估来检测抗体与临床相关细胞中的抗原的结合。例如,可使用并入抗端粒酶抗体的免疫分析。在此实施例中,病理学评估用于检测抗端粒酶抗体与端粒酶的结合。在本公开的方法中,端粒酶是“抗原”。还设想可将端粒酶检测方法并入自动端粒酶检测系统中。此类自动免疫分析系统将提供样品的自动处理和端粒酶的病理学检测。设想此类系统将允许样品中端粒酶的高通量分析。例示性的自动染色平台包括ventanabenchmarkultra或xt平台(ultraview或optiview检测系统)、leicabondiii(bondpolymerrefine检测系统)、dakoautostainer(dakoenvision检测系统)。
免疫分析
对于常规临床评估,设想将使用基于免疫分析格式的方法来检测样品中端粒酶的存在。在本公开的上下文中,免疫分析是通过使用抗体或免疫球蛋白测量溶液中抗原的存在或浓度的生物化学测试。
本公开中使用的抗体可以是能够检测样品中的一个或多个细胞中是否存在端粒酶的任何抗体。可检测细胞中是否存在端粒酶的各种市售抗体可用于本公开的方法。所述抗体可从以下各项获得:sapphirebiosciences、lifespanbiosciences、novusbiologicals、australianbiosearch、epitomics、santacruz、emdmillipore、genwaybiotech公司、jomarbiosciences、sigma-aldrich、biocorepty有限公司、usbiologicals、thermoscientific、liferesearch、resolvingimages和siennacancerdiagnostics有限公司。在一个实施例中,抗体结合端粒酶复合物(包括人类端粒酶反转录酶、端粒酶rna(tr或terc)和角化不良蛋白(dkc1)中的每一种和/或端粒酶反转录酶(htert))。优选地,抗体是抗htert抗体。最优选地,结合端粒酶的抗体是scd-a7、2d8、c-12、h-231、抗端粒酶催化亚单位、10e9-2、2c4和tel336-10。
这些抗体是本领域已知的。例如,抗htert(tel3)抗体是从杂交瘤克隆36-10产生的单克隆抗体。为了纯化抗体,通过蛋白质g亲和层析来纯化腹水的igg流份。抗htert(克隆scd-a7)抗体是从杂交瘤克隆hj123-2c4(masutomi等,2003)产生在中空纤维培养物中生长的igmmab。在产生此抗体时,使用从杆状病毒载体感染的昆虫细胞纯化的氨基末端flag表位加标签的htert作为免疫原,以刺激抗htert克隆scd-a7mab的产生。
抗htert(克隆2c4)抗体在(masutomi等,2003)中有描述。在产生此抗体时,使用从杆状病毒载体感染的昆虫细胞纯化的氨基末端flag表位加标签的htert作为免疫原,以刺激抗htert克隆2c4mab的产生。2c4是从杂交瘤克隆hj123-2c4产生在中空纤维培养物中生长的igmmab。
用于本公开方法中的抗体也可商购获得,例如2d8(novusnb100-297)、c-12(santacruz377511)、h-231(santacruz7212)、抗端粒酶催化亚单位(rockland600-401-252)、10e9-2(mblm216-3)、2c4(novusnb100-317)、scd-a7(siennacancerdiagnosticsp/n01-5001)。
在一个实施例中,本公开的抗体被可检测地标记。可检测标记的实例包括染料、荧光团或其它报告分子的结合物,用于分析、跟踪或成像。
本公开中所使用的抗体不限于由igm表示的单价抗体和多价抗体,并且还包括由igg表示的二价抗体,只要其结合端粒酶即可。
此外,本公开中所使用的抗体不限于整体抗体分子,而是包括微型体、二体和其修饰产物,只要其结合端粒酶即可。
微型体包含缺乏整体抗体(例如,整体igg)的一部分的抗体片段,并且只要其具有端粒酶结合能力就没有特别限制。除了端粒酶结合能力之外,对本公开的抗体片段没有特别限制,只要所述抗体片段是整体抗体的一部分即可,但所述抗体片段优选含有重链可变区(vh)和/或轻链可变区(vl)。此外,只要其具有端粒酶抗原结合能力,部分vh和/或vl可缺失。可变区可为嵌合或人源化的。抗体片段的特定实例包括fab、fab′、f(ab′)2和fv。微型体的特定实例包括fab、fab′、f(ab′)2、fv、scfv(单链fv)、双体和sc(fv)2(单链(fv)2)。这些抗体的多聚体(例如二聚体、三聚体、四聚体和聚合物)也包括在可用于检测端粒酶的微型体内。
双体是由两条多肽链组成的二聚体,并且通常,多肽链由例如五个残基左右的连接体个别地连接,该连接体足够短以防止同一链中vl与vh之间的结合。由相同多肽链编码的vl和vh在它们之间具有短的连接体,并且由于它们不能形成单链可变区片段而形成二聚体。因此,双体具有两个抗原结合位点。
优选地,结合端粒酶的抗体是单克隆、多克隆、双特异性、嵌合、重组、抗个体基因型、人源化、单链抗体分子或其抗原结合片段。
在根据本公开的优选实施方案中,用于检测端粒酶的方法使用端粒酶特异性初级抗体。初级抗体与端粒酶的结合可经由各种已知方法来可视化。例如,可使用识别初级抗体的被标记次级抗体。在此实施例中,标记物可以是酶(例如辣根过氧化物酶)、放射性同位素、荧光报告物、电致化学发光标签。被标记的二级抗体与一级抗体的结合将经由病理学评估来检测。
在一个具体实施例中,使样品与端粒酶特异性初级抗htert抗体接触。接下来洗涤样品以去除任何未结合的初级抗体,接下来将对初级抗体特异并且与过氧化物酶连接的次级抗体施加至样品。接下来洗涤样品以去除任何未结合的二级抗体,并且将3,3′-二氨基联苯胺(dab)施加至样品。dab转化为有色产物可通过常规病理学评估来可视化,其中有色产物的存在指示样品中存在端粒酶。
癌症类型
在所要求保护的方法中,癌症可以是任何癌症,只要受试者癌细胞表达端粒酶即可。在一个实施例中,癌症是膀胱癌。在各种其它实施例中,癌症是胰腺癌、肝癌、胆囊癌、甲状腺癌、乳腺癌、肺癌、间皮瘤、子宫颈癌、卵巢癌、肾癌、结直肠癌、前列腺癌、胃癌、食道癌或脑癌。
如本领域技术人员将理解的,每种癌症类型具有与癌症级别相关的各种特征。这些级别通常由癌症扩散或侵入周围组织的程度决定。例如,晚期癌症或“高级别”通常与较高的转移可能性和较差的预后相关。高级别癌症通常从起源组织或器官扩散至周围组织中或全身。相比之下,“低级别”癌症可被描述为原位癌(cis),这意味着细胞正异常增殖,但仍含在起源组织或器官内。
在一个实施例中,本公开的方法可用于确定受试者是否患有高级别癌症。
在一个实施例中,本公开的方法可用于确定受试者是否患有低级别癌症。例如,本公开的方法可用于确定受试者是否患有原位癌。例如,本公开的方法可用于确定受试者是否患有导管原位癌。
在膀胱癌的情况下,“高级别”或“较高级别”膀胱癌是指在受试者中较可能复发和/或进展和/或变得侵袭性的膀胱癌,包括具有较高转移可能性的恶性癌症(被视为侵袭性较强的膀胱癌)。不局限于膀胱的癌症(即肌肉侵袭性膀胱癌)被视为侵犯性较强的膀胱癌。
低级别膀胱癌可被描述为原位癌(cis),这意味着细胞正异常增殖但仍含在膀胱内。“低级别”或“较低级别”膀胱癌是指包括复发、进展、侵袭和/或转移的可能性较低的恶性癌症(即被认为侵犯性较弱的膀胱癌)在内的膀胱癌。局限于膀胱的癌症(即非肌肉侵袭性膀胱癌,nmibc)被视为侵犯性较弱的膀胱癌。在一个实施例中,本公开的方法可用于确定受试者是否患有高级别癌症。
在一个实施例中,本公开的方法可用于确定受试者是否患有高级别膀胱癌。
在一个实施例中,本公开的方法可用于确定受试者是否患有低级别膀胱癌。例如,本公开的方法可用于确定受试者是否患有原位膀胱癌。
样品制备和分析
在进行本公开的方法时,需要来自受试者的样品。如本文所用,术语“样品”是指来自受试者的细胞或细胞群或一定量的组织。“样品”包括样品的提取物、衍生物、碎片、悬浮液或切片。认为诸如“样品”和“样本”等术语是可在本公开的上下文中互换使用的术语。在本公开中,可使用任何细胞或组织作为上述样品,只要其可从受试者收集即可。预计本公开中所使用的样品是来自人类的细胞或组织样品。
适当的样品还将取决于所进行的病理学评估。例如,细胞学评估需要细胞样品。优选地,样品是流体样品。流体样品可包括选自(但不限于)由以下各项组成的组的各种生物材料:血液(包括全血)、血浆、血清、溶血产物、淋巴液、滑液、脊髓液、尿液、膀胱冲洗液、膀胱擦洗液、脑脊液、精液、粪便、痰、粘液、羊水、泪液、囊肿液、汗腺分泌物、胆汁、乳汁、眼泪或唾液。在其它实施例中,流体样品可以是细针吸出物或细胞悬浮液。在膀胱癌的情况下,流体样品是尿液样品。设想这些样品可使用本领域已知的技术获得。例如,在膀胱癌的情况下,可从受试者的尿液样品获得细胞样品。在乳腺癌或甲状腺癌的情况下,可经由细针抽吸获得样品。在子宫颈癌的情况下,样品可以是从巴氏测试制备的细胞悬浮液。
在一个实施例中,细胞样品在从受试者中移出之后并且在细胞学评估之前进行处理。例如,可对组织进行固定、渗透和/或洗涤剂处理。
相比之下,组织学评估需要组织样品。在一个实施例中,组织样品是从膀胱、胰腺、肝脏、胆囊、甲状腺、乳房、肺、子宫颈、卵巢、肾、结肠、前列腺、胃、食道或脑获得。
组织样品可包括从活检或切除术获得的材料。设想在本公开的方法中使用的组织样品也可使用本领域已知的技术获得。例如,在膀胱癌的情况下,可经由膀胱镜检查获得组织样品。在胃癌或食道癌的情况下,可经由内窥镜检查获得组织样品。在结肠癌的情况下,可经由结肠镜检查获得组织样品。在乳腺癌的情况下,可经由核心针活检或外科活检获得组织样品。
在一个实施例中,组织样品在从受试者移出之后并且在病理学评估之前进行处理。例如,组织可以是石蜡包埋的、固定的、渗透的和/或洗涤剂处理的。
设想可对从同一患者获得的多个样品进行本公开的方法。例如,本公开的方法可用于评估从同一患者获得的至少两个、至少三个、至少四个、至少五个、至少六个样品。所述多个样品可在单一会诊或程序期间获得。
例如,可在单一活检程序期间获得多个组织样品。例如,四象限食道活检程序可提供四个组织样品以使用本公开的方法进行评估。
当评估癌症手术移除后的癌边缘时,也可获得多个活检。在一个实施例中,本公开的方法是在癌症的外科移除之后使用。在此实施例中,当从癌边缘获得的组织样品的细胞形态的病理学评估关于癌症为阴性时,本公开的方法可用于确定受试者是否患有癌症。
还可设想,在进行本方法时,细胞形态的病理学评估和端粒酶检测的病理学评估可在从相同样品获得的分开的细胞或组织切片上进行,或者在从相同患者获得的分开的细胞或组织样品上进行。
本发明人已经发现,当细胞形态的病理学评估关于癌症为阴性时,抗端粒酶抗体与这些细胞的结合指示受试者患有癌症。因此,优选的是,使用相同的样品、尤其是相同的载玻片进行细胞形态的病理学评估和端粒酶检测的病理学评估。
因此,在一个实施例中,对从受试者样品获得的相同细胞或组织切片进行细胞形态的病理学评估和端粒酶检测的病理学评估。在一个实施例中,在相同的细胞上同时或依序进行细胞形态的病理学评估和检测抗端粒酶抗体结合的病理学评估。
临床相关细胞
短语“临床相关细胞”是指病理学家正在检查以确定患者的癌症状态的那些细胞。
临床相关细胞将取决于所研究的癌症,并且在本公开的上下文中可包括乳房的导管细胞和小叶细胞、肺的呼吸细胞、消化道的粘膜细胞、胰腺的导管细胞和胰岛细胞、肝细胞、滤泡细胞、间皮细胞、生殖细胞、卵巢的颗粒细胞和上皮细胞、食道或胃、前列腺的腺细胞和基底细胞、输尿管的上皮细胞、尿路上皮细胞、肾的导管细胞和管状细胞、子宫内膜细胞、脑的神经细胞或胶质细胞。
在一个实施例中,临床相关细胞在形态学上是正常的。在另一实施例中,临床上相关的细胞是恶变前的。在另一实施例中,临床相关细胞是化生的。在另一实施例中,临床相关细胞是发育不良的。
癌症的确定是根据正常细胞不表达端粒酶而恶性细胞表达端粒酶的一般原理进行的。然而,如本领域技术人员将理解的,由于某些非恶性细胞类型也表达端粒酶,因此此一般原理存在例外。这些细胞被认为与临床不相关并且应排除在评估之外。优选地,排除的细胞是选自包含以下各项的组:t细胞、b细胞、嗜中性粒细胞、巨噬细胞、粒细胞、树突细胞、肥大细胞、记忆细胞、浆细胞、嗜酸性粒细胞、精囊腺细胞、精子。这些细胞具有与临床相关细胞明显不同的形态,并且因此在进行病理学评估时可容易地在视觉上排除。
例如,当使用本发明的方法确定膀胱癌时,存在本领域技术人员可从组织学分析中视觉上排除的几种细胞类型。这些细胞包括发炎细胞,例如嗜中性粒细胞、巨噬细胞和嗜酸性粒细胞,以及肾小管细胞、精囊腺细胞、精子和鳞状细胞。这些细胞具有与临床相关的正常尿路上皮细胞(膀胱壁细胞)明显不同的形态,并且因此在进行病理学评估时可容易地在视觉上排除。
在进行本方法时,端粒酶可存在于一种以上临床相关细胞中,并且指示受试者患有癌症。在各个实施方案中,抗端粒酶抗体与来自受试者的样品中病理学评估的至少约1、至少约2、至少约3、至少约4、至少约5、至少约6、至少约7、至少约8、至少约9、至少约10、至少约11、至少约12、至少约13、至少约14、至少约15、至少约20、至少约30、至少约40、至少约50、至少约60、至少约70、至少约80、至少约90、至少约100、至少约200个临床相关细胞的结合,指示该受试者患有癌症。相比之下,抗端粒酶抗体不与临床相关细胞结合指示样品中不存在恶性细胞。
此外,端粒酶可以样品中评估的临床相关细胞总数的百分比存在,并且指示受试者患有癌症。在各个实施方案中,抗端粒酶抗体与来自受试者的样品中评估的至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约11%、至少约12%、至少约13%、至少约14%、至少约15%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%的临床相关细胞的结合,指示所述受试者患有癌症。
例如,抗端粒酶抗体与从受试者组织样品获得的组织切片中的至少约5%膀胱尿路上皮细胞的结合指示所述受试者患有癌症。
为了避免疑问,设想抗端粒酶抗体与每20个临床相关细胞中的一个细胞的结合指示所述受试者患有癌症。
自反测试
设想所要求保护的方法可作为自反测试来进行。“自反测试”是指基于在先前测试(例如,第一测试)中获得的结果而进行的后续测试(例如,第二测试)。当确定受试者是否患有癌症时,样品的病理学评估可能导致对另一目标进行测试的需要。在本公开的上下文中,对另一目标进行测试(即检测抗端粒酶抗体与临床相关细胞的结合)的需要是通过对关于癌症阴性的细胞形态的病理学评估驱动的。
辅助测试
还可设想,所要求保护的方法可作为辅助测试进行。提供补充或辅助解释其它测试结果的信息并且提供有助于纠正早期阴性癌症评估的信息的测试可归类为辅助测试。在临床环境中,可能要求细胞形态的病理学评估以确定受试者是否患有癌症。尽管病理学评估可能关于癌症为阴性,但为了帮助确定受试者是否患有癌症,进行进一步的病理学评估以检测抗端粒酶抗体与来自受试者的样品中的临床相关细胞的结合,作为细胞形态的病理学评估的辅助。在此情况下,抗端粒酶抗体与一个或多个临床相关细胞的结合指示受试者患有癌症,从而纠正了细胞形态的阴性病理学评估。
在进行辅助测试时,设想细胞形态的病理学评估可与端粒酶的病理学检测同时或大约同时进行。然而,这些步骤可分开进行。
受试者
如本文所用,“受试者”可以是任何可能患有癌症的生物体。在优选的实施方案中,受试者是哺乳动物。哺乳动物可以是伴侣动物,例如狗或猫,或者家畜动物,例如马或牛。在一个实施例中,受试者是人类。诸如“受试者”、“患者”或“个体”等术语是可在本公开的上下文中互换使用的术语。
如果使用本公开的方法在受试者中鉴别出恶性细胞,则所述受试者可被指导或开具癌症治疗。例如,使用本公开的方法检测的癌症可用药剂进行治疗。适合的例示性疗法包括手术、放射疗法、化学疗法、免疫疗法、生物制剂、抗体疗法、激素疗法、干细胞移植、光动力疗法、消融疗法和其各种组合。
适当的治疗过程将取决于所鉴别的癌症。例如,如果在受试者中鉴别出膀胱癌,则可指导所述受试者进行治疗,例如经尿道膀胱肿瘤切除术、化学疗法、放射疗法、卡介苗(bacilluscalmette-guérin,bcg)免疫疗法、抗体疗法或其组合。例如,如果在受试者中鉴别出乳腺癌,则可指导受试者进行治疗,例如乳房切除、化学疗法、放射疗法、激素疗法(例如抗雌激素疗法)、抗体疗法或其组合。例如,如果在受试者中鉴别出前列腺癌,则可指导受试者进行治疗,例如前列腺切除术、化学疗法、放射疗法、激素疗法(例如抗睾酮疗法)、抗体疗法或其组合。
设想本公开的方法可用于确定任何受试者是否患有癌症。优选地,该方法用于在具有指示癌症症状的受试者中确定癌症。例如,在膀胱癌的情况下,本方法可应用于向临床呈现指示膀胱疾病的症状的受试者,例如血尿(尿中带血);尿频尿急;排尿灼痛。
本公开中使用的样品也可从需要定期监视以监测新的或复发的癌症的受试者获得。例如,患有诸如巴瑞特氏食道症或导管原位癌(dcis)的恶变前病况的受试者或癌症幸存者可能需要定期监视以监测新的或复发的恶性肿瘤。如果细胞形态的组织学评估关于癌症为阴性,则临床医师可从受监视的受试者获得组织样品,并且应用本方法来确定他们是否患有癌症。如果鉴别出癌症,则可建立适当的治疗方案。
治疗干预后监视的适当时程将取决于受试者的风险因素和癌症分期。在膀胱癌的情况下,治疗后的适当监视可从每3个月对细胞形态进行一到两年的泌尿病理学评估开始。根据先前的细胞和膀胱镜检查发现,延长了细胞形态病理学评估的筛选间隔。在乳腺癌的情况下,在手术后6个月进行乳房摄影术评估且随后进行年度随访可能是适当的。在前列腺癌的情况下,适当的监视可包括定期评估前列腺特异性抗原(psa)、直肠指检(dre)和超声波。
诊断确定
设想在进行所要求保护的方法时,端粒酶的病理学评估和细胞形态的病理学评估的具体结果将与每名受试者的特定诊断确定相关联。当进行所要求保护的方法时可获得的端粒酶和细胞形态的结果总结在下表1中。
以下结果指示受试者患有癌症,并且因此准许治疗性干预:
-抗端粒酶抗体与临床相关细胞的结合和细胞形态的阳性病理学评估;
-抗端粒酶抗体与临床相关细胞的结合和细胞形态的阴性病理学评估;
-尽管由于细胞形态的阳性病理学评估和抗端粒酶抗体与临床相关细胞的结合二者的匹配敏感性而不可能发生;抗端粒酶抗体不与临床相关细胞结合和细胞形态的阳性病理学评估。
抗端粒酶抗体不与临床相关细胞结合和细胞形态的阴性病理学评估指示样品中的细胞不是恶性的。例如,抗端粒酶抗体不与临床相关细胞结合和细胞形态的阴性病理学评估指示受试者可能具有与癌症无关的良性/反应性变化。
表1:与细胞形态的病理学评估和端粒酶结果的病理学评估相关的诊断确定和临床结果
在本公开的上下文中,细胞形态的阳性病理学评估是指具有指示癌症的形态学变化的细胞的鉴别。可能与癌症相关的形态学变化包括细胞核增大、大小和形状不规则,核仁突出,细胞质稀少、颜色可能强烈或苍白。相比之下,细胞形态的阴性病理学评估被定义为没有任何指示癌症的形态学变化。
明确诊断
在应用本公开的方法来确定受试者是否患有癌症时,认为可基于抗端粒酶抗体与来自从受试者获得的样品的一个或多个临床相关细胞的结合作出关于癌症存在的诊断确定。然而,诊断确定对于明确诊断可能是结论性的,也可能不是结论性的,在该明确诊断之后,治疗医师将确定治疗过程。换句话说,使用本公开的技术获得的诊断确定将被本领域技术人员理解为指尝试确定或鉴别可能的癌症的方法。
本公开的方法可用于提供评估癌症发展风险的辅助,并且将被认为有助于评估关于癌症的存在或性质或倾向性或前体的临床前确定。此将被视为是指发现受试者发展癌症的概率显著增加。
可设想,本公开的方法还可与本领域已知的其它癌症临床评估方法组合使用,以提供癌症存在或癌症风险增加的评价。
确定患有癌症的受试者的癌症状态的明确诊断在准许的情况下可通过(例如)成像技术(包括pet、mri、超声波、ct、pet/ct)来验证或确认。因此,本公开的方法可以预筛选的方式使用,并且如果准许,可进行进一步的评估。
灵敏度和特异性
在一些实施方案中,针对癌症的临床诊断来测量灵敏度和/或特异性。
在各个实施方案中,由目前要求保护的用于确定受试者是否患有癌症的方法实现的灵敏度为至少约50%、至少约60%、至少约70%、至少约71%、至少约72%、至少约73%、至少约74%、至少约75%、至少约76%、至少约77%、至少约78%、至少约79%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%。
在各个实施方案中,由目前要求保护的用于确定受试者是否患有癌症的方法实现的特异性为至少约50%、至少约60%、至少约70%、至少约71%、至少约72%、至少约73%、至少约74%、至少约75%、至少约76%、至少约77%、至少约78%、至少约79%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%或至少约95%。
实施例
实施例1:临床样品
为了证明端粒酶htert蛋白免疫染色的临床诊断潜力,对怀疑患有膀胱癌(尿路上皮细胞癌)或有膀胱癌病史的泌尿系患者的临床材料进行了伦理控制和批准的概念验证研究。此外,该研究旨在证明htert免疫染色可区分从低级别患者获得的样品与从高级别患者获得的样品。
在此研究中,临床阳性的患者已活检证实膀胱癌(包括非侵袭性和肌肉侵袭性)。所有阶段和级别的确定都是通过组织学进行。在患者具有多个处于不同阶段/级别的膀胱癌病灶的情形中,记录较高阶段/级别。
临床阴性患者都是健康良好的无症状个体,且无泌尿生殖系统疾病史,或者所有无疾病患者首次或在先前膀胱癌的监测下出现膀胱壁视觉检查(通过柔性/刚性膀胱镜检查)。
如果满足以下任一标准,则患者将被排除在该研究之外:
a)患者在视觉检查(柔性/刚性膀胱镜检查)中有可疑/非特征性的非膀胱癌诊断,且未进行组织学检查;
b)监测具有根治性膀胱切除术的患者;
c)患有腺癌和非尿路上皮膀胱癌(包括小细胞癌、癌肉瘤、原发性淋巴瘤和肉瘤)的患者;和/或
d)患有其它泌尿生殖系统肿瘤(肾、前列腺、上输尿管)的患者。
最初共测试253个样品。其中,108个样品是使用以下实施例2中概述的方案来评估,其中通过冻融或热诱导使用表位修复的形式。其中,90个样品中至少存在一种尿路上皮(膀胱壁)细胞。由于没有发现相关的膀胱细胞壁细胞(即:尿路上皮细胞),其余18个样品从所有进一步的分析中移除。在那90个样品中,由于没有活检证实的疾病,5个临床阳性样品从进一步分析中去除。其余85个样品示于表2(所有临床阳性样品-活检证实)和表3(所有临床阴性样品-膀胱镜检查清楚)中,示出了每个样品的细胞形态的细胞学评估和端粒酶免疫染色结果。
在所分析的85个样品中,临床阳性和阴性患者的临床相关细胞的数量在5至3000范围内。
·临床阴性样品:范围5-900个尿路上皮细胞。
·临床阳性样品:范围10-3000个尿路上皮细胞。
所有患者都在同一样品上进行端粒酶免疫染色和细胞形态的平行细胞学评估,并且记录结果。端粒酶htert蛋白免疫染色和细胞形态的细胞学评估是在互不了解并且不了解临床状态的情况下进行的(是通过膀胱镜检查+/-活检获得)。免疫染色、细胞形态的细胞学评估和膀胱镜检查都由训练有素的临床医师和/或病理学家进行,登记以在其各自的临床诊断和/或医学领域中进行这些分析。
端粒酶免疫染色的评分由细胞学家来测定,该细胞学家扫描足够数量的视野以获得载玻片的可靠评估。显示细胞核染色的尿路上皮细胞的数量/百分比由阅读细胞学家来记录。测试阳性的截止值设定为>5%的尿路上皮细胞显示细胞核染色。
在细胞形态的细胞学评估之后被分类为非典型的所有样品(临床阳性和阴性)都在表4中给出。
实施例2:样品的收集和处理
对患者的排尿立即处理,或在4℃下维持不超过4-6小时的时段之后进行处理。将样品转移至无菌的50ml离心管中,并且在4℃下以600g离心10分钟。移出所述管并且弃去上清液。将细胞沉淀重悬于15ml1×pbs中并且转移至无菌的15ml离心管中。将样品在4℃下以600g再离心10分钟,并且再次弃去上清液。最终将细胞沉淀重悬于1ml1×pbs中,之后进行细胞计数。
将每个样品约30,000个细胞转移至无菌的15ml离心管中,并且用shandoncytospincollectionfluid将体积调节至10ml(thermoscientific,参考号:6768001,批号:226955)。将管再次在4℃下以600g离心10分钟。弃去上清液,之后以250μl/30,000个细胞的比率重悬于shandoncytospincollectionfluid中。使用shandoncytospin4(thermoscientific,部件号:a778300101,系列号:cy66951055)通过将细胞以低加速度以1000rpm离心4分钟将细胞固定至玻璃显微镜载玻片。
将带有固定细胞的载玻片在4℃下在显微镜载玻片盒中储存过夜,之后将所述载玻片转移至-20℃冷冻器中。
本文报告的所有染色结果都是在ventanabenchmarkxt或ventanabenchmark超自动染色平台上进行。优化后,在其它自动染色平台(包括但不限于leicabond和biocareintellipathflx)上获得了相同的结果。除了自动染色平台之外,在优化之后,使用手动免疫染色方法也获得了相同的结果。
对于手动免疫染色方法,将载玻片在冷的50%丙酮:甲醇中后固定10分钟。在ph7.4的1×磷酸盐缓冲盐水(pbs)(目录号:10010-023,5×500ml
对于自动免疫染色方法,将载玻片在冷的50%丙酮:甲醇中后固定10分钟。在ventana抗体稀释缓冲液(ventanamedicalsystems公司,目录号:adb250)中洗涤/浸泡载玻片以去除残留的固定剂,接下来将其置于自动染色平台上,并且将抗原在95℃下在板上修复8分钟。修复后,用ventanadiscovery试剂(ventanamedicalsystems公司,目录号:760-108)将载玻片封阻4分钟,之后与端粒酶特异性初级抗htert抗体一起在36℃下培育32分钟。其余步骤依赖于使用ventanadiscovery和ventanaultraviewuniversaldab检测试剂盒(ventanamedicalsystems公司,目录号:760-500)的标准ventana平台设置。在标准浸泡染色器中脱板进行苏木精复染。也可在板上进行复染以获得相同的结果。
本文的结果是使用(masutomi等,2003)中所描述的抗htert(克隆2c4)抗体获得的。
表2:对临床阳性样品(活检证实)中的细胞形态的细胞学评估和端粒酶免疫染色结果。
*细胞形态的“非典型”细胞学评估指示,样品中的细胞已失去其正常外观,但尚未达到恶性细胞的异常水平。
^样品再染色
表3:临床阴性样品(活检证实)中的细胞形态的细胞学评估和端粒酶免疫染色结果。
*细胞形态的“非典型”细胞学评估指示,样品中的细胞已失去其正常外观,但尚未达到恶性细胞的异常水平。
表4:具有非典型细胞学的所有样品(临床阳性和阴性)中的临床状态、细胞形态的细胞学评估和端粒酶免疫染色结果。
*细胞形态的“非典型”细胞学评估指示,样品中的细胞已失去其正常外观,但尚未达到恶性细胞的异常水平。
^样品再染色
实施例3:膀胱癌样品中端粒酶的免疫染色与疾病相关
使用上述方案将85个临床样品处理至显微镜载玻片上并进行染色。在样品对样品的基础上凭经验确定对抗体条件或细胞样品制备物的微小调节。接受端粒酶免疫染色的每个样品也在同一样品上进行细胞形态的标准细胞学评估。细胞形态的细胞学评估被评定为阳性、阴性或非典型性。
比较临床阳性样品(表2)和临床阴性样品(表3)的细胞形态的细胞学评估和端粒酶免疫染色结果。评估了22个临床阳性结果,其中16个具有端粒酶阳性染色。在6个其余的临床阳性样品中,6个在细胞形态的细胞学评估后被鉴别为良性。因此,22个中16个(72%)的端粒酶指示恶性膀胱癌。
评估了63个临床阴性样品,其中48个(76%)具有端粒酶阴性染色。在其余的15个临床阴性样品中,11个(73%)在细胞形态的细胞学评估后被鉴别为良性。其余4个(27%)在细胞形态的细胞学评估后被鉴别为不确定(n=3)或阳性(n=1)。
与疾病相关的端粒酶染色示于图1中。在样品wh11-107中未观察到细胞染色(临床阴性;图1a)。相比之下,在临床阳性样品wh11-122中观察到显著的细胞染色(图1b)。在此样品中,在最佳抗体浓度下,在40-75%的所存在尿路上皮细胞中观察到强细胞核染色形式的阳性染色。有趣的是,并不是所有存在于此临床样品中的尿路上皮细胞都因端粒酶htert蛋白的存在而被染色,这表明并非样品内的所有细胞都是癌性的。
实施例4:解决细胞形态的假阴性和不确定性细胞学评估
接受端粒酶免疫染色的每个样品(n=85)也在同一样品上进行了细胞形态的标准细胞学评估。细胞形态的细胞学评估被评为阳性、阴性或非典型性。在细胞形态的细胞学评估后被分类为非典型的所有样品(临床阳性和阴性)(n=16)连同端粒酶免疫染色的相关评分一起示于表4中。
在具有和没有表位修复形式的情况下,使用两种不同免疫染色方案中的一种对16个具有非典型细胞学的样品进行评价。每个方案组有8个样品,每个样品得到相似的结果。在所述16个样品中,5个样品为临床阳性,并且11个样品为临床阴性。端粒酶免疫染色法评估这5个样品中的5个都为阳性(其中>5%的尿路上皮细胞的细胞核染色呈阳性)。
在所述11个临床阴性样品中,通过免疫染色测试8个显示阴性,并且3个显示阳性。在这三个样品中,两名纵向随访患者后来被评估为临床阳性(活检证实;临床样品aua12-058;wh12-291)。另一样品目前正在等待确认性临床随访(wh12-318)。然而,此患者进行了膀胱切除术。此程序的进行指示患者关于膀胱癌为阳性。
以目前的临床状态为根据,对照膀胱镜检查,所进行的端粒酶免疫染色测试的特异性为80%,并且灵敏度为83%。此外,免疫染色结果在至少94%的病例(16例中的15例)(在wh12-318进行了膀胱切除术时可能100%的病例,16例中的16例)中提供了正确的诊断指标(相对于膀胱镜检查),其中细胞形态的细胞学评估给出了非结论性的读教。
实施例5:改良诊断读数
制备临床样品并进行免疫染色以检测端粒酶的存在以及同时细胞学评估抗端粒酶抗体与临床相关细胞的结合和以每个细胞为基础细胞学评估细胞形态的独特方法,允许相对于单独的细胞形态的细胞学评估显著改良了诊断。
在图3中,示出了通过以每个细胞为基础的端粒酶免疫染色来解决细胞形态结果的不确定性细胞学评估或挽救细胞形态结果的假阴性细胞学评估的能力。在此图中,所有组中显示的细胞都来自于端粒酶免疫染色最佳的低级别膀胱癌临床样品。
a组示出了非膀胱鳞状细胞。此细胞不是来自膀胱,并且被训练有素的细胞学家视觉排除在所有诊断确定之外。该细胞在此临床样品中用作阴性免疫染色对照。如a组所示,鳞状细胞完全没有细胞核染色,如所预期的那样。
b组示出了正常尿路上皮细胞。所示的两种细胞都具有确定的形状和核质比。对训练有素的细胞学家来说,这些细胞看起来完全正常,并且在细胞形态的细胞学评估后,这些细胞会被适当地定义为细胞学阴性。缺乏关于端粒酶htert蛋白的细胞核免疫染色表明,虽然这些尿路上皮细胞见于已知患有低级别膀胱癌的患者的排尿中,但所述尿路上皮细胞很可能是来自膀胱壁正常区域的正常尿路上皮细胞。
c组示出了具有确定的形状和核质比的形态正常的尿路上皮细胞,但在此情形下,示出了关于端粒酶htert蛋白的强细胞核免疫染色。相反,此细胞学阴性的尿路上皮细胞正表达异常水平的细胞核端粒酶,并且因此极有可能是尚未显示任何形态异常的早期恶性细胞。端粒酶htert免疫染色与临床结果之间的强临床相关性支持此结论,如图2所示。
在同一样品和同一细胞上没有端粒酶免疫染色的情况下,基于细胞形态的细胞学评估对所述样品和细胞进行测定,此细胞将被训练有素的细胞学家和/或病理学家定义为正常或非癌症。此将是不正确的并且导致对该特定细胞的假阴性判定。因此,端粒酶的每细胞免疫染色正确地确定了此判定。
在d组中,在由训练有素的细胞学家对细胞形态进行细胞学评估之后,显示小的非典型特质的尿路上皮细胞的强度不足以被称为细胞学阳性,其显示出强的细胞核端粒酶免疫染色。此是这样的一个实施例:其中在细胞形态的细胞学评估后分类为不确定的个别细胞仍然可通过端粒酶htert免疫染色在最佳条件下成功地解决。
实施例6:鉴别具有正常形态的恶性细胞
在第一个实验中,三个临床阴性样品在细胞形态的细胞学评估后分类为非结论性的,其通过免疫染色测试显示为阳性。在这三个样品中,两名纵向随访的患者后来被评估为临床阳性(活检证实;临床样品aua12-058;wh12-291)。另一样品目前正在等待确认性临床随访(wh12-318),然而,此患者进行了膀胱切除术。此程序的表现指示该患者关于膀胱癌为阳性。
在进一步的实验中,通过公立和私立医院的采集点和生物库获得伦理批准的临床样本。对患者排出的尿液或组织样品(在无菌盐水中收集)立即处理,或者在4℃下维持不超过48小时的时段之后进行处理。如果组织样品是完整的并且没有作为细针吸出物收集,则将其切碎成细胞悬浮液。将样品转移至无菌的50ml离心管中,并且在4℃下以470g离心10分钟。移出所述管并弃去上清液。将细胞沉淀重悬于10ml1×pbs中,并且在4℃下以470g再离心10分钟,并且再次弃去上清液。最终将细胞沉淀重悬于1ml1×pbs中,之后进行细胞计数。
用shandoncytospincollectionfluid将1ml细胞悬浮液调节至10ml(thermoscientific,参考号:6768001,批号:226955)。将管再次在4℃下以470g离心10分钟。弃去上清液,之后以250μl/30,000个细胞的比率重悬于shandoncytospincollectionfluid中。使用shandoncytospin4(thermoscientific,部件号:a778300101、系列号:cy66951055)来通过将细胞以低加速度以1000rpm离心4分钟将细胞固定至玻璃显微镜载玻片。将带有固定细胞的载玻片储存在4℃直至使用。
对于自动免疫染色方法,将载玻片置于自动染色平台上,并且在95℃下在板上将抗原修复8分钟。修复后,施加前初级过氧化物抑制剂,之后在37℃下与端粒酶特异性初级抗htert抗体一起培育36分钟。需要ventanadiscovery试剂(ventanamedicalsystems公司,目录号760-108)用于16分钟的后封阻步骤。其余步骤依赖于使用ventanaoptiviewdabihc检测试剂盒(ventanamedicalsystems公司,目录号:760-700)的标准ventana平台设置。使用苏木精ii(ventanamedicalsystems公司,目录号:790-2208)进行苏木精复染。
通过细胞学和免疫细胞化学评估两种方法对样品进行分析。接下来将结果与患者的临床状态相匹配(膀胱镜检查和/或活检证实)。使用巴氏染色(pap染色)来测定个别细胞的形态学特征,同时免疫分析使用抗htert抗体来检测端粒酶的存在(由临床相关细胞细胞核的棕色染色指示)。倘若样品被定义为良性,则评估仅鉴别形态学上正常的细胞。对于基于细胞学评估被分类为恶性的样品,其可含有恶性细胞和形态学上正常的细胞。
分析揭露18个膀胱癌临床阳性样品的形态正常细胞中有细胞核端粒酶免疫染色(表5)。其中两个样品先前经由细胞学被分类为良性或非典型性(表5)。其中16个样品先前经由细胞学被分类为恶性或非典型性(表5)。
在所提供的数据中,我们已经鉴别出仅基于形态即给出阴性癌症诊断的样品。在细胞学评估为良性的情形下,患者将被给予阴性诊断。样品rmh16-320被评估为良性,但通过免疫分析检测到了端粒酶。形态学正常的细胞中端粒酶的检测与临床结果(通过膀胱镜检查和/或活检确认)正确地匹配。抗htert抗体的阳性结果改良了癌症检测的灵敏度。
表5:关于膀胱癌临床阳性的样品中的临床状态、细胞形态的细胞学评估和端粒酶免疫染色结果。
分析揭露来自关于甲状腺癌临床阳性的两个样品的形态学正常的细胞中的细胞核端粒酶免疫染色(表6)。这两个样品先前经由细胞形态的细胞学评估被分类为良性(表6)。
表6:关于甲状腺癌临床阳性的样品中的临床状态、细胞形态的细胞学评估和端粒酶免疫染色结果。
分析揭露另外两个关于胰腺癌临床阳性的样品的形态学正常细胞中的细胞核端粒酶免疫染色(表7)。这两个样品先前经由细胞形态的细胞学评估被分类为良性或非典型性(表7)。
表7:关于胰腺癌临床阳性的样品中的临床状态、细胞形态的细胞学评估和端粒酶免疫染色结果。
这些数据表明端粒酶可指示具有正常形态的恶性细胞。这些数据显示端粒酶可指示具有正常形态但通过细胞学被分类为恶性或非典型性的恶性细胞。此为实现正确的临床结果提供了更大的置信度。因此,具有关于癌症为阴性的病理学的患者,如果提供的样品具有阳性端粒酶染色,则可进行进一步的测试,例如在膀胱癌的情况下,进行膀胱镜检查结合活检和组织学评估。关于癌症临床阴性的患者,如果提供的样品具有阳性端粒酶染色,则可加强临床监视。
实施例7:临床环境中的端粒酶染色以诊断膀胱癌
患者向临床呈现指示膀胱疾病的症状,例如血尿(尿中带血)、尿频尿急或排尿灼痛。虽然这些症状可由其它比癌症轻得多的病况(例如尿液感染)引起,但它们是膀胱癌的特征。
因此,从患者获得尿液样品,并送去进行细胞形态的细胞学评估和端粒酶免疫染色。如果细胞形态的细胞学评估结果为关于膀胱癌阴性,则临床医师可使用端粒酶免疫染色结果来确定患者是否患有膀胱癌。
如果样品是端粒酶阳性,则端粒酶分析相对于细胞学的灵敏度改良至少可保证膀胱镜检查研究用于膀胱癌。
然后可对患者进行膀胱镜检查,并且如果随后鉴别膀胱癌,则可建立适当的治疗方案。
实施例8:端粒酶染色和膀胱癌监视
表现出与上述那些症状相似但仍未解决的患者或癌症发展或复发风险增加的患者可能需要定期监视癌症的发展。
可从这些患者获得周期性组织样品,并且将其送去进行细胞形态的组织学评估和端粒酶免疫染色。如果细胞形态的组织学评估结果关于癌症为阴性并且样品为端粒酶阳性,则临床医师可要求进一步的膀胱镜检查和/或建立适当的治疗方案。如果组织学评估的结果为阴性,则临床医师可随时间推移继续监视受试者,并且要求在稍后的日期进行进一步随访膀胱镜检查以及组织学和端粒酶染色。
实施例9:临床环境中的端粒酶染色以诊断乳腺癌
一名病人到诊所进行乳腺癌的常规乳房摄影术筛选。观察到轻微钙化,这在放射摄影学上具有较低嫌疑。
怀疑导管原位癌,并且从患者乳房获得细针抽吸样品。可将细针抽吸样品送去进行细胞形态的细胞学评估和端粒酶免疫染色。
如果细胞形态的细胞学评估结果为关于乳腺癌阴性,则临床医师可使用端粒酶免疫染色结果来确定患者是否患有乳腺癌。
如果样品为端粒酶阳性,则可获得核心活检样品以提供受试者患有癌症的额外确认和/或可建立适当的治疗方案。
实施例10:膀胱癌样品中端粒酶的比较免免疫染色
使用上述实施例2中概述的方法在临床样品中比较端粒酶染色。使用scd-a7、novus2c4、novusnb100-297、santacruz377511、santacruz7212、rockland600-401-252和mblm216-3抗体进行比较免疫染色。比较免疫染色结果示于表8中。
实施例12:载玻片读取算法
已经利用实施例1中描述的临床样品评价了两种载玻片读取算法。第一种算法涉及关于端粒酶的细胞核染色阳性的尿路上皮细胞和鳞状细胞的计数。基于染色细胞的百分比来确定阳性测试结果。第二种算法涉及评估尿路上皮细胞的形态学变化并结合端粒酶的阳性核染色以得出阳性测试结果。
读取算法-5%截止
以200-400倍的放大倍率评估载玻片,并且在足够的视野范围内进行视觉扫描,以鉴别20多个尿路上皮细胞。记录了以下细胞数量:
1.显示细胞核染色的尿路上皮细胞的数量。
2.在记录上述第(1)点的过程中鉴别/评价的尿路上皮细胞的数量。
还注意到以下细节:
1.尿路上皮染色特征(细胞核/细胞质)。
2.显示细胞核染色的鳞状细胞的百分比(包括有或没有细胞质染色的细胞)。
3.评估的鳞状上皮细胞的总数。
对于此算法,阳性测试结果被定义为如下载玻片:其中超过5%的尿路上皮细胞证明阳性细胞核染色(即每20个尿路上皮细胞超过约2至3个细胞具有阳性细胞核染色)。
阅读算法-基于形态学
评估载玻片以鉴别证明形态不典型(例如核质比高、细胞核染色质变异、细胞核轮廓不规则)的尿路上皮细胞。然后评估证明形态不典型的细胞是否存在阳性免疫细胞化学信号。
在临床样品评价期间,结合端粒酶免疫细胞化学载玻片检查相应的巴氏染色尿液制剂。
对于此算法,阳性测试结果被定义为如下载玻片:其中尿路上皮细胞在存在阳性细胞核染色的情况下证明形态不典型。
阅读算法的比较
表9总结了上述阅读算法的比较。使用形态学与细胞端粒酶阳性染色的组合的载玻片的检查导致总灵敏度为83.3%,而5%截止算法导致总灵敏度为57.1%。与用5%截止算法实现的50.0%相比,使用基于形态学的阅读算法,检测低级别尿路上皮癌的灵敏度提高到75.0%。
与5%截止算法相比,基于形态学的算法证明了对尿路上皮癌的整体检测的灵敏度和特异性增加,以及对高级别和低级别疾病分类的灵敏度和特异性增加。
尽管如此,5%截止算法也提供了一种有效的方法来解决所分析膀胱癌样品中非结论性的细胞学评估。例如,据预计每20个尿路上皮细胞中有1个细胞具有阳性细胞核染色指示阳性测试结果。
表9:5%截止算法和基于形态学的算法的结果的比较。
实施例13:鉴别组织学样品中的形态正常的恶性细胞
本申请的方法可在细胞形态的组织学评估关于癌症为阴性的情况下用于确定受试者是否患有癌症。
从伦理批准的组织生物库获得福尔马林固定的石蜡包埋组织(4μm安装至载玻片上)。
对于自动免疫染色方法,将载玻片置于自动染色平台上,并且通过在60℃烘烤28分钟将组织粘附至载玻片。选择脱蜡步骤以从载玻片中去除蜡。将抗原在95℃下修复32分钟。修复后,施加前初级过氧化物抑制剂,之后在37℃下与端粒酶特异性初级抗htert抗体一起培育28分钟。需要ventanadiscovery试剂(ventanamedicalsystems公司,目录号:760-108)进行16分钟的后封阻步骤。其余步骤依赖于使用ventanaoptiviewdabihc检测试剂盒(ventanamedicalsystems公司,目录号:760-700)的标准ventana平台设置。使用苏木精ii(ventanamedicalsystems公司,目录号790-2208)进行苏木精复染。
通过寻找临床相关细胞中端粒酶的存在或缺乏来评价来自阳性癌症患者(肿瘤和匹配的正常样品)的样品。基于形态学评估证实肿瘤样品含有恶性细胞。匹配的正常样品含有形态正常的细胞。皮肤肿瘤样品(09rmh5251f)在恶性鳞状细胞中显示阳性端粒酶染色,而在相应的匹配样品(09rmh5252a)中在形态学上正常的鳞状细胞中也检测到了端粒酶。两个样品还含有非临床相关细胞,所述非临床相关细胞用抗htert抗体染色呈阳性,其可基于形态学与临床相关细胞区分开。
本领域技术人员将理解,在不背离如广泛描述的本发明的精神或范围的情况下,可对如特定实施方案中所示的本发明作出多种变化和/或修改。因此,本实施方案在所有方面都被视为说明性的而非限制性的。
上文讨论的所有出版物都以全文并入本文中。
本申请要求于2015年8月19日提交的au2015903361的优先权,所述案件的公开内容以引用方式并入本文中。
对包括在本说明书中的文件、行动、材料、装置、物品等的任何讨论仅仅是为了提供本发明的背景。其不应被视为承认任何或所有这些物项都构成现有技术基础的一部分或者是与本发明相关的领域中的公知常识,因为其存在于本申请的每个权利要求的优先权日之前。
参考文献
ausubeletal.(1988)currentprotocolsinmolecularbiology,greenepub.associatesandwiley-interscience(includingallupdatesuntilpresent).
blackburnetal.(2005)molecularcancerresearch3,477-482.
bodnaretal.(1998)science279,349-52.
brown(1991)essentialmolecularbiology:apracticalapproach,volumes1and2,irlpress.
coliganetal.(1994)currentprotocolsinimmunology,johnwiley&sons(includingallupdatesuntilpresent).gloveretal.(1991)dnacloning:apracticalapproach,volumes1-4,irl
harlowandlane(1988)antibodies:alaboratorymanual,coldspringharbourlaboratory.
leongandzhuang,(2011)pathobiology,78(2),99-114.
perbal(1984)apracticalguidetomolecularcloning,johnwileyandsons.
masutomietal.,(2003)cell,114(2),241-253.
sambrooketal.(1989)molecularcloning:alaboratorymanual,coldspringharbourlaboratorypress.
- 还没有人留言评论。精彩留言会获得点赞!