一种方便灵敏检测羊草叶片磷含量的新方法与流程
本发明涉及一种方便灵敏检测羊草叶片磷含量的新方法。
背景技术:
羊草[leymuschinensis(trin.)]是我国北方草原的主要牧草和优势物种,其生长状况直接决定该地区的草原生产力。磷是植物生长和发育所必须的大量元素,不仅是植物生物膜、核酸、蛋白质、磷脂、atp等重要物质的组成成分,同时以多种方式参与植物体内的生理过程。
目前现有技术中检测植物磷含量的方法主要是分光光度法,分光光度法一般有钼酸抗、磷钼蓝和磷钒钼黄分光光度法等,但常用的有磷钼蓝和磷钒钼黄分光光度法。磷钼蓝分光光度法灵敏度高,适用于微量组分的测定,但需要价格昂贵的分光光度仪。磷钒钼黄分光光度法简便、快速、极易掌握,但灵敏度比磷钼蓝低,准确度低,也需要价格昂贵的分光光度仪。
技术实现要素:
本发明的目的是提供一种方便灵敏检测羊草叶片磷含量的方法。
本发明所提供的检测羊草叶片磷含量的方法,包括下述步骤:
1)对羊草幼苗进行不同的已知磷浓度处理,对同一叶片分别进行羊草叶片的磷含量测定和atp酶活性测定,分别得到不同磷浓度处理后羊草叶片的磷含量和不同磷浓度处理后羊草叶片中的atp酶活性,得到羊草叶片磷含量与羊草叶片中的atp酶活性的对应关系;
2)对磷含量待测的羊草叶片进行atp酶活性测定,根据上述羊草叶片磷含量与羊草叶片中的atp酶活性的对应关系,评估羊草叶片磷含量。
上述方法步骤(1)中,所述不同的已知磷浓度具体可为250um、2.5um和0um。
所述羊草叶片的磷含量的测定方法为磷钼蓝法。
所述羊草叶片的atp酶活性的测定方法为叶绿素荧光技术,即利用非损伤、简便、灵敏的叶绿素荧光技术对羊草叶片进行p515参数的测定,得到羊草叶片的atp酶活性数据。
羊草叶片磷含量与羊草叶片中的atp酶活性的对应关系可用下述函数关系式表示:y=0.2337x+15.421r2=0.9937,其中,y代表atp酶活性gh+(s-1);x代表叶片磷含量(以μm表示)。
步骤(2)中,使用叶绿素荧光技术对磷含量待测的羊草叶片进行atp酶活性测定。
所述atp酶活性测定的具体操作为:先将羊草充分暗适应10小时后,通过dual-pam100照射活化光(325μes-1m-2)10min,关闭活化光后观察0-500ms内p515值的变化。
本发明利用非损伤、简便、灵敏的叶绿素荧光技术对羊草进行叶绿素荧光参数p515的测定,分析了不同磷浓度条件下其atp酶活性的变化,并建立了与无机磷含量之间的线性关系,用于评估该经济植物的磷素状况,对有效管理羊草草原,促进其可持续发展有重要价值。
我们的新方法不仅简便、快速、灵敏度高,最重要的是本方法对实验材料是非损伤的,无需提取、反应、比色等繁琐步骤。只需将材料黑暗处理后无损伤的测定叶片atp酶活性,利用公式计算出其磷含量即可。
附图说明
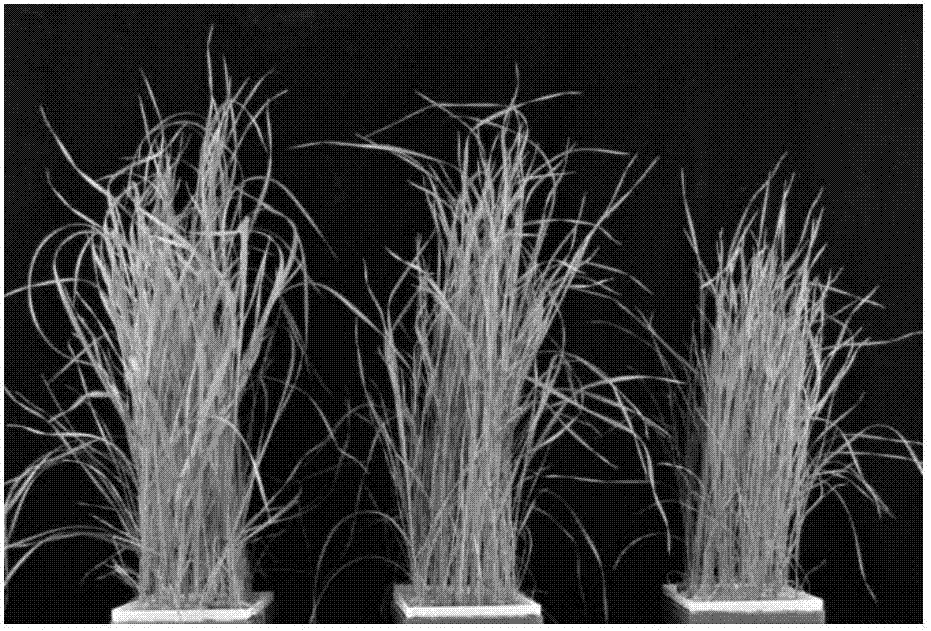
图1为本发明实施例中不同磷浓度处理之后羊草的生长情况。
图2a为不同磷浓度处理后羊草叶片磷含量的变化。
图2b为不同磷浓度处理后羊草叶片的atp酶活性的变化。
具体实施方式
下面通过具体实施例对本发明进行说明,但本发明并不局限于此。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所用的试剂、生物材料等,如无特殊说明,均可从商业途径得到。
一、材料
植物材料:
羊草[leymuschinensis(trin.)]种子由中国农业科学院草原研究所提供,种子采集自内蒙古锡林浩特。
二、方法
1材料培养:
1)正常hoagland培养液:ca(no3)2·4h2o236g/l,kno3102g/l,mgso4·7h2o98g/l,kh2po427g/l,k2so488g/l,cacl2111g/l,nah2po424g/l,nano3170g/l,na2so421g/l,fe-edta:(na2edta7.45g/l;feso4·7h2o5.57g/l),微量元素:h3bo32.86g/l,mnso41.015g/l,cuso4·5h2o0.079g/l,znso4·7h2o0.22g/l,h2moo40.09g/l;
2)羊草种子在kmno4(0.7%,w/v)消毒10分钟后用蒸馏水冲洗两遍,置湿润的滤纸上在光照培养箱中萌发。培养条件为白天25℃,夜晚20℃,光照强度270μes-1m-2,湿度为50%,光照时间14小时/天。将萌发10天左右的幼苗置于1/4强度的hoagland溶液中通气培养,每周更换一次培养液,4周后用于不同磷浓度处理。
2不同磷浓度处理
将上述培养的羊草幼苗分为对照(250um)、2.5um和0um三组做处理实验。在上述培养箱中进行溶液培养。对照组采用新鲜配制的上述完全培养液(正常hoagland培养液)进行培养。2.5um和0um组用等摩尔的k2so4代替上述完全培养液中的kh2po4。每组处理设三个重复。培养20天后的第三片叶用于atp酶活性测定,并采用磷钼兰法测定第三片叶的磷含量。
3atp酶活性测定
在进行atp酶活性测定时,先将羊草充分暗适应10小时后,通过dual-pam100照射活化光(325μes-1m-2)10min,关闭活化光后观察0-500ms内p515值的变化。
psii和psi反应中心的电荷分离、cytb6/f复合体上的q循环会引起跨膜电荷,而atp酶复合体上的质子外流会恢复这一跨膜电荷。该过程可被p515信号检测到,并用来反映类囊体膜和atp酶活性。
三、结果
1、羊草不同磷浓度处理之后的生长情况
图1为羊草不同磷浓度处理之后的生长情况。
由图1可知,通过20天不同磷浓度的处理,羊草的生长差异较明显,即随着磷浓度的降低,羊草的生长呈现降低的趋势。
2、羊草在不同磷浓度处理后的叶片磷含量及atp酶活性的变化
图2a为不同磷浓度处理后羊草叶片的磷含量的变化。通过20天不同磷浓度的处理,我们对羊草第三片叶进行了磷含量的测定。发现随着培养液中磷浓度的降低,叶片中磷浓度也随之降低。
图2b为不同磷浓度处理后羊草叶片atp酶活性的变化。可以看出,随着磷浓度的降低,atp酶的活性也随之降低。说明磷浓度和atp酶活性是相关的。
将磷含量和atp酶活性相对应的几组数值导入spss或者exel软件,插入散点图,添加趋势线,并显示方程及r2值。
羊草叶片磷含量与羊草叶片中的atp酶活性的对应关系为y=0.2337x+15.421r2=0.9937,其中,y代表atp酶活性gh+(s-1);x代表叶片磷含量(μm)。
- 还没有人留言评论。精彩留言会获得点赞!