用于测定化学状态的系统和方法与流程
本申请是申请号为201380065943.6、发明名称为“用于测定化学状态的系统和方法”的专利申请案的分案申请。
相关申请的交叉引用
本申请要求2012年12月17日提交的kasdan等人的美国临时专利申请61/737,854,2012年12月17日提交的kasdan等人的美国临时专利申请61/737,856,以及2012年12月17日提交的美国专利申请no.13/716,246的优先权,这些文献的内容以引用方式并入本文。
本发明总体涉及检测生物状况的仪器和方法,更具体而言本发明涉及用于检测少的流体样品中的生物状况的方法和仪器。
背景技术:
存在着多种难以诊断的医学状况。通常,医生的诊断是基于该医生所观察的患者症状的结合。这有时会导致误诊。此外,通常患者对治疗(药品或其他模式)产生应答后,医生才观察到。
许多实验室测试是在肌体样本或流体上在诊断平台中实施的,从而测定患者的生物状况。然而,这些测试在诊断实验室中是离线实施的。通常,实验室服务仅在一天中单一的8小时转换中提供,并往往是劳动密集的。
本领域中一些现有技术的公开尤其包括davis等人的us8,116,984,其公开了定量白细胞中cd64和cd163表达的方法,具体而言,公开了与流式细胞仪一起使用的试剂盒,其包含定量荧光微珠标准品的悬液、定向于cd64和cd163的荧光标记抗体、以及分析软件。该软件用于取得关于微珠悬液及得自流式细胞仪的荧光标记抗体的信息;以及分析数据,对曲线进行平滑处理,计算新参数,提供质控测量和通知检验系统的期限。
在微流体领域中已经公开了多个研发,例如:us2006215155a,其描述了包含3个分层排布的平板(3-5)的流动池,其中由挠性材料组成的中间平板(4)插在由更坚硬的材料组成的平板(3,5)之间,并且至少一个平板包含用于接收流体的至少一个凹陷(15,17),该平板与分层排布的另一个平板(3,5)毗邻。所述的凹陷主要为微通道和反应室。根据该发明,所述的平板通过与该平板平面平行排布的、与所述的凹陷保持一定距离(压紧中间的平板)的方式相互连接。
wo12019599a描述了用于运输流体的微流体装置,特别是微型泵或微型阀。根据该发明的装置可表征为:膜(2,3),该膜以膜表面彼此面对的方式而彼此相靠,并且以如下方式彼此连接:在膜(2,3)之间形成的运输通道(19);以及倾斜仪器,其用于通过在垂直于膜表面的方向上共同倾斜彼此相靠的膜(2,3)而形成运输通道(19),其中在倾斜方向上,背膜(2)的倾斜表面区域(12)位于倾斜方向上前膜(3)的倾斜表面区域(14)内,其中所述的倾斜方向是由膜(2,3)之间的连接(15)来定义的。
us2012187117a公开了流体贮液器,特别是整合至小型化流动池内的流体贮液器,其包含贮液器空间,其通过2个实体(6,7)封闭,该2个实体以流体密闭的方式彼此相靠。根据该发明,除去储存的液体(9)以外,充满剩余贮液器空间的固体填充体(12)排布于贮液器空间中。被储存的液体充满的一部分贮液器空间优选地主要由2个实体(6,7)中的一者和固体填充体(12)来限定。
用于现有技术的诊断检验的典型周转时间为30-120分钟。通常,浪费在等待实验室结果中的时间可以导致患者进一步恶化,有时还会导致死亡。在一些情况下,医生必须在不具有实验室结果的情况下行动。这可以导致为患者提供了错误的治疗。因此需要提供快速的检验以解救生命并为患者提供快速正确的治疗。尽管存在上文所述的发明,但是提供用于检测和诊断患者生物状况的改进的仪器和方法仍是未被满足的需要。
存在着许多其他的诊断测试(例如对水样品)以检测目前具有长的周转时间的毒素和污染物。提供能够用于测定化学状态的定量和/或定性测试的系统、试剂盒和方法仍是未被满足的需要。
发明概述
本发明的一些方面的目的是提供了用于检测样品的化学状态的改进的仪器和方法。
在本发明的一些实施方案中,提供了用于检测和诊断患者的生物状况的改进的方法、系统、仪器和试剂盒。
在本发明的其他实施方案中,描述了方法和系统,其用于快速检测由患者得到的样品中的生物部分。
在本发明的另一些实施方案中,公开了方法和试剂盒,其用于提供检测由患者得到的少的流体样品中的生物部分。
本发明的一些方面的目的是提供了用于检测少的流体样品中的化学个体的改进的仪器和方法。
在本发明的一些实施方案中,提供了用于检测化学个体的改进的快速方法、仪器和试剂盒。
在本发明的一些实施方案中,提供了用于检测生物个体的改进的快速方法、仪器和试剂盒。
在本发明的其他的实施方案中,公开了方法和试剂盒,其用于提供检测少的流体样品中的生物和/或化学部分。
在本发明的其他的实施方案中,公开了微流体方法、仪器和试剂盒,其用于提供检测少的流体样品中的生物和/或化学部分。
因此,根据本发明的实施方案,提供了一种自容系统,其用于实施测定化学状态的检验,所述的细胞包括:
a)其中用于实施所述的检验的固定盒;
b)适用于与样品反应的至少一种试剂;以及
c)至少一种报告功能,适用于报告所述的至少一种试剂与所述的样品的反应,从而报告检验的结果;
其中所述的至少一种试剂、所述的样品和所述的至少一种报告功能都包含在所述的盒中。
此外,根据本发明的实施方案,所述的检验为流式细胞仪检验。
此外,根据本发明的实施方案,所述的化学状态为生物化学状态。
此外,根据本发明的实施方案,所述的生物化学状态表明了生物状况。
此外,根据本发明的实施方案,所述的样品为生物样品。
此外,根据本发明的实施方案,所述的生物样品为肌体样品。
此外,根据本发明的实施方案,所述的肌体样品选自血液,血清,血浆,尿,唾液,脑脊液(csf),浆液,腹膜液和滑液血液,尿,血浆,血清和唾液。
重要的是,根据本发明的实施方案,所述的盒是无阀的。
注意,根据本发明的实施方案,所述的盒为一次性微流体盒。
此外,根据本发明的实施方案,所述的至少一种试剂包含以下至少一种:
d)至少一种靶向抗体;
e)至少一种阳性对照识别抗体;以及
f)至少一种阴性对照识别检验部分。
此外,根据本发明的实施方案,所述的至少一种试剂包含至少一种参照组合物,其包含以下至少一种:
g)靶向信号参照组合物;以及
h)参照识别器组合物。
因此,根据本发明的另一个实施方案,提供了一种方法,其用于实施测定自容固定盒中化学状态的检验,所述的方法包括:
i)将样品引入至所述的盒中;
j)使至少一种试剂与所述的样品反应;以及
k)检测与至少一种报告功能有关的信号,所述的至少一种报告功能适用于报告所述的至少一种试剂与所述的样品的反应,由此测定化学状态。
此外,根据本发明的实施方案,所述的方法进一步包括形成至少一种产物,并检测监测与该产物有关的信号。
此外,根据本发明的实施方案,所述的检验为流式细胞仪检验。
此外,根据本发明的实施方案,所述的化学状态为生物化学状态。
注意,根据本发明的实施方案,所述的生物化学状态表明生物状况。
此外,根据本发明的实施方案,所述的样品为生物样品。
此外,根据本发明的实施方案,所述的生物样品为肌体样品。
此外,根据本发明的实施方案,所述的肌体样品选自血液,血清,血浆,尿,唾液,脑脊液(csf),浆液,腹膜液和滑液。
此外,根据本发明的实施方案,所述的至少一种试剂包含:
l)细胞表面标志物;
m)细胞染色;
n)与固体载体结合的试剂;
o)化学指示剂;以及
p)生物细胞指示剂。
此外,根据本发明的实施方案,所述的细胞表面标志物选自cd64,cd4,cd8,干细胞指示剂,微小残留病灶指示剂和淋巴细胞亚型指示剂。
此外,根据本发明的实施方案,所述的细胞染色选自白细胞分类指示剂、细胞凋亡指示剂。
此外,根据本发明的实施方案,与固体载体结合的试剂选自固定化酶、固定化底物、血浆蛋白珠、抗体珠、抗原珠和elisa检验。
此外,根据本发明的实施方案,所述的化学指示剂选自颜色指示剂,浊度指示剂,ph指示剂,吸附指示剂,放射指示剂和化学反应指示剂。
此外,根据本发明的实施方案,所述的生物细胞指示剂选自细胞周期阶段指示剂,细胞增殖指示剂,细胞因子指示剂,代谢指示剂和细胞凋亡指示剂。
此外,根据本发明的实施方案,所述的至少一种试剂包含至少2种试剂。
此外,根据本发明的实施方案,所述的至少2种试剂包含以下至少一种:
q)细胞表面标志物和细胞元素染色;
r)细胞表面标志物和血浆蛋白珠检验;
s)细胞表面标志物和溶液改变标志物;
t)细胞元素染色和血浆蛋白珠检验;以及
u)细胞元素染色和溶液改变标志物。
此外,根据本发明的实施方案,所述的生物状况选自血液疾病,例如白血病,血小板减少症免疫系统疾病,局部感染,泌尿系统紊乱,自身免疫病和脓毒病。
因此,根据本发明的另一个实施方案,提供了一种方法,其用于在固定盒中形成化学反应,所述的方法包括:
v)将至少一种组合物储存在所述的盒中;以及
w)启动至少一个可充气的室,从而向所述的至少一种组合物提供至少一种压力,由此诱导化学反应。
此外,根据本发明的实施方案,所述的盒为无阀盒。
此外,根据本发明的实施方案,所述的至少一种组合物包含至少2种组合物。
此外,根据本发明的实施方案,所述的至少一种压力为正压力。
此外,根据本发明的实施方案,所述的至少一种压力为负压力。
重要的是,根据本发明的实施方案,所述的至少一种压力包括至少一种正压力和至少一种负压力。
此外,根据本发明的实施方案,所述的至少一种正压力和所述的至少一种负压力包括交替的正压力和负压力。
此外,根据本发明的实施方案,所述的至少一种可充气的室包括2个可充气的室。
此外,根据本发明的实施方案,所述的化学反应包含至少一种中间体。
此外,根据本发明的实施方案,所述的至少一种压力继续地提供至至少一种组合物的数种组合。
根据本发明的实施方案,所述的方法进一步包括在启动步骤之前将样本引入至所述的盒中。
此外,根据本发明的实施方案,所述的样本为肌体样品。
此外,根据本发明的实施方案,所述的化学反应提供了肌体样品的流式细胞仪检验结果。
此外,根据本发明的实施方案,所述的化学反应用于测定哺乳动物受试对象的生物状况。
此外,根据本发明的实施方案,所述的方法进一步包括:
1.将由受试对象得到的样本在所述的盒中温育预定的时间段;以及
2.接收对至少一种报告元件产生应答的指示,由此提供受试对象中生物状况的指示。
此外,根据本发明的实施方案,所述的生物状况选自血液疾病,例如白血病,血小板减少症免疫系统疾病,局部感染,泌尿系统紊乱,自身免疫病和脓毒病。
此外,根据本发明的实施方案,设置于所述的盒中的至少一种组合物包含脓毒病生物标志物。
此外,根据本发明的实施方案,所述的生物标志物包括cd64和cd163的至少一种。
此外,根据本发明的实施方案,所述的指示是定量的。
重要的是,根据本发明的实施方案,所述的样品的体积小于200微升(μl)。
此外注意,根据本发明的实施方案,所述的方法是在20分钟内完成的。在一些情况下,所述的方法是在15分钟、10分钟或5分钟内完成的。
因此,根据本发明的实施方案,提供了一种方法,其用于测定哺乳动物受试对象的生物状况,所述的方法包括:
a)当受试对象具有所述的生物状况时,将由受试对象得到的样本与至少一种组合物在本文所述的固定盒中温育预定的时间段,从而形成至少一种反应产物;以及
b)接收至少一种反应产物的指示,由此提供受试对象中生物状况的指示,其中所述的至少一种反应产物是对所述的方法中的至少一种报告元件产生的应答。
因此,根据本发明的实施方案,提供了一种用于检测化学个体的微流体试剂盒,该试剂盒包含:
a)用于接收样品以及用于将所述的样品与至少一种组合物结合的一次性元件;
b)包含至少一个检测器部分的至少一种组合物,从而形成反应产物,其中所述的检测器部分适用于与所述的样品反应;以及
c)适用于提供反应产物的指示的至少一种报告元件,从而提供化学个体存在的指示。此外,根据本发明的实施方案,所述的试剂盒进一步包含:
d)使用该试剂盒的说明书。
因此,根据本发明的实施方案,提供了用于评价患者的生物状况的试剂盒,该试剂盒包含:
a)用于接收生物样品以及用于将所述的样本与至少一种组合物结合的一次性元件;
b)当所述的患者具有所述的生物状况时,包含至少一个检测器部分的至少一种组合物,从而形成反应产物,其中所述的检测器部分适用于与所述的样本反应;以及
c)适用于提供反应产物的指示的至少一种报告元件,从而提供化学个体的指示。
此外,根据本发明的实施方案,所述的试剂盒进一步包含:使用该试剂盒的说明书。
此外,根据本发明的实施方案,所述的一次性元件为一次性盒。
此外,根据本发明的实施方案,所述的一次性盒为一次性微流体盒。
此外,根据本发明的实施方案,所述的一次性微流体盒包含以下元件的至少一种:
a)贮液器;
b)泵;
c)导管;
d)小型化流动池;
e)运输通道;
f)微流体元件;
g)压缩气体保持元件;
h)压缩气体释放元件;
i)喷嘴元件;
j)混合元件;
k)风箱元件;
l)适用于根据特定的顺序来启动所述的元件的软件;以及
m)根据特定的顺序来启动所述的元件的硬件。
此外,根据本发明的实施方案,所述的一次性微流体盒包含至少2种所述的元件。
此外,根据本发明的实施方案,所述的一次性微流体盒包含至少3种所述的元件。
此外,根据本发明的实施方案,所述的一次性微流体盒包含至少4种所述的元件。
此外,根据本发明的实施方案,所述的一次性微流体盒包含至少5种所述的元件。
此外,根据本发明的实施方案,所述的一次性微流体盒包含至少10种所述的元件。
此外,根据本发明的实施方案,所述的一次性微流体盒包含至少20种所述的元件。
此外,根据本发明的实施方案,所述的一次性微流体盒包含至少30种所述的元件。
根据本发明的实施方案,微流体试剂盒被构造成能够在1个小时内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在30分钟内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在15分钟内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在10分钟内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在5分钟内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在1分钟内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在30秒内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在10秒内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在1秒内提供快速指示。
因此,根据本发明的实施方案,提供了用于实施快速生物检验的微流体检验试剂盒,该试剂盒包含:
a)包含反应物的一次性元件,该一次性元件适用于接收包含生物个体的样品以及将所述的反应物与所述的生物个体结合从而形成反应产物;以及
b)适用于提供快速指示所述的反应物消失的至少一种报告元件,由此提供生物个体的快速检验。
因此,根据本发明的实施方案,提供了用于实施生物个体的快速检验的微流体检验试剂盒,该试剂盒包含:
a)包含反应物的一次性元件,该一次性元件适用于接收包含生物个体的样品以及将所述的反应物与所述的生物个体结合从而形成反应产物;以及
b)适用于提供快速指示所述的反应物出现的至少一种报告元件,由此提供生物个体的快速检验。
因此,根据本发明的实施方案,提供了用于评价生物状况的组合物,该组合物包含:
x)包含以下至少一种的样品组合物:
a)包含靶向部分的肌体样本;
b)阳性对照部分;以及
c)阴性对照部分;
y)包含以下至少一种的检测组合物:
a)至少一个靶向抗体;
b)至少一个阳性对照识别抗体;以及
c)至少一个阴性对照识别检测部分或特征;以及
z)包含以下至少一种的至少一种参照组合物;
i.靶向信号参照组合物;以及
ii.参照识别器组合物。
因此,根据本发明的另一个实施方案,提供了用于评价生物状况的组合物,该组合物包含:
aa)包含以下至少一种的样品组合物:
i.包含靶向部分的肌体样本;
ii.阳性对照部分;以及
iii.阴性对照部分;
bb)包含以下至少一种的抗体组合物:
i.至少一种靶向抗体(cd64抗体);
ii.至少一种阳性对照识别抗体(cd163);以及
iii.至少一种阴性对照识别抗体或特征;以及
cc)包含以下至少一种的至少一种参照组合物:
i.靶向信号参照组合物;以及
ii.参照识别器组合物。
此外,根据本发明的实施方案,所述的组合物进一步包含至少一种调节部分,其包含:
a)至少一种溶解试剂;以及
b)至少一种稀释剂。
此外,根据本发明的实施方案,所述的生物状况选自血液疾病,例如白血病,血小板减少症免疫系统疾病,局部感染,泌尿系统紊乱,自身免疫病和脓毒病。
此外,根据本发明的实施方案,肌体样本选自血液,血清,血浆,尿,唾液,脑脊液(csf),浆液,腹膜液和滑液。
根据本发明的另一个实施方案,所述的靶向部分包括嗜中性粒细胞上的cd64表面抗原。
此外,根据本发明的另一个实施方案,所述的阳性对照部分包含单核细胞,所述的阴性对照包含淋巴细胞。
此外,根据本发明的实施方案,所述的靶向部分为嗜中性粒细胞上的cd64,所述的阳性对照部分包含单核细胞上的cd64的表达,所述的阴性对照部分包含不具有cd64表达的淋巴细胞。
此外,根据本发明的实施方案,所述的靶向指示剂与至少一个靶向抗体上的信号部分结合。
此外,根据本发明的实施方案,所述的至少一种参照组合物包含珠。
此外,根据本发明的实施方案,所述的珠包含聚苯乙烯微珠。
此外,根据本发明的实施方案,所述的靶向抗体参照组合物包含第一荧光信号,所述的参照识别器组合物包含第二荧光信号。
此外,根据本发明的实施方案,所述的第一荧光信号包含fitc,所述的第二荧光信号包含starfireredfluor。
因此,根据本发明的实施方案,提供了识别样品中生物标志物的方法,该方法包括:
dd)将所述的样品与荧光标记的结合部分相接触,其中所述的荧光标记的结合部分特异性地结合所述的生物标志物;
ee)由至少一部分所述的标记样品中检测第一荧光信号;
ff)由荧光标记的颗粒的群体中检测第二荧光信号,其中所述的群体包含经过固定时间后的已知的荧光强度;以及
gg)将第一荧光信号对第二荧光信号归一化,由此定量生物标志物,其中所述的归一化包括使用包含软件的装置,其中所述的软件能够比较第一和第二荧光信号。
此外,根据本发明的实施方案,所述的生物标志物为脓毒病生物标志物。
此外,根据本发明的实施方案,所述的生物标志物为cd64或cd163。
此外,根据本发明的实施方案,所述的样品为血液样品。
根据本发明的另一个实施方案,所述的结合部分的荧光标记和所述的颗粒的荧光标记是相同的荧光标记。
此外,根据本发明的实施方案,所述的结合部分为抗体。
根据本发明的实施方案,所述的软件能够识别特定的多种荧光标记的颗粒。
此外,根据本发明的实施方案,所述的单独的荧光信号包含至少一个第一荧光信号和至少一个第二荧光信号。
此外,根据本发明的实施方案,所述的荧光标记的结合部分靶向样品中的第一细胞群体和第二细胞群体。
根据本发明的另一个实施方案,检测结合部分与第二细胞群体的结合为样品提供了内部阳性对照。
此外,根据本发明的实施方案,所述的结合部分为抗cd64抗体,所述的第一细胞群体包含嗜中性粒细胞白细胞。
此外,根据本发明的实施方案,所述的第二细胞群体包含单核细胞。
根据本发明的实施方案,所述的方法进一步包括测定样品中至少一个细胞群体存在情况的步骤,从而为样品提供了内部阴性对照,其中所述的样品未与所述的结合部分结合。
因此,根据本发明的另一个实施方案,提供了用于评价生物状况的组合物,该组合物包含:
hh)包含以下至少一种的样品:
i.包含靶向部分的肌体样本;
ii.阳性对照部分;以及
iii.阴性对照部分;
ii)包含以下至少一种的抗体组合物:
i.至少一种靶向抗体(cd64抗体);
ii.至少一种阳性对照识别抗体(cd163);以及
iii.至少一种阴性对照识别抗体或特征(分散);以及
jj)包含以下至少一种的至少一种参照组合物(珠):
i.靶向抗体参照组合物;以及
ii.参照识别器组合物。
根据本发明的另一个实施方案,所述的组合物进一步包含至少一个调节部分,其包含:
i.至少一种溶解试剂;以及
ii.至少一种稀释剂。
因此,根据本发明的另一个实施方案,提供了测定受试对象中脓毒病的存在或缺乏情况的方法,该方法包括:
i.将由所述的受试对象得到的血液样品与对脓毒病标志物具有特异性的荧光标记的结合部分相接触,其中所述的血液样品的体积为50μl或更少;以及
ii.检测所述的样品中结合部分的存在、缺乏或水平,从而测定所述的受试对象中脓毒病的存在或缺乏情况。
因此,根据本发明的另一个实施方案,提供了定量样品中生物标志物的方法,该方法包括:
a)将所述的样品与荧光标记的结合部分相接触,其中所述的荧光标记的结合部分特异性地结合所述的生物标志物;
b)由至少一部分所述的标记样品中检测第一荧光信号;
c)由荧光标记的颗粒的群体中检测第二荧光信号,其中所述的群体包含经过固定时间后的已知的荧光强度;以及
d)将第一荧光信号对第二荧光信号归一化,由此定量生物标志物,其中所述的归一化包括使用包含软件的装置,其中所述的软件能够比较第一和第二荧光信号。
因此,根据本发明的实施方案,提供了定量样品中第二生物标志物的方法,该方法包括:
kk)将所述的样品与第一荧光标记的结合部分相接触,其中所述的第一荧光标记的结合部分特异性地结合第一生物标志物;
ll)将所述的样品与第二荧光标记的结合部分相接触,其中所述的第二荧光标记的结合部分特异性地结合第二生物标志物;
mm)由至少一部分所述的标记样品中检测第一荧光信号;
nn)由荧光标记的颗粒的群体中检测第二荧光信号,其中所述的群体包含经过固定时间后的已知的荧光强度;以及
oo)将第一荧光信号对第二荧光信号归一化,由此定量第二生物标志物,其中所述的归一化包括使用包含软件的装置,其中所述的软件能够比较第一和第二荧光信号。
根据一些实施方案,所述的样品可以是液体,根据其他的实施方案,所述的样品可以是胶体或悬液。根据其他的实施方案,所述的样品可以是固体,例如粉末或晶体形式。
因此,根据本发明的实施方案,提供了用于实施化学反应的微流体试剂盒,该试剂盒包含:
a)用于接收样品以及用于将所述的样品与至少一种组合物结合的一次性元件;
b)包含至少一个检测器部分的至少一种组合物,其中所述的至少一个检测器部分适用于与所述的样品反应从而形成反应产物;以及
c)适用于提供所述的反应产物的指示的至少一种报告元件。
因此,根据本发明的实施方案,提供了用于实施化学反应的微流体试剂盒,该试剂盒包含:
a)用于接收样品以及用于将所述的样品与至少一种组合物结合的一次性元件;
b)包含至少一个检测器部分的至少一种组合物,其中所述的至少一个检测器部分适用于与所述的样品反应从而形成反应产物;以及
c)适用于指示所述的样品中反应物的消失情况的至少一种报告元件,从而提供反应产物存在情况的指示。
因此,根据本发明的实施方案,提供了用于实施化学反应的微流体试剂盒,该试剂盒包含:
a)用于接收第一反应物以及用于将所述的第一反应物与至少一种组合物结合的一次性元件;
b)包含至少一个检测器部分的至少一种组合物,其中所述的至少一个检测器部分适用于与反应产物反应;以及
c)适用于指示所述的至少一个检测器部分的至少一种报告元件,从而提供反应产物存在情况的指示。
因此,根据本发明的实施方案,提供了用于实施化学个体的快速检测的微流体试剂盒,其该试剂盒包含:
a)用于接收第一反应物以及用于将所述的样品与至少一种组合物结合的一次性元件;
b)包含至少一个检测器部分的至少一种组合物,其中所述的至少一个检测器部分适用于与反应产物反应;以及
c)适用于快速指示所述的至少一个检测器部分的至少一种报告元件,从而提供化学个体的快速检测。
因此,根据本发明的实施方案,提供了用于实施化学个体的快速检测的微流体试剂盒,其该试剂盒包含:
a)用于接收第一反应物以及用于将所述的样品与至少一种组合物结合从而形成反应产物的一次性元件;
b)适用于与反应产物反应的至少一个检测器部分;以及
c)适用于快速指示所述的至少一个检测器部分的至少一种报告元件,从而提供化学个体的快速检测。
因此,根据本发明的实施方案,提供了用于实施化学个体的快速检测的微流体试剂盒,其该试剂盒包含:
a)用于接收第一反应物以及用于将所述的样品与至少一种组合物结合从而形成反应产物的一次性元件;
b)适用于快速指示所述的反应产物的至少一种报告元件,从而提供化学个体的快速检测。
因此,根据本发明的实施方案,提供了用于实施化学个体的快速检测的微流体试剂盒,其该试剂盒包含:
a)用于接收第一反应物以及用于将所述的样品与至少一种组合物结合从而形成反应产物的一次性元件;以及
b)适用于快速指示所述的化学个体的消失情况的至少一种报告元件,从而提供化学个体的快速检测。
根据本发明的实施方案,微流体试剂盒被构造成能够在1个小时内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在30分钟内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在15分钟内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在10分钟内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在5分钟内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在1分钟内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在30秒内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在10秒内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在1秒内提供快速指示。
因此,根据本发明的实施方案,提供了用于实施化学个体的快速检测的微流体试剂盒,其该试剂盒包含:
a)用于接收第一反应物以及用于将所述的样品与至少一种组合物结合从而形成反应产物的一次性元件;以及
b)适用于快速指示所述的反应产物的至少一种报告元件,从而提供化学个体的快速检测。
因此,根据本发明的实施方案,提供了用于实施化学个体的快速检测的微流体试剂盒,其该试剂盒包含:
a)用于接收第一反应物以及用于将所述的样品与至少一种组合物结合从而形成反应产物的一次性元件;以及
b)适用于快速指示所述的化学个体的消失情况的至少一种报告元件,从而提供化学个体的快速检测。
因此,根据本发明的实施方案,提供了用于检验化学个体的微流体检验试剂盒,其该试剂盒包含:
a)用于接收第一反应物以及用于将所述的样品与至少一种组合物结合的一次性元件;
b)包含至少一个检测器部分的至少一种组合物,其中所述的至少一个检测器部分适用于与所述的样品反应从而形成反应产物;以及
c)适用于提供反应产物的指示的至少一种报告元件,从而提供化学个体的检验。
此外,根据本发明的实施方案,所述的试剂盒进一步包含:
d)使用该试剂盒的说明书。
此外,根据本发明的实施方案,所述的一次性元件为一次性盒。
此外,根据本发明的实施方案,所述的一次性盒为一次性微流体盒。
因此,根据本发明的实施方案,提供了定量样品中生物标志物的方法,该方法包括:
a)将所述的样品与荧光标记的结合部分相接触,其中所述的荧光标记的结合部分特异性地结合所述的生物标志物;
b)由至少一部分所述的标记样品中检测第一荧光信号;
c)由荧光标记的颗粒的群体中检测第二荧光信号,其中所述的群体包含经过固定时间后的已知的荧光强度;以及
d)将第一荧光信号对第二荧光信号归一化,由此定量生物标志物,其中所述的归一化包括使用包含软件的装置,其中所述的软件能够比较第一和第二荧光信号。
因此,根据本发明的实施方案,提供了定量样品中第二生物标志物的方法,该方法包括:
pp)将所述的样品与第一荧光标记的结合部分相接触,其中所述的第一荧光标记的结合部分特异性地结合第一生物标志物;
qq)将所述的样品与第二荧光标记的结合部分相接触,其中所述的第二荧光标记的结合部分特异性地结合第二生物标志物;
rr)由至少一部分所述的标记样品中检测第一荧光信号;
ss)由荧光标记的颗粒的群体中检测第二荧光信号,其中所述的群体包含经过固定时间后的已知的荧光强度;以及
tt)将第一荧光信号对第二荧光信号归一化,由此定量第二生物标志物,其中所述的归一化包括使用包含软件的装置,其中所述的软件能够比较第一和第二荧光信号。
因此,根据本发明的实施方案,提供了在样品上实施微流体化学反应的方法,该方法包括:
a)将所述的样品与包含至少一个检测器部分的至少一种组合物结合,其中所述的至少一个检测器部分适用于与所述的样品反应,从而形成反应产物;以及
b)检测所述的至少一个检测器部分,从而提供所述的反应产物的指示。
因此,根据本发明的实施方案,提供了在微流体规模上实施化学反应的方法,该方法包括:
a)将样品接收至微流体元件中;
b)将所述的样品与包含至少一个检测器部分的至少一种组合物结合,其中所述的至少一个检测器部分设置于所述的微流体元件中,以及
c)检测所述的至少一个检测器部分。
因此,根据本发明的实施方案,提供了在微流体规模上实施化学反应的方法,该方法包括:
a)使样品与设置于微流体元件中的至少一种组合物反应,从而在所述的微流体元件中形成反应产物;以及
b)检测至少一个检测器部分,该检测器部分适用于与所述的样品反应从而提供所述的反应产物的出现情况的指示,由此提供化学反应的指示。
因此,根据本发明的实施方案,提供了实施化学反应的方法,该方法包括:
a)将第一反应物接收于微流体一次性元件中;
b)将所述的第一反应物与包含至少一个检测器部分的至少一种组合物结合,从而形成反应产物,所述的检测器部分适用于与反应产物反应;以及
c)提供所述的化学反应的指示,其中所述的化学反应是对所述的检测器部分产生的应答。
因此,根据本发明的实施方案,提供了实施化学反应的方法,该方法包括:
a)将第一反应物接收于微流体一次性元件中;
b)将所述的第一反应物与包含至少一个检测器部分的至少一种组合物结合,从而形成反应产物,所述的检测器部分适用于与第一反应产物反应;以及
c)提供所述的化学反应的指示,其中所述的化学反应是对所述的检测器部分产生的应答。
因此,根据本发明的实施方案,提供了用于实施化学个体的快速检测的方法,该方法包括:
a)将包含第一反应物的样品接收于一次性元件中;
b)将所述的样品与设置于所述的一次性元件中的组合物反应,从而形成至少一种反应产物;以及
c)检测所述的第一反应物的所述的消失情况,从而提供所述的化学个体的快速检测,其中所述的第一反应物是对设置于所述的一次性元件中的报告元件的启动产生的应答。
因此,根据本发明的实施方案,提供了用于实施化学个体的快速检测的方法,该方法包括:
a)将所述的包含化学个体的样品接收于一次性元件中;
b)将至少一部分所述的样品与设置于所述的一次性元件中的至少一种组合物反应,从而形成至少一种反应产物;以及
c)检测所述的至少一种组合物中的至少一个检测器部分,从而检测所述的化学个体,其中所述的至少一个检测器部分是对所述的反应步骤产生的应答。
因此,根据本发明的实施方案,提供了用于实施化学个体的快速检测的方法,该方法包括:
a)将包含第一反应物的样品接收于一次性元件中;
b)将所述的样品与设置于所述的一次性元件中的至少一种组合物反应,从而形成至少一种反应产物;以及
c)检测设置于所述的一次性元件中的至少一个检测器部分,所述的至少一个检测器部分适用于与反应产物反应,从而提供化学个体的快速检测。
因此,根据本发明的实施方案,提供了用于实施化学个体的快速检测的方法,该方法包括:
a)将样品中的第一反应物接收于一次性元件中;
b)将至少一种组合物与至少一部分所述的样品反应,从而形成反应产物;以及
c)检测设置于所述的一次性元件中的至少一种报告元件,所述的至少一种报告元件适用于提供所述的反应产物的快速指示,从而提供化学个体的快速检测。
因此,根据本发明的实施方案,提供了用于实施化学个体的快速检测的方法,该方法包括:
a)将样品中的第一反应物接收于微流体元件中;
b)将至少一部分所述的样品与设置于所述的微流体元件中的至少一种组合物反应,从而形成反应产物;以及
c)检测设置于所述的微流体元件中的至少一种报告元件,所述的至少一种报告元件适用于快速指示所述的化学个体的消失情况,从而提供化学个体的快速检测。
根据本发明的实施方案,微流体方法被构造成能够在1个小时内提供快速指示。
根据本发明的另一个实施方案,微流体方法被构造成能够在30分钟内提供快速指示。
根据本发明的另一个实施方案,微流体方法被构造成能够在15分钟内提供快速指示。
根据本发明的另一个实施方案,微流体方法被构造成能够在10分钟内提供快速指示。
根据本发明的另一个实施方案,微流体方法被构造成能够在5分钟内提供快速指示。
根据本发明的另一个实施方案,微流体方法被构造成能够在1分钟内提供快速指示。
根据本发明的另一个实施方案,微流体方法被构造成能够在30秒内提供快速指示。
根据本发明的另一个实施方案,微流体方法被构造成能够在10秒内提供快速指示。
根据本发明的另一个实施方案,微流体方法被构造成能够在1秒内提供快速指示。
因此,根据本发明的实施方案,提供了用于实施生物个体的快速检测的方法,该方法包括:
a)将包含生物个体的样品接收于包含反应物的一次性元件中;
b)将所述的样品与所述的反应物反应,从而形成反应产物;以及
c)检测所述的一次性元件中的至少一种报告元件,以便快速指示所述的反应物的消失情况,从而提供生物个体的快速检测。
因此,根据本发明的实施方案,提供了用于实施生物个体的快速检测的微流体方法,该方法包括:
a)将包含生物个体的样品接收于包含反应物的一次性元件中;
b)将所述的样品与所述的反应物反应,从而形成反应产物;以及
c)检测所述的一次性元件中的至少一种报告元件,以便快速指示所述的反应物的消失情况,从而提供生物个体的快速检测。
因此,根据本发明的实施方案,提供了用于实施化学个体的快速检测的微流体方法,该方法包括:
a)将包含第一反应物的样品接收于一次性元件中;
b)将至少一部分所述的样品与至少一种组合物结合于所述的一次性元件中,从而形成反应产物;
c)将设置于所述的一次性元件中的至少一种检测器部分与所述的反应产物反应;以及
d)检测所述的至少一个检测器部分,从而提供化学个体的快速检测。
因此,根据本发明的实施方案,提供了用于实施化学个体的快速检测的微流体方法,该方法包括:
a)将包含第一反应物的样品接收于一次性元件中;
b)将所述的样品与至少一种组合物结合,从而形成反应产物;以及
c)检测至少一种报告元件,所述的至少一种报告元件适用于所述的反应产物的快速指示,从而提供化学个体的快速检测。
因此,根据本发明的实施方案,提供了用于实施化学个体的快速检测的微流体方法,该方法包括:
a)将包含第一反应物的样品接收于一次性元件中;
b)将所述的样品与设置于所述的一次性元件中的至少一种组合物结合,从而形成反应产物;以及
c)检测至少一种报告元件,所述的至少一种报告元件适用于快速指示所述的化学个体的消失情况,从而提供化学个体的快速检测。
根据一些实施方案,所述的样品可以是液体,根据其他的实施方案,所述的样品可以为胶体或悬液。根据其他的实施方案,所述的样品可以为固体,例如粉末或晶体形式。
通过以下本发明优选实施方案的详细描述,连同附图将会更全面地理解本发明。
附图简述
现在,参照以下示例性附图,连同某些优选的实施方案来描述本发明,这样可以更全面地理解本发明。
现在详细地特定地参照附图,强调所示的特点为举例的方式并且仅是为了示例性地讨论本发明的优选的实施方案,并且是为了提供认为哪些方面最有用且容易地理解本发明的原理和概念方面的描述而列出的。就此而言,并未试图更详细地显示本发明的结构细节,只示出基础理解本发明所必需的细节,这些描述以及附图对于本领域的那些技术人员而言显而易见的是本发明的多种形式可以如何体现在实践中。
附图中:
图1为根据本发明的实施方案,显示用于检测生物状况的仪器的简化示意图;
图2为根据本发明的实施方案,用于检测生物状况的方法的简化流程图;
图3为简化示意图,其显示根据本方面的实施方案,用于检测与cd64细胞表面抗原有关的生物状况的方法;
图4为方法的简化流程图,所述的方法用于根据本发明的实施方案,检测与cd64细胞表面抗原有关的生物状况;
图5a为根据本发明的实施方案,非活化嗜中性粒细胞特征的荧光检测检验的图形输出,其中所述的检验与图3-4的方法有关;
图5b为根据本发明的实施方案,活化嗜中性粒细胞特征的荧光检测检验的图形输出,其中所述的检验与图3-4的方法有关;
图5c为根据本发明的实施方案,单核细胞特征的荧光检测检验的图形输出,其中所述的检验与图3-4的方法有关;
图5d为根据本发明的实施方案,参照珠特征的荧光检测检验的图形输出,其中所述的检验与图3-4的方法有关;
图6为简化示意图,其显示根据本方面的实施方案,用于检测与血浆蛋白质有关的生物状况的方法;
图7为方法的简化流程图,所述的方法用于根据本发明的实施方案,检测与血浆蛋白质有关的生物状况;
图8a为根据本发明的实施方案,血浆蛋白珠的荧光检测检验的图形输出,其中所述的血浆蛋白珠不具有靶向结合特征,并且所述的检验与图6-7的方法有关;
图8b为根据本发明的实施方案,未结合的标记抗体特征的荧光检测检验的图形输出,其中所述的检验与图6-7的方法有关;
图8c为根据本发明的实施方案,血浆蛋白靶向珠的荧光检测检验的图形输出,其中所述的血浆蛋白靶向珠具有靶向结合,并且所述的检验与图6-7的方法有关;
图8d为根据本发明的实施方案,参照珠特征的荧光检测检验的图形输出,其中所述的检验与图6-7的方法有关;
图9为简化示意图,其显示根据本方面的实施方案,用于检测化学个体的另一种微流体仪器;
图10为方法的另一个简化流程图,所述的方法用于根据本发明的实施方案,检测化学个体;
图11为简化示意图,其显示根据本方面的实施方案,用于检测和定量血清样品中葡萄糖、蛋白质和白蛋白的方法;
图12a为根据本发明的实施方案,用于检测生物状况的读取器组件和盒的简化三维正视图;
图12b为根据本发明的实施方案,用于检测生物状况的读取器组件的简化三维内部正视图;
图12c为根据本发明的实施方案,用于检测生物状况的读取器组件的简化三维内部后视图;
图13a为根据本发明的实施方案,盒组件的外部侧视图;
图13b为根据本发明的实施方案,盒组件的内部侧视图;
图14a-14o显示根据本发明的实施方案,盒组件中处理事件的顺序;
图15为根据本发明的实施方案,微流体分光光度计读数的示意图;
图16为根据本发明的实施方案,用于检测生物状况的光学读取器组件的简化拆分图;
图17为根据本发明的实施方案,用于检测生物状况的光学读取器组件的光电倍增管的另一个简化拆分图;
图18a显示根据本发明的实施方案,读取器光学组件、盒操作单元和前向散射检测单元;
图18b显示根据本发明的实施方案,读取器光学组件的右视图;
图18c显示根据本发明的实施方案,读取器光学组件的左视图;
图18d为根据本发明的实施方案,前向散射检测组件;
图18e为根据本发明的实施方案,前向散射检测组件的侧视图;
图19a显示根据本发明的实施方案,读取器组件的剖视图;
图19b显示根据本发明的实施方案,读取器组件的拆分右视图;
图19c显示根据本发明的实施方案,读取器组件的左视拆分图;
图19d显示根据本发明的实施方案,盒操作单元(chu)的后视图;
图19e显示根据本发明的实施方案,盒操作单元(chu)的正视图;
图19f为根据本发明的实施方案,图12a系统的一次性盒的简化图;
图20为根据本发明的实施方案,用于医学状况快速测定的一次性盒的简化图;
图21a为根据本发明的实施方案,读取器光学组件的光学排布的简化示意图;
图21b为根据本发明的实施方案,读取器光学组件的光学排布的简化示意图;
图22a为根据本发明的实施方案,在图21a或21b的光学单元中多波长激发的一个实例的示意图;
图22b其显示根据本发明的实施方案的传输的图形输出2220,其为用于图21b的二向色滤光片2200的波长的函数,其中使用图22a的多波长激发;
图22c为根据本发明的实施方案,光学单元的部件的示意图,其中使用了图22a的多波长激发以及图21a的二向色滤光片;
图23a为根据本发明的实施方案,图1系统的取样盒的示意图;
图23b显示根据本发明的实施方案,在流式细胞仪装置中一次性盒的示意图;
图24为根据本发明的实施方案,用于医学状况快速测定的方法的简化流程图;
图25为根据本发明的实施方案,显示参照珠(rm)相对于由人类患者得到的样品(pmn)而言,在经过一定时间后光学输出的三维图;以及
图26a-26c显示根据本发明的实施方案,参照珠和由人类患者得到的样品在经过一定时间后光学输出的图。
在所有的图中,相同的参数识别为相同的部件。
优选实施方案的详细描述
在详细描述中,列出了多种特定的细节,从而提供了对本发明的完全理解。但是,本领域的那些技术人员应该理解的是这些为具体的实施方案,并且本发明还可以以不同的方式的实施,这些方式体现了本文所述的和所要求的本发明的特征化的特性。
kasdan等人的国际专利申请公开no.wo2011/128893描述了医学状况快速测定的装置、系统和方法,并以引用方式并入本文。
本发明的微流体盒可以为附图所示的任何合适的盒,或者为本文所述的或所引用的任何现有技术的盒,例如但不限于在usd669191s1,us20120266986a1,ep1846159a2,us2012275972,wo11094577a,us2007292941a和ep1263533b1中所述的那些。
现在参照图1,其为根据本发明的实施方案,显示用于检测生物状况的仪器100的简化示意图。
仪器100为试剂盒,其包含盒102和多种化学/生物化学反应物,其在本文中称为处理组合物。该处理组合物适用于(至少部分)与引入至仪器中的生物样本(例如肌体样本)反应。肌体样本可以为体液,例如但不限于血液,血清,血浆,尿,唾液,脑脊液(csf),浆液,腹膜液和滑液。此外或备选地,肌体样本可以为固体,例如头发、牙齿的部分、骨骼的部分或一些软骨。
仪器100包含样本接收元件118,其适用于将样本转移至样品组合物室104中。样品组合物室包含一个或多个转移元件105,其适用于将样本由样品组合物室转移至盒内的一个或多个其他的位置。在图1所示的非限定性实例中,转移元件105为导管,其与处理室112流体连通。在本发明中,这些导管可以在其他附图中出现,并且在一些情况下,这些导管为微流体通道。在一些实施方案中,微流体通道的横截面可以为0.1至2mm2。
此外,所述的盒包含多个处理组合物室106,108,110,其适用于分别容纳相应数量的处理组合物120,122,124。此外,在本发明中,这些室还称为“泡”。这些处理组合物可以为液体、固体或它们的组合。仪器100通常作为试剂盒(其中设置有处理组合物)在市场上出售。在一些情况下,所述的试剂盒可以适用于一次性测试,并且可以为一次性试剂盒。在其他情况下,该试剂盒可以重复使用。可重复使用的试剂盒可以适用于接收其他的外部组合物(未示出),或者可以具有多种处理组合物,其中对于每次测试仅使用一部分。
所述的仪器可以构造并配置,使得所述的处理组合物包含附着在表面(例如珠)上的蛋白质。多个珠或者蛋白质附着于其表面上的其他结构元件是通过以下任意一种或多种方法来实施的:
a)简单附着,例如通过静电或疏水相互作用吸附在表面上,诱捕至固定化聚合物中等;
b)所述的蛋白质与珠表面共价结合;
c)生物识别(例如生物素/链霉亲和素);
d)需要2个步骤:第一层是通过硅烷化学形成的,使得表面呈现反应性基团(例如环氧基,氨基,巯基等),以及第二层(例如待固定的蛋白质或连接体分子)通过固定化的反应性基团而共价附着;
e)与装置内表面上的官能化聚合物涂层共价附着,或者与金表面上的自组装单层(sam)的游离末端连接;
反应类型可以包括抗原-抗体结合、夹心(例如抗体-抗体-抗体)、物理诱捕、受体-配体、酶-底物、蛋白质-蛋白质、适体、共价结合或生物识别中的任意一种或多种。
盒102进一步包含至少一个转移元件107,109,111,其与各自的处理组合物室是流体连通的,每个转移元件还与处理室112是流体连通的。
可以使用通过转移元件将处理组合物室和样品组合物室的内容物转移至处理室的多种方法,其中的一些方法是微流体技术中已知的。这些方法包括鼓风、抽吸、真空处理、机械转移、泵送等。
盒102进一步包含至少一个转移元件113,其与处理室112和评价室114是流体连通的。
可任选地,评价室114与转移元件115是进一步流体连通的,所述的转移元件115适用于将评价室的内容物清理至盒的外部。备选地,评价室可以不具有外部清理手段。
表1显示本发明的仪器100和方法的一些代表性应用。
表1.本发明的仪器和方法的一些生物应用
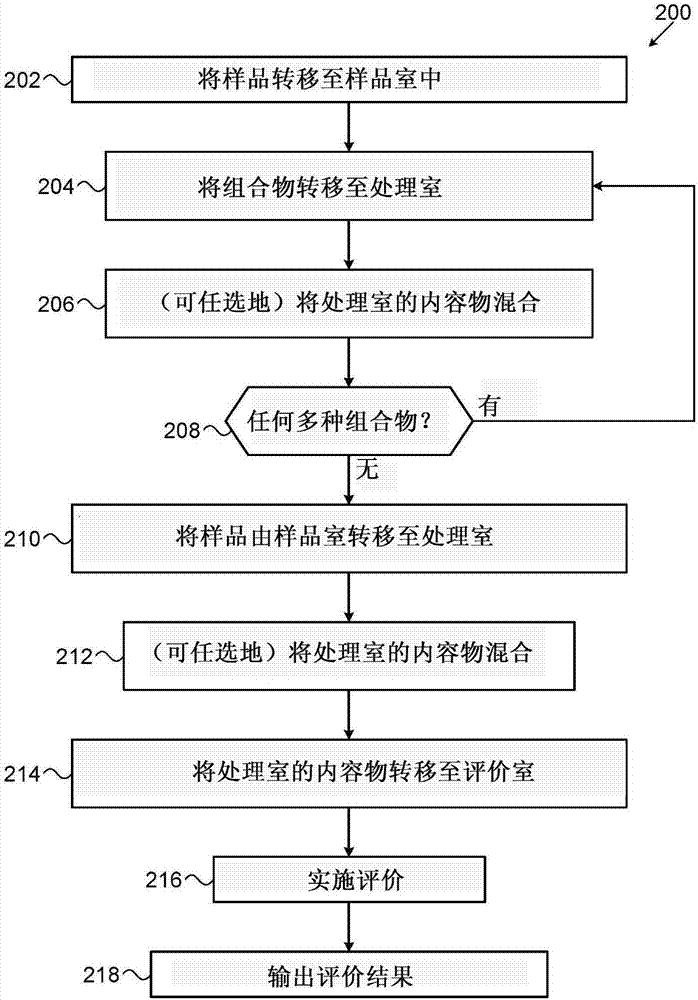
现在参照图2,其为根据本发明的实施方案,用于检测生物状况的方法的简化流程图200。
应该理解的是所述的方法的每一步骤都可以采取预定的时间段来实施,并且在这些步骤之间可以为温育和/或等待步骤,为了简化,图中未示出。
在样品转移步骤202中,诸如肌体样本之类的样品通过接收元件118由外部仪器100转移至样品组合物室104中。根据一些实施方案,样本或样品的体积为低于200μl,低于100μl,低于50μl,低于25μl或低于11μl。
此后,在组合物转移步骤204中,处理组合物120通过转移元件107转移至处理室中。在一些情况下,处理组合物或液体(未示出)可以设置于处理室中。
根据处理组合物和样品/样品类型的本性,可能需要在可任选的混合步骤206中混合或搅拌处理室内容物。这可以通过使用设置于所述的室中的小型搅拌棒(未示出)来实施。此外或备选地,这可以通过试剂盒的流体动力学来实施。此外或备选地,搅拌棒可以设置于仪器中的任何其他的室中。
多种处理组合物的转移顺序对于反应顺序而言是重要的,并且通常是预定的。例如可以对处理组合物室106、此后对处理组合物室108以及此后对处理组合物室110实施步骤204-206。在一些情况下,这些步骤的一些步骤可以同时实施。
在检查步骤208中,应该查明样品处理所需的所有组合物是否已经转移至处理室中。如果有任何组合物剩余,则对随后的处理组合物室(多个)实施步骤204-206。如果没有其他的处理组合物需要转移,则将样品/样本由室104转移至处理室中。
此后,在第二样品转移步骤210中,将样品由样品组合物室转移至处理室中。
根据一些实施方案,步骤210可以在步骤204-208之前实施。
如果需要,可以对处理室中的内容物实施可任选的混合步骤212。
在转移步骤214中,将处理室的内容物转移至评价室中。
评价室114可以配置和构造用于一个或多个评价步骤216中。这些步骤可以包括以下步骤的任意组合或排列:
●其中通过的辐射的转移;
●随即发生冲击辐射;
●检测反射的和/或折射的辐射;
●检测发射的辐射;
●捕获其一个或多个图像;
●对捕获的图像实施图像分析;
●测量处理样本的电学特征;
●随即发生冲击声能;
●检测其中的声能;以及
●分析上述任意一个或多个步骤的输出。
根据一些实施方案,将所述的盒引入至kasdan等人的国际专利申请公开no.wo2011/128893中所述的系统中,其中所述的文献以引用方式并入本文。
然后,在结果输出步骤218中,输出评价步骤的结果。
根据一些实施方案,所述的仪器可以具有用于显示结果的机载手段,例如比色试纸(未示出)。此外或备选地,所述的结果在显示单元中显示,其与仪器100分开并远离。
使用仪器100完成检验所需的时间根据多种因素改编,其非限定性实例包括本发明所述的那些。在一些实施方案中,完成检验所需的时间为大约0.5至100分钟。在其他的实施方案中,完成检验所需的时间为大约1至20分钟。在其他的实施方案中,完成检验所需的时间为大约1至10分钟。完成检验所需的时间为大约1,2,3,4,5,6,7,8,9,10,15,20,25,30,35,40,50,60,80或100分钟。
现在参照图3,其为简化示意图,其显示根据本方面的实施方案,用于检测与cd64细胞表面抗原有关的生物状况的方法300。
根据一些实施方案,所述的方法是在图1所示的并且如本文所述的仪器中实施的。诸如血液样品之类的生物样本是通过样本接收元件118而吸入至样品组合物室104中,然后吸入至处理室112中。样品的体积通常为10-200μl。
血液样品通常为由患者最新移出的全血。全血主要包含红细胞(也称为rbc或红血球)、血小板和白血球(也称为白细胞)(包括淋巴细胞和嗜中性粒细胞)。嗜中性粒细胞(特别是活化的嗜中性粒细胞)的数量增加通常是在炎症(特别是由于细菌感染、环境暴露和一些癌症)开始(急性)阶段的血流中发现。
包含cd64的抗体和cd163的抗体的混合物304被引入至处理室中(参见davisetal.(2006))。各种类型的抗体通常通过特异性荧光标签来标记。在一些情况下,荧光标签被设计成当抗体与其抗原结合时而被活化。在其他情况下,荧光标签总是有活性的。
将所述的室的内容物根据需要温育和/或混合,从而使活化的血液嗜中性粒细胞与cd64标记的抗体(也称为标志物)结合,从而形成具有cd64标志物310的活化的嗜中性粒细胞和/或具有cd64标记的抗体和cd163标记的抗体的单核细胞。不具有标志物314的淋巴细胞以及未受影响的rbc316存在于内容物中。
此后,将溶解试剂或稀释剂306引入至处理室112中。在溶解试剂的情况下,适用于溶解红细胞,从而形成溶解的红细胞324。此外,将参照/校准珠308加入至处理室中。这些用于校准输出,这可以参照下文中的图5a-5d来说明。
cd64(分化群64)为完整的膜糖蛋白类型,也称为fc受体,其以高的亲和性与单体的igg型抗体结合。与目前医学实践中使用的标准的诊断测试相比,嗜中性粒细胞cd64表达的定量提供了感染/脓毒病的改进的诊断检测。
cd163(分化群163)为cd163基因编码的人类蛋白质。此外,其已经显示标记了单核细胞/巨噬细胞系的细胞。
现在参照图4,其为方法的简化流程图400,所述的方法用于根据本发明的实施方案,检测与cd64细胞表面抗原有关的生物状况。
根据一些实施方案,所述的方法是在图1所示的并且如本文所述的仪器中实施的。在第一转移步骤402中,诸如血液样品之类的生物样本是通过样本接收元件118而吸入至样品组合物室104中,然后吸入至处理室112中。样品的体积通常为10-200μl。
在另一个步骤404中,将cd64和cd163的标记抗体的混合物加入至处理室112中,并与血液样品混合和温育。在该步骤的温育阶段,抗体与具有cd64标志物310的活化的嗜中性粒细胞和/或使用cd64标记的抗体和cd163标记的抗体312而活化的单核细胞结合。
在溶解试剂加入步骤406中,将溶解试剂加入至处理室中,从而溶解该室中至少一些rbc。
在任何合适的时间,通常在溶解步骤406之后,在参照珠加入步骤408中将参照珠加入至处理室的内容物中。
在预定的时间段后,实施分析步骤410来分析内容物的荧光放射特征。这可参照图5a-5d来进一步详细地描述。根据一些实例,评价室114可以构造和配置,从而允许细胞通过读数区130,这样每个从其中通过的细胞都单独地被分析。
现在参照图5a,其为根据本发明的实施方案,非活化嗜中性粒细胞特征500的荧光检测检验的图形输出,其中所述的检验与图3-4的方法有关。非活化的标记的嗜中性粒细胞在强度i1、波长w1下均发射信号502。
图5b显示根据本发明的实施方案,活化嗜中性粒细胞特征510的荧光检测检验的图形输出,其中所述的检验与图3-4的方法有关。各种活化的标记的嗜中性粒细胞在强度i2、波长w1下均发射活化的嗜中性粒细胞特征512。通常i2大于i1。在一些情况下,特征512和510的差异可以通过图像分析、荧光辐射计数或本领域已知的其他定性或定量方法来检测。本实例并非是限定性的。
转向图5c,可以见到根据本发明的实施方案,单核细胞特征520的荧光检测检验的图形输出,其中所述的检验与图3-4的方法有关。单核细胞特征包含在强度i3、第一波长w1下的第一信号522,以及在强度i4、第一波长w2下的第二信号524。
图5d显示根据本发明的实施方案,参照珠特征530的荧光检测检验的图形输出,其中所述的检验与图3-4的方法有关。参照珠特征包含在强度i1(类似于或等于非活化的标记的嗜中性粒细胞的信号502)、第一波长w1下的第一信号532,以及在强度i5、第一波长w3下的第二信号534。
该方法能通过cd64标签的特征512的强度来识别和定量活化的嗜中性粒细胞。单核细胞是通过双重信号特征522,524来识别的,其作为阳性对照。参照珠是通过在波长w3下独特的信号534来识别的。在波长w1下信号532的强度提供了用于与嗜中性粒细胞的512的强度相比较的cd64标签的参照水平。
不具有标志物330的淋巴细胞(图3)作为阴性对照,并且应该提供无荧光特征,而且可以通过它们的散射或其他特征来检测。这种检验过程的一些实施方案的其他细节在us8,116,984和davis,bh等人(2006)中有所描述。
现在参照图6,其为简化示意图,其显示根据本方面的实施方案,用于检测与血浆蛋白质有关的生物状况的方法600。
根据一些实施方案,所述的方法是在图1所示的并且如本文所述的仪器中实施的。诸如血液样品602之类的生物样本是通过样本接收元件118而吸入至样品组合物室104中,然后吸入至处理室112中。样品的体积通常为10-200μl。
血液样品通常为由患者最新移出的全血。全血主要包含红细胞(也称为rbc或红血球)、血小板和白血球(也称为白细胞)(包括淋巴细胞和嗜中性粒细胞)。血液样品包含至少一种蛋白质靶向抗原。例如根据bangs实验室产品数据表854的过程(用于流式细胞仪蛋白质g抗体结合珠编号554)来制备蛋白质抗体604覆盖的珠。
将珠604引入至处理室112中,此外,还引入血液样品602。因此在该处理阶段,有一些已经结合(血浆)蛋白质靶物612的珠,一些保持不具有任何结合的蛋白质靶向抗原610、未受影响的白细胞614、未受影响的血小板616和未受影响的rbc618的珠.
各种类型的抗体通常由特异性的荧光标签来标记。在一些情况下,荧光标签被设计成当抗体与抗原结合时而被活化。将室的内容物根据需要温育和/或混合,从而诱导抗原-抗体的结合。
此后,将血浆蛋白质荧光标记的抗体组合物606加入至室中,并混合/温育,由此形成在具有荧光标志物620的抗体珠上捕获的血浆蛋白质,以及未结合的珠619(与未结合的珠610相似或一致)。此外,未受影响的白细胞622与614相似或一致,未受影响的血细胞624与616相似或抑制,未受影响的rbc与618相似或一致。
此外,将参照/校准珠608加入至处理室中。这些用于校准输出,这可以参照下文中的图8a-8d来说明。根据下文中进一步详细描述的图7的方法,在具有fluor标志物628(与620相似或一致)的抗体珠上捕获的血浆蛋白质以及其他成分(未结合的珠629(与619相似或一致)、未受影响的血小板624(与624相似或一致)、以及参照珠636(与608相似或一致))现在准备进行评价。
图7显示方法700的简化流程图,所述的方法用于根据本发明的实施方案,检测与血浆蛋白质有关的生物状况.
根据一些实施方案,所述的方法是在图1所示的并且如本文所述的仪器中实施的。在第一转移步骤702中,诸如血液样品之类的生物样本是通过样本接收元件118而吸入至样品组合物室104中,然后吸入至处理室112中。样品的体积通常为10-200μl。
在另一个步骤704中,将血浆蛋白质抗体604覆盖的珠加入至处理室112中,并与血液样品温育。在该步骤的温育阶段,珠上的抗体与一些或所有的蛋白质靶向抗原结合,从而在抗体珠612上形成结合的血浆蛋白质。
在血浆蛋白质荧光标记抗体的另一个步骤708中,将血浆蛋白质荧光标记抗体606加入至处理室中。
在任何合适的时间,通常在加入步骤706之后,在参照珠加入步骤708中将参照珠加入至处理室的内容物中。
在预定的时间段后,实施分析步骤710来分析内容物的荧光放射特征。这可参照图8a-8d来进一步详细地描述。根据一些实例,评价室114可以构造和配置,从而允许细胞通过读数区130,这样每个从其中通过的细胞都单独地被分析。
现在参照图8a,其为根据本发明的实施方案,血浆蛋白珠的荧光检测检验的图形输出,其中所述的血浆蛋白珠不具有靶向结合特征800,并且所述的检验与图6-7的方法有关。未结合靶向抗原604的血浆蛋白质靶向珠在强度i1、第一波长w1下均发射信号802。
现在参照图8b,其为根据本发明的实施方案,未结合的标记抗体特征810的荧光检测检验的图形输出,其中所述的检验与图6-7的方法有关。
每个未结合的标记靶向抗体606在强度i2、第一波长w2下均发射未结合的标记靶向抗体特征810。
图8c为根据本发明的实施方案,血浆蛋白靶向珠的荧光检测检验的图形输出,其中所述的血浆蛋白靶向珠具有靶向结合特征820,并且所述的检验与图6-7的方法有关。
特征820包含在强度i3、第一波长w1下的第一信号822,以及在强度i4、第一波长w2下的第二信号824。通常i4大于i2。在一些情况下,特征812和810的差异可以通过图像分析、荧光辐射计数或本领域已知的其他定性或定量方法来检测。本实例并非是限定性的。
图8d为根据本发明的实施方案,参照珠特征830的荧光检测检验的图形输出,其中所述的检验与图6-7的方法有关。
参照珠特征包含在强度i5(类似于或等于标记的靶向抗体606,其在波长w2下放射未结合的标记的靶向抗体特征810)、第一波长w2下的第一信号832,以及在强度i6、第一波长w3下的第二信号834。
在分析步骤710(图7)的总结中,细胞可以单独通过读数区710。不具有结合的靶向蛋白质的珠604是通过w1下靶向珠荧光信号802的存在来识别的。荧光的总体水平测定了样品中蛋白质的水平。具有结合的靶向蛋白质的珠放射特征820(其为珠荧光信号w1,822(与802相似或一致)和夹心荧光标签w2,824),其如图8c所示。
参照珠608是通过独特的荧光w3信号834来识别的。将具有靶物结合特征820的血浆蛋白质靶向珠中w2的水平/强度与第一波长w2、强度i5下参照珠的第一信号832的水平/强度相比,从而测定样品中靶向蛋白质浓度的总体水平。
实施例
实施例1
应用no.1–cd64感染与脓毒病
制备用于接收血液样品的盒102(图1)。该盒包含多个处理组合物室106,108,110,其适用于分别容纳相应数量的处理组合物120,122,124。这些组合物在us8,116,984和davis,bh等人(2006)中进一步详细的描述,该文献以引用方式并入本文。简言之,试剂a包含鼠科单克隆抗体(包含缓冲的生理盐水)、试剂b(10x浓缩的延龄草裂解液(包含氯化铵))和试剂c(使用starfirered和异硫氰酸荧光素(fitc)标记的5.2μm聚苯乙烯珠的悬液(包含0.1%叠氮化钠和0.01%tween20))的混合物。
在样品转移步骤202(图2)中,将10ul血液样品通过接收元件118由外部仪器100转移至样品组合物室104中,然后在转移步骤214中,转移至处理室112中。
在组合物转移步骤204中,将包含cd64抗体的抗体组合物(试剂a)120通过转移元件107转移至处理室中。
使用本发明的盒102,这2步骤与混合步骤206结合花费大约4分钟。
此外,还加入溶解缓冲剂(试剂b)122,并与所得的混合组合物混合。使用本发明的盒102,该步骤以及混合所有的组合物花费大约3分钟。将参照珠(试剂c)308加入至处理室中。
评价室114可以配制并构造用于一个或多个评价步骤216。
根据一些实施方案,将所述的盒引入至kasdan等人的国际专利申请公开no.wo2011/128893中所述的系统中,所述的文献以引用方式并入本文。该系统具有随之携带的用于计算白细胞上cd64和cd163指数的软件。
然后,在结果输出步骤218中输出评价步骤的结果。根据本实施例,由引入少的血液样品至获得脓毒病的指示所花费的时间少于15分钟,通常大约10分钟(参见表2中现有技术与本发明的方法的比较)。
就使用者的观点来看,实施以下步骤:
a)使用者将血滴加入至盒102中并将其密封(通过微流体测量为10μl)。
b)挤压blistera(106),释放100μl试剂a。盒中的混合是通过盒操作单元(chu)控制的,然后进行4分钟的温育。
c)挤压blisterb(108),释放~250μl试剂b。盒中的混合是通过chu控制的,然后进行3-5分钟的温育。
d)启动磁性搅拌棒,搅拌珠悬液(试剂c)。
e)挤压blisterc(110),释放100μl试剂c。盒中的混合是通过chu控制的。根据一个实施例,试剂a为鼠科单克隆抗体在缓冲的生理盐水(以1:5稀释)中的混合物(pbs+0.5%bsa);试剂b为延龄草裂解液(在工作浓度下);试剂c为使用starfirered和fitc标记的5.2μm聚苯乙烯珠在pbs+0.01%tween20(以1:100稀释)中形成的悬液。
f)通过光电子核心读取样品,并收集数据。
g)自动分析数据并呈现结果。
h)该盒设置为生物危害的。
表2.现有技术的方法与使用cd64和cd163抗体来检测脓毒病的本发明方法的比较
实施例2
应用no.2–胎儿血红蛋白测试
如dziegiel等人所述(2006),使用包含组合物的盒来实施胎儿血红蛋白测试。该测试是使用图1-2以及6-8d中所述的方法来实施的。
根据一些实施方案,将所述的盒引入至kasdan等人的国际专利申请公开no.wo2011/128893所述的系统中,所述的文献以引用方式并入本文。该系统使用leukodx软件,从而分析所收集的并以与流式细胞仪列表模式的文件相似的格式储存的数据。由引入样品直至由该系统收到结果,该测试花费了大约10-15分钟。
应该理解的是,表1中所列的所有实例都可以使用本发明的盒并结合wo2011/128893的系统来实施。对于各应用而言,如相关参照中所述(表1),使用用于检验的组合物来预制不同的盒。体积及其稀释都经过优化。通常,样品总体积的范围为10至1000μl,100至900μl,200至800μl,300至700μl,400至600μl,或者420to500μl。
根据一些实施方案,处理组合物室106,108,110(也称为泡)的体积为大约1μl至1000μl。根据其他的实施方案,样本的体积为大约10μl至200μl。根据其他的实施方案,样本的体积为大约1,10,20,30,40,50,60,70,80,90,100,120,140,160,180,200,250,300,350,400,450或500μl。
根据一些实施方案,处理组合物120,122,124的体积最多为大约500μl。根据其他的实施方案,样本的体积最多为大约200μl。根据其他的实施方案,样本的体积最多为大约500,450,400,350,300,250,200,180,160,140,120,100,90,80,70,60,50,40,30,20,10或1μl。
根据一些实施方案,反应物的体积至少为大约1μl。根据其他的实施方案是,样本的体积为大约10μl。根据其他的实施方案,样本的体积至少为大约1,10,20,30,40,50,60,70,80,90,100,120,140,160,180,200,250,300,350,400,450或500μl。
盒102可以构造和配置,从而能够在平行的微通道上运行多个测试。
本设计的一个实施方案时是适用于3个泡,代表了3种不同的处理。这些处理可以为例如:a)通过荧光抗体(或抗体片段,fab)直接染色;b)rbc溶解;以及c)加入内部对照。
其他实施方案公开了通过一级抗体和二级抗体的二阶段染色,从而得到更强的信号;加入珠(例如磁性、金属、聚合物以及抗原结合珠),用于选择和检测特定的细胞、蛋白质、抗体、自身抗体和其他生物分子;组织样品分解细胞渗透(从而允许检测细胞内蛋白质);dna染色(能够进行细胞计数);rna染色(使用噻唑橙,由于网织红细胞可以通过它们高含量的rna而区别于红血球,所以能够进行网织红细胞计数);通过适体荧光染色和/或标记(可以与所选的靶物以高亲和性结合的单链dna或rna分子,其中所述的靶物包括蛋白质和肽);加入底物用于酶偶联反应(储存在分开的泡中,并且加入试剂时混合,所述的试剂例如为用于化学发光反应的hrp缀合的抗体);以及加入用于洗涤的缓冲剂(注意洗涤步骤需要进一步设计所述的盒)。
此外,本发明包含盒本身的处理,例如但不限于可以使溶液在床上前后通过以增加捕获的效率,从而可以使用固定化的选择性的珠;用于细胞尺寸、分子尺寸的过滤器;以及配体结合的过滤器(可以进行洗涤步骤和/或群体选择)。
此外,所述的样品还包含生物组织,其需要机械分解组织样品的另一个步骤。例如将皮肤活组织检查样品加入至专用的口中。将该口密封,并且一个泡加入液体缓冲剂。专用的风箱推动该混合物,并通过多次推拉循环或者通过网状物压制来分解所述的组织。
此外,本发明的盒还可以用于食品/环境的安全评价:食品/饮料样品的细菌检测(还可能进行过敏原检测)以及在环境样品中测量活细菌。
根据一些实施方案,读数可以包含光电子核心,其能够识别和检测荧光信号。
此外,用于聚焦的核心中的ccd还可以用于读取化学发光信号。此外,使用者读值还可以指示所得结果相对于参照范围所落入的区域。
如本文的表中可见,本发明的系统、仪器、盒和方法有许多应用,并且本文所述的实施例不应该被看作是限定性的。
现在参照图9,其为简化示意图,其显示根据本方面的实施方案,用于检测化学或生物化学个体的微流体仪器900。
仪器900为试剂盒,其包含盒902和多种化学/生物化学反应物,其在本文中称为处理组合物。该处理组合物适用于(至少部分)与引入至仪器中的生物样本970(例如肌体样本)反应。肌体样本可以为体液,例如但不限于血液,血清,血浆,尿,唾液,脑脊液(csf),浆液,腹膜液和滑液。此外或备选地,肌体样本可以为固体,例如头发、牙齿的部分、骨骼的部分或一些软骨。
化学样本可以选自例如液体样品、固体样品、悬液、胶体、组合物、离子溶液或者本领域已知的任何其他合适的样品。
仪器900包含样本接收元件918,其适用于将样本转移至样品组合物室904中。样品组合物室包含一个或多个转移元件905,其适用于将样本由样品组合物室转移至盒内的一个或多个其他的位置。在图9所示的非限定性实例中,转移元件905为导管,其在第一末端913处与处理室912流体连通。
此外,所述的盒包含多个处理组合物室906,908,919,其适用于分别容纳相应数量的处理组合物920,922,924。这些处理组合物可以为液体、固体或它们的组合。仪器900通常作为试剂盒(其中设置有处理组合物)在市场上出售。在一些情况下,所述的试剂盒可以适用于一次性测试,并且可以为一次性试剂盒。在其他情况下,该试剂盒可以重复使用。可重复使用的试剂盒可以适用于接收其他的外部组合物(未示出),或者可以具有多种处理组合物,其中对于每次测试仅使用一部分。
盒902进一步包含气体保持隔间901,其适用于包含空气950和/或其他气体。在一些情况下,该气体可以为惰性的,例如氮气。
每个处理组合物室906,908和919具有至少一个各自的导管907,909,910,其与处理室912流体连通。
根据一个实施方案,导管907,909和910与处理室以固定相等的间隔平行设置。
根据另一个实施方案,导管907,909和910与处理室以固定不等的间隔平行设置。
可以使用通过转移元件将处理组合物室和样品组合物室的内容物转移至处理室的多种方法,其中的一些方法是微流体技术中已知的。这些方法包括鼓风、抽吸、真空处理、机械转移、泵送等。
盒902进一步包含至少一个转移元件913,其与处理室912和评价室914是流体连通的。
可任选地,评价室914与转移元件915是进一步流体连通的,所述的转移元件915适用于将评价室的内容物清理至盒的外部。备选地,评价室可以不具有外部清理手段。
根据一些实例,评价室914可以构造和配置,从而允许一些或所有的经处理的样品通过读数区930。
根据一些实施方案,流体转移元件915与至少一个真空泵或风箱940是流体连通的。
仪器900可以构造并配置,从而通常通过启动泵940将少量的气体引入至处理室中。此后,将少体积的样品966引入至处理室中。空气以及另外的少量的样品964,962,960可以多次交替引入。
根据一些实施方案,处理室可以构造并配置用于接收特定的处理组合物以便仅用于少量的样品。例如如附图所示,组合物924引入至少量的样品966中,组合物922引入至少量的样品964中,以及组合物920引入至少量的样品962中。少量的样品960保持未处理的,并且可以作为对照。
根据一些其他的实施方案,处理室可以构造并配置,从而接收特定的处理组合物以便依次用于所有少量的样品。例如少量样品966进入在第一末端913的处理室,并通过泵940拉至与导管907具有流体连通性的位置处,并且接收少量的处理组合物920。然后移动至与导管909具有流体连通性的位置处,并且组合物922被引入至其中。此后,样品966移动至与导管910具有流体连通性的另一个位置处,并且组合物924被引入至少量样品966中。此后,少量的样品966通过导管913进入至评价室的读数区930。
读数区可以构造并配置,从而使多种不同的检测机制受到影响。检测机制的一些非限定性实例包括:
f)图像捕获
g)图像分析
h)光学检测
i)动力学研究检测
j)声音检测
k)体积检测
l)气体检测
m)色谱
光学检测可以为人类视觉检测,人类显微镜检查或自动化的机械光学检测。光学检测可以涉及检测至少光学输出信号的一种或多种。输出信号可以选自传输信号、吸收信号、反射信号、折射信号或它们的组合。
光学检测可以使用位于盒外部的光学元件和系统。这些可以包括例如光学显微镜、图像分析仪、电子显微镜或本领域已知的任何其他的系统。
在实施评价后,少量样品可以保留在所述的室中或者通过导管915清除。
现在参照图10,其为方法的另一个简化流程图1000,所述的方法用于根据本发明的实施方案,检测化学与生物化学个体。
应该理解的是该方法的每一步都可以花费预定的时间段来实施,并且在这些步骤之间可以为温育和/或等待步骤,为了简化,图中未示出。在样品转移步骤1002中,诸如化学样品样本970之类的样品通过接收元件918由外部仪器900转移至样品组合物室904中。根据一些实施方案,样本或样品的体积为低于200μl,低于100μl,低于50μl,低于25μl或低于11μl。
在泵启动步骤中,将泵940启动一段时间。
在样品引入步骤906中,将第一少量的样品966引入至处理室中。样品966的体积可以为例如低于50-100μl,25-50μl,10-25μl,或者0-10μl的范围。仪器可以包含硬件和软件元件(未示出),如本文领域已知,所述的元件能够预先编制泵940的程序。例如所述的泵可以以规则的预定时间间隔打开和关闭,这样在任何时间,仅少量的样品970可以被引入至处理室中,例如少量960。可以进一步驱动所述的泵,将空气380引入至所述室的少量样品950中,从而在不同的少量样品960,962,964和966之间之间进行清洁和分离。
在空气引入步骤1008中,少量的空气950通过空气管线903由容器901转移至处理室中。少量空气样品950的体积可以为例如低于50-100μl,25-50μl,10-25μl或0-10μl的范围。空气分离了所处理的等分物并清洁了通道,从而防止滞留(carryover),如本领域已知的那样(skeggs,1964,1966)。
步骤1006,1008可以重复多次。可以存在决定步骤1010,以决定是否重复这些步骤。
在处理组合物转移步骤1012中,一种或多种处理组合物通过转移元件/管线907,909,910而转移至处理室的特定区域。引入至各少量样品中的处理组合物的数量取决于所实施的检验/测试的本性。如上文提及的那样,可以依次使用一种特定的组合物或组合物的组合来处理少量的样品。此外,各处理组合物920,922,924均可以包含多种不同的试剂、标志物、辅助因子、催化剂、酶和它们的组合。
在一些情况下,可以存在至少一种设置于处理室中的其他处理组合物或液体(未示出)。
根据处理组合物的本性和样品/样本类型,可能需要在可任选的混合步骤413中混合或搅拌处理室中的内容物(未示出)。
在一些情况下,可以同时实施这些步骤1006,1008,1010,1012中的一些步骤。
在第一转移步骤1014中,第一较少的样品966在使用组合物924处理后被转移至评价室中。
评价室914可以配制并构造用于一个或多个评价步骤1016中。这些可以包含以下步骤的任意组合或排列:
n)其中通过的辐射的转移;
o)随即发生冲击辐射;
p)检测反射的和/或折射的辐射;
q)检测发射的辐射;
r)捕获其一个或多个图像;
s)对捕获的图像实施图像分析;
t)测量处理样本的电学特征;
u)随即发生冲击声能;
v)检测其中的声能;以及
w)分析上述任意一个或多个步骤的输出。
根据一些实施方案,将所述的盒引入至kasdan等人的国际专利申请公开no.wo2011/128893所述的系统中,该文献以引用方式并入本文。
步骤1014,1016可以多次重复。可以存在决定步骤1018,以决定是否重复这些步骤。例如可以依次对各个少量的样品966,964,962和960实施评价步骤1016。此外或备选地,可以对相同的样品对此实施评价步骤,以便测定动力学数据等。
此外或备选地,可以再读数区的一个位置处实施评价步骤,或者可以在读数区的多个连续的位置处实施评价步骤。
然后,在结果输出步骤1020中输出评价步骤的结果。
根据一些实施方案,所述的仪器可以具有用于显示结果的机载手段,例如比色试纸(未示出)。此外或备选地,所述的结果在显示单元中显示,其与仪器900分开并远离。
使用仪器100或仪器900完成检验所需的时间根据多种因素改编,其非限定性实例包括本发明所述的那些。在一些实施方案中,完成检验所需的时间为大约0.5至100分钟。在其他的实施方案中,完成检验所需的时间为大约1至20分钟。在其他的实施方案中,完成检验所需的时间为大约1至10分钟。在一些实例中,完成检验所需的时间为大约1,2,3,4,5,6,7,8,9,10,15,20,25,30,35,40,50,60,80或100分钟。
现在参照图11,其为简化示意图,其显示根据本方面的实施方案,用于检测和定量血清样品中葡萄糖、蛋白质和白蛋白的方法。这些测试用于举例说明,不应该视为限定性的。这些测试的详情可以在schwartzetal.,1974中找到。
根据一些实施方案,所述的方法是在图9所述的并且在本文所述的仪器900中实施的。诸如血液样品之类的样本是通过样本接收元件918而吸入至样品组合物室904中,然后吸入至处理室912中。样品的体积通常为10-200μl。
血液样品通常为由患者最新移出的全血来制备。此外,还将空气901引入至处理室中。
如图9所示,第一少量的样品(血清966)显示位于处理室的第二末端917附近。在时间0(t0),处理组合物未与样品966混合。
在时间0(t0)之后的时间t1,第一组合物(产生葡萄糖显色的试剂gcpr1124)在样品1166(与其中的葡萄糖反应(可能的话))中反应,从而形成与gcpr1166反应的葡萄糖。任何蛋白质1164、白蛋白1162和其他分析物1160保持未处理,因此未受影响。
在t1后的时间,例如t2,产生蛋白质显色的试剂pcpr1122与另一种样品1164(与其中的蛋白质反应(可能的话))反应,从而形成与pcpr1104反应的蛋白质。任何葡萄糖1102、白蛋白1106和其他分析物1108保持未处理,因此未受影响。
在t2后的时间,例如t3,产生白蛋白显色的试剂acpr1120与另一种样品1162(与其中的蛋白白反应(可能的话))反应,从而形成与acpr1116反应的白蛋白。任何葡萄糖1112、蛋白质1114和其他分析物1118保持未处理,因此未受影响。
然后,使用schwartz等人,1974所述的比色方法(例如在评价室914的检测区930)来检测在样品1166中与gcpr1166反应的葡萄糖,在样品1164中与pcpr1104反应的蛋白质,以及在样品1162中与acpr1116反应的白蛋白。可以使用在kasdan等人的国际专利申请公开no.wo2011/128893中所述的系统来实施检测。
表3示出了本发明的仪器100和方法的一些代表性化学应用。
表3.本发明的仪器和方法的化学应用
现在参照图12a,其为根据本发明的实施方案,用于检测生物状况的读取器组件1200和盒1210的简化三维正视图1201。
图12a中示出了读取器组件1200和盒1210。如所示,所述的盒插入至读取器组件中。一旦所述的盒被插入读取器组件中,则将自动地实施所有检测的与分析处理和分析。分析的结果示于使用者界面触摸屏1215上,其还用于控制读数人的操作。
图12b为根据本发明的实施方案,用于检测生物状况的读取器组件1200的简化三维内部正视图1203。
读取器组件的内部构件示于图12b中。可见左侧侧视图1220,其显示出itx计算机1222,galil电动机控制器1224,电子电源1226,插入至盒操作单元(chu)128中的盒110,以及向前散射检测器1230。此外,可见右侧侧视图1240,其显示读取器光学1242,数据获取板1244,以及常规的电子印制电路板1246。
图13a为根据本发明的实施方案,盒组件1300的外部侧视图,以及图13b显示根据本发明的实施方案,盒组件1300的内部侧视图1350。
图14a-14o显示根据本发明的实施方案,盒组件1400(在用于检测生物状况的仪器100的操作中(图1))中处理事件的顺序。在图14a中,血液样品1401进入样本接收元件1418,并充满室1404。
在图14b中,包含处理组合物120(图1)的泡1420被挤压,并且抗体混合物与10微升(μl)的血液样品混合。
在图14c中,混合风箱1415被挤压,这影响了抗体混合物与10微升血液样品在第一混合室1412中的混合,从而形成第一混合物1403。
在图14d中,风箱被释放,混合物1403沿着扭曲的通道1413被虹吸,并进入第二混合室1411中。在风箱被释放时,第一混合物由第二混合室沿着扭曲的通道返回至第一混合室中。每次风箱被挤压时,混合物都向第二室移动,并且每次风箱被释放,混合物都完全或部分返回至第一室中。这种混合可以多次实施。
图14e-14g中,第二组合物泡1422被挤压,从而释放第二组合物122(图1)(例如溶解组合物),从而形成第二混合物1405。第二混合物通过加压风箱1415进行混合,第二混合物沿着扭曲的通道1413由第二混合室返回至第一混合室。每次风箱被挤压,混合物都向第二室1411移动,并且每次风箱被释放,混合物都完全或部分返回至第一室1412中。这种混合可以多次实施。
在图14h-14j中,包含第三组合物124(图1)(例如对照参照物)的第三泡1424被释放至第二混合室中,由此形成第三组合物1407。第三混合物通过挤压风箱1415进行混合,第三混合物沿着扭曲的通道1413由第二混合室返回至第一混合室中。每次风箱被挤压,混合物都向第二室1411移动,并且每次风箱被释放,混合物都完全或部分返回至第一室1412中。这种混合可以多次实施。
在图14j-14m中,挤压读取风箱1417,其迫使第三组合的一部分趋于读取小管1430。
在图14n-14o中,由第三组合物得到的颗粒1460沿着通道1452由所述的小管1430流向读取区1450。细胞通过读取趋于,并被一束或多束激光1462,1463激发。至少一个激发激光束1464冲击在细胞1460上,并通过检测器1470来检测放射束1466。在一个实例中,这为细胞放射荧光,并且检测器1470为分光光度计。
图15为根据本发明的实施方案,微流体分光光度计读数的示意图。
单个细胞1505在微流体通道(未示出)中流动通过检测区1510。此外,使用与多波长荧光标签缀合的抗体而标记的靶向细胞1520流动通过检测区。二极管激光器1530将光线/光束1510冲击在细胞和靶向细胞上。细胞和靶向的细胞放射不同的发射光谱(未示出)。光栅1540通过栅格1540将发射光谱分散在其构成波长1550中。
光电倍增管(pmt)阵列1560或雪崩二极管阵列在相当于8个光谱区域的8个不同的空间位置处检测荧光。
图16显示读取器光学组件的主要模块构件。除了顶视图1622以外,可见光学组件的完整的侧视图1620。激光单元1603在其散热组件中包含激光以及光束扩展器。需要光电倍增器(pmt)组件1602…..1605-1611的其他详情。
图17显示光电倍增器(pmt)组件的细节。pmt组件的侧面和底面分别显示为侧视图1770和底视图1772。pmt组件的主要元件包含pmt盒1751,pmt光栅组件1752,pmt桥接组件1755,pmt盖组件,pmt单元1759,pmt透镜组件1760,pmt针孔螺帽1761,针孔1762,针孔罩1763,以及调节杆1765。
图18a显示根据本发明的实施方案,读取器光学组件1810、盒操作单元1812和前向散射检测单元1814。
图18b显示根据本发明的实施方案,完整的读取器光学组件1842的右视图。
图18c显示根据本发明的实施方案,读取器光学组件的左视图。
图18d为根据本发明的实施方案,前向散射检测组件1830。该组件包含:led1852,用于在自动聚焦过程中照明读取通道(读取区130,图1);堵塞1858,用于阻挡低角散射;以及透镜1856,用于收集检测光电二极管(例如(pmt)阵列1560,图15)的所需的前向散射。
图18e为根据本发明的实施方案,前向散射检测组件1830的侧视图。该图中显示照明透镜1850、收集透镜1856,1857和1858、以及检测光电二极管1860。
图19a显示根据本发明的实施方案,读取器组件1930的剖视图。读取器组件的这种剖视图显示其前面和左侧上的构件。这些构件包含itx板1922,盒操作单元1928,以及前向散射检测组件1930。
图19b显示根据本发明的实施方案,读取器组件1905的拆分右视图。该图中的3个主要的构件为读取器光学组件1942,盒操作单元1928以及前向散射检测模块1930。
图19c显示根据本发明的实施方案,读取器组件的左视拆分图。该图显示itx计算机板1922,盒操作单元1928,前向散射检测模块1930,以及读取器光学组件1942的另一侧。
图19d显示根据本发明的实施方案,盒操作单元(chu)1928的后视图。在该图中,可以看见插入盒1910的手柄1901。其中配置传感器1912,从而检测发动机1910和执行器1914的位置(其适用于压制泡106,108,110(图1)或420,1422,1424(图14a-14l)),以及在发动机的柄上可以看见用于操作风箱(940,图9,1415,1417,图14a-l)执行器1916。提供开口1918用于显微镜的物镜2138(图21a),从而观察盒上的读取通道。
图19e显示根据本发明的实施方案,盒操作单元(chu)的正视图。该图显示盒操作单元(chu)1928的正视图。在该图中,可以看见盒1910上部的手柄。提供了用于观察微流体路径的部件1920。该部件通过照相机1930观察,以便确保盒内进行正确操作。提供另一个开口1940用于前向散射离开盒操作单元,并可以通过前向散射检测组件1930观察。
图19f显示根据本发明的实施方案,读取器光学组件1999的拆分图。
图20为根据本发明的实施方案,用于医学状况快速测定的一次性盒2050的简化图。
一次性盒2050适用于接收体积流体,例如但不限于血液,尿,血清或血浆。一次性盒可以构造并配置,从而具有多个不同的部分2052,2054,2056和2058。部分2052为体液吸入部分,其适用于由患者(或动物)直接或间接接收体液,并且这部分可以用作体液的贮液器。
一次性盒2050在所述的多个部分之间包含流体传输手段,例如但不限于空气压力、液体压力、机械手段和它们的组合。体液吸入部分2052适用于将预定量的体液(体液样品2051)传输至预分析样品处理部分2054。
在预分析样品处理部分2054中,在体液上实施至少一个预备步骤,例如但不限于:
1)与至少一种抗体温育;
2)与至少一种抗原温育;
3)体液中至少一种类型的细胞的染色;
4)体液的至少一种类型的细胞的酶溶解;
5)体液的至少一种类型的细胞的渗透溶解;
6)加热或冷却体液的至少一部分;
7)将参照材料加入体液中;以及
8)与体积流体的至少一种元素发生化学反应。
然后,将体液的预处理样品由预分析样品处理部分2054传输至样品激发/相互作用的区域或部分2056。这种预处理样品可以以连续的或分批的模式传输至样品激发/相互作用的部分2056。
图21a为根据本发明的实施方案,读取器光学组件2100的光学排布的简化示意图。
激光2140或其他合适的光源提供光束2142,其可以定向于多个光学元件,包括二向色滤光片2143,光束分裂器2144,聚焦透镜2145,针孔2146,以及硅读取器单元2147,用于记录朝向样品2150定向通过物镜2138并返回至光学单元的光束2142得到的信号。其他的光学元件可以包括光学衰减器2148,高通滤光片2149,聚焦透镜2151,狭缝2152,凹光栅2153,以及pmt阵列2154。
元件的这种排布(代表了本发明的实施方案)可以用于激发光生成,将其聚焦在样品上,收集样品中由激发光与荧光团的相互作用而得到的光信号,并记录所述的返回的光,以便测定样品响应于由激光2140得到的光照而产生的荧光。
参照图21a,激光照明2142被二向色滤光片2143反射通过物镜2138,并聚焦在包含流动颗粒2158的通道上。该照明激发了附着在蛋白质标志物上的荧光团,其中所述的蛋白质标志物与所述的细胞结合。所得的荧光照片被物镜2138收集,并且由于更长波长的这种辐射通过二向色滤光片2143,并被光束分裂器2144反射通过高通滤光片2149。高通滤光片阻挡了任何反射的激光照明。聚焦透镜2151将多波长辐射照明聚焦在狭缝2152上。凹光栅2153在多波长下通过狭缝成像在pmt阵列2154的元件上。这完成了创建荧光辐射的多谱线检测的过程。尽管物镜收集的大部分照明被光束分裂器2144反射,但是允许一小部分通过,并通过聚焦透镜2145通过针孔2146聚焦在硅读取器元件2147上,其可以为单一光电二极管或焦平面阵列,例如ccd传感器。
在聚焦操作过程中,当该读取器单元2147上的信号最大时,取得最佳焦点。当该信号最大时,pmt阵列2154上的信号强度也最大。
现在参照图22a,其为根据本发明的实施方案,在图21a或21b的光学单元中多波长激发的一个实例的示意图2200。图22a-22c显示图21a和21b中光学构造的扩展,从而允许多激发的波长。
图22a显示用于结合不同波长的多重激光从而产生包含所有波长的单一同轴光束2214的构造(参见附图)。可以使用二向色镜2204结合2种不同的波长,例如绿色2202和红色2206。光束之一,红色2206被二向色镜反射,而第二光束,绿色2202通过二向色镜,从而产生包含2种波长的单一光束2208,黄色。这种结合波长的光束现在可以用作朝向第二二向色镜2210的输入之一,其中第三波长2212被第二二向色镜反射,从而产生包含所有3个波长的单一同轴光束2216。
现在参照图22b,其显示根据本发明的实施方案的传输的图形输出2220,其为用于图22a的二向色滤光片2200的波长的函数,其中使用图22a的多波长激发。与图22c的镜子2252相似或抑制的多波段二向色镜(未示出)用于通过物镜2254照明样品(图8c),同时允许所得的辐射在所有波长下都通过二向色镜2252,除了多光束激发2214的那些(图8a)。按照这种方式,使用单一波长的相同的epi-构型事实上可以对二向色镜2252适当地改变,并加入多重激光2202,2206,2212,从而提供多波长激发,同时实际上保持单一激发系统的所有检测波长。
转向图22c,可见根据本发明的实施方案,光学单元的部件2250的示意图,其中使用了图22a的多波长激发以及图21a的二向色滤光片。在一些情况下,部件2250可以替代亚系统2175(图21b)。
表4.用于本发明的代表性构件的代表值
尽管很多之前的讨论集中于本发明一些实施方案的光学元件,但是本文所提出的诊断系统的重要构件之一为一次性样品盒。
现在参照图23a,其为根据本发明的实施方案,图19a的取样盒110或102(图1)的示意图。盒2350包含预分析构件2352,样品(未示出)可以引入至其中。
所述的样品通常为全部或部分(血清等)的血液。另外或备选地可以使用其他液体样品。在预分析构件2352中,允许样品与预包装于构件2352中的化学品相互作用。该相互作用可以是被动的,或者包括主动混合。
在分析构件2352中包含的化学品可以为湿态或干态,并且通常包含与荧光探针结合的抗体。可以针对于预定的生物标志物等的结合能力来预先选择抗体。在典型的试验中,预定量(通常少于50微升)的血液被引入至一次性盒2350的预分析构件2352中。
将所述的样品与预分析构件2352中存在的化学试剂主动混合预定的时间段,通常少于10分钟。然后通过即将讨论的手段使所述的样品移动通过毛细管区域2353,在此,其暴露于由物镜2338传递的光束2342。在毛细管区域2352中,样品流动的方向通过箭头显示。
毛细管区域2353被设计成可以使颗粒流以单行通过光束2342。这种排布可以计数颗粒的数量以及对颗粒的单独查询,从而测定各颗粒上生物标志物的存在情况(通过它们相关的荧光标签)。此类物理排布允许检测各颗粒上一种或多种生物标志物(而与颗粒特定的性质无关,例如大小、形状和数量)。
最后,具有收集构建2354,其接收暴露于光束2342后的样品。这是废物区,并且可以是完全自容式的清除,以用于样品制备、分析和废物收集。注意一次性盒可以为任何相关的形状,并且为了理解其构件和功能,如图20所示。
如上文提及的那样,在预分析处理从而允许荧光标签与细胞/颗粒结合后的样品必需在光学单元产生的光束2342下流动(未示出)。这种流动通常为“单行的”,从而允许精确地测定各分析细胞上的细胞特异性标志物。诱导流动的方法包括但不限于电学刺激、化学诱导和真空拉动。在电学刺激系统中,在跨越毛细管区域2353上施加电荷,从而诱导电荷颗粒由预分析构件2352向收集构件2354移动。可以通过细胞计数器施加电荷,一次性盒2350可以放置于其中或者是外部来源的。
备选地,毛细管区域可以包含促进样品由左侧向右侧移动的化学特征(亲水性/疏水性;正电荷/负电荷),如图23a所示。备选地,可以对收集构件2354施加真空,从而由预分析构件2352将样品拉动通过毛细管区域2353。可以使用其他方法使液体样品在光束2342之下移动,以用于分析。
如本文所述,光学和样品处理可以分别处理。此类排布并非是强制的,在一次性盒中可以包含适当样品分析所必需的一些光学特征。
现在参照图23b,其显示根据本发明的实施方案,在流式细胞仪装置中一次性盒2300(例如系统100)的示意图。现在注意力转向图23b,其显示毛细管区域2353的放大图。在毛细管区域2353中,颗粒2390沿着箭头2380所示意的方向流动。
颗粒2390流动通过物镜2338,其发出光2342通过毛细管2353。流动限制元件2394可以存在于毛细管区域2353中,从而促进颗粒2390以几乎单行的方式移动通过光2342。多个颗粒一起通过可以通过处理软件分辨。
可以通过光2342照明颗粒2390上的分子标志物2395,并且其荧光将被临近的光电倍增管2399捕获。光电倍增管2399可以区分荧光的波长,因此生物标志物2395存在于颗粒2390上。因此,本发明的系统可以测定哪些生物标志物存在于颗粒2390上,其可以在本发明的系统中检测。光电倍增管2399可以具有用于区分精细波长的多个管或元件的阵列,并且备选地,可以使用薄膜、ccd或其他合适的光接收读取单元来替代该光电倍增管2399。应该理解的是在传输构造下,图23b显示系统1200的构造(图12)的一个实施方案,其中检测器(光电倍增管2399)设置于盒2300的物镜2338的对面。
本发明的系统包含适用于运行诊断过程的控制软件。应该理解的是控制软件可以为流式细胞仪的整合部件,或者备选地,安装于相关的计算装置中(参见图1和12a),其可以包括但不限于笔记本电脑、ipod、ipad、手机或大型计算机。
现在参照图24,其为根据本发明的实施方案,用于医学状况快速测定的方法的简化流程图2400。应该理解的是,本发明所述的方法描绘了用于测定患者健康状态的本发明的一个非限定性实施方案。此外,其他实施方案也可以解释为本发明的一部分。
在体液提供步骤2402中,诸如血液、尿、血清或血浆之类的体液由人类或动物患者提供。通常,所述的样品为新鲜的,但是也可以是储存的、冷冻的或冻融的样品。所述的流体通常为液体,并且在4-37℃的温度下。
在体液引入步骤2404中,部分或所有的体液样品2051(图20)被引入至一次性盒中(102,图1)。
在反应步骤2406中,流体样品在盒中与至少一种反应物反应,从而形成处理的样品。根据一些实施方案,该步骤是在预分析样品处理部分2054(图20)中实施的,如下文中详细描述的那样。
在冲击步骤2408中,辐射冲击在处理的样品上,例如但不限于样品激发/相互作用部分2056,由此在光学单元1242的方向上形成多个光谱不同的信号(图12c,参见上文所述)。
在光谱辐射监测步骤2410中,多个光谱不同的信号由多个辐射检测器2154(图21a)检测。检测剂输出数据。
此后,在数据处理步骤2412中,输出数据由信号处理器2036(图20)和/或计算机1222(图12c)来处理,从而提供表示医学状况的输出。
图25为根据本发明的实施方案,显示参照珠(rm)相对于由人类患者得到的样品(pmn)而言,在经过一定时间后光学输出的三维图。
图25显示根据本发明的实施方案,显示参照珠(rm)相对于由人类患者得到的样品(pmn)而言,在经过一定时间后光学输出的三维图。在6个波段(500-525nm,525-550nm,550-575nm,575-600nm,600-625nm以及625至650nm)中,辐射的振幅示于适用于各样品的时间的图中。不同的荧光团具有不同的辐射光谱。可以理解的是在各波长下光谱含量或形状、以及振幅都与使用吖啶橙(ao)染色的嗜中性粒细胞和包含明亮的光谱荧光团的参照珠(rm)明显不同。ao辐射的峰为525-550nm波段,而rm的峰为500-525nm波段,并且在任何波段中都比ao具有明显更大的振幅。
图26a-26c显示根据本发明的实施方案,参照珠和由人类患者得到的样品在经过一定时间后光学输出的图。
转向图26a-26c,可见根据本发明的实施方案,参照珠和由人类患者得到的样品在经过一定时间后光学输出的图。在这些二维附图中,由各波段得到的踪迹叠加在相同的图上。图26a显示图26b中由嗜中性粒细胞得到的额框中的脉冲。
由这些图可见,525-550nm通道中的振幅超出了500-525nm通道中的振幅,其为ao的特征。图26c显示ao染色嗜中性粒细胞发射光谱与rm发射光谱的比较。500-525nm波段中光谱的相对振幅与525-550nm波段中的相对振幅明显区分为2个荧光团。此外,rm发射的最大振幅显著大于ao的最大振幅。
本发明所述的并示出的本发明的系统提供了用途,例如但不限于4个以下设想的情况中的至少一种:
a)当为了作出精确的诊断测定而需要多重信息(例如生物标志物和白细胞状态)时;
b)当为了测定患者在疾病曲线上的位置时必须进行多种相继的测量时;
c)当快速需要白细胞和相似数据并且处于poc环境下时;以及
d)当在波长中荧光信号重叠并且对于给定的波长范围需要测定各信号的相对贡献时。
本发明的系统、试剂盒、方法、仪器和盒以及优先权文件为许多实验室应用提供了非常有用的平台。下文的列举是示例性的,并且不应视为限定性的。
本发明的系统、试剂盒、方法、仪器和盒可以用于细胞表面标志物,例如cd64检验(参见us8,116,984,和davis,bruceh等人的"neutrophilcd64isanimprovedindicatorofinfectionorsepsisinemergencydepartmentpatients."archivesofpathology&laboratorymedicine130.5(2006):654-661;hoffmann,johannesjml."neutrophilcd64asasepsisbiomarker."biochemiamedica21.3(2011):282-290)。
本发明的系统、试剂盒、方法、仪器和盒可以用于细胞表面标志物,例如cd64检验细胞表面标志物,例如cd4/cd8检验(参见crowe,suzanne,etal."monitoringofhumanimmunodeficiencyvirusinfectioninresource-constrainedcountries."clinicalinfectiousdiseases37.supplement1(2003):s25-s35)。
本发明的系统、试剂盒、方法、仪器和盒可以用于干细胞识别(参见nielsen,julies.,andkellym.mcnagny."novelfunctionsofthecd34family."journalofcellscience121.22(2008):3683-3692)。
本发明的系统、试剂盒、方法、仪器和盒可以用于微小残留病灶检验(参见rawstron,a.c.,etal."internationalstandardizedapproachforflowcytometricresidualdiseasemonitoringinchroniclymphocyticleukaemia."leukemia21.5(2007):956-964;rawstron,andyc.,etal."reportoftheeuropeanmyelomanetworkonmultiparametricflowcytometryinmultiplemyelomaandrelateddisorders."haematologica93.3(2008):431-438.;brüggemann,m.,etal."standardizedmrdquantificationineuropeanalltrials:proceedingsofthesecondinternationalsymposiumonmrdassessmentinkiel,germany,18–20september2008."leukemia24.3(2009):521-535.;rawstron,a.c.,etal."improvingefficiencyandsensitivity:europeanresearchinitiativeincll(eric)updateontheinternationalharmonisedapproachforflowcytometricresidualdiseasemonitoringincll."leukemia27.1(2012):142-149.;
本发明的系统、试剂盒、方法、仪器和盒可以用于淋巴细胞亚型分型(参见blue,marie-luise,etal."coexpressionoft4andt8onperipheralbloodtcellsdemonstratedbytwo-colorfluorescenceflowcytometry."thejournalofimmunology134.4(1985):2281-2286.;lanier,lewisl.,andmichaelr.loken."humanlymphocytesubpopulationsidentifiedbyusingthree-colorimmunofluorescenceandflowcytometryanalysis:correlationofleu-2,leu-3,leu-7,leu-8,andleu-11cellsurfaceantigenexpression."thejournalofimmunology132.1(1984):151-156.;mercolino,thomasj.,etal."immunologicdifferentiationofabsolutelymphocytecountwithanintegratedflowcytometricsystem:anewconceptforabsolutetcellsubsetdeterminations."cytometry22.1(1995):48-59.;comans-bitter,w.marieke,etal."immunophenotypingofbloodlymphocytesinchildhoodreferencevaluesforlymphocytesubpopulations."thejournalofpediatrics130.3(1997):388-393.;inghirami,g.,etal."flowcytometricandimmunohistochemicalcharacterizationofthegamma/deltat-lymphocytepopulationinnormalhumanlymphoidtissueandperipheralblood."theamericanjournalofpathology136.2(1990):357)。
本发明的系统、试剂盒、方法、仪器和盒可以用于t亚型和自然杀伤(nk)亚型的亚型分型。
本发明的系统、试剂盒、方法、仪器和盒可以用于bo21白细胞分化分析(参见kass,lawrence."metachromaticdyesorptionandfluorescentlightemmisivemeansfordifferentialdeterminationofdevelopmentalstagesofneutrophilicgranulocyticcellsandotherleukocytes."u.s.patentno.4,500,509.19feb.1985)。
本发明的系统、试剂盒、方法、仪器和盒可以用于细胞周期分析、细胞增殖检验、细胞因子检测等。
本发明的系统、试剂盒、方法、仪器和盒可以用于使用碘化丙啶和/或其他染料来检测细胞凋亡。
本发明的系统、试剂盒、方法、仪器和盒可以用于血浆蛋白质检验(参见cheng,ann-joy,etal."oralcancer血浆tumormarkeridentifiedwithbead-basedaffinity-fractionatedproteomictechnology."clinicalchemistry51.12(2005):2236-2244)。
本发明的系统、试剂盒、方法、仪器和盒可以用于溶液改变(颜色、浊度等,参见bonini,pierangelo,etal."errorsinlaboratorymedicine."clinicalchemistry48.5(2002):691-698.;legrand,c.,etal."lactatedehydrogenase(ldh)activityofthenumberofdeadcellsinthemediumofculturedeukaryoticcellsasmarker."journalofbiotechnology25.3(1992):231-243.ldh,lactatedehydrogenase,andgreentop."lactatedehydrogenase(ldh)."(1980).;canning,d.m.,andr.g.huntsman."anassessmentofsickledexasanalternativetothesicklingtest."journalofclinicalpathology23.8(1970):736-737)。
本发明的系统、试剂盒、方法、仪器和盒可以用于组合分析,例如但不限于:
a)细胞表面标志物和细胞元素染色
b)使用膜联蛋白的细胞凋亡(参见bossy-wetzel,ella,anddouglasr.green."detectionofapoptosisbyannexinvlabeling."methodsinenzymology322(2000):15-18)
c)细胞表面标志物和血浆蛋白珠检验
d)细胞元素染色和血浆蛋白珠检验
e)细胞表面标志物和溶液改变
f)5.细胞元素染色和溶液改变
g)2.细胞周期分析
本发明包含用于进行适当的数据分析以及将原始荧光数据转换成相对生物标志物的实际浓度的软件和算法。
本文所述的参考文献教导了用于本发明的许多原理。因此,这些公开的全部内容在适用于教导其他的或备选的细节、特征和/或背景技术的情况下可以以引用方式并入本文。
应该理解的是本发明的应用不限于本文所包含的说明或附图所示的描述中列出的细节。本发明能够用于其他实施方案并且能够以多种方式实施和进行。本本领域的那些技术人员可以容易地理解多种修改和改变在不脱离所附的权利要求书中和由该权利要求书定义的范围的条件下可以用于上文所述的本发明的实施方案中。
参考文献
assicot,marcel,etal."highserumprocalcitoninconcentrationsinpatientswithsepsisandinfection."thelancet341.8844(1993):515-518.
aulesa,c.,etal."validationofthecoulterlh750inahospitalreferencelaboratory."laboratoryhematology9.1(2003):15-28.hawkins,robertc."laboratoryturnaroundtime."theclinicalbiochemistreviews28.4(2007):179.
ault,kennetha."flowcytometricmeasurementofplateletfunctionandreticulatedplatelets."annalsofthenewyorkacademyofsciences677.1(1993):293-308.
blajchman,morrisa.,etal."bacterialdetectionofplatelets:currentproblemsandpossibleresolutions."transfusionmedicinereviews19.4(2005):259-272.
bodensteiner,davidc."aflowcytometrictechniquetoaccuratelymeasurepost‐filtrationwhitebloodcellcounts."transfusion29.7(1989):651-653.
cheson,bruced.,etal."nationalcancerinstitute-sponsoredworkinggroupguidelinesforchroniclymphocyticleukemia:revisedguidelinesfordiagnosisandtreatment."blood87.12(1996):4990-4997.
christ-crain,mirjam,etal."effectofprocalcitonin-guidedtreatmentonantibioticuseandoutcomeinlowerrespiratorytractinfections:cluster-randomised,single-blindedinterventiontrial."lancet363.9409(2004):600-607.
cristofanilli,massimo,etal."circulatingtumorcells,diseaseprogression,andsurvivalinmetastaticbreastcancer."newenglandjournalofmedicine351.8(2004):781-791.
davis,bruceh.,etal."neutrophilcd64isanimprovedindicatorofinfectionorsepsisinemergencydepartmentpatients."archivesofpathology&laboratorymedicine130.5(2006):654-661.
dieye,tandakhandiaye,etal."absolutecd4t-cellcountinginresource-poorsettings:directvolumetricmeasurementsversusbead-basedclinicalflowcytometryinstruments."jaidsjournalofacquiredimmunedeficiencysyndromes39.1(2005):32-37.
divers,s.g.,etal."quantitationofcd62,solublecd62,andlysosome‐associatedmembraneproteins1and2forevaluationofthequalityofstoredplateletconcentrates."transfusion35.4(2003):292-297.
drexler,hansg.,etal."diagnosticvalueofimmunologicalleukemiaphenotyping."actahaematologica76.1(1986):1-8.
dziegiel,mortenhanefeld,leifkofoednielsen,andadelaberkowicz."detectingfetomaternalhemorrhagebyflowcytometry."currentopinioninhematology13.6(2006):490.
fischer,johannesc.,etal."reducingcostsinflowcytometriccountingofresidualwhitebloodcellsinbloodproducts:utilizationofasingleplatformbeadfreeflowratecalibrationmethod."transfusion51.7(2011):1431-1438.
free,a.h.,andh.m.free."urinalysis,criticaldisciplineofclinicalscience."criticalreviewsinclinicallaboratorysciences3.4(1972):481-531.
frengen,jomar,etal."demonstrationandminimizationofseruminterferenceinflowcytometrictwo-siteimmunoassays."clinicalchemistry40.3(1994):420-425.
frengen,j.,etal."homogeneousimmunofluorometricassaysofalpha-fetoproteinwithmacroporous,monosizedparticlesandflowcytometry."clinicalchemistry39.10(1993):2174-2181.
gosling,jamesp."adecadeofdevelopmentinimmunoassaymethodology."clinicalchemistry36.8(1990):1408-1427.
graff,jochen,etal."closerelationshipbetweentheplateletactivationmarkercd62andthegranularreleaseofplatelet-derivedgrowthfactor."journalofpharmacologyandexperimentaltherapeutics300.3(2002):952-957.
guerti,k.,etal."performanceevaluationofthepentra60c+automatedhematologyanalyzerandcomparisonwiththeadvia2120."internationaljournaloflaboratoryhematology31.2(2009):132-141.
hawkins,robertc."laboratoryturnaroundtime."theclinicalbiochemistreviews28.4(2007):179.
hershman,m.j.,etal."monocytehla‐drantigenexpressioncharacterizesclinicaloutcomeinthetraumapatient."britishjournalofsurgery77.2(2005):204-207.
hilfrich,ralf,andjalilhariri."prognosticrelevanceofhumanpapillomavirusl1capsidproteindetectionwithinmildandmoderatedysplasticlesionsofthecervixuteriincombinationwithp16biomarker."analyticalandquantitativecytologyandhistology30.2(2008):78-82.
hillier,sharonl.,etal."acase–controlstudyofchorioamnionicinfectionandhistologicchorioamnionitisinprematurity."newenglandjournalofmedicine319.15(1988):972-978.
kibe,savitri,kateadams,andgavinbarlow."diagnosticandprognosticbiomarkersofsepsisincriticalcare."journalofantimicrobialchemotherapy66.suppl2(2011):ii33-ii40.
larosa,stevenp.,andstevenm.opal."biomarkers:thefuture."criticalcareclinics27.2(2011):407.
liu,n.i.n.g.,a.h.wu,andshans.wong."improvedquantitativeapttestfordetectingfetalhemoglobininbloodystoolsofnewborns."clinicalchemistry39.11(1993):2326-2329.
lotan,yair,etal."bladdercancerscreeninginahighriskasymptomaticpopulationusingapointofcareurinebasedproteintumormarker."thejournalofurology182.1(2009):52-58.
masse,m.,etal."validationofasimplemethodtocountverylowwhitecellconcentrationsinfilteredredcellsorplatelets."transfusion32.6(2003):565-571.
matic,goranb.,etal."wholebloodanalysisofreticulatedplatelets:improvementsofdetectionandassaystability."cytometry34.5(1998):229-234.
mcdonald,c.p.,etal."useofasolid‐phasefluorescentcytometrictechniqueforthedetectionofbacteriainplateletconcentrates."transfusionmedicine15.3(2005):175-183.
michelson,aland."flowcytometry:aclinicaltestofplateletfunction."openaccessarticles(1996):290.
miller,e.m.;freire,s.l.s.;wheeler,a.r."proteomicsinmicrofluidicdevices"inencyclopediaofmicro-andnanofluidics;li,d.q.,ed.;springer:heidelberg,germany,2008;vol.3,pp1749-1758.."
moro,ricardo,etal."anewbroad-spectrumcancermarker."vitrodiagnostictechnology(2005).
ozanichjr,richardm.,etal."rapidmultiplexedflowcytometricassayforbotulinumneurotoxindetectionusinganautomatedfluidicmicrobead-trappingflowcellforenhancedsensitivity."analyticalchemistry81.14(2009):5783-5793.
pál,józsef,etal."sandwichtypeelisaandafluorescentcytometricmicrobeadassayforquantitativedeterminationofhepatitisbvirusxantigenlevelinhumansera."journalofimmunologicalmethods306.1(2005):183-192.
perry,sarae.,etal."islowmonocytehla-drexpressionhelpfultopredictoutcomeinseveresepsis?."intensivecaremedicine29.8(2003):1245-1252.
ramakumar,sanjay,etal."comparisonofscreeningmethodsinthedetectionofbladdercancer."thejournalofurology161.2(1999):388-394.
rawstron,andyc.,etal."quantitationofminimaldiseaselevelsinchroniclymphocyticleukemiausingasensitiveflowcytometricassayimprovesthepredictionofoutcomeandcanbeusedtooptimizetherapy."blood98.1(2001):29-35.
rodriguez,williamr.,etal."amicrochipcd4countingmethodforhivmonitoringinresource-poorsettings."plosmedicine2.7(2005):e182.
rylatt,d.b.,etal."animmunoassayforhumanddimerusingmonoclonalantibodies."thrombosisresearch31.6(1983):767-778.sacks,davidb.,etal."guidelinesandrecommendationsforlaboratoryanalysisinthediagnosisandmanagementofdiabetesmellitus."clinicalchemistry48.3(2002):436-472.
schwartz,mortonk.,etal."chemicalandclinicalevaluationofthecontinuous-flowanalyzer"smac"."clinicalchemistry20.8(1974):1062-1070.
segal,h.c.,etal."accuracyofplateletcountinghaematologyanalysersinseverethrombocytopeniaandpotentialimpactonplatelettransfusion."britishjournalofhaematology128.4(2005):520-525.
skeggs,leonardt."methodandapparatusforsequentiallyperforminganalysesonapluralityoffluidsamples."u.s.patentno.3,241,432.22mar.1966.
skeggs,leonardt.,andharryhochstrasser."multipleautomaticsequentialanalysis."clinicalchemistry10.10(1964):918-936.
stein,pauld.,etal."d-dimerfortheexclusionofacutevenousthrombosisandpulmonaryembolism:asystematicreview."annalsofinternalmedicine140.8(2004):589.
sutherland,d.robert,etal."theishageguidelinesforcd34+celldeterminationbyflowcytometry."journalofhematotherapy5.3(1996):213-226.
wang,chao,etal."reticulatedplateletspredictplateletcountrecoveryfollowingchemotherapy."transfusion42.3(2002):368-374.
westgard,j.o.,etal."performancestudiesonthetechnicon"smac"analyzer:precisionandcomparisonofvalueswithmethodsinroutinelaboratoryservice."clinicalchemistry22.4(1976):489-496.
- 还没有人留言评论。精彩留言会获得点赞!