α-突触核蛋白检测测定法和用于诊断α-突触核蛋白病的方法与流程
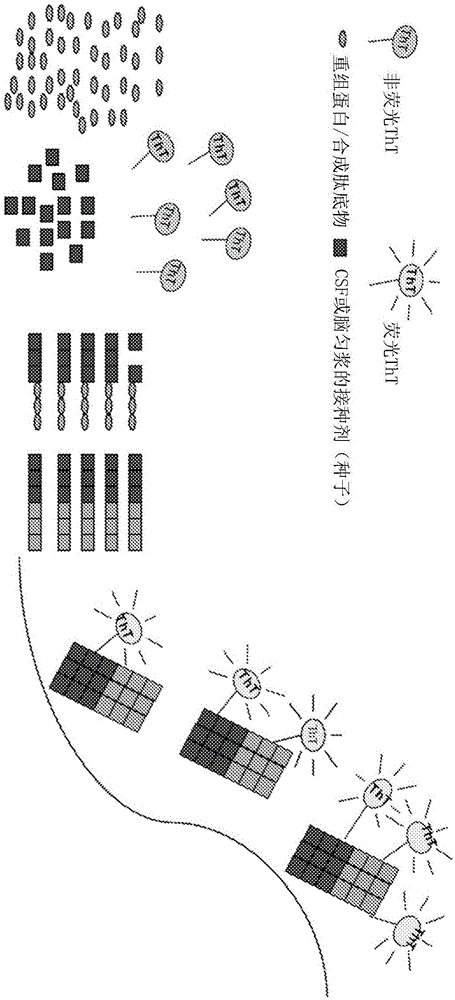
本发明涉及用于检测生物样品中的聚集蛋白质的测定法,更具体地涉及用于检测生物样品中的聚集α-突触核蛋白的测定法。
背景技术:
:α-突触核蛋白(a-syn)是一种140个氨基酸的非常保守的酸性小蛋白质,分子量为19kda,其由位于4号染色体上的snca基因编码1。它以高浓度位于中枢神经系统的突触前神经末梢,在此其对突触小泡生物学发挥作用2。突触核蛋白病是一组与神经元和神经胶质的选择性群体中a-syn的纤维性聚集体的沉积有关的神经退行性病症。这些沉积物可见于神经胞体(如路易体(lb))中或如帕金森病(pd)或路易体痴呆(dlb)的疾病的营养不良神经突起中;或多系统萎缩症(msa)的神经胶质细胞质包涵体中3。已经在如脑脊液(csf)4和血清5的生物流体中检测到存在a-syn。已经提议将由elisa测量csf中的a-syn浓度作为用于与a-syn相关病症的生物标志物。然而,尽管许多研究表明在pd和dlb中csfa-syn水平降低4,6,但是总体结果并不一致7。即使在已经证实csfa-syn降低的那些研究中,差异虽很小8,但是在患者组内以及在患者组和对照组之间存在相当大的重叠。此外,已证明将实验室之间csfa-syn测量标准化是困难的9。最近已经将a-syn的聚集特性与朊蛋白进行了比较,该朊蛋白的聚集会导致传染性海绵状脑病(tse)10。实际上,目前文献有很多关于α-突触核蛋白病是否实际上是朊病毒样疾病的讨论11。已经将最近所描述的一种被称为实时震动诱导转换(rt-quic)的技术(该技术利用朊病毒蛋白诱导自聚集的能力)开发用于散发性克雅二氏症(scjd)的诊断性csf测试,该散发性克雅二氏症是最常见人类形式的tse12。然而,鉴于朊病毒蛋白和a-syn之间的显著差异,这些技术未能以任何可靠的方式检测到生物样品中a-syn或a-syn聚集体的存在。因此,对于检测生物样品中a-syn和a-syn聚集体存在的可靠测定法仍然存在需求。本发明的至少一个目的是提供用于检测生物样品中a-syn和/或a-syn聚集体存在的改进的测定法。技术实现要素:根据本发明的第一方面,提供了检测生物样品中α-突触核蛋白聚集体存在的方法,该方法包括以下步骤:(i)提供生物样品;(ii)提供反应样品,其包含珠粒群体、适合于结合蛋白质聚集体并在与蛋白质聚集体结合时荧光增强的荧光团、和α-突触核蛋白或其片段或变体;(iii)将生物样品和反应样品混合以形成反应混合物;(iv)以间歇式搅拌循环孵育反应混合物;(v)用激发反应样品荧光团的波长的光照射样品;和(vi)确定在孵育期间反应混合物的荧光水平,其中步骤(iv)至(vi)同时进行,并且在步骤(iv)至(vi)期间反应混合物的荧光显著增加表明在反应混合物中存在α-突触核蛋白聚集体,并且其中在反应混合物中存在α-突触核蛋白聚集体表明在生物样品中存在α-突触核蛋白聚集体。本领域技术人员将理解,术语“α-突触核蛋白(alpha-synuclein)”、“a-syn”、“α-突触核蛋白(α-synuclein)”和“α-syn”是指α-突触核蛋白,并且在全文中可互换使用。例如,在从人受试者获得生物样品的实施方式中,α-突触核蛋白是具有序列seqidno.1的人α-突触核蛋白:seqidno.1:参照α-突触核蛋白,术语“片段”旨在表示α-突触核蛋白序列的至少10个、20个、30个、50个、100个、120个、130个或140个或其之间任何整数的连续核苷酸的多核苷酸;优选的片段是在本发明方法的条件下能够聚集的那些片段。例如,片段可以包含天然α-突触核蛋白序列的氨基酸序列1-60或61-140。参照α-突触核蛋白,“变体”是指在肽或多肽序列中具有至少一个氨基酸取代、插入和/或缺失或具有对该蛋白质化学连接部分的改变的α-突触核蛋白。保守取代:具有相似生物化学性质的氨基酸残基的一个或多个氨基酸取代(例如,1个、2个、5个或10个残基)。通常,保守取代对所得肽或多肽的活性几乎没有影响。例如,α-突触核蛋白中的保守取代可以是基本上不影响肽在本发明方法的反应条件下聚集的能力的氨基酸取代。在一个具体的实施例中,α-突触核蛋白中的保守取代是不会显著改变蛋白质在本发明方法的反应条件下聚集的能力的氨基酸取代。可以将筛选α-突触核蛋白的变体用于鉴定哪些氨基酸残基可耐受氨基酸取代。在一个实施例中,α-突触核蛋白可以是人α-突触核蛋白,并且一个保守取代可以被包含在肽中,例如seqidno:1中的保守取代。在另一个实施例中,10个或更少的保守取代可以被包含在肽中,如5个或更少。因此,本发明的肽或蛋白质可以包含1个、2个、3个、4个、5个、6个、7个、8个、9个、10个或更多个保守取代。通过采用例如标准方法(如定点诱变或pcr)操纵编码多肽的核苷酸序列,可以产生含有一个或多个保守取代的多肽。可替换地,通过采用肽合成方法(例如本领域已知的肽合成方法),可以产生含有一个或多个保守取代的多肽。取代变体是其中已经将氨基酸序列中的至少一个残基除去并在其位置处插入不同残基的变体。可以取代蛋白质中的原始氨基酸并被认为是保守取代的氨基酸的实例包括:ser取代ala;lys取代arg;gln或his取代asn;glu取代asp;asn取代gln;asp取代glu;pro取代gly;asn或gln取代his;leu或val取代ile;ile或val取代leu;arg或gln取代lys;leu或ile取代met;met、leu或tyr取代phe;thr取代ser;ser取代thr;tyr取代trp;trp或phe取代tyr;和ile或leu取代val。在一个实施方式中,取代发生在ala、val、leu和ile之中;ser和thr之中;asp和glu之中;asn和gln之中;lys和arg之中;和/或phe和tyr之中。可以在其它地方,ben-bassat等人(j.bacteriol.169:751-7,1987)、o'regan等人(gene77:237-51,1989)、sahin-toth等人(proteinsci.3:240-7,1994)、hochuli等人(bio/technology6:1321-5,1988)、wo00/67796(curd等人)以及遗传学和分子生物学的标准教科书中发掘关于保守取代的其它信息。通常,α-突触核蛋白形成抗聚集的折叠的稳定四聚体。然而,已经被提出α-突触核蛋白的突变会促进聚集,并且α-突触核蛋白的这些聚集体是被认为与α-突触核蛋白病(如路易体痴呆和帕金森病)相关的原纤维的主要组成部分。因此,检测或确定生物样品是否包含α-突触核蛋白聚集体可以允许检测这类病变(pathology)而无需采用侵入性或昂贵的技术,并且可以允许可能存在这些病变之前采用标准方法对其进行检测。如实时震动诱导转化(rt-quic)的测定法迄今尚未能够检测到α-突触核蛋白聚集体的存在。本发明人惊奇地发现,本发明的经过改良rt-quic方法允许以非常高的敏感度和特异性检测α-突触核蛋白,并且允许将α-突触核蛋白聚集相关的病变与其它蛋白质聚集相关的病变区分开来。对于“荧光显著增加”,我们是指在合适的时间点(通常在90-120小时之内)荧光至少增加为相对荧光平均值加上阴性对照或基线荧光的相对荧光平均值的标准偏差的两倍。通常,生物样品是体液样品。然而,生物样品可以是基于细胞的组织样品。可以使用本发明的方法从受试者中获取生物样品用于分析,以允许保健医生确定受试者是否可能患有与α-突触核蛋白聚集体存在相关的疾病。体液可以选自包括脑脊液、血液或血液成分、鼻部液体或组织、尿液、粪便和淋巴的组。优选地,体液选自包括脑脊液、血浆或其它成分、及鼻部组织或液体的组。例如,体液可以是脑脊液。在另一个实施例中,体液可以是例如采用鼻拭子提取的鼻部组织或液体。在另一个实施例中,体液可以是血液样品或血液成分。因此,本发明的方法可以允许检测与取自受试者的生物样品中的α-突触核蛋白聚集相关的疾病,从而允许用于诊断或预后的非侵入性方法。生物样品通常取自哺乳动物受试者,优选来自人受试者。然而,生物样品可以取自鱼类、禽类、爬虫类或两栖类受试者。反应样品通常包含溶剂。溶剂可以是水性溶剂,使得反应样品是水性溶液。反应样品可以是基本上维持反应样品ph的经过缓冲的反应样品。例如,反应样品可以包含生物学上可接受的缓冲液,如三(羟甲基)氨基甲烷(tris)、磷酸盐缓冲的盐溶液(pbs)、4-(2-羟乙基)-1-哌嗪乙磺酸(hepes)、哌嗪-n,n′-双(2-乙磺酸)(pipes),或者例如sorensen磷酸盐缓冲液。通常,将反应样品缓冲以维持反应样品的ph在约ph6至约ph8.5。优选地,将反应样品缓冲以维持反应样品的ph在约7.0至约8.5。例如,可以将反应样品缓冲以维持样品的ph在ph7.0、7.2、7.4、7.6、7.8、8.0、8.2或8.4。优选地,将反应样品缓冲以维持ph在小于ph9.0。优选地,将反应样品缓冲以维持反应样品的ph在ph8.0、8.2或8.4。当反应样品的荧光团与蛋白质聚集体结合时,该荧光团通常会改变荧光。例如,荧光团游离在溶液中时可以发出微弱的荧光,并且当其与蛋白质聚集体结合时可以发出强烈的荧光。可替换地,当荧光团在溶液中游离时,该荧光团可以不发出荧光,并且当荧光团与蛋白质聚集体结合时,该荧光团可以发出荧光。蛋白质聚集体可以包含显著含量的β-折叠,并且非聚集的蛋白质可以不含显著含量的β-折叠,并且可以将荧光团配置为结合蛋白质的β-折叠。当荧光团与聚集的蛋白质结合时,荧光团的发射光谱可能发生偏移。例如,当荧光团与蛋白质聚集体结合时,荧光团的发射光谱可能会红移。可替换地,当荧光团与蛋白质聚集体结合时,荧光团的发射光谱可能会蓝移。通常,荧光团是硫黄素。优选地,荧光团是硫黄素t(tht)。可替换地,荧光团可以是花青t-284,或当与蛋白质聚集体(如α-突触核蛋白聚集体)结合时荧光增强的另一种荧光团。在标准的rt-quic中,少量待聚集的蛋白质被包含在反应样品中以充当蛋白质聚集的底物。因此,反应样品可以包含小于1mg/ml的α-突触核蛋白以充当聚集底物。反应样品可以包含小于0.5mg/ml的α-突触核蛋白。反应样品可以包含小于0.1mg/ml的α-突触核蛋白。反应样品可以包含约0.01mg/ml的α-突触核蛋白至约10mg/ml的α-突触核蛋白以充当聚集底物。反应样品可以包含约0.1mg/ml至约1mg/ml的α-突触核蛋白以充当聚集底物。反应样品的α-突触核蛋白可以是来自人或其它物种的重组α-突触核蛋白。反应样品的α-突触核蛋白可以是全长α-突触核蛋白的片段。例如,该片段可以包含全长α-突触核蛋白的氨基酸1-60或61-140。反应样品中珠粒群体的珠粒可以包括氧化锆,二氧化硅,玻璃,石英或聚合物,如聚苯乙烯,聚四氟乙烯(ptfe),聚甲基丙烯酸甲酯(pmma),或其组合。通常,珠粒群体的平均珠粒直径为约1mm至约0.001mm。珠粒群体的平均直径可以为约1mm至约0.1mm。例如,平均珠粒直径可以为1mm、0.5mm或0.1mm。珠粒群体的标准直径分布可以是平均直径加上或减去约10%。因此,珠粒直径可以是基本上均匀的。每100μl的反应混合物,反应样品可以包含约1mg至约150mg的珠粒。每100μl的反应混合物,反应样品可以包含约10mg至约100mg的珠粒。每100μl的反应混合物,反应混合物可以包含约10mg、20mg、30mg、40mg或50mg的珠粒,或其之间的量。例如,每100μl的反应混合物,反应混合物可以包含约10至50mg的珠粒,每100μl的反应混合物,反应混合物可以包含20至50mg的珠粒,或每100μl的反应混合物,反应混合物可以包含30至50mg的珠粒。生物样品中α-突触核蛋白聚集体的存在指示与α-突触核蛋白的异常聚集相关的疾病。例如,该疾病可以是路易体痴呆或帕金森病,或其它α-突触核蛋白病。可以将反应混合物孵育超过40小时、超过60小时、超过80小时或超过120小时。可将反应混合物搅拌一段时间并允许静置一段时间。通常,搅拌反应混合物的时期明显短于在不搅拌下使反应混合物静置的时期。可以将反应混合物搅拌至少1分钟、至少2分钟或至少5分钟的时期。可以使反应混合物静置至少10分钟、至少15分钟或至少20分钟的时期。例如,可以将反应混合物搅拌1分钟的时期,并且在不搅拌下使反应混合物静置14分钟的时期。间歇式搅拌循环可以包括间歇式振动循环。振动循环可以使反应混合物以环形或轨道运动的方式进行移动,因此,例如,可以以每分钟转数来定义振动速率。可替换地,振动循环可以使反应混合物沿单轴前后移动,因此,可以按每分钟往返次数来定义振动速率。可以以固定速率来搅拌反应混合物。在下文中,以每分钟转数表示搅拌速率,但是对于按照线性运动进行振动的实施方式,可以同等地用每分钟往返次数表示。可以以每分钟至少100转来对反应混合物进行搅拌。可以以每分钟至少150转来对反应混合物进行搅拌。可以以每分钟至少200转来对反应混合物进行搅拌。可以以至少100转/分钟至至少300转/分钟对反应混合物进行搅拌。可以以至少150转/分钟至至少250转/分钟对反应混合物进行搅拌。例如,可以以每分钟150转、200转或250转来对反应混合物进行搅拌。优选地,以每分钟200转对反应混合物进行搅拌。反应混合物的所需搅拌速率可根据振动器的振动轨道而改变。反应混合物的所需搅拌速率可以根据该方法中所使用的生物样品而改变。例如,在生物样品为血液成分(如血浆中的血小板)的实施方式中,可以以每分钟400转、600转、800转、900转或1000转的转速搅拌反应混合物。间歇式搅拌循环可以包括对反应混合物进行间歇式超声处理。反应混合物的超声处理可以搅拌反应混合物以促进聚集。也可以采用搅拌反应混合物的替代方法。可以在25℃至45℃的温度下进行本发明的方法。可以在30℃至40℃的温度下进行本发明的方法。例如,可以在30℃、32℃、34℃、36℃、38℃或40℃及之间值的温度下进行该方法。在一个实施方式中,可以在约30℃的温度下进行本发明的方法。在另一个实施方式中,可以在约35℃或约37℃的温度下进行本发明的方法。可以在进行本发明方法之前处理生物样品以将生物样品中的α-突触核蛋白浓缩。可以在进行本发明方法之前处理生物样品以从复杂的生物样品中提取α-突触核蛋白。可以用珠粒群体处理生物样品。珠粒可以包括磁性材料。例如,珠粒可以包括顺磁性材料,并且通过采用外部施加的磁场从复杂混合物中提取珠粒,而使得珠粒可以允许将特异性结合至珠粒表面的材料分离出来。在进行本发明方法之前,磁性珠粒可以允许提取或浓缩生物样品中的α-突触核蛋白。例如,珠粒可以包括超顺磁性氧化铁或另一种顺磁性材料,并且α-突触核蛋白可以与珠粒结合,并且施加磁场可以允许珠粒因而允许α-突触核蛋白从生物样品中分离出来或被浓缩。在本发明的第二方面,提供了诊断α-突触核蛋白病的方法,该方法包括以下步骤:(i)提供来自受试者的生物样品;(ii)提供反应样品,其包含珠粒群体、适合于结合蛋白质聚集体并在与蛋白质聚集体结合时荧光增强的荧光团、和α-突触核蛋白或其片段或变体;(iii)将生物样品和反应样品混合以形成反应混合物;(iv)以间歇式搅拌循环孵育反应混合物;(v)用激发反应样品荧光团的波长的光照射样品;和(vi)确定在孵育期间反应混合物的荧光水平,其中步骤(iv)至(vi)同时进行,并且在步骤(iv)至(vi)期间反应混合物的荧光显著增加表明受试者患有α-突触核蛋白病。α-突触核蛋白病通常是帕金森病或路易体痴呆。本发明的第三方面延展为提供包含水性缓冲溶液的多组分试剂盒(akitofparts),所述水性缓冲溶液包含珠粒群体、荧光团和α-突触核蛋白或其片段或变体。可以将该多组分试剂盒用于作为第一方面和第二方面的方法的反应样品。本发明第一方面的优选的可选特征也是第二方面和第三方面的优选的可选特征。附图说明现在将参考附图以非限制性实例的方式来描述本发明的实施方式。图1:示出标准rt-quic方法的示意图;图2:来自患有路易体痴呆(dlb)、阿尔茨海默病(ad)和散发性克雅二氏症(scjd)患者的脑匀浆(bh)样品的rt-quic曲线,将猝死(sd)而无神经病变迹象疾病的患者作为对照;图3:来自患有混合性病变的患者的bh样品的rt-quic曲线;图4:来自确诊为dlb和scjd患者的脑脊液(csf)样品的rt-quic曲线;图5:对照csf样品和来自患有dlb的患者的一个bh样品的rt-quic曲线;图6:来自患有ad的患者的csf样品和来自患有dlb的患者的一个bh样品的rt-quic曲线;图7:来自患有dlb的患者的csf样品和来自患有dlb的患者的一个bh样品的rt-quic曲线;图8:来自患有dlb和ad的患者的csf样品和来自患有dlb的患者的一个bh样品的rt-quic曲线;图9:来自患有帕金森病(pd)的患者的csf样品和来自对照受试者的csf样品的rt-quic曲线;图10:a)含有珠粒和b)不含珠粒的sdbh样品的rt-quic曲线;图11:a)含有珠粒和b)不含珠粒的dlbbh样品的rt-quic曲线;图12:a)含有珠粒和b)不含珠粒的帕金森病脑脊液(csf)样品的rt-quic曲线;图13:a)含有珠粒和b)不含珠粒的路易体痴呆csf样品的rt-quic曲线;图14:a)不含珠粒、b)每孔18.7mg珠粒和c)每孔37.5mg珠粒的路易体痴呆bh样品的rt-quic曲线;图15:对于(a)0.1mm锆/二氧化硅珠粒、(b)0.5mm锆/二氧化硅珠粒和(c)2.3mm锆/二氧化硅珠粒的来自对照受试者(sdbh)、路易体病患者(lbdbh)、阿尔茨海默病(adbh)或散发性克雅二氏症(scjdbh)的bh或未接种的rt-quic曲线;图16:来自路易体病(lb)患者或来自对照受试者的csf样品(其中添加37mg的(a)0.1mm锆/二氧化硅珠粒、(b)0.5mm锆/二氧化硅珠粒和(c)2.3mm锆/二氧化硅珠粒)的rt-quic曲线;图17:采用(a)0.5mm钢珠或(b)0.5mm玻璃珠,来自对照受试者(sdbh)、路易体病患者(lbdbh)和阿尔茨海默病(adbh)的bh样品的rt-quic曲线并与未接种的那些反应的rt-quic曲线进行比较;图18:采用(a)0.5mm钢珠或(b)0.5mm玻璃珠,来自对照受试者和路易体病患者(lbdbh)的csf样品的rt-quic曲线并与未接种的那些反应的rt-quic曲线进行比较;和图19:从pd和对照受试者的edta抗凝血液样品中分离出的血小板样品的rt-quic曲线。具体实施方式虽然下面详细讨论了制备和使用本发明的各种实施方式,但是应该理解,本发明提供了许多可以在各种具体环境中实施的可应用的发明构思。本文所讨论的具体实施方式仅仅举例说明制备和使用本发明的具体方式,并不限制本发明的范围。为了便于理解本发明,下面定义了许多术语。本文定义的术语具有在与本发明相关的领域中的普通技术人员通常理解的含义。术语如“一个(a)”,“一种(an)”和“该(the)”并不旨在仅指单数实体,而是包括可以将具体实例用于举例说明的常规类别。本文的术语用于描述本发明的具体实施方式,但是除了权利要求中所概述的之外,它们的使用并不限制本发明。常规的材料和方法实时震动诱导α-突触核蛋白聚集rt-quic反应缓冲液(rb)由100mm磷酸盐缓冲液(ph8.2)、10μm硫黄素t(tht)和0.1mg/ml人全长重组α-突触核蛋白(1-140aa)(stratech,剑桥,英国)组成。底部透明的黑色96孔板(nalgenenuncinternational,fisherscientificltd,uk)的每个孔含有98μl、90μl或85μlrb(取决于添加的种子体积)和37±3mg的0.5mm锆/二氧化硅珠粒(thistlescientificltd,格拉斯哥,英国)。用2μl工作强度脑匀浆(bh),5μl、10μl或15μl未稀释的csf接种反应,最终反应体积为100μl。用平板密封膜(fisherscientificltd,英国)密封平板,并在30℃下于bmgoptimafluostar酶标仪中孵育120小时,伴有间歇式振动循环:双轨道,振动1分钟(200rpm),静置14分钟。每15分钟进行一次tht荧光测量(450nm激发和480nm发射)。每个样品以一式两份进行,允许在一个平板上同时测试2个阴性对照样品(用sd和adbh接种的反应)、1个阳性对照(用dlbbh接种的反应)、未接种的反应和44个待测csf样品。患者组对从optima队列(调查记忆和衰老的牛津项目,oxfordprojecttoinvestigatememoryandageing)获得的99个csf样品进行csfrt-quic开发的初始阶段,其中经临床和神经病理学证实的诊断为单纯性dlb(n=12)、pd(n=2)、进行性核上性麻痹(psp)(n=2)、皮质基底核退化症(n=3)、伴ad病理的dlb(n=17)、伴偶发性lb的ad(n=13)、单纯性ad(n=30)和对照组(n=20)。optima始于1988年,是一项针对痴呆和衰老的前瞻性纵向临床病理学研究,包括在临床随访期间的多个时间点收集csf。所有临床和病理方案已经得以详细描述13,并且得到当地伦理委员会的批准,参与者在登记之前提供有知情同意书。对从牛津探索(oxforddiscovery)队列获得的csf样品(20个pd、15个对照和3个风险)进行rt-quic验证阶段,该牛津探索队列是迄今为止最大的临床上特征最好的纵向pd队列之一。先前已经描述了该队列的完整临床详情14。简而言之,根据英国pd社会脑库诊断标准15,在2010年9月至2014年9月期间从290万人群中招募在3.5年内被诊断为原发性pd患者(伦理研究10/h0505/71)。20名pd患者的疾病持续时间平均值为1.6±1.1年(在0.1-3.2年的范围内),hoehn-yahr阶段为1.9±0.4年(在1-3的范围内,可能的评分最大值为5)。从参与该项研究患者的配偶和朋友以及普通公众中招募对照人群。风险组包括通过整夜的多导睡眠描记法证实的患有rem睡眠行为的患者16,其中80%的患者随着时间推移显示出发展为路易体病症17。表1示出了人口统计学信息。最佳组(optima)患者(n)死亡年龄平均值±sd(范围)f/m单纯性lbd(12)80.8±6.5(71-92)4/8帕金森病(2)77.5±7.8(72-83)0/2混合性lbd/ad(17)80.1±6.4(69-90)10/7伴偶发性lb的ad(13)79.8±7.8(67-91)9/4单纯性ad(30)77.7±8.6(61-93)17/13进行性核上性麻痹(psp)(2)69.5±3.5(67-72)2/0皮质基底核退化症(cbd)(3)64.0±10.6(52-72)1/2对照(20)82.9±6.9(68-93)10/10探索组(discovery)患者(n)帕金森病(20)65.1±9.1(42-80)6/14具有患rbd风险的患者(3)67.6±7.7(59-74)0/3对照(15)65.8±7.4(55-83)8/7表1:所调查的optima和discovery患者的患者人口统计信息脑匀浆由ncjdrsu的mrc脑库(道德许可证11/es/0022)提供脑组织。在取样后2小时内将所有组织冷冻在-80℃中,并在分析前储存在-80℃中。在使用前已经将脑组织储存了2-18年。额叶皮层组织取自患有阿尔茨海默病(ad)、散发性克雅二氏症(scjd)、和弥漫性路易体痴呆(dlb)的患者。此外,还从mrc猝死脑组织库的未患神经退行性疾病的个体获得额叶皮层(猝死(sd)对照)。额叶皮层和黑质体组织均获得自患有混合性ad/dlb、混合性scjd/dlb和混合性ad/pd的患者。所有使用的病例均经组织学检查,并使用国际公认的标准进行诊断18。使用含有1mmedta、150mmnacl、0.5%tritonx和来自罗氏的全蛋白酶抑制剂混合物的磷酸盐缓冲溶液(pbs)制备初始10%w/v脑匀浆(bh)。通过用pbs将上述稀释为1:20,000来制备随后的工作强度bh。脑脊液样品在分析之前,将csf样品以0.5ml等分试样储存在-80℃的聚丙烯管中。来自optima队列的99个csf样品和来自牛津帕金森病中心(opdc)探索研究(oxfordparkinson’sdiseasecentre(opdc)discoverystudy)的38个csf样品来自牛津大学纳菲尔德临床神经科学系。用干冰将所有csf样品从牛津运到爱丁堡,并在抵达时储存在-80℃中。此外,对来自ncjdrsucsf库的患有经神经病理学证实的scjd或dlb的患者的csf样品进行了分析。苏格兰多中心研究伦理委员会涵盖了使用来自ncjdrsucsf库的csf样品的伦理批准05/mre00/67。在分析之前,将所有csf旋转离心并储存在-80℃中。结果采用来自患有经临床病理诊断为dlb、阿尔茨海默病(ad)和scjd的患者的额叶皮层bh进行rt-quic的开发。将猝死的无神经病变迹象的神经系统疾病且为mrc猝死脑库成员的患者作为对照(sd)(图2)。用来自dlb的bh接种的rt-quic反应具有50小时的滞后期,之后观察到硫黄素t荧光信号增大,在70小时时达到最大值。来自患有其它蛋白质折叠错误病症(ad或scjd)的患者或sd对照的bh接种的反应无一产生阳性反应,甚至在120小时后也未产生阳性反应。许多疾病病变通常共存,尤其是与ad相关的病变和a-syn病变19。为了研究其它蛋白质折叠错误病症的存在是否会干扰由dlb或pd诱导的a-syn聚集,对来自患有混合性病变的患者的额叶皮层的bh进行了检查(图3)。第二种蛋白质折叠错误疾病(如ad或scjd)的存在不会抑制由dlb或pdbh诱导的rt-quic反应(图2和图3)。为了研究所开发的rt-quic方法是否对检测csf中的a-syn足够敏感,对来自患有经神经病理学证实的dlb的患者的两个csf样品和来自经神经病理学证实的scjd病例的1个csf进行了分析(图4)。来自dlb患者的两个csf样品均产生了阳性反应,滞后期在60-100小时之间。分析了三个不同体积(即5μl、10μl和15μl)下获得自患有经随后神经病理学证实的疾病的患者(作为optima研究的一部分)的99个体内csf样品的探索性组合,以研究rt-quic的敏感性和特异性,并计算最佳的csf体积以用于分析(表2)。采用15μl的体积,对于来自dlb的csf样品,获得92%的敏感度(图7和8),并且对于来自患有混合性dlb/ad病变的患者的csf样品,获得65%的敏感度。对于来自对照受试者(图5)或患有单纯性ad(图6)、cbd或psp的患者的csf样品,无一为阳性。采用这种csf样品的探索性组合,将阳性反应定义为两个csf重复样品中至少一个在120小时时相对荧光单位(rfu)值高于阴性对照平均值的2倍标准偏差以上。表2.用来自患有经神经病变证实的dlb、混合性dlb/ad、伴偶发性lb的ad、ad、pd的患者和健康对照(探索组)以及患有临床诊断为pd、pd风险、经神经病变证实的皮质基底核退化症和核上性麻痹的患者及pd对照(验证组)的csf样品接种的阳性rt-quic反应。将阳性rt-quic反应分类为两个csf重复样品中至少一个在120小时时相对荧光单位(rfu)值高于阴性对照平均值的2倍标准偏差以上。该项研究的第二阶段是将这些分析条件和截止标准应用于一组来自20名临床诊断为患pd的患者、15名对照患者和3名患有rem睡眠行为障碍(rbd)的患者(认为具有未来患α-突触核蛋白病的高风险)的验证性体内csf样品20,这些样品获得自大型前瞻性opdc探索队列20。在不具有最终诊断结果的先验知识的情况下,将这些csf样品进行编码、分析和报告结果。在对样品进行解码后,结果表明20名pd患者中的19名pd患者具有阳性rt-quic反应(图9),并且发现15名对照无一为阳性。这导致rt-quic对pd的敏感性和特异性分别为95%和100%(表2)。有趣的是,所有三名具有患pd风险的患者均具有阳性rt-quic反应。这些患有rbd的患者中的80%患者已被证实正逐渐发展为路易体病症20。讨论由于缺乏灵敏可靠的临床诊断测试,dlb和pd的早期诊断受到阻碍。这两种病况都得到释放到csf中的聚集形式a-syn的神经病理学沉积支持。我们已经利用聚集a-syn以循环方式诱导非聚集a-syn进一步聚集的能力,以开发能够检测dlb和pd中异常csfa-syn的技术,对于dlb和pd敏感度分别为92%和95%,特异性均为100%。独特的是,我们发现3名具有患路易体病症高风险的rbd患者产生了阳性的rt-quic反应,这表明可以将该试验用于作为前驱pd的早期诊断试验。未来的工作重点是对更大的rbd患者队列进行测试验证,然后持续进行纵向评估,该未来工作将测试该测定法在对最有可能具有早期pd转换风险的那些前驱个体进行风险分层的效用,其中该个体可能已经进行过神经保护性治疗。我们还发现来自cbd和psp患者的csf样品不能产生阳性rt-quic反应。该cbd和psp是与tau蛋白而不是a-syn异常相关的运动障碍,其可能在早期阶段被误诊为pd。因此,rt-quic提供了一种检测a-syn异常的新途径,并且其还具有改善除其它α-突触核蛋白病(如msa)之外的pd和dlb早期临床诊断的潜能。珠粒在检测α-突触核蛋白的改良rt-quic测定法中的作用参考图10-13,为了显示在上述测定法中所用珠粒所发挥的作用,对a)含有珠粒和b)不含珠粒的猝死(sd)脑匀浆(bh)样品、a)含有珠粒和b)不含珠粒的路易体痴呆bh样品、a)含有珠粒和b)不含珠粒的帕金森病脑脊液(csf)样品和a)含有珠粒和b)不含珠粒的路易体痴呆csf样品进行了平行测定。使用与上述相同的常规方法进行这些测定法。从图10中可以看出,sd样品没有看到读数。此外,对于不含珠粒的患有路易体病和帕金森病的那些样品未显示出读数(图11b、图12b或图13b)。然而,对于具有珠粒的患有路易体病或帕金森病的样品可以清楚地看到读数。因此,珠粒的存在对于使用rt-quic检测a-syn聚集体存在的能力是至关重要的。参考图14,采用路易体痴呆脑匀浆样品来研究珠粒浓度的影响。在反应混合物中不存在珠粒的样品显示出恒定的荧光信号,表明rt-quic结果为阴性。相反,对于每孔含18.7mg珠粒和每孔含37.5mg珠粒的样品,荧光明显增强,并且珠粒浓度越高,信号越清晰,且越早产生信号。因此,清楚地表明,在反应混合物中存在珠粒对于检测待获得的α-突触核蛋白聚集体的信号是至关重要的。1.采用0.1mm、0.5mm和2.3mm锆/二氧化硅珠粒(约37±3mg)并接种bh来进行a-synrt-quic反应将添加有37mg的0.1mm、0.5mm或2.3mm珠粒的rt-quic反应接种有5μl的1:200,000稀释度的相同bh,该bh来自对照受试者(sdbh)、路易体病患者(lbdbh)、阿尔茨海默病(adbh)或散发性克雅二氏症(scjdbh),或不接种bh。用0.1mm锆/二氧化硅珠粒获得的a-synrt-quic反应示于图15a中,用0.5mm锆/二氧化硅珠粒获得的a-synrt-quic反应示于图15b中,用2.3mm锆/二氧化硅珠粒获得的a-synrt-quic反应示于图15c中。从图15a、b、c可以看出,增加锆/二氧化硅珠粒的尺寸导致用lbdbh接种的反应引起阳性a-synrt-quic反应的时间增加。然而,尽管采用0.1mm锆/二氧化硅珠粒使得反应时间更快,但是用adbh接种的反应产生了阳性a-synrt-quic反应。2.采用0.1mm、0.5mm和2.3mm锆/二氧化硅珠粒(约37±3mg)并接种csf样品来进行a-synrt-quic反应添加有37mg的0.1mm、0.5mm或2.3mm珠粒的rt-quic反应接种有来自患路易体病(lb)的患者或对照受试者的15μlcsf样品。用0.1mm锆/二氧化硅珠粒获得的a-synrt-quic反应示于图16a中,用0.5mm锆/二氧化硅珠粒获得的a-synrt-quic反应示于图16b中,用2.3mm锆/二氧化硅珠粒获得的a-synrt-quic反应示于图16c中。采用0.1mm和0.5mm锆/二氧化硅珠粒导致接种有lbcsf样品的a-synrt-quic反应为阳性,但是对于对照csf样品,a-synrt-quic反应不为阳性。相比之下,采用2.3mm锆/二氧化硅珠粒不支持接种有来自lb患者的csf样品的a-synrt-quic反应。在图16a、b和c所示的实验中采用了相同的csf样品。图15和16中所示实验的结果表明,采用2.3mm锆/二氧化硅不会加速接种有来自lb患者的bh或csf的a-synrt-quic反应。采用0.1mm或0.5mm锆/二氧化硅珠粒产生的a-synrt-quic反应结果是相似的,尽管采用0.1mm锆/二氧化硅珠粒的a-synrt-quic反应导致adbh诱导阳性反应。处理0.1mm锆/二氧化硅珠粒较为困难,因为非常小的尺寸意味着它们比较大的0.5mm锆/二氧化硅更易于静止。因此,采用直径为0.5mm的珠粒对珠粒组成进行所有的其它研究。3.采用0.5mm钢珠和0.5mm玻璃珠并接种bh来进行a-synrt-quic反应将添加有37mg的0.5mm钢珠或玻璃珠的rt-quic反应接种有5μl的1:200,000稀释度的相同bh,该bh来自对照受试者(sdbh)、路易体病患者(lbdbh)和阿尔茨海默病(adbh),并且与那些未接种的反应进行比较。采用0.5μm钢珠的a-synrt-quic反应示于图17a中,采用玻璃珠的a-synrt-quic反应示于图17b中。采用0.5mm钢珠并不支持接种有lbdbh的a-synrt-quic反应。相比之下,采用0.5mm玻璃珠确实导致接种有lbdbh的a-synrt-quic反应为阳性,然而未接种和接种adbh的反应示出荧光逐渐增加,导致缺乏稳定的基线。4.采用0.5mm钢珠和0.5mm玻璃珠并接种csf样品来进行a-synrt-quic反应将添加有37mg的0.5mm钢珠或玻璃珠的rt-quic反应接种有15μl的来自患路易体病(lb)的患者或来自对照受试者的csf样品。采用0.5mm钢珠接种有csf的a-synrt-quic反应示于图18a中,而对于采用玻璃珠的那些a-synrt-quic反应示于18b中。钢珠的使用抑制了来自lb患者的csf样品接种a-synrt-quic的能力,而玻璃珠的使用导致荧光非特异性增加,并且其也不支持a-synrt-quic反应。由上述实验得到的总体结论是添加有每孔37mg0.5mm锆/二氧化硅珠粒对于接种有来自患lbd的患者的bh或csf样品的a-synrt-quic反应是最佳的启动因子。调查来自帕金森病(pd)患者血液组分激发α-突触核蛋白(α-syn)实时震动诱导转换(rt-quic)的能力从来自两名pd患者和对照受试者的edta抗凝血液样品中分离出血小板。通过将振动速度从200rpm增加到600rpm,并且将反应温度升高到42℃,可以采用来自这2名pd患者的15μl血小板来激发α-synrt-quic反应(图19)。相比之下,来自对照受试者的血小板未能成功激发该反应。因此,这证明了本发明方法在确定血液样品是否包含a-syn聚集体方面是有效的,并且因此该方法具有诊断血液样品所来源的受试者是否患有α-突触核蛋白病(如帕金森病或路易体痴呆)的潜力。参考文献1.spillantinimg,divanea,andgoedertm.assignmentofhumanalpha-synuclein(snca)andbeta-synuclein(sncb)generstochromosome4q21and5q35.genomics.1995;27:379-381.2.goedertm,spillantinimg,deltredicik,etal.100yearsoflewypathology.natrevneurol.2013;9:13-24.3.martfmj,tolsae,andcampdelacreuj.clinicaloverviewofthesynucleinopathies.movementdisorders.2003;18:s21-s27.4.mollenhauerm,cullenv,kahni,etal.directquantificationofcsfalpha-synucleinbyelisaandfirstcross-sectionalstudyinpatientswithneurodegeneration.expneurol.2008;213:315-325.5.williamssm,schultp,andsierksmr.oligomerica-synucleinanb-amyloidvariantsaspotentialbiomarkersforparkinson'sandalzheimer'sdiseases.eurjneurosci.2015.6.shim,bradnerj,andhancockam.cerebrospinalfluidbiomarkersforparkinson'sdiseasediagnosisandprogression.annalsofneurology.2011;69:570-580.7.ohrfelta,grognetp,andreasenn,etal.cerebrospinalfluidalpha-synucleininneurodegenerativedisorders-amarkerofsynapseloss?neuroscienceletts.2009;450:332-335.8.hongz,shim,chungka,etal.dj-1andalpha-synucelininhumancerebrospinalfluidasbiomarkersofparkinson'sdisease.brain.2010;133:713-726.9.krusen,perssons,alcolead,etal.validationofaquantitativecerebrospinalfluidalpha-synucleinassayinaeuropean-wideinterlaboratorystudy.neurobiolaging.2015;36:2587-2596.10.bernisme,babilajt,breids,etal.prion-liepropagationofhumanbrain-derivedalpha-synucleinintransgenicmiceexpressinghumanwild-typealpha-synuclein.actaneuropatholcommun.2015;3.11.brandeljp,corbilleag,derkinderenp,etal.isparkinson'sdiseaseapriondisease?revneurol(paris).2015;171:812-824.12.lmcguire,apeden,corru,etal.prionseedingactivityincerebrospinalfluidfrompatientswithsporadiccreutzfeldt-jakobdiseasepatientsusingreal-timequicanalysis:apotentialnewclinicaldiagnostictestwithhighsensitivityandspecificity.annalsofneurology72(2),278-285.13.clarker,smithad,jobstka,etal.folate,vitaminb12andserumtotalhomocysteinelevelsnconfirmedalzheimer'sdisease.archivesofneurology.1998;55:1449-1455.14.szewwczyk-krolikowskik,tomlinsonp,nithik,etal.theinfluenceofageandgenderonmotorandnon-motorfeaturesofearlyparkinson'sdisease:initialfindingsformtheoxfordparkinsondiseasecenter(opdc)discoverycohort.parkinsonismrelatdisord.2014;20:99-105.15.hughesaj,danielse,kilfordl,etal.accuracyofclinicaldiagnosisofidiopathicparkinson'sdisease-aclinicopathologicalstudyof100cases.jneurolneurosurgpsychiatry.1992;55:181-184.16.rolinskim,zokaein,baigf,etal.visualshort-termmemorydeficitsinremsleepbehaviourdisordermirrorthoseinparkinson'sdisease.brain.2016;139:47-53.17.iranzoa,tolosae,gelpie,etal.neurodegnerativediseasestatusandpost-mortempathologyinidiopathicrapid-eye-movementsleepbehaviourdisorder:anobservationalcohortstudy.lancet.2013;12:443-453.18.thomasjmontine,creightonhphelps,thomasgbeach,etal.nationalinstituteonaging-alzheimer'sassociationguidleinesfortheneuropathologicalassessmentofalzheimer'sdisease:apracticalapproach.actaneuropathol.2012;123:1-11.19.kovacsgg,alafuzoffi,a-ss,arzbergert,etal.mixedbrainpathologiesindementia:thebrainneteuropeconsortiumexperience.dementgeriatrcogndisord.2008;26:343-350.20.iranzoa,tolosae,gelpie,etal.neurodegnerativediseasestatusandpost-mortempathologyinidiopathicrapid-eye-movementsleepbehaviourdisorder:anobservationalcohortstudy.lancet.2013;12:443-453.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1