使用由不同的方式固定化抗原的抗原负载不溶性载体粒子的抗体测定法、抗体测定用试剂的制作方法
本发明是涉及生物体物质的测定方法的发明,再具体而言,是涉及用不同的方式固定化抗原的抗原负载不溶性载体粒子、例如,抗原负载乳胶粒子、将彼此混合使用的抗体的测定手段的发明。
背景技术:
现在,在使用不溶性载体粒子的诊断药中,特别是通用作为免疫学测定方法之一使用乳胶凝集法的试剂。
在乳胶凝集法中,在液相中使用负载抗原或抗体(coated或coupled)乳胶,形成检测抗体或抗原的测定系统。可基于由免疫复合物的形成而凝集乳胶粒子的性质,将凝集的程度由目测确认,或光学地进行以浊度的增加作为吸光度或散射光强度的变化测定(以下,也称为乳胶法:专利文献1)。
elisa等的夹心免疫测定法的测定本身是正确的,能作为基准法使用,但由于在测定的过程中包括除去测定样品中所含的被测定物质以外的成分或测定试剂中的成分的清洗工序,有测定要求长时间,测定操作烦琐这样的缺点。因此,不适宜于短时间内的多数的测定试样的测定。
与此相比,乳胶法的操作简便,容易向在临床检查中广泛使用的通用的生物化学自动分析装置的应用,能在短时间内的测定和多数的受试试样的测定。
从而,在多个临床检查项目中,使用乳胶法。
【现有技术文献】
【专利文献】
专利文献1:特开昭53-62826号公报
发明的公开
【发明要解决的课题】
在本发明中,以在使用负载抗原的乳胶等的不溶性载体粒子的抗体测定中扩大测定范围,及灵敏度和特异性的提升作为课题。特别是,进行即使负载微生物来源的溶解物等的多种物质的混合物,也得到良好的测定结果的手段的提供。
在使用不溶性载体粒子的诊断药的开发时,负载在不溶性载体粒子的物质的分子量或负载方式的选择对其性能有大影响。
例如,在使用物理吸附法时,即,在利用不溶性载体粒子和负载蛋白质的静电的相互作用(疏水相互作用)而由直接的接触向不溶性载体粒子负载蛋白质等时,适宜于比较高分子量的物质的负载。但是,有在低分子量的物质或半抗原的负载中可发生在不溶性载体表面的埋没,或由用于抑制非特异性的凝集的封闭剂的埋没这样的难点。另外,物理吸附法在疏水性氨基酸残基非常地缺乏的蛋白质的负载上也确认到难点。
在使用化学结合法时,即,在由将不溶性载体粒子或蛋白质表面的羧基和氨基由碳二亚胺等的偶联试剂共价键合的方法、使不溶性载体粒子表面的醛基或甲苯磺酰基等和蛋白质的氨基结合的方法等向不溶性载体粒子负载蛋白质等时,对于物理的吸附法有难点的低分子量的蛋白质或半抗原的负载也比较容易。再者,在使用化学结合法时,通过适宜选择不溶性载体的官能团,能进行形成共价键的蛋白质侧的结合部位侧的控制、即,选择蛋白质侧的结合部位(共价键合的氨基酸残基)。但是,确认到官能团缺乏蛋白质(换言之,疏水性高的蛋白质)的负载困难这样的问题,再者,所述负载粒子的制作工序烦琐,也确认负载蛋白质的变性的问题。
特别是,使负载微生物来源的溶解物等的“多种物质的混合物”时,当负载方式是仅物理吸附法或化学结合法之任一方时,由于每物质的其大小或在蛋白质中亲水性氨基酸残基和疏水性氨基酸残基的含量不同,在负载的物质上发生了偏倚,结果,有在得到的抗原负载不溶性载体粒子中难以得到良好的测定结果这样的问题、即,被捕获的目标抗体的种类被限制为与有限的物质结合了,有对于成为所述目标抗体所来源的疾病等的原因的微生物等的数据取得不充分地进行的可能性的这样的问题。
另外,由于对于生物体内的微生物的抗体不是对于单一的抗原的抗体,而是作为对于多个抗原的多个抗体存在,当可一次捕获这些多个抗体时,与更确实的数据取得相联系。在本申请的申请时,在本发明人知道的范围内还不存在作为抗原而使用负载生物来源的抗原性物质等的不特定多数的物质的混合物的不溶性载体粒子的例。
【用于解决课题的手段】
本发明人对于上述的课题进行探讨,发现通过在抗体测定中使用含有由物理吸附法进行抗原物质的负载的不溶性载体粒子和由化学结合法进行所述抗原物质的负载的不溶性载体粒子这双方的,不溶性载体粒子的含有液,与宽的测定范围一同,实现高的灵敏度和特异性,特别是在抗原是生物来源的抗原性物质等的多种物质的混合物时也能实现,从而完成本发明。
即,本发明提供抗体测定方法(以下,也称为本发明的测定方法),其特征在于,使含有由物理吸附负载指定的抗原的不溶性载体粒子(以下也称为物理吸附粒子)及由化学结合负载所述抗原的不溶性载体粒子(以下也称为化学结合粒子)双方的不溶性载体粒子的含有液(以下也称为本发明的含有液)与从可含有目标抗体的生物体分离的样品接触而检测由负载在所述载体粒子的抗原和所述样品中的目标抗体的抗原抗体反应的所述载体粒子的凝集反应。在本发明的抗体测定方法中,适宜地,除了本发明的含有液之外,使用稀释液。在使用稀释液时,优选在将从可含有目标抗体的生物体分离的样品用稀释液稀释之后,与不溶性载体粒子的含有液接触。
另外本发明提供抗体的测定用试剂(以下,也称为本发明的测定用试剂),其特征在于,是含有物理吸附粒子、及化学结合粒子这双方的不溶性载体粒子的含有液(本发明的含有液)。再者,本发明提供测定用试剂盒(以下,也称为本发明的试剂盒),其特征在于,含本发明的测定用试剂(本发明的含有液)及稀释液。
物理吸附粒子和化学结合粒子均一同作为乳胶提供是适宜的。此外,可使用氧化硅胶体、磁性粒子、金属胶体等的不溶性载体粒子。含有液只要含有不溶性载体粒子,就不特别限定其含有状态。即,在含有液中,含分散液、乳化液、悬浮液、沉淀液、多层分离液等。另外,含有液中的不溶性载体粒子也可根据需要实施表面处理。
物理吸附粒子是根据上述的规定由物理吸附法负载指定的抗原的不溶性载体粒子。物理吸附粒子的平均粒径能以0.01μm~1.0μm的范围使用,适宜地为0.05μm~0.35μm、再优选为0.10μm~0.35μm、最适宜地为0.20μm~0.35μm。物理吸附粒子可通过使成为进行物理吸附法的对象的不溶性载体粒子的含有液接触吸附对象抗原来制作。
化学结合粒子是根据上述的规定由化学结合法负载指定的抗原的不溶性载体粒子。化学结合粒子的平均粒径能以0.01μm~1.0μm的范围使用,适宜地为0.05μm~0.35μm、再优选为0.10μm~0.35μm、最适宜地为0.20μm~0.35μm。化学结合粒子可通过进行使结合对象抗原共价键合于成为进行化学结合法的对象的不溶性载体粒子的含有液的操作来制作。
即,本发明的含有液适宜地可通过将上述的“物理吸附粒子的含有液”和“化学结合粒子的含有液”混合来调制。
物理吸附粒子和化学结合粒子的混合比(质量比)适宜地为10:1~1:10(物理吸附粒子:化学结合粒子)、再优选为5:1~1:5(物理吸附粒子:化学结合粒子)、极其适宜地为3:1~1:3(物理吸附粒子:化学结合粒子)、最适宜地为3:1~1:2(物理吸附粒子:化学结合粒子)。但是,样品中的目标抗体的测定时的测定用试剂中,或在使用稀释液时测定用试剂及稀释液的混合液中的物理吸附粒子的含量是0.045质量%以上,则有变得确认不到与所述粒子的含量的增加相应的效果的提升的倾向。
在“指定的抗原”中的“指定的”也可称为例如,“选择的”。作为与作为测定的对象选择的抗体结合的抗原“确定”、或者,“选择”这样的含意,一旦确定,或者,一旦被选择,独特地确定所述抗原。
可成为“指定的抗原”的抗原不特别限定,只要是与测定对象的抗体结合的物质,就可广泛选择,优选为与从生物体分离的样品中的抗体结合的抗原。即,伴随特定的疾病或体质,以对于存在于生物体内的物质的抗体作为目标抗体,以与其结合的抗原作为“指定的抗原”是适宜的。可成为“指定的抗原”的代表性物质是蛋白质也含糖链、脂质等的其他物质。
另外,“生物体”广义上是指一般的生物体,通常是人体。
通过以所述抗原作为“多种物质的混合物”,适宜地发挥本发明的效果。作为所述混合物,可举出生物来源的抗原性物质,适宜地可举出细菌、病毒等的微生物来源的溶解物。
另外,所述抗原含至少1种分子量5000以上、特别优选10000以上的物质时,适宜地发挥本发明的效果。通过对于微生物来源的溶解物并用物理吸附粒子和化学结合粒子这两者,作为总体多样的表位提示变得可能。所述分子量的上限尽可能不特别限定对于不溶性载体粒子的负载大致是2000000以下左右是适宜的。还有上述的“多种物质的混合物”符合此特定分子量的条件的情况。
可通过使上述的本发明的含有液与从可含有目标抗体的生物体分离的样品接触来检测由负载在所述含有液的不溶性载体粒子的抗原和所述样品中的目标抗体的抗原抗体反应的所述载体粒子的凝集反应的程度。
“从可含有目标抗体的生物体分离的样品”只要是有含有被测定抗体的可能性,就不特别限定,例如,可举出血液、血清、血浆、尿、淋巴液、刺液、髓液、汗、唾液、胃液、肺清洗液、粪便等。这些中,血液、血清、血浆是适宜的。
作为“负载由抗原抗体反应的指定的抗原的不溶性载体粒子的反应”,主要是凝集反应,通过使用载玻片凝集法、光学测定法、微滴定法、滤器分离法等而检测不溶性载体粒子的凝集,可进行期望的抗体的测定。
本发明的测定方法适宜地使用生物化学自动分析装置而进行。生物化学自动分析装置以光学测定方法作为测定原理,通常,在用时,将血清等的样品用稀释液稀释而加温之后,加试剂(在本发明的情况中是本发明的含有液)而成为进行测定的规格。作为现在提供的生物化学自动分析装置,例如,可举出日立7180形、labospect008、labospect006等(株式会社日立hightechnologies制);jca-bm6010、jca-bm6050、jca-bm9130等(日本电子株式会社制);tba-c16000、tba-2000fr、tba-120fr等(东芝medicalsystems株式会社制);au680、au5800等(beckmancoulter株式会社制)等,但不限于这些。
【发明的效果】
由本发明,提供与宽的测定范围一同,伴随高的灵敏度和特异性而测定抗体的手段。
【附图的简单的说明】
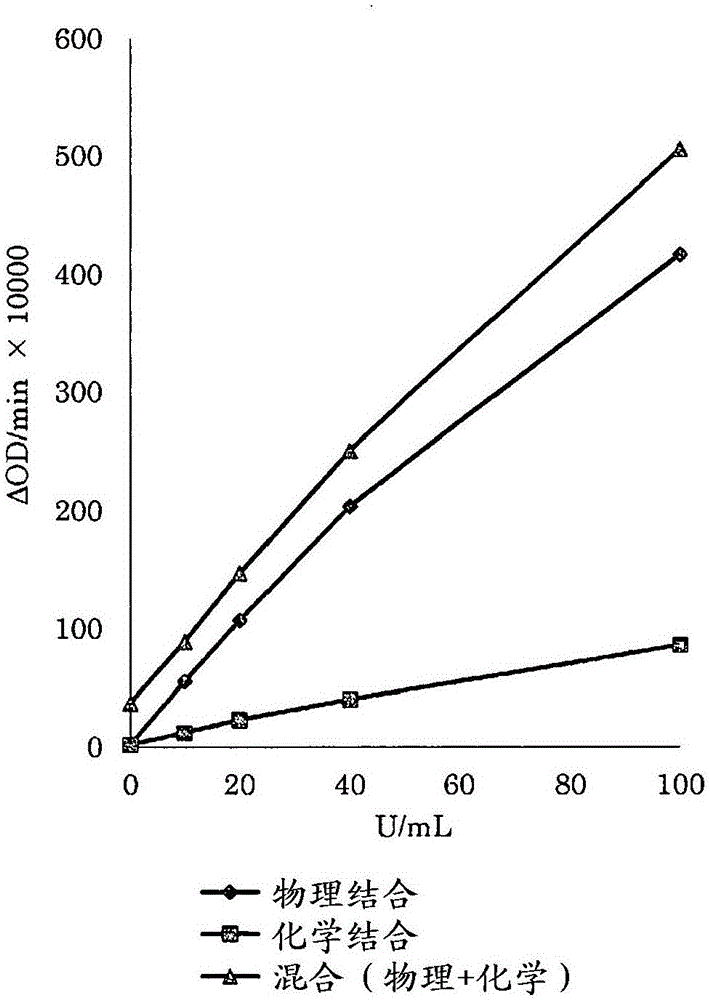
【图1】是探讨在粒径0.145μm的化学结合乳胶和粒径0.235μm的物理吸附乳胶的混合的反应性中的效果的附图。
【图2】是探讨在通过改变相对于粒径0.235μm的物理吸附乳胶的粒径0.300μm的化学结合乳胶的混合量的反应性中的效果的附图。
【具体实施方式】
1.本发明的含有液
如上所述本发明的含有液是含有物理吸附粒子、及化学结合粒子这双方的含有液。
(1)不溶性载体粒子的筹备
如上所述,物理吸附粒子和化学结合粒子均一同作为乳胶提供是适宜的。乳胶是聚合物的微粒子(乳胶粒子)稳定分散到水性溶剂中的乳液。
乳胶的制作方法能使用乳化聚合法、无肥皂乳化聚合法、种聚合法、阶段加料乳化聚合法、功率加料聚合法、悬浮聚合法等的常规方法而进行。粒径的调节也可使用在各这些乳胶的调制方法中的常规方法而进行。例如,当是乳化聚合法,通过调节单体、乳化剂、起始剂的种类和量、聚合温度等,可进行乳胶的粒径的调节。使用乳胶的市售品也当然是可能的。
乳胶的种类只要可应用在物理吸附粒子的制作中使用的物理吸附法、或者,在化学结合粒子的制作中使用的化学结合法,就不特别限定,选择适宜于物理吸附法及化学结合法各自的种类是适宜的。
作为适宜于物理吸附法的乳胶,可举出聚苯乙烯乳胶、极低羧酸乳胶、亲水基定位乳胶等。
作为适宜于化学结合法的乳胶,可举出含有在表面有羧基、羟基、氨基、醛基、或者,甲苯磺酰基等的乳胶粒子的乳胶。
即使是适宜于物理吸附法的乳胶,或者,即使是适宜于化学结合法的乳胶,均能使用实施着色的着色乳胶或实施荧光物质的荧光乳胶。
如前所述,进行物理吸附的乳胶粒子和进行化学结合的乳胶粒子的粒径均不特别限定,能以0.01μm~1.0μm的范围使用,适宜地为0.05μm~0.35μm、再优选为0.10μm~0.35μm、最适宜地为0.20μm~0.35μm。
由于在这双方的负载方式的乳胶粒子各自中得到对应于负载抗原和测定抗体的性质的适合的灵敏度和特异性和测定范围,可确定在测定中使用的乳胶粒子的粒径。具体而言,在想要提高由免疫反应的乳胶的凝集性的情况中,选择中度至大的粒径(0.20-0.35μm)是适宜的,在测定对象(抗体)的浓度非常地高的情况中,也有选择小的粒径(0.10μm以下)优选的情况。
如上所述,作为乳胶粒子以外的不溶性载体粒子,可举出氧化硅胶体粒子、磁性粒子、金属胶体粒子等。通过进行向这些不溶性载体粒子附加适宜于物理吸附或化学结合的官能团的粒子表面的改性,能作为能在本发明中使用的不溶性载体粒子。
(2)向不溶性载体粒子的负载工序
(a)负载抗原
对于不溶性载体粒子负载的抗原只要是能与作为测定的目标的抗体结合,就完全不限定,如前所述,通过作为“多种物质的混合物”或“大的分子量的物质的含有物”,适宜地发挥本发明的效果。作为所述混合物,可举出生物来源的抗原性物质,适宜地可举出细菌、病毒等的微生物来源的溶解物。例如,在后述的实施例中使用的幽门螺杆菌(helicobacterpylori)的溶解物中,含有脲酶b(ureaseb)、脲酶a(ureasea)、caga、鞭毛蛋白(flagellin)、热休克蛋白(heatshockprotein)、此外的物质。这些幽门螺杆菌(helicobacterpylori)的溶解物中所含的物质的分子量大部分是10000-200000左右。
为了此如幽门螺杆菌(helicobacterpylori)一样的体内感染微生物的特定,可以所述感染微生物特有的物质作为负载抗原使用。作为微生物,此幽门螺杆菌(helicobacterpylori)之外、可举出a组溶菌链球菌、b组溶菌链球菌、肺炎球菌u中抗原、大肠杆菌o157、艰难梭菌(clostridiumdifficile)、军团菌、霍乱菌、髓膜炎起因菌等的细菌类;流感病毒、副流感病毒、轮状病毒、诺罗病毒、日本脑炎病毒、狂犬病病毒、脊髓灰质炎病毒、埃可病毒、柯萨奇病毒a组、柯萨奇病毒b组、腮腺炎病毒、单纯疱疹病毒、水痘-带状疱疹病毒、麻疹病毒、风疹病毒、eb病毒、乳头瘤病毒、传染性软属肿病毒、手足口病病毒、急性出血性结膜炎病毒、hav、hbv、hcv、流行性角结膜炎病毒、亨特病毒、人t淋巴细胞好性病毒、hiv、淋巴细胞性脉络髓膜炎病毒、rs病毒、腺病毒、呼肠病毒、鼻病毒、冠状病毒等的病毒类;成为假丝酵母(candida)症、曲霉(aspergillus)症、隐球菌症、接合菌症、肺囊虫肺炎、毛孢子菌(trichosporon)症等的深在性真菌症的原因的真菌;成为恙虫病、红斑热、斑疹伤寒等的原因的立克次氏体;衣原体、原虫、寄生虫等。
除了微生物来源的抗原之外,作为可在本发明中使用的负载抗原,可举出对于抗tsh受体抗体、抗乙酰胆碱受体抗体、抗胰岛素受体抗体等的抗受体抗体的抗原;对于抗甲状腺球蛋白抗体、抗微体抗体等的抗甲状腺抗体的抗原;对于抗胰岛细胞抗体、抗gad抗体、抗胰岛素抗体等的抗胰岛抗体的抗原;对于抗肾上腺皮质抗体、抗平滑肌抗体、抗lkm抗体、抗胃壁细胞抗体、抗内因子抗体、抗横纹肌抗体、抗心肌抗体、抗皮肤桥粒核心糖蛋白抗体、抗嗜中性粒细胞细胞质抗体、抗磷脂抗体等的器官特异性本身抗体的抗原等。
再者,作为可在本发明中使用的负载抗原,可举出分布于dna、核小体、组蛋白、聚adp核糖、着丝粒、scl-70、ku等的染色质的本身抗原;分布于u1rnp、sm、ss-b/la,ss-a/ro、pcna、ki等的核质的本身抗原;分布于u3rnp、th/to、pm-sci、rna聚合酶等的核小体的本身抗原;分布于aa-a/ro、jo-1、核糖体p、线粒体m2、信号识别粒子等的细胞质的本身抗原等的对于器官非特异性本身抗体的抗原。
以上的记载是例示列举,也能使用此外的现时间点能应用的抗原,也能还使用将来提供的抗原。
(b)抗原的负载工序
抗原向不溶性载体粒子的负载可根据物理吸附法、化学结合法、各自常规方法而进行。
物理吸附法可例如,使在蒸馏水或pbs中以0.1-1质量%左右含有不溶性载体粒子的含有液与要负载的抗原混合,向不溶性载体粒子负载所述抗原。再者,通过使用离心分离而分开未吸附的抗原和抗原负载载体粒子,再分散于水性溶剂(通常是缓冲液)中,可制作物理吸附粒子的含有液。作为缓冲液,例如,可举出hepes缓冲液等的good缓冲液、tris缓冲液、甘氨酸缓冲液、硼酸缓冲液等。
化学结合法利用不溶性载体粒子表面的官能团,将指定的抗原用共价键结合。例如,在不溶性载体粒子表面的官能团是羧基、羟基、氨基的情况中,能通过各自以碳二亚胺、溴氰、戊二醛作为活性剂利用而使抗原与不溶性载体粒子表面共价键合。事前将不溶性载体粒子表面的官能团用活化剂活化后与抗原接触也是可能的,也可使活化剂和抗原同时与不溶性载体粒子接触。在不溶性载体粒子表面的官能团是醛基、甲苯磺酰基时,无使用活性剂的必要。再者,向不溶性载体粒子和抗原之间放入寡氨基酸或氨基羧酸等的间隔物分子而进行共价键也是可能的。
上述的化学结合反应在水性溶剂(通常,缓冲液)中进行,通过将得到的化学结合粒子再分散于水性溶剂(通常是缓冲液)中,可制作化学结合粒子的含有液。作为缓冲液,例如,可举出hepes缓冲液等的good缓冲液、tris缓冲液,甘氨酸缓冲液、硼酸缓冲液等。
这样,可制作物理吸附粒子和化学结合粒子。物理吸附粒子和化学结合粒子在水性溶剂中作为不溶性载体粒子的含有液保存。
(3)本发明的含有液
本发明的含有液是含有物理吸附粒子、及化学结合粒子这双方的含有液,其溶剂通常是缓冲液。作为缓冲液,例如,可举出hepes缓冲液等的good缓冲液、tris缓冲液,甘氨酸缓冲液、硼酸缓冲液等。例如,本发明的含有液可通过将作为上述的物理吸附粒子的含有液制作的物理吸附粒子和作为化学结合粒子的含有液制作的化学结合粒子在水性溶剂(通常,缓冲液)中混合来制作。只要是得到含有物理吸附粒子及化学结合粒子这双方的含有液,本发明的含有液的制作方法就不限于此。
在本发明的含有液中,也可根据需要,含有例如,各种电解质、稳定化剂、表面活性剂、增感剂等。
在本发明的含有液中的各自的抗原负载载体粒子的含有比也因期望的测定范围和灵敏度不同,适宜地以质量比10:1~1:10(物理吸附粒子:化学结合粒子)、再优选为5:1~1:5(物理吸附粒子:化学结合粒子)、极其适宜地为3:1~1:3(物理吸附粒子:化学结合粒子)、最适宜地为3:1~1:2(物理吸附粒子:化学结合粒子)。但是,对样品中的目标抗体进行测定时的含有液中,或在使用稀释液时含有液及稀释液的混合液中的物理吸附粒子的含量是0.045质量%以上,则有变得确认不到与所述粒子的含量的增加相应的效果的提升的倾向。
2.抗体的测定
在本发明的测定方法中,使用上述的本发明的含有液而进行抗体的测定。即,可通过使本发明的含有液与从可含有目标抗体的生物体分离的样品接触而检测由负载在所述含有液的不溶性载体粒子的抗原和所述样品中的目标抗体的抗原抗体反应的所述微粒子的反应。不使用稀释液而进行本发明的测定方法也是可能的,适宜地使用稀释液而进行。
在使用稀释液而进行测定时,也可使混合稀释液而稀释的本发明的含有液与所述样品接触,但适宜地使向所述样品加稀释液而稀释的所述样品与本发明的含有液接触。优选使用相对于本发明的含有液而以容积比9倍以下的稀释液,特别优选使用1~5倍的稀释液。
“从可含有目标抗体的生物体分离的样品”只要是有含有被测定抗体的可能性,就不特别限定,如上所述,例如,可举出血液、血清、血浆、尿、淋巴液、刺液、髓液、汗、唾液、胃液、肺清洗液、粪便等,这些中,血液、血清、血浆是适宜的。血清等的样品可根据需要,用生理盐水等稀释。用生理盐水等稀释的样品也包括在“从可含有目标抗体的生物体分离的样品”中。再者,其中的稀释与由稀释液的稀释是分开的。
3.本发明的试剂盒
本发明的试剂盒是用于进行本发明的测定方法的测定用试剂盒,含本发明的含有液及下述的稀释液作为构成要素。
作为本发明的含有液以外的本发明的试剂盒中的构成要素,例如,可举出成为测定对象的目标抗体的标准品、精度管理用试样、稀释液等。
稀释液适宜地是在使“从可含有目标抗体的生物体分离的样品”与本发明的含有液接触之前用于稀释的液体,只要是不实质上抑制目标抗体的测定,就不特别限定。稀释液与本发明的含有液同样、缓冲液是典型的。作为缓冲液,例如,可举出hepes缓冲液等的good缓冲液、tris缓冲液、甘氨酸缓冲液、硼酸缓冲液等。在所述稀释液中,也可根据需要,含有例如,各种电解质、稳定化剂、表面活性剂、增感剂等。所述稀释液优选为与本发明的含有液的溶剂相同或类似。
另外,使用本发明的试剂盒而进行本发明的测定方法时,也可有不使用稀释液而进行测定的,在使用稀释液时,使用相对于本发明的含有液而容积比优选为9倍以下,特别优选为1~5倍的稀释液。
在后述的实施例中,作为用时稀释液的第1试剂是上述的稀释液,作为乳胶分散液的第2试剂是本发明的含有液。含这些第1试剂和第2试剂作为构成要素是本发明的试剂盒的具体例之一。
【实施例】
以下,记载本发明的实施例。%当不特别指定时,是质量%。
[制造例]
1.乳胶
在本实施例中使用的乳胶如下所述。
(1)进行物理吸附法的乳胶
·0.235μm聚苯乙烯乳胶(以下,称为物理乳胶1)
·0.223μm聚苯乙烯乳胶(以下,称为物理乳胶2)
·0.310μm聚苯乙烯乳胶(以下,称为物理乳胶3)
(2)进行化学结合法的乳胶
·0.145μm羧基乳胶(以下,称为化学乳胶1)
·0.245μm羧基乳胶(以下,称为化学乳胶2)
·0.300μm羧基乳胶(以下,称为化学乳胶3)
2.负载抗原的调制
作为本实施例的细菌来源的负载抗原,使用幽门螺杆菌(helicobacterpylori)的调制抗原。所述细菌来源抗原的调制根据以下述的顺序进行。
(1)预备培养
将原菌株使用幽门螺杆菌(helicobacterpylori)选择分离用多孔介质(注册商标)hp分离培养基(荣研化学株式会社)而由anaeropack(三菱气化学株式会社)制成微好氧环境,于37℃进行培养。
(2)主培养
主培养的培养液使用向pearlcore(注册商标)brainheartinfusionbroth培养基‘荣研’(荣研化学株式会社)加5%马血清的培养液200ml。将上述预备培养基的单集落采菌到此主培养液中之后,接种调整到mcfarlandno.1.0的接种菌液,在微好氧气体下,于37℃进行振荡培养。
(3)溶菌
上述主培养结束后,用离心进行集菌,再用生理盐水离心清洗,向沉淀添加溶菌液(含0.15mnacl、0.1%聚氧乙烯辛基苯基醚、5mmedta、0.1%nan3的50mmhepes缓冲液,ph7.4),将其用冷冻融解进行溶菌。
(4)抗原调制
将上述的幽门螺杆菌(helicobacterpylori)的溶解物对于含0.15mnacl、0.1%nan3的hepes缓冲液(ph7.4)而进行透析后,得到离心上清而对其实施孔径0.45μm的膜滤器过滤。以所述过滤物作为抗原,结束抗原调制,以其作为“幽门螺杆菌(helicobacterpylori)溶解物”,供于以下的工序。幽门螺杆菌(helicobacterpylori)溶解物的抗原蛋白浓度由bca法测定。
3.乳胶的负载工序
(1)由物理吸附法的负载
向含有0.09%聚苯乙烯乳胶的液21.1ml添加0.5mches缓冲液(ph8.8)0.48ml之后,将8mg/ml的幽门螺杆菌(helicobacterpylori)溶解物0.25ml混合。将混合液于室温搅拌30分钟之后,添加10%bsa溶液1.04ml,用纯化水将全量设为24.0ml。再者,于56℃加热处理4小时之后,用离心分离除去未吸附抗原。将用离心分离除去未吸附抗原的乳胶再分散于0.01mhepes缓冲液(ph7.4)4.0ml,添加10%bsa溶液0.04ml之后,将其于56℃加热处理2小时。对加热后的含有抗原吸附乳胶的液进行过滤,制作乳胶浓度0.48%的物理吸附乳胶。
通过在由离心分离的未吸附抗原除去后适宜变更在乳胶的再分散中使用的0.01mhepes缓冲液(ph7.4)的容量,可适宜调整制作的物理吸附乳胶的浓度(对于化学结合也是同样)。
(2)由化学结合法的负载
向含有0.3%羧基乳胶的液6.4ml以羧基的2摩尔等量添加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐,搅拌反应15分钟而使羧基活化。向将羧基活化的乳胶含有液添加纯化水63.2ml及0.5mhepes缓冲液(ph7.0)1.28ml后,将8mg/ml的幽门螺杆菌(helicobacterpylori)溶解物0.340ml混合,反应3小时。向反应混合液添加10%bsa溶液0.776ml,反应4小时之后,用离心分离除去未吸附抗原。将用离心分离除去未结合抗原的乳胶再分散于0.01mhepes缓冲液(ph7.4)4.0ml,添加10%bsa溶液0.04ml,于56℃加热处理4小时。对加热后的含有抗原结合乳胶的液进行过滤,制作乳胶浓度0.48%的化学结合乳胶。
(3)乳胶分散液的调制
向含0.3mnacl、0.8ml-精氨酸盐酸盐及0.2%nan3的hepes缓冲液(ph7.4)2.5ml添加上述(1)中调制的物理吸附乳胶1.563ml及上述(2)中调制的化学结合乳胶0.521ml,用纯化水调制作为全量5.0ml而含0.15%的物理吸附乳胶和0.05%的化学结合乳胶的乳胶分散液。
通过适宜选择物理吸附乳胶和化学结合乳胶的添加量,可设为各种混合比率。
4.测定系统
在本实施例中的测定使用浊度法进行。
第1试剂是稀释液(用时稀释液),0.05mhepes、0.15mnacl、0.5%硫酸软骨素na、0.1%bsa、0.1%pbc-34、0.1%nan3ph7.4、余量是纯化水。
第2试剂是乳胶分散液(本发明的含有液),0.05mhepes、0.15mnacl、0.4ml-arg·hcl、0.1%nan3、latexph7.4、余量是纯化水。
测定使用生物化学自动分析装置jca-bm2250(日本电子株式会社)进行。
具体而言,用所述装置,向用生理盐水稀释5倍的样品(血清样品)6.0μl混合第1试剂60μl而于37℃温育5分钟之后,向此混合液混合20μl第2试剂而于37℃反应,对第2试剂混合后约3分钟的在主波长658nm及副波长805nm这两波长处的吸光度变化进行测定。即,在本实施例中,使用相对于第2试剂而容积比3倍的第1试剂(稀释倍率:4倍)。
作为基准法,进行由elisa法(eplate‘荣研’h.pyloriii:荣研化学株式会社)的测定。
[实施例1]2种乳胶的混合效果的探讨
如上所述,使用由不同的方式负载幽门螺杆菌(helicobacterpylori)溶解物的粒径0.235μm的物理吸附乳胶(物理乳胶2)和粒径0.145μm的化学结合乳胶(化学乳胶1)而使用合并血清的稀释系列确认仅使用物理吸附乳胶时、仅使用化学结合乳胶时、及使用这些的混合物时的反应性(表1·图1)。在探讨中使用的第2试剂的乳胶浓度在仅使用物理吸附乳胶时是0.15%,在仅使用化学结合乳胶时是0.30%,在使用混合物时是物理吸附乳胶、化学结合乳胶各自设为0.15%、0.30%。接下来,测定血清样品而探讨各自的情况的特异性(表2)。再者,“表1的反应性的单位”和“图1的纵轴的单位”是吸光度变化量(δod/min)的10000倍的值。
另外,表1所示的物理吸附乳胶及化学结合乳胶的浓度,如上所述,是在第2试剂中的浓度,在测定时的所述乳胶浓度,通过由第1试剂的稀释,各自是所表示的1/4。例如,当表示为“物理乳胶10.15%”时,在测定时的物理乳胶1的浓度是“0.15×1/4=0.0375%”。
【表1】
【表2】
通过向物理吸附乳胶混合化学结合乳胶,原样维持高的阴性一致率而阳性一致率提升、特异性提升,在将物理吸附乳胶、化学结合乳胶在第2试剂中的浓度各自设为0.15%、0.30%(1:2)时,确认到整体的一致率好的结果(表2)。
[实施例2]2种乳胶的混合比率的探讨
如上所述,将用不同的方式负载幽门螺杆菌(helicobacterpylori)溶解物的粒径0.223μm的物理吸附乳胶(物理乳胶2)在第2试剂中的浓度设为0.20%,向其添加粒径0.145μm的化学结合乳胶粒子(化学乳胶1)至成为0~0.20%,测定血清样品而探讨特异性(表3)。
另外,在表3中的物理吸附乳胶和化学结合乳胶的浓度的表示和利用由第1试剂的稀释4倍的测定时的它们的浓度的关系如实施例1中记载。
【表3】物理吸附乳胶=0.223μm、化学结合乳胶=0.145μm
在将化学结合乳胶混合时,通过化学结合乳胶的混合量增加而一致率提升。特别是,伴随化学结合乳胶在第2试剂中的浓度以0%、0.05%、0.10%、0.20%增加而阳性一致率以53%、67%、73%、80%显著地提升,得知能避免假阴性(看漏)。但是,由于物理吸附乳胶的混合量是0.20%,超过后述的0.18%(测定时:0.045%),一致率的延伸是抑制性的(表3)。
[实施例3]2种乳胶的混合比率的探讨(1)
如上所述,使用lz-幽门螺杆菌(h.pylori)抗体校准物‘荣研’(荣研化学株式会社)而探讨将用不同的方式负载幽门螺杆菌(helicobacterpylori)溶解物的粒径0.235μm的物理吸附乳胶粒子(物理乳胶1)在第2试剂中的浓度设为0.12%,向其添加粒径0.300μm的化学结合乳胶粒子(化学乳胶3)至成为0~0.10%时的反应性(表4·图2)、接下来,测定血清样品而探讨特异性(表5)。再者,“表4的反应性的单位”和“图2的纵轴的单位”是吸光度变化量(δod/min)的10000倍的值。
另外,在表4及表5中的物理吸附乳胶和化学结合乳胶的浓度的表示和利用由第1试剂的稀释4倍的测定时的它们的浓度的关系如实施例1记载。
【表4】
【表5】物理吸附乳胶=0.223μm、化学结合乳胶=0.300μm
从结果看,随着相对于物理吸附乳胶的化学结合乳胶的混合量增加,阳性一致率提升,可避免假阴性(看漏)。再者,随着化学结合乳胶的混合量增加,反应性提升,物理吸附乳胶和化学结合乳胶在第2试剂中的浓度比在12:5~12:10(3:1~1:3以内),整体的一致率是适宜的(表5)。
[实施例4]2种乳胶的混合比率的探讨(2)
进一步扩大测定范围而进行与实施例3同宗旨的探讨。使用的乳胶与实施例3同样地是物理乳胶1和化学乳胶3。
(1)测定血清样品而探讨将物理乳胶1在第2试剂中的浓度固定为0.12%,将化学乳胶3的浓度设为0%(物理吸附:化学结合=7.5:0)、0.016%(7.5:1)、0.048%(7.5:3)、0.08%(7.5:5)、0.12%(7.5:7.5)、0.16%(7.5:10)时的特异性(表6)。幽门螺杆菌(h.pylori)抗体值从使用lz-幽门螺杆菌(h.pylori)抗体校准物‘荣研’(荣研化学株式会社)制成的校准曲线求出。
另外,表6中的物理吸附乳胶和化学结合乳胶的浓度的表示和利用由第1试剂的稀释4倍的测定时的它们的浓度的关系如实施例1记载。
【表6】
(2)测定血清样品而探讨将化学乳胶3在第2试剂中的浓度固定为0.08%,将物理乳胶1的浓度设为0%(物理吸附:化学结合=0:5)、0.024%(1.5:5)、0.072%(4.5:5)、0.12%(7.5:5)、0.18%(11.3:5)、0.24%(15:5)时的特异性(表7)。幽门螺杆菌(h.pylori)抗体值从使用lz-幽门螺杆菌(h.pylori)抗体校准物‘荣研’(荣研化学株式会社)制成的校准曲线求出。
另外,在表7中的物理吸附乳胶和化学结合乳胶的浓度的表示和利用由第1试剂的稀释4倍的测定时的它们的浓度的关系如实施例1记载。
【表7】
在上述(1)(2)中,确认到比上述实施例4宽的范围内的物理吸附乳胶和化学结合乳胶的混合的效果。
即,在物理吸附乳胶和化学结合乳胶在第2试剂中的浓度比是7.5:1~7.5:10的范围内进行探讨的结果,在7.5:1的例中,确认到这2种乳胶的混合效果,在其他7.5:3~7.5:10(3:1~1:3以内),整体的一致率是适宜的(表6)。
另外,在上述浓度比是1.5:5~15:5的范围内进行探讨的结果,尽管在1.5:5(5:1~1:5以内)、及4.5:5和7.5:5(3:1~1:3以内),整体的一致率是适宜的,物理吸附乳胶在第2试剂中的浓度是0.18%(测定时:0.045%)以上的2例(11.3:5和15:5的例)是配合比本身在3:1~1:3的范围内,妨碍由混合的特异性的提升效果(表7)。
再者,在物理吸附乳胶和化学结合乳胶之任一方的使用的情况中,阳性一致率和阴性一致率的差异更加极端,但这被认为是因为样品数少。
[实施例5]对于乳胶粒子的粒径的探讨
如上所述,将用不同的方式负载幽门螺杆菌(helicobacterpylori)溶解物的粒径0.235μm的物理吸附乳胶粒子(物理乳胶1)在第2试剂中的浓度设为0.15%,向其混合0.05%粒径0.245μm或0.300μm的化学结合乳胶粒子(各自化学乳胶2(中粒径)、化学乳胶3(大粒径)),测定血清样品而探讨各自的特异性。幽门螺杆菌(h.pylori)抗体值从使用lz-幽门螺杆菌(h.pylori)抗体校准物‘荣研’(荣研化学株式会社)制成的校准曲线求出。结果,整体的一致率(合并阳性一致率和阴性一致率的)各自是92%和88%,确认不到双方实质上的差异。
再者,为了确认给物理吸附乳胶间的粒径的测定值的影响,将物理乳胶2(粒径:0.223μm(中粒径))和物理乳胶3(粒径:0.310μm(大粒径))各自设为第2试剂中0.10%的浓度,将各自的特异性用与上述同样的方法测定,在阳性一致率、阴性一致率、及整体的一致率中确认不到实质上的差异。再者,在本实施例5中,物理吸附乳胶和化学结合乳胶的浓度的表示和利用由第1试剂的稀释4倍的测定时的它们的浓度的关系也如实施例1记载。
从结果确认到,化学结合乳胶的粒径和物理吸附乳胶的粒径在至少中~大粒径中,实质上不影响一同从生物体分离的样品的测定的特异性。
- 还没有人留言评论。精彩留言会获得点赞!