用于鉴定造血细胞亚型的用途、方法、试剂盒、组合物和抗体与流程
本发明涉及使用荧光染料标记的抗体用于鉴定分离样品中的造血细胞亚型、确定其相对频率和/或对其中的细胞数进行定量的用途。
背景技术:
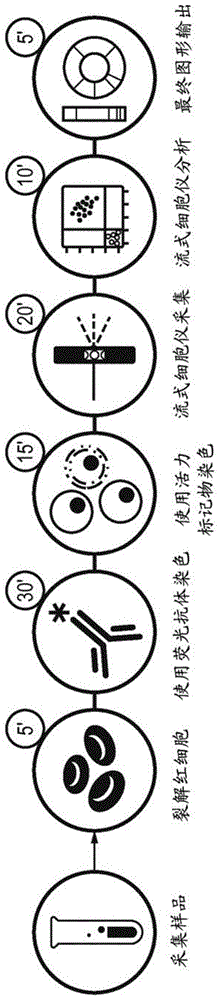
:造血系统是血液中发现的不同成熟细胞谱系细胞的复杂层次结构,这些包括提供对病原体的防护的免疫系统的细胞,携带氧通过机体的细胞和参与创伤愈合的细胞。这些成熟细胞来自造血干细胞(hsc)池,其在称为造血作用的过程中能够自我更新并分化成任何造血细胞谱系。共有20多种不同类型的造血细胞——包括完全分化的成熟细胞类型、部分分化的祖细胞和未成熟细胞以及未分化的多能干细胞。人类造血作用是一个过程,通过该过程具有不同特性和特征的不同造血细胞的分层组织系统从主要存在于骨髓(bm)中的原始造血祖细胞连续产生。对这种复杂系统的精细调控能够维持其重要功能,如凝血、氧/代谢物的转运和病原体/病毒的清除。一些病理状况(如免疫缺陷和肿瘤)能够引起造血细胞分化途径的改变,导致未成熟对比成熟细胞类型的频率失衡或者导致异常的细胞表型(1–13)。例如,原发性免疫缺陷(pid)是影响先天性和适应性免疫系统不同成分(如中性粒细胞、巨噬细胞、树突状细胞、补体蛋白、自然杀伤细胞、t细胞和b细胞)的遗传性疾病,导致细胞分化和/或功能受损。异常的造血作用还可能是转化的造血细胞异常扩增的结果。急性淋巴细胞白血病(all)是一种遗传异质性疾病,主要影响儿童,导致具有淋巴前体样表型的未成熟母细胞的累积(12-15)。急性髓性白血病(aml)是成人中最常见的急性白血病。与all不同的是,aml白血病母细胞显示出更多的异质性髓样表型,其具有增殖和部分分化的能力(11,16)。在all和aml中,白血病母细胞在bm室中占主导地位,其对其他造血谱系有明显的抑制作用,导致造血细胞类型的相对频率严重失衡和外周血(pb)血球减少(1,2,11,13,15)。形态学检查是用于诊断怀疑血液细胞的生理分化发生改变的血液病症(例如,造血/免疫系统病症或血癌)的常规实验室检测之一(1,17,18)。然而,这项检测需要有经验的研究人员,而且非常耗时。此外,这项检测对细胞定量具有局限性,并且在尝试鉴定罕见造血细胞亚型时存在困难。作为检查细胞形态的替代方法,对造血细胞表面上谱系特异性分子标记物的分析提供了更加定量和可重复的结果。在这种方法中,基于表面标记物(例如,cd34、cd38和cd45ra)的表达差异来区分细胞。将某种细胞类型细胞表面标记物特征的特定组合成为细胞的免疫表型。因而,通过同时测量分别与特异性表面标记物结合的多种荧光标记的抗体,可以使用流式细胞术基于免疫表型对不同细胞类型进行高分辨率分类和定量。与所述多色流式细胞术相关的主要挑战是由多种荧光染料发射的光的光谱重叠。鉴于光谱重叠的问题,目前在实验室中使用的大多数流式细胞仪限于十次同时测量,对应于八种不同荧光标记和两种物理参数的检测。由于存在超过20种不同的造血细胞亚型,其中的一些仅能够通过单一标记物的表达差异来区分,因此使用多达八种不同的标记物不足以鉴定全血样品中所有不同的造血细胞亚型。因此,目前不可能通过流式细胞术评估单一样品中所有不同造血细胞亚型的相对频率。通过流式细胞术代替造血细胞分析目前需要将可用的生物样品分配至不同试管中,然后将每个试管用于基于有限组的表面标记物表达分析受限制的造血细胞亚型的组。例如,dongen等(euroflowtm抗体嵌板(2009)handoutat14thehacongress,berlin)开发了能够用于鉴定所关注的特定细胞类型的很多荧光标记抗体的嵌板。wo2011/041912描述了通过cd34+选择或耗尽lin+细胞制备的富含hsc样品的七种颜色流式细胞术分析。然而,这种方法与需要大量原料相关,因为在细胞分离过程中会有损失。此外,这一附加步骤的引入增加了成本和时间负担。perfetto等(2004natrevimmunol4:648-655)报道开发了多色流式细胞术设置,可以将其用于检测多达17个不同的荧光信号。然而,这个较早的方案不能用于区分祖细胞,因此不能将该应用扩展到bm样品。还开发了基于质谱的流式细胞术(质谱流式细胞术),可以将其用于同时研究大量不同的细胞标记物(ornatsky等)。该技术利用了与同抗体相连的分子缀合的重金属同位素。然而,质谱流式细胞术需要对嵌板设计进行广泛的优化。而且,设备成本较高,需要专业人员以及该技术耗时的性质限制了其在常规实验室检测中的应用。因此,仍需要一种用于确定样品中存在的所有不同造血细胞亚型的相对频率的新的和改良的方法。技术实现要素:本发明人设计了一组荧光染料标记的抗体,可以将其用于鉴定分离样品中的造血细胞亚型,确定样品中造血细胞亚型的相对频率和/或对样品中造血细胞亚型内的细胞数进行定量。重要的是,本发明人得出的细胞表面标记物的组合能够对血液样品进行标记,而不需要将样品分成子样品或预先对所关注的细胞亚群进行分离。此外,本发明提供了对血液中存在的各种造血细胞亚型的优异覆盖,使得区分23种不同造血细胞亚型成为可能。可以将确定样品中造血细胞亚型的相对频率和对样品中造血细胞亚型内的细胞数进行定量的能力用于诊断血液病症。例如,确定造血细胞亚型的相对频率能够鉴定不同细胞区室之间细胞的不平衡分布。此外,绝对细胞定量能够检测是否每个细胞区室均在正常细胞范围内。因而,在第一个方面中,本发明提供了使用(i)抗-cd3抗体、(ii)抗-cd56抗体、(iii)抗-cd14抗体、(iv)抗-cd38抗体、(v)抗-cd45抗体、(vi)抗-cd90抗体、(vii)抗-cd135抗体、(viii)抗-cd10抗体、(ix)抗-cd11c抗体、(x)抗-cd19抗体、(xi)抗-cd34抗体、(xii)抗-cd45ra抗体、(xiii)抗-cd7抗体、(xiv)抗-cd71抗体、(xv)抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(xvi)、抗-cd33抗体和/或抗-cd66b抗体,用于鉴定分离样品中的造血细胞亚型,确定分离样品中造血细胞亚型的相对频率和/或对分离样品中造血细胞亚型内的细胞数进行定量的用途,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。抗-cd41/cd61复合抗体是对cd41/cd61复合物具有免疫特异性的抗体。因而,在一个实施方式中,(xv)是抗-cd41/cd61复合抗体。在另一个实施方式中,(xv)是抗-cd41抗体。在另一个实施方式中,(xv)是抗-cd61抗体。在另一个实施方式中,(xv)是抗-cd41抗体和抗-cd61抗体,其中使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。在一个实施方式中,(xvi)是抗-cd33抗体。在另一个实施方式中,(xvi)是抗-cd66b抗体。在另一个实施方式中,(xvi)是抗-cd33抗体和抗-cd66b抗体,其中使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在一个实施方式中,提供了使用(i)抗-cd3抗体、(ii)抗-cd56抗体、(iii)抗-cd14抗体、(iv)抗-cd38抗体、(v)抗-cd45抗体、(vi)抗-cd90抗体、(vii)抗-cd135抗体、(viii)抗-cd10抗体、(ix)抗-cd11c抗体、(x)抗-cd19抗体、(xi)抗-cd34抗体、(xii)抗-cd45ra抗体、(xiii)抗-cd7抗体、(xiv)抗-cd71抗体、(xv)抗-cd41/cd61复合抗体、(xvi)抗-cd33抗体和抗-cd66b抗体,用于鉴定分离样品中的造血细胞亚型,确定分离样品中造血细胞亚型的相对频率和/或对分离样品中造血细胞亚型内的细胞数进行定量的用途,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在一个实施方式中,根据本发明的用途用于鉴定选自下组的一种或多种造血细胞亚型,确定其相对频率和/或对其中的细胞数进行定量:未成熟多形核白细胞(ipmn)、多形核白细胞(pmn)、单核细胞、树突状细胞(dc)/dc祖细胞、成髓细胞、t细胞、自然杀伤t细胞(nkt)、自然杀伤细胞(nk)、b-细胞、前-b细胞、原-b细胞、原淋巴细胞、原成红细胞、成红细胞、造血干细胞(hsc)、多能祖细胞(mpp)、多能淋巴祖细胞(mlp)、早期t祖细胞(etp)、前-b/自然杀伤细胞(pre-b/nk)、共同骨髓祖细胞(cmp)、粒细胞/巨噬细胞祖细胞(gmp)和巨核细胞/红细胞祖细胞(mep)。在另一个方面中,本发明提供了使用(b-i)抗-cd3抗体、(b-ii)抗-cd56抗体、(b-iii)抗-cd45抗体、(b-iv)抗-cd19抗体、(b-v)抗-cd45ra抗体、(b-vi)抗-cd33抗体和/或抗-cd66b抗体、(b-vii)抗-cd4抗体、(b-viii)抗-cd8抗体、(b-ix)抗-cd95抗体、(b-x)抗-tcrγδ抗体、(b-xi)抗-cd127抗体、(b-xii)抗-cd62l抗体、(b-xiii)抗-cd25抗体,用于鉴定分离样品中的淋巴细胞亚型,确定分离样品中淋巴细胞亚型的相对频率和/或对分离样品中淋巴细胞亚型内的细胞数进行定量的用途,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染标记抗-cd33抗体和抗-cd66b。可以将一组标记物(b-i)-(b-xiii)与一组标记物(i)-(xvi)联用(例如,使用相同样品的不同等量分装样品),以提供对可以与能够通过标记物(i)-(xvi)的广泛分析偶联的淋巴细胞的详细分析。由于两组标记物可以与门控策略的相同初始步骤一起使用,因而可以将从两个分析获得的信息合并。或者,使用标记物(b-i)-(b-xiii)的分析可以独立地进行。在一个实施方式中,(b-vi)是抗-cd33抗体。在另一个实施方式中,(b-vi)是抗-cd66b抗体。在另一个实施方式中,(b-vi)是抗-cd33抗体和抗-cd66b抗体,其中使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在一个实施方式中,根据本发明的用途是用于鉴定一个或多个t细胞亚群,确定其相对频率和/或对其中的细胞数进行定量的用途。在一个实施方式中,根据本发明的用途是用于鉴定一个或多个淋巴细胞亚群,确定其相对频率和/或对其中的细胞数进行定量,所述淋巴细胞亚群选自下组:b细胞、t细胞和自然杀伤t细胞(nkt);任选地还针对选自下组的一个或多个t细胞亚群:调节性t细胞(treg)、cd4+t细胞和cd8+t细胞;还任选地针对一个或多个t细胞亚群的一种或多种分化状态(例如,幼稚或记忆)。在另一个方面中,本发明提供了一种用于鉴定分离样品中的造血细胞亚型,确定其相对频率和/或对其中的细胞数进行定量的方法,所述方法包括下述步骤:(a)将样品与(i)抗-cd3抗体、(ii)抗-cd56抗体、(iii)抗-cd14抗体、(iv)抗-cd38抗体、(v)抗-cd45抗体、(vi)抗-cd90抗体、(vii)抗-cd135抗体、(viii)抗-cd10抗体、(ix)抗-cd11c抗体、(x)抗-cd19抗体、(xi)抗-cd34抗体、(xii)抗-cd45ra抗体、(xiii)抗-cd7抗体、(xiv)抗-cd71抗体、(xv)抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体、(xvi)抗-cd33抗体和/或抗-cd66b抗体接触,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同染料标记抗-cd41抗体和抗-cd61抗体;(b)检测荧光染料标记的造血细胞。在一个实施方式中,(xv)是抗-cd41/cd61复合抗体。在另一个实施方式中,(xv)是抗-cd41抗体。在另一个实施方式中,(xv)是抗-cd61抗体。在另一个实施方式中,(xv)是抗-cd41抗体和抗-cd61抗体,其中使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。在一个实施方式中,(xvi)是抗-cd33抗体。在另一个实施方式中,(xvi)是抗-cd66b抗体。在另一个实施方式中,(xvi)是抗-cd33抗体和抗-cd66b抗体,其中使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在一个优选的实施方式中,提供了一种用于鉴定分离样品中的造血细胞亚型,确定其相对频率和/或对其中的细胞数进行定量的方法,所述方法包括下述步骤:(a)将样品与(i)抗-cd3抗体、(ii)抗-cd56抗体、(iii)抗-cd14抗体、(iv)抗-cd38抗体、(v)抗-cd45抗体、(vi)抗-cd90抗体、(vii)抗-cd135抗体、(viii)抗-cd10抗体、(ix)抗-cd11c抗体、(x)抗-cd19抗体、(xi)抗-cd34抗体、(xii)抗-cd45ra抗体、(xiii)抗-cd7抗体、(xiv)抗-cd71抗体、(xv)抗-cd41/cd61复合抗体、(xvi)抗-cd33抗体和抗-cd66b抗体接触,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体;(b)检测荧光染料标记的造血细胞。检测荧光染料标记的造血细胞的步骤可以通过流式细胞术进行。本发明的方法可以适于进一步表征样品中的淋巴细胞亚型。在一个实施方式中,所述方法还可以包括下述步骤:(c)提供样品的另一部分,该部分未在步骤(a)和/或(b)中使用;(d)将步骤(c)的样品与(b-i)抗-cd3抗体、(b-ii)抗-cd56抗体、(b-iii)抗-cd45抗体、(b-iv)抗-cd19抗体、(b-v)抗-cd45ra抗体、(b-vi)抗-cd33抗体和/或抗-cd66b抗体、(b-vii)抗-cd4抗体、(b-viii)抗-cd8抗体、(b-ix)抗-cd95抗体、(b-x)抗-tcrγδ抗体、(b-xi)抗-cd127抗体、(b-xii)抗-cd62l抗体、(b-xiii)抗-cd25抗体接触,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体;(e)检测荧光染料标记的淋巴细胞。在另一个方面中,本发明提供了一种用于鉴定分离样品中的淋巴细胞亚型,确定其相对频率和/或对其中的细胞数进行定量的方法,所述方法包括下述步骤:(a)将样品与(b-i)抗-cd3抗体、(b-ii)抗-cd56抗体、(b-iii)抗-cd45抗体、(b-iv)抗-cd19抗体、(b-v)抗-cd45ra抗体、(b-vi)抗-cd33抗体和/或抗-cd66b抗体、(b-vii)抗-cd4抗体、(b-viii)抗-cd8抗体、(b-ix)抗-cd95抗体、(b-x)抗-tcrγδ抗体、(b-xi)抗-cd127抗体、(b-xii)抗-cd62l抗体、(b-xiii)抗-cd25抗体接触,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体;(b)检测荧光染料标记的淋巴细胞。在一个实施方式中,(b-vi)是抗-cd33抗体。在另一个实施方式中,(b-vi)是抗-cd66b抗体。在另一个实施方式中,(b-vi)是抗-cd33抗体和抗-cd66b抗体,其中使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。检测荧光染料标记的淋巴细胞的步骤可以通过流式细胞术进行。本发明的方法还可以包括将样品与荧光细胞活力标记物接触的步骤;优选的荧光细胞活力标记物选自碘化丙啶(pi)、叠氮溴化丙啶、叠氮溴化乙锭、钙黄绿素am、7-氨基放线菌素(7-aad)、4',6-二脒基-2-苯基吲哚(dapi)及其衍生物;更优选地荧光细胞活力标记物是pi。本发明的方法还可以包括其中在步骤(d)和/或(d)的接触之前将样品与已知数量的微球接触的步骤。优选地,微球是荧光标记的。本发明的方法还可以包括使用门控策略,其包括下述步骤(a)排除细胞聚集体和死细胞;(b)鉴定cd45+细胞(白细胞);(c)区分骨髓细胞群和淋巴细胞群;(d)鉴定骨髓细胞(单核细胞、ipmn、pmn、树突状细胞、成髓细胞和骨髓祖细胞)和淋巴细胞(t细胞、nkt细胞、成熟b细胞、原-b、前-b和nk细胞)的主要亚群;(e)汇集骨髓定向祖细胞和lin-cd34+细胞;和(f)鉴定造血干细胞和祖细胞(hspc)子集。或者,本发明的方法还可以包括使用门控策略,其包括下述步骤:(a)排除细胞聚集体和死细胞;(b)鉴定cd34+细胞(祖细胞);(c)鉴定cd45+细胞(白细胞);(d)从cd34+cd45+细胞群,鉴定hspc子集和lin+cd34+子集。本发明的方法还可以包括下述步骤:(a)裂解样品中的红细胞;和(b)从裂解的红细胞中分离样品中的未裂解细胞。可以将本发明的方法用于鉴定选自下组的一种或多种造血细胞亚型,确定其相对频率和/或对其中的细胞数进行定量:未成熟多形核白细胞(ipmn)、多形核白细胞(pmn)、单核细胞、树突状细胞(dc)/dc祖细胞、成髓细胞、t细胞、自然杀伤t细胞(nkt)、自然杀伤细胞(nk)、b-细胞、前-b细胞、原-b细胞、原淋巴细胞、原成红细胞、成红细胞、造血干细胞(hsc)、多能祖细胞(mpp)、多能淋巴祖细胞(mlp)、早期t祖细胞(etp)、前-b/自然杀伤细胞(pre-b/nk)、共同骨髓祖细胞(cmp)、粒细胞/巨噬细胞祖细胞(gmp)和巨核细胞/红细胞祖细胞(mep)。可以将本发明的方法用于鉴定一种或多种t细胞亚群,确定其相对频率和/或对其中的细胞数进行定量。可以将本发明的方法用于鉴定选自下组的一种或多种淋巴细胞亚型,确定其相对频率和/或对其中的细胞数进行定量:b细胞、t细胞和自然杀伤t细胞(nkt);任选地还针对选自下组的一个或多个t细胞亚群:调节性t细胞(treg)、cd4+t细胞和cd8+t细胞;还任选地针对一个或多个t细胞亚群的一种或多种分化状态(例如,幼稚或记忆)。样品可以是全血样品,和/或其中所述样品获自外周血、骨髓、脐带血(cb)、动员的pb(mpb)、人向小鼠(human-in-mouse)的异种移植或体外人细胞悬液。样品体积可以是10-5000μl;优选地50-1000μl,更优选地100-500μl。体积可以是约10μl;约20μl、约30μl、约40μl、约50μl、约60μl、约70μl、约80μl、约90μl、约100μl、约150μl、约200μl、约250μl、约300μl、约350μl、约400μl、约450μl、约500μl、约750μl、约1000μl、约2000μl、约3000μl、约4000μl;或约5000μl。当样品从bm获得时,可以使用更小体积。例如,bm样品的体积可以是50-200μl。或者,当样品从pb获得时,可以使用更大体积。例如,pb样品的体积可以是200-500μl。在一些实施方式中,鉴定了样品中大于95%的造血细胞亚型,优选地鉴定了样品中大于99%的造血细胞亚型,更优选地鉴定了样品中大于99.5%的造血细胞亚型。在另一个方面中,本发明提供了一种用于鉴定造血细胞亚型、确定其相对频率和/或对其中的细胞数进行定量的试剂盒,所述试剂盒包含(i)抗-cd3抗体、(ii)抗-cd56抗体、(iii)抗-cd14抗体、(iv)抗-cd38抗体、(v)抗-cd45抗体、(vi)抗-cd90抗体、(vii)抗-cd135抗体、(viii)抗-cd10抗体、(ix)抗-cd11c抗体、(x)抗-cd19抗体、(xi)抗-cd34抗体、(xii)抗-cd45ra抗体、(xiii)抗-cd7抗体、(xiv)抗-cd71抗体、(xv)抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体、(xvi)抗-cd33抗体和/或抗-cd66b抗体,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体;任选地其中所述试剂盒包含红细胞裂解缓冲剂。在另一个方面中,本发明提供了一种用于鉴定造血细胞亚型、确定其相对频率和/或对其中的细胞数进行定量的组合物,所述组合物包含(i)抗-cd3抗体、(ii)抗-cd56抗体、(iii)抗-cd14抗体、(iv)抗-cd38抗体、(v)抗-cd45抗体、(vi)抗-cd90抗体、(vii)抗-cd135抗体、(viii)抗-cd10抗体、(ix)抗-cd11c抗体、(x)抗-cd19抗体、(xi)抗-cd34抗体、(xii)抗-cd45ra抗体、(xiii)抗-cd7抗体、(xiv)抗-cd71抗体、(xv)抗cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体、(xvi)抗-cd33抗体和/或抗-cd66b抗体,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。在本发明试剂盒的一个实施方式中,所述试剂盒还包含(b-i)抗-cd3抗体、(b-ii)抗-cd56抗体、(b-iii)抗-cd45抗体、(b-iv)抗-cd19抗体、(b-v)抗-cd45ra抗体、(b-vi)抗-cd33抗体和/或抗-cd66b抗体、(b-vii)抗-cd4抗体、(b-viii)抗-cd8抗体、(b-ix)抗-cd95抗体、(b-x)抗-tcrγδ抗体、(b-xi)抗-cd127抗体、(b-xii)抗-cd62l抗体、(b-xiii)抗-cd25抗体,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在本发明试剂盒和/或组合物的一个实施方式中,(xv)是抗-cd41/cd61复合抗体。在本发明试剂盒和/或组合物的一个实施方式中,(xvi)是抗-cd33抗体和抗-cd66b抗体,其中使用相同荧光染料标记这两种抗体。在本发明试剂盒和/或组合物的一个优选实施方式中,(xv)是抗-cd41/cd61复合抗体和(xvi)是抗-cd33抗体和抗-cd66b抗体,其中使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在另一个方面中,本发明提供了一种用于鉴定淋巴细胞亚型、确定其相对频率和/或对其中的细胞数进行定量的试剂盒,所述试剂盒包含(b-i)抗-cd3抗体、(b-ii)抗-cd56抗体、(b-iii)抗-cd45抗体、(b-iv)抗-cd19抗体、(b-v)抗-cd45ra抗体、(b-vi)抗-cd33抗体和/或抗-cd66b抗体、(b-vii)抗-cd4抗体、(b-viii)抗-cd8抗体、(b-ix)抗-cd95抗体、(b-x)抗-tcrγδ抗体、(b-xi)抗-cd127抗体、(b-xii)抗-cd62l抗体、(b-xiii)抗-cd25抗体,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体;任选地其中所述试剂盒还包含红细胞裂解缓冲液。在另一个方面中,本发明提供了一种用于鉴定淋巴细胞亚型、确定其相对频率和/或对其中的细胞数进行定量的组合物,所述组合物包含(b-i)抗-cd3抗体、(b-ii)抗-cd56抗体、(b-iii)抗-cd45抗体、(b-iv)抗-cd19抗体、(b-v)抗-cd45ra抗体、(b-vi)抗-cd33抗体和/或抗-cd66b抗体、(b-vii)抗-cd4抗体、(b-viii)抗-cd8抗体、(b-ix)抗-cd95抗体、(b-x)抗-tcrγδ抗体、(b-xi)抗-cd127抗体、(b-xii)抗-cd62l抗体、(b-xiii)抗-cd25抗体,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体是,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在一个实施方式中,(b-vi)是抗-cd33抗体和抗-cd66b抗体,其中使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在一个优选的实施方式中,本发明的试剂盒和/或组合物还包含微球,优选地荧光标记的微球,用于提供内部计数标准品。本发明的试剂盒和/或组合物还可以包含荧光细胞活力标记物;优选的荧光细胞活力标记物选自碘化丙啶(pi)、叠氮溴化丙啶、叠氮溴化乙锭、钙黄绿素am、7-氨基放线菌素(7-aad)、4',6-二脒基-2-苯基吲哚及其衍生物;更优选地荧光细胞活力标记物是pi。在另一个方面中,本发明提供了抗-cd90抗体(i)用于诊断血液病症的用途,其中将抗-cd90抗体(i)与抗-cd3抗体(ii)、抗-cd56抗体(iii)、抗-cd14抗体(iv)、抗-cd38抗体(v)、抗-cd45抗体(vi)、抗-cd135抗体(vii)、抗-cd10抗体(viii)、抗-cd11c抗体(ix)、抗-cd19抗体(x)、抗-cd34抗体(xi)、抗-cd45ra抗体(xii)、抗-cd7抗体(xiii)、抗-cd71抗体(xiv)、抗cd41/cd61复合抗体或抗-cd61抗体和/或抗-cd41抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。荧光染料可以选自下组:小分子荧光染料、蛋白荧光染料、有机聚合物荧光染料及其多组分组合。优选地,荧光染料可以选自下组:别藻蓝蛋白(apc)、别藻蓝蛋白花青7(apc-cy7)、别藻蓝蛋白r700(apc-r700)、藻红蛋白(pe)、藻红蛋白花青5(pe-cy5)、藻红蛋白花青7(pe-cy7)、多甲藻素叶绿素蛋白花青5.5(percp-cy5.5)、亮蓝515(bb515)、亮紫421(bv421)、亮紫510(bv510)、亮紫605(bv605)、亮紫650(bv650)、亮紫711(bv711)、亮紫785(bv785)、brilliantultraviolet395(buv395)和brilliantultraviolet737(buv737)。在本发明的任何方面或实施方式中,抗-cd90抗体可以使用蛋白荧光染料标记,抗-cd3抗体可以使用有机聚合物荧光染料标记,抗-cd56抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,抗-cd14抗体可以使用有机聚合物荧光染料标记,抗-cd38抗体可以使用有机聚合物荧光染料标记,抗-cd45抗体可以使用有机聚合物荧光染料标记,抗-cd135抗体可以使用蛋白荧光染料标记,抗-cd10抗体可以使用有机聚合物荧光染料标记,抗-cd11c抗体可以使用有机聚合物荧光染料标记,抗-cd19抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,抗-cd34抗体可以使用有机聚合物荧光染料标记,抗-cd45ra抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,抗-cd7抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,抗-cd71抗体可以使用有机聚合物荧光染料标记,抗-cd41/cd61复合抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,抗-cd61抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,抗-cd41抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,抗-cd33抗体可以使用有机聚合物荧光染料标记和/或抗-cd66b抗体可以使用有机聚合物荧光染料标记。优选地,抗-cd90抗体使用apc标记,抗-cd3抗体使用bv605标记,抗-cd56抗体使用pe-cy5标记,抗-cd14抗体使用bv510标记,抗-cd38抗体使用buv737标记,抗-cd45抗体使用buv395标记,抗-cd135抗体使用pe标记,抗-cd10抗体使用bv785标记,抗-cd11c抗体使用bv650标记,抗-cd19抗体使用apc-r700标记,抗-cd34抗体使用bv421标记,抗-cd45ra抗体使用apc-cy7标记,抗-cd7抗体使用percp-cy5.5标记,抗-cd71抗体使用bv711标记,抗-cd41/cd61复合抗体使用pe-cy7标记,抗-cd41抗体使用pe-cy7标记,抗-cd61抗体使用pe-cy7标记,抗-cd33抗体使用bb515标记和/或抗-cd66b抗体使用bb515标记。在另一个实施方式中,抗-cd3抗体使用bv605标记,抗-cd56抗体使用pe-cy5标记,抗-cd45抗体使用buv395标记,抗-cd19抗体使用apc-r700标记,抗-cd45ra抗体使用apc-cy7标记,抗-cd33抗体使用bb515标记,抗-cd66b抗体使用bb515标记,抗-cd4抗体使用bv711标记,抗-cd8抗体使用buv737标记,抗-cd95抗体使用pe标记,抗-tcrγδ抗体使用bv421标记,抗-cd127抗体使用apc标记,抗-cd62l抗体使用bv510标记和/或抗-cd25抗体使用bv786标记。附图说明图1方案工作流程和门控策略。(a)全血详细研究(wbd)方案流程。在bm或pb取样后,裂解红细胞并使用针对wbd标记物的荧光抗体对样品染色。包括下述步骤:使用碘化丙啶(piu)孵育以区分活细胞和死细胞,使用lsr-fortessa(bdbioscience)进行采集,进行数据分析和用图形表示样品组成。小圈中的数字表示进行各步骤所需的分钟数:一旦设置,在样品送达1.5小时以内可以获得最终wbd结果。(b-e)用于表征健康供体(hd)骨髓(bm,彩色框的左侧)和外周血(pb,彩色框的右侧)的门控策略。(b)黑框,在对物理参数、活细胞/死细胞和全-白细胞cd45标记物表达进行区分后,采用门控策略鉴别骨髓(蓝门)和非骨髓细胞(绿门)。(d)蓝框:骨髓细胞亚型和骨髓定向cd34+细胞(红门和星号)。(c)绿框:针对非骨髓细胞的门控策略鉴定淋巴细胞和谱系阴性(lin-,橙门)细胞。根据cd34表达情况将lin-细胞分为lin-cd34-(橙色星号)和lin-cd34+(红门和星号)细胞。(e)橙框:lin-cd34-亚型(橙色星号);红框:从骨髓定向cd34+(来自d图)和lin-cd34+(来自c图)细胞叠加分析的hspc亚群(双红色星号)。图2形态验证。表中显示了分选策略和从健康供体骨髓分离的骨髓细胞(b)、淋巴细胞(c)和未成熟细胞(d)亚型的所得到的形态。根据表a中列出的标记物和“图1b-e”中所述的门控策略对细胞进行分选。对于每个区室,点图显示了用于鉴定和分选不同亚群的物理参数(左图)和标记物(右图)。右侧的图片显示了观察到的分离细胞的形态(may-grunwald-giemsa染色:在每张照片的右下角报告放大倍数)。图3来自健康供体和患者的bm样品分析:(a)cd45+细胞群组成的示例图示。突出的勾(ticks)能够评价不同造血细胞亚型的相对贡献。环形图显示了造血细胞亚型的频率占总cd45+细胞的百分比。左图:表示未成熟的亚型。“较小分解的”部分显示了未成熟的细胞(lin-cd34-和原-b细胞),而“较大分解的”部分显示了lin-cd34+(hspc)亚群占总cd45+细胞群的频率。环形图左侧的堆积条形图是lin-cd34+区室内不同hspc亚型频率的扩展表示。各图中报告的百分比展示了lin-cd34+细胞占总cd45+细胞的相对频率。右图:表示成熟亚群。环形图未分解的部分(灰色)显示了lin+cd34-细胞的骨髓细胞和淋巴细胞亚群。(b-d)与was(c左图,n=6)、ada-scid(c右图,n=4)、cgd(n=1)患者和mld(d,n=7)受影响个体相比,儿童(b左图,n=5)和成人(b右图,n=5)健康供体(hd)的平均bm造血细胞亚型频率。(ad=成人;ped=儿童;was=wiskott-aldrich综合征;ada-scid=腺苷脱氨酶-重度联合免疫缺陷;cgd=慢性肉芽肿病;mld=异染性脑白质营养不良)。图4来自髓性或淋巴细胞白血病患者的bm样品分析。从a至e:显示1个代表性成人hd(a),5名急性髓性白血病(aml)患者(b-c),1名急性淋巴细胞白血病(all)患者(d)和1名多发性骨髓瘤(mm)患者(e)的bm组成的全血详细研究(wbd)图示。百分比表示具有可能属于白血病母细胞的未成熟标记物的细胞占总cd45+细胞的相对频率。在mm样品中,我们用黑色突出显示了在未知区室中cd38高推定浆母细胞的比例。图5cd34对比cd33/66b标记物能够对白血病样品的类型和分化状态进行分类。左侧的点图显示了cd45标记物的表达(以活细胞门控)和右侧的点图显示了cd34对比cd33/cd66b表面分子的组合表达(以cd45+门控),图中从上到下表示1个代表性成人hd(a),6名急性髓性白血病(aml)患者(b-c),1名急性淋巴细胞白血病(all)患者(d)和1名多发性骨髓瘤(mm)患者(e)。对于mm患者,我们还在未知事件上显示了cd38对比cd34标记物的表达以评价cd38高浆母样细胞的存在情况。图6全血详细研究(wbd)染色的荧光扣除(fmo)对照。使用物理参数(前向散射和侧向散射)、细胞活力标记物(pi)和荧光染料标记区分造血细胞亚群-见实施例1。图7健康供体骨髓和外周血中造血细胞亚群的相对频率。对从健康供体获得的骨髓(bm,n=9)和外周血(pb,n=8)全血样品的比较。从左上角到右下角,条形图显示了bm(左侧堆叠的条形图)和pb(右侧堆叠的条形图)中cd45+(a)、骨髓细胞(b)、淋巴细胞(c)、cd19+(d)、lin-(e)和hspc(f)亚群的分布。堆叠条的顺序对应于每个条形图右侧的图例。图8健康供体和患者中骨髓造血细胞亚型的比较。堆叠的条形图显示了在成人(n=5)和儿童(n=5)健康供体中和在was(n=6),ada-scid(n=7),mld(n=6)和cgd(n=1)患者中的骨髓(bm)造血细胞亚型。(a-b)cd45+区室详细的和一般的组成;(c)骨髓细胞区室内的细胞频率;(d)淋巴细胞区室内的细胞频率;(e)cd19+区室内的细胞频率;(f)lin-区室内的细胞频率;(g)lin-cd34+区室内的细胞频率。堆叠条的顺序对应于每个条形图右侧的图例。图9替代的全血详细研究(wbd)门控策略:(a-d)健康供体(hd)骨髓(bm,彩色框的左侧)和外周血(pb,彩色框的右侧)cd34+区室表征的门控策略。(a)黑框:在对物理参数、活细胞/死细胞和cd34标记物表达丰富的祖细胞进行区分后,采用门控策略鉴别cd45+和cd45-亚群。在cd45+细胞中,我们对骨髓细胞(蓝门)和非骨髓细胞(绿门)进行了区分。(b)蓝框:cd34+骨髓细胞亚型和lin-cd33+祖细胞(红门和星号)。(c)绿框:针对非骨髓细胞的门控策略鉴定淋巴细胞和谱系阴性(lin-,橙门)细胞。(d)橙/红框:从骨髓定向cd34+(来自b图)和lin-cd34+(来自c图)细胞叠加分析的hspc亚群(双红色星号)。图10健康供体和患者中骨髓cd34+造血细胞子集的比较:堆叠的条形图显示了在成人(n=5)和儿童(n=5)健康供体中和在was(n=6),ada(n=7),mld(n=6)和cgd(n=1)患者中的骨髓(bm)cd34+造血细胞亚群。(a)cd34+区室详细的和一般的组成;(b)cd34+细胞内hspc亚群和lin+区室的频率;(c)lin+cd34+区室内lin+cd34+亚群的频率。图11通过全血详细研究(wbd)对造血细胞子集的绝对计数定量。(a)使用pbs稀释全pb的3次独立实验的线性回归。收集来自相同等量分装样品的不同量(500ul,200ul,100ul)的pb。加入pbs以使得所有样品的终体积均达到500ul。在所有样品中使用相同量的计数小珠以计算细胞量并计算线性回归。在右侧报告每次重复的r2和三次重复的平均值。(b)在3个代表性was、ada-scid和mld患者中对bm和pb造血细胞子集进行定量。在同一天从相同患者中收集bm和pb样品。突出的勾(ticks)能够评价不同造血细胞亚型在全血中的绝对计数/ul。图12全血详细研究(wbd)能够对异种移植中的人细胞进行表征。(a)人向小鼠移植的实验方案。使用300.000个脐带血(cb)来源的cd34+细胞/小鼠对经亚致死剂量照射的nsg(n=3)和sgm3(n=3)小鼠进行移植。在6周和13周进行取血。在16周时,将小鼠处死,收集外周血(pb)、骨髓(bm)和脾脏(spl)并进行分析。(b)经治疗小鼠的生存曲线。(c)点图显示了人抗-cd45抗体在总存活细胞中的特异性。左侧为使用人cbcd34+细胞移植的1只nsg和1只sgm3代表性小鼠,右侧为对1只nsg和1只sgm3未移植小鼠的pb分析。(d)右图显示了随着时间的推移pb中人细胞的百分率以及处死时在nsg和sgm3移植小鼠的bm和spl中人细胞的百分率。左图显示了在nsg和sgm3移植小鼠pb中检测到的人细胞的绝对计数。绝对计数以每ul全pb的细胞数表示。(e-f)随着时间的推移在pb中人移植物的组成以及处死时在nsg(e)和3sgm3(f)小鼠的bm和spl中人移植物的组成。突出的勾能够评价不同造血细胞亚型在全血(pb)或在整个器官(bm和spl)中的绝对计数/ul。图13在移植小鼠的外周血中检测人造血细胞:堆叠的条形图显示了人脐带血来源的hspc异种移植后不同时间点nsg(n=3)和3sgm(n=3)小鼠的外周血(pb)中人造血细胞的组成。(a-b)cd45+区室内人细胞详细的和一般的组成。(c)骨髓细胞区室内人骨髓细胞的频率。(d)淋巴细胞区室内人淋巴细胞的频率。(e)lin-区室内人lin-细胞的频率。(f)lin-cd34+区室内人hspc亚型的频率。图14处死时在移植小鼠的骨髓和脾脏中检测人造血细胞:堆叠的条形图显示了人脐带血来源的hspc异种移植后处死时nsg(n=2)和3sgm(n=1)小鼠的骨髓(bm)和脾脏(spl)中人造血细胞的组成。(a-b)cd45+区室内人细胞详细的和一般的组成。(c)骨髓细胞区室内人骨髓细胞的频率。(d)淋巴细胞区室内人淋巴细胞的频率。(e)lin-区室内人lin-细胞的频率。(f)lin-cd34+区室内人hspc亚型的频率。图15在移植小鼠的外周血肿人造血细胞的绝对定量:图中显示了在人脐带血来源的hspc异种移植后在nsg(n=3)和3sgm(n=3)小鼠的外周血(pb)中人造血细胞随着时间推移的绝对计数。(a)在移植小鼠的外周血中人淋巴细胞(绿色)、骨髓细胞(蓝色)和lin-(橙色)亚群随着时间推移的测量结果;(b-c)在移植小鼠的外周血中人骨髓细胞(b)和淋巴细胞(c)子集随着时间推移的绝对细胞计数。图16淋巴细胞子集详细研究的附加组(additionalpanel)。a:用于鉴定t细胞亚群的标记物和荧光染料的表。在ad和pedhd中的cd3+(b)、t细胞(c)、cd4+t细胞(d)、cd8+t细胞(e)子集。具体实施方式除非另有说明,否则本发明的实施将采用细胞生物学、分子生物学、组织学、免疫学、肿瘤学的常规技术,其在本领域普通技术人员的能力范围之内。在文献中对此类技术进行了说明。造血细胞造血细胞,也称为血细胞(bloodcell)、血细胞(hemocyte)或血细胞(hematocyte)是血液的细胞成分。造血谱系中的细胞来源于多能造血干细胞(hsc),其能够自我更新和分化成任何血细胞谱系,并提供所有造血细胞谱系的终生生产。造血祖细胞还具有分化成更特化的细胞类型的能力。然而,与hsc不同的是,其已经更加特化,即其已经被推动分化成了其“靶”细胞。干细胞与祖细胞之间的区别在于干细胞能够无限复制,而祖细胞只能分裂有限次数。如在本申请中所使用的,应将术语“分化细胞”理解为比hsc更特化的细胞。细胞分化可以在多细胞生物体发育过程中发生,当生物体从单个受精卵变为组织和细胞类型的复杂系统。分化还是在成体中的常见过程:在组织修复和正常细胞更新过程中,成体干细胞分裂并产生完全分化的子代细胞。分化显著改变了细胞的尺寸、形状、膜电势、代谢活性和对信号的响应。这些变化在很大程度上是由于基因表达中的高度受控的修饰。换句话说,分化细胞是具有特定结构并由于涉及特定基因的激活与失活的发育过程而发挥特定功能的细胞。因而,如在本申请中所使用的,术语“造血细胞”包括最原始的(最少分化的)hsc和来自hsc的所有细胞,无论其分化状态如何。因此,造血谱系包括未成熟的多形核白细胞(ipmn)、多形核白细胞(pmn)、单核细胞、树突状细胞(dc)/dc祖细胞、成髓细胞、t细胞、自然杀伤t细胞(nkt)、自然杀伤细胞(nk)、b-细胞、前-b细胞、原-b细胞、原淋巴细胞、原成红细胞、成红细胞、造血干细胞(hsc)、多能祖细胞(mpp)、多能淋巴祖细胞(mlp)、早期t祖细胞(etp)、前-b/自然杀伤细胞(pre-b/nk)、共同骨髓祖细胞(cmp)、粒细胞/巨噬细胞祖细胞(gmp)和巨核细胞/红细胞祖细胞(mep)。分化的造血细胞属于骨髓细胞谱系或淋巴细胞谱系。骨髓细胞谱系包括血小板、红细胞、粒细胞和单核细胞(例如,巨噬细胞和骨髓树突状细胞)。淋巴细胞谱系包括b细胞、t细胞、自然杀伤细胞和淋巴树突状细胞。可以通过各自存在或不存在骨髓细胞标记物(如cd33或cd66b)来区分骨髓细胞和淋巴细胞。可以根据cd33和cd66b表达的组合区分骨髓细胞和淋巴细胞。因此,造血细胞包括超过20种不同的细胞亚型,其每种具有不同的特征和功能。例如,通过在显微镜下检查细胞形态,可以将造血细胞亚型彼此区分开。然而,这是耗时的并且需要受过专门训练的细胞生物学家。此外,密切相关细胞之间的形态差异很难通过肉眼辨别。在一种替代方法中,可以根据细胞表面标记物的差异表达来鉴定和分类造血细胞亚型,如在细胞膜上暴露的受体蛋白或配体。可以使用分化群(cd)命名法来指代此类细胞标记物。例如,cd4是在t辅助细胞表面上表达的蛋白,而cd8是在细胞毒性t细胞表面上表达的蛋白。cd分子可以是一种以上细胞类型共有的,例如,cd45,其由所有白细胞表达(即,其均为cd45+),但不由红细胞表达(即,其均为cd45-)。因此,为了明确地彼此区分样品中的每个造血细胞亚型,有必要检查若干cd分子的表达状态。这能够确定所谓的细胞免疫表型。根据本发明,可以使用对下述cd标记物具有特异性的抗体鉴定造血细胞亚型:cd3、cd56、cd14、cd38、cd45、cd90、cd135、cd10、cd11c、cd19、cd34、cd45ra、cd7、cd71、cd61、cd41、cd41/cd61复合物;cd33或cd66b。本发明中鉴定的造血细胞亚型可以具有如表1中所示的免疫表型。表1:造血细胞亚型的免疫表型抗体如在本申请中所使用的,应将术语“抗体”理解为基本上由免疫球蛋白基因或者免疫球蛋白基因或其片段编码的多肽,其特异性结合和识别抗原(例如,细胞表面标记物)。如在本申请中所使用的,术语“抗体”指全部或完整的抗体分子(例如,igm、igg(包括igg1、igg2、igg3和igg4)、iga、igd或ige)或其任意抗原结合片段。抗体可以是多克隆抗体或单克隆抗体。单克隆抗体由相同免疫细胞生产(例如,由产生抗体的b细胞系与癌性b细胞系融合产生的杂交瘤)。针对特定抗原的单克隆抗体将识别在所述抗原上的单个特异性表位。而相反的是,多克隆抗体由多个不相同的细胞系生产,因此识别特定抗原上若干不同的表位。抗体的抗原结合片段包括例如单链抗体、单链fv片段(scfv)、fd片段、fab片段、fab'片段或f(ab')2片段。scfv片段是单一多肽链,其包含scfv所来自的抗体的重链和轻链可变区。此外,胞内抗体、微抗体、三体和双体(参见,例如todorovska等(2001)jimmunolmethods248(1):47-66;hudson和kortt(1999)jimmunolmethods231(1):177-189;poljak25(1994)structure2(12):1121-1123;rondon和marasco(1997)annualreviewofmicrobiology21:257-283)也包括在抗体的定义中并且适用于本申请所述的方法。如在本申请中所使用的,术语“抗体”还包括通过修饰完整抗体产生的抗体片段或使用重组方法从头合成的抗体片段。用于生产针对特定抗原的抗体或其抗原结合片段的适宜方法是本领域公知的(参见例如,greenfield(2014)antibodies:alaboratorymanual,第2版,201-221)。抗-cd41/cd61复合抗体是对cd41/cd61复合物具有免疫特异性的抗体。cd41/cd61,也称为gpiib/iiia,是整合素受体家族成员。其是由cd41和cd61通过非共价结合形成的复合物。荧光染料如在本申请中所使用的,术语“荧光染料”指在用具有特定波长的吸收光激发后可以重新发光的荧光分子。通常地,由荧光染料发射的光具有比吸收的光更长的波长。术语“荧光染料”可以与术语“荧光团”、“荧光标记”、“荧光染料(fluorescentdye)”、“荧光标签”、“荧光标记物”、“荧光探针”和“荧光报告分子”互换使用。可以通过很多性质对荧光染料进行表征。此类性质包括最大激发和发射波长,其对应于荧光染料发射和激发光谱的各个峰。最大激发和发射波长之间的差异称为斯托克斯位移。可以用于表征荧光染料的其他参数包括消光系数,其是在给定波长下吸收的光量的浓度依赖性指标;量子产率,其是衡量从吸收光向发射光的能量转移效率的指标;和荧光寿命——即荧光染料重新发光并返回基态之前的激发态的持续时间。本发明涉及使用不同荧光染料标记的抗体的用途。可以以其特征性质对不同荧光染料加以区分。例如,不同荧光染料可以具有不同的最大激发波长、不同的发射波长、不同的斯托克斯位移、不同的消光系数、不同的量子产率和/或不同的荧光寿命。荧光染料可以由单个荧光分子构成,其负责光的吸收和发射。或者,荧光染料可以是多组分系统,例如串联荧光染料,其包含负责光的吸收的供体分子和负责光的发射的受体分子。能够通过荧光共振能量转移从激发的供体分子向受体分子转移。荧光染料大致可以分为四类:小分子、蛋白(或肽)、有机聚合物和量子点。小分子荧光染料多种小分子荧光染料是本领域公知的——参见例如,lavis和raines(2008)acschembiol20;3(3):142-155。小分子荧光团通常具有200-2000da的分子量。小分子荧光染料可以选自芳香族氨基酸(例如,苯丙氨酸、酪氨酸和色氨酸);多环芳烃(例如,萘、芘和蒽的衍生物);香豆素;喹诺酮;吲哚(例如,dapi);咪唑(例如,hoechst染料);苯并恶二唑衍生物(例如,nbd);荧光素;罗丹明;萘并氧杂蒽;菲啶;二氟化硼二吡咯甲川(bodipy)衍生物;花青;酞菁;恶嗪;和三芳基甲烷。花青荧光染料的特征为在两个氮原子之间具有聚甲炔链(即,r2n-(ch=ch)n-ch=n+r2),其中通常n=2、3、5或7。因此,在一些实施方式中,至少一种荧光染料是花青或其衍生物。在一些实施方式中,花青在其聚甲炔链中具有2、3、5或7个甲炔基团。在一些实施方式中,至少一种荧光染料是三芳基甲烷,优选地是乙基-[4-[[4-[乙基-[(3-磺基苯基)甲基]氨基]苯基]-(2-磺基苯基)亚甲基]-1-环己-2,5-二亚乙基]-[(3-磺基苯基)甲基]铵(也称为亮蓝)。蛋白荧光染料蛋白(肽)荧光染料是本领域熟知的,并且可以具有约20-300kda的分子量。蛋白荧光染料包含至少一个称为发色团的荧光基团,其负责光的吸收和发射。这种发色团可以由如在绿色荧光蛋白(gfp)中经修饰的氨基酸残基提供,gfp是从aequoravictoria水母中首次分离得到的。gfp的衍生物包括增强的gfp(egfp);黄色荧光蛋白(yfp)及其衍生物(例如,citrine、venus和ypet);蓝色荧光蛋白(bfp)及其衍生物(例如,增强的ebfp和azurite);青色荧光蛋白(cfp)及其衍生物(例如,增强的cfp、cerulean和cypet,以及mturquoise2);morange;和mcherry。蛋白荧光染料的替代类别是由光合蓝藻和藻类生产的藻胆蛋白。与gfp衍生物不同的是,藻胆蛋白的发色团由称为bilin的辅因子提供,其具有四个吡咯环的线性排布。因此,在一些实施方式中,至少一种荧光染料是藻胆蛋白或其衍生物。荧光染料可以是藻红蛋白(pe);藻蓝蛋白(cpc);别藻蓝蛋白(apc);或包含pe、cpc、apc或其衍生物的多组分体系;或者其衍生物。可以用于本发明的另一类别的蛋白荧光染料是多甲藻黄素叶绿素蛋白(percp),其由光合作用的鞭毛藻类生产(参见例如,hofman等,(1996)sciencevol.272,pp.1788-1791)。因而,在一些实施方式中至少一种荧光染料是percp;包含percp或其衍生物的多组分体系;或其衍生物。有机聚合物荧光染料有机聚合物荧光染料由协同发挥作用的重复荧光亚基构成。例如,一些聚合物荧光染料包含具有交替的单键和双键以及芳香单元的不饱和有机部分。这种共轭结构产生连续的π-轨道系统,并且在聚合物荧光染料的长度上延伸电子离域,产生例如较大的消光系数(>106m-1cm-1)和较高的荧光强度。参见例如,chattopadhyay等,(2012)cytometryparta81a:456-466和导电聚合物手册,第3版,共轭聚合物,第14、17和22章。可以用于本发明的市售有机聚合物荧光染料的实例是由biolegend开发的亮紫tm(bv)系列和由bdbiosciences开发的brilliantultraviolettm(buv)。因而,在一些实施方式中,至少一种荧光染料是有机聚合物荧光染料,包含有机聚合物荧光染料的多组分体系,或其衍生物。量子点荧光染料量子点(qd)是具有范围从2-10nm直径的半导体材料的颗粒或纳米晶体,其能够重新发射吸收的光。激发qd所需的能量取决于其直径。因此,可以通过改变其直径来调节qd的发射波长(即,荧光颜色)。qd的其他有利性质包括具有较高的光稳定性和较大的消光系数(参见例如,resch-genger(2008)naturemethods5,763-775)。可以采用本领域公知的任何方法生产qd点。因而,在一些实施方式中,至少一种荧光染料是qd荧光染料,包含qd荧光染料的多组分体系,或其衍生物。可以用于本发明的荧光染料的实例是具有下述光谱性质的荧光染料:*替代激发波长荧光染料可以选自例如下组:别藻蓝蛋白(apc)、别藻蓝蛋白花青7(apc-cy7)、别藻蓝蛋白r700(apc-r700)、藻红蛋白(pe)、藻红蛋白花青5(pe-cy5)、藻红蛋白花青7(pe-cy7)、多甲藻素叶绿素蛋白花青5.5(percp-cy5.5)、亮蓝515(bb515)、亮紫421(bv421)、亮紫510(bv510)、亮紫605(bv605)、亮紫650(bv650)、亮紫711(bv711)、亮紫785(bv785)、brilliantultraviolet395(buv395)和brilliantultraviolet737(buv737)。荧光染料可以具有如下所示的光谱性质。*替代激发波长荧光染料标记的抗体本发明涉及使用荧光染料标记的抗体的用途。如在本申请中所使用的,应将“标记的”理解为意指将抗体结合、缀合、标记、连接或附接至荧光染料。抗体可以是共价或非共价标记的。举例来说,可以通过反应性胺基标记抗体,例如暴露的赖氨酸侧链胺基或α-胺基。本领域技术人员能够常规制备用荧光染料标记的抗体而无需过多的实验。可以根据本领域公知的任何方法制备使用荧光染料标记的抗体。例如,可以将市售的荧光染料标记的抗体用于本发明。在本发明的任何方面或实施方式中,抗-cd90抗体可以使用蛋白荧光染料标记,抗-cd3抗体可以使用有机聚合物荧光染料标记,抗-cd56抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,抗-cd14抗体可以使用有机聚合物荧光染料标记,抗-cd38抗体可以使用有机聚合物荧光染料标记,抗-cd45抗体可以使用有机聚合物荧光染料标记,抗-cd135抗体可以使用蛋白荧光染料标记,抗-cd10抗体可以使用有机聚合物荧光染料标记,抗-cd11c抗体可以使用有机聚合物荧光染料标记,抗-cd19抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,抗-cd34抗体可以使用有机聚合物荧光染料标记,抗-cd45ra抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,抗-cd7抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,抗-cd71抗体可以使用有机聚合物荧光染料标记,抗-cd41/cd61复合抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,抗-cd61抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,抗-cd41抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,抗-cd33抗体可以使用有机聚合物荧光染料标记和/或抗-cd66b抗体可以使用有机聚合物荧光染料标记。在本发明的任何方面或实施方式中,抗-cd90抗体可以使用具有约635nm的激发波长和约650-670nm范围的最大发射波长的荧光染料标记;抗-cd3抗体可以使用具有约405nm的激发波长和约590-620nm范围的最大发射波长的荧光染料标记;抗-cd56抗体可以使用具有约561nm或约488nm的激发波长和约650-690nm范围的最大发射波长的荧光染料标记;抗-cd14抗体可以使用具有约405nm的激发波长和约480-560nm范围的最大发射波长的荧光染料标记;抗-cd38抗体可以使用具有约355nm的激发波长和约720-760nm范围的最大发射波长的荧光染料标记;抗-cd45抗体可以使用具有约355nm的激发波长和约365-430nm范围的最大发射波长的荧光染料标记;抗-cd135抗体可以使用具有约561或约488nm的激发波长和约560-610nm范围的最大发射波长的荧光染料标记;抗-cd10抗体可以使用具有约405nm的激发波长和约750-810nm范围的最大发射波长的荧光染料标记;抗-cd11c抗体可以使用具有约405nm的激发波长和约630-670nm范围的最大发射波长的荧光染料标记;抗-cd19抗体可以使用具有约635nm的激发波长和约690-720nm范围的最大发射波长的荧光染料标记;抗-cd34抗体可以使用具有约405nm的激发波长和约410-460nm范围的最大发射波长的荧光染料标记;抗-cd45ra抗体可以使用具有约635nm的激发波长和约750-810nm范围的最大发射波长的荧光染料标记;抗-cd7抗体可以使用具有约488nm的激发波长和约670-720nm范围的最大发射波长的荧光染料标记;抗-cd71抗体可以使用具有约405nm的激发波长和约685-735nm范围的最大发射波长的荧光染料标记;抗-cd41抗体可以使用具有约561nm或约488nm的激发波长和约750-810nm范围的最大发射波长的荧光染料标记;抗-cd61抗体可以使用具有约561nm或约488nm的激发波长和约750-810nm范围的最大发射波长的荧光染料标记;抗-cd41/cd61复合抗体可以使用具有约561nm或约488nm的激发波长和约750-810nm范围的最大发射波长的荧光染料标记;抗-cd33抗体可以使用具有约488nm的激发波长和约495-550nm范围的最大发射波长的荧光染料标记;和/或抗-cd66b抗体可以使用具有约488nm的激发波长和约495-550nm范围的最大发射波长的荧光染料标记。抗-cd90抗体可以使用具有约635nm的激发波长和约650-670nm范围的最大发射波长的蛋白荧光染料标记;抗-cd3抗体可以使用具有约405nm的激发波长和约590-620nm范围的最大发射波长的有机聚合物荧光染料标记;抗-cd56抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,其中多组分荧光染料具有约561nm或约488nm的激发波长和约650-690nm范围的最大发射波长;抗-cd14抗体可以使用具有约405nm的激发波长和约480-560nm范围的最大发射波长的有机聚合物荧光染料标记;抗-cd38抗体可以使用具有约355nm的激发波长和约720-760nm范围的最大发射波长的有机聚合物荧光染料标记;抗-cd45抗体可以使用具有约355nm的激发波长和约365-430nm范围的最大发射波长的有机聚合物荧光染料标记;抗-cd135抗体可以使用具有约561或488nm的激发波长和约560-610nm范围的最大发射波长的蛋白荧光染料标记;抗-cd10抗体可以使用具有约405nm的激发波长和约750-810nm范围的最大发射波长的有机聚合物荧光染料标记;抗-cd11c抗体可以使用具有约405nm的激发波长和约630-670nm范围的最大发射波长的有机聚合物荧光染料标记;抗-cd19抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,其中多组分荧光染料具有约635nm的激发波长和约690-720nm范围的最大发射波长;抗-cd34抗体可以使用具有约405nm的激发波长和约410-460nm范围的最大发射波长的有机聚合物荧光染料标记;抗-cd45ra抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,其中多组分荧光染料具有约635nm的激发波长和约750-810nm范围的最大发射波长;抗-cd7抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,其中多组分荧光染料具有约488nm的激发波长和约670-720nm范围的最大发射波长;抗-cd71抗体可以使用具有约405nm的激发波长和约685-735nm范围的最大发射波长的有机聚合物荧光染料标记;抗-cd41抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,其中多组分荧光染料具有约561nm或约488nm的激发波长和约750-810nm范围的最大发射波长;抗-cd61抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,其中多组分荧光染料具有约561nm或约488nm的激发波长和约750-810nm范围的最大发射波长;抗-cd41/cd61复合抗体可以使用包含蛋白荧光染料和小分子荧光染料的多组分荧光染料标记,其中多组分荧光染料具有约561nm或约488nm的激发波长和约750-810nm范围的最大发射波长;抗-cd33抗体可以使用具有约488nm的激发波长和约495-550nm范围的最大发射波长的有机聚合物荧光染料标记;和/或抗-cd66b抗体可以使用具有约488nm的激发波长和约495-550nm范围的最大发射波长的有机聚合物荧光染料标记。优选地,抗-cd90抗体可以使用apc标记,抗-cd3抗体可以使用bv605标记,抗-cd56抗体可以使用pe-cy5标记,抗-cd14抗体可以使用bv510标记,抗-cd38抗体可以使用buv737标记,抗-cd45抗体可以使用buv395标记,抗-cd135抗体可以使用pe标记,抗-cd10抗体可以使用bv785标记,抗-cd11c抗体可以使用bv650标记,抗-cd19抗体可以使用apc-r700标记,抗-cd34抗体可以使用bv421标记,抗-cd45ra抗体可以使用apc-cy7标记,抗-cd7抗体可以使用percp-cy5.5标记,抗-cd71抗体可以使用bv711标记,抗-cd41/cd61复合抗体可以使用pe-cy7标记,抗-cd41抗体可以使用pe-cy7标记,抗-cd61抗体可以使用pe-cy7标记,抗-cd33抗体可以使用bb515标记和/或抗-cd66b抗体可以使用bb515标记。在另一个实施方式中,抗-cd3抗体使用具有约405nm的激发波长和约590-620nm范围的最大发射波长的荧光染料标记;抗-cd56抗体使用具有约561nm或约488nm的激发波长和约650-690nm范围的最大发射波长的荧光染料标记;抗-cd45抗体使用具有约355nm的激发波长和约365-430nm范围的最大发射波长的荧光染料标记;抗-cd19抗体使用具有约635nm的激发波长和约690-720nm范围的最大发射波长的荧光染料标记;抗-cd45ra抗体使用具有约635nm的激发波长和约750-810nm范围的最大发射波长的荧光染料标记;抗-cd33抗体使用具有约488nm的激发波长和约495-550nm范围的最大发射波长的荧光染料标记;抗-cd66b抗体使用具有约488nm的激发波长和约495-550nm范围的最大发射波长的荧光染料标记;抗-cd4抗体使用具有约405nm的激发波长和约685-735nm范围的最大发射波长的荧光染料标记;抗-cd8抗体使用具有约355nm的激发波长和约720-760nm范围的最大发射波长的荧光染料标记;抗-cd95抗体使用具有约561nm或约488nm的激发波长和约560-610nm范围的最大发射波长的荧光染料标记;抗-tcrγδ抗体使用具有约405nm的激发波长和约410-460nm范围的最大发射波长的荧光染料标记;抗-cd127抗体使用具有约635nm的激发波长和约650-670nm范围的最大发射波长的荧光染料标记;抗-cd62l抗体使用具有约405nm的激发波长和约480-560nm范围的最大发射波长的荧光染料标记;和/或抗-cd25抗体使用具有约405nm的激发波长和约750-810nm范围的最大发射波长的荧光染料标记。优选地,抗-cd3抗体使用bv605标记,抗-cd56抗体使用pe-cy5标记,抗-cd45抗体使用buv395标记,抗-cd19抗体使用apc-r700标记,抗-cd45ra抗体使用apc-cy7标记,抗-cd33抗体使用bb515标记,抗-cd66b抗体使用bb515标记,抗-cd4抗体使用bv711标记,抗-cd8抗体使用buv737标记,抗-cd95抗体使用pe标记,抗-tcrγδ抗体使用bv421标记,抗-cd127抗体使用apc标记,抗-cd62l抗体使用bv510标记和/或抗-cd25抗体使用bv786标记。荧光细胞活力标记物分离的造血细胞样品含有活(存活)细胞和死细胞。死细胞在已经活化或解冻的样品中特别普遍,并且当尝试分析那些以较低频率(例如,小于群体的1%)存在的造血细胞亚型时是有问题的。特别是,在采用免疫染色法的情况下,由于抗体具有与死细胞非特异性结合的倾向,因而死细胞能够导致较大错误。解决死细胞问题的一种方法是在分析活细胞群的组成之前将活细胞与死细胞相分离,从而减少非特异性抗体结合。在另一种方法中,可以将荧光细胞活力标记物用于区分样品中存在的活造血细胞和死造血细胞。因而,本发明的方法还可以包括将样品与荧光细胞活力标记物接触的步骤。荧光细胞活力标记物可以对死细胞或活细胞具有特异性。在一个优选的实施方式中,荧光细胞活力标记物对死细胞具有特异性。在一个实施方式中,荧光细胞活力标记物选自碘化丙啶(pi)、叠氮溴化丙啶、叠氮溴化乙锭、钙黄绿素am、7-氨基放线菌素(7-aad)、4',6-二脒基-2-苯基吲哚(dapi)及其衍生物。pi是荧光嵌入剂,其最大激发波长为535nm和最大发射波长为617nm。pi是膜不可渗透的,因而被排除在活细胞之外。因此,由于pi仅被死细胞摄入,因而可以根据pi荧光信号将其与活细胞群相区分。因而,在本发明优选的实施方式中,荧光细胞活力标记物是碘化丙啶(pi)。标记细胞的检测可以采用本领域公知的任意适宜方法检测荧光染料标记的造血细胞。在一些实施方式中,检测荧光染料标记的细胞的步骤通过流式细胞术进行。在流式细胞术实验中,通过使悬浮在液体流中的细胞通过由适当定位的激光产生的光束,在逐个细胞的基础上进行高通量多参数分析(也称为采集)。将测得的细胞散射光的程度作为所谓的物理参数。此外,可以通过适当定位的检测器测量通过光束的激发荧光染料标记细胞(或自发荧光细胞)的相对荧光。现代的流式细胞仪配有不同波长(例如,红色、蓝色、绿色和紫色)的多个光源和多个检测器,使得能够同时测量多达17种不同的荧光信号(参见例如,perfetto等,(2004)natrevimmunol4:648-655)。因而,可以使用17色流式细胞术进行荧光染料标记细胞的检测步骤。绝对细胞定量本发明的用途、方法和试剂盒能够对每种细胞亚型内的细胞数进行定量。可以通过将样品与已知数量的独立的可鉴定实体接触实现细胞定量,所述独立的可鉴定实体可以提供针对其对细胞数进行定量的参照。例如,可以将微球(在本申请中也称为“小珠”或“计数小珠”)与样品接触以实现定量,所述微球可以是形态上不同于细胞的和/或可以被标记(例如,荧光标记的)。微球的功能是提供内部计数标准品。适宜的微球是市售的,如precisioncountbeadstm(biolegend)。通常,计数小珠是经校正的荧光微球(例如,约7-10μm)混悬液形式,其可以在宽波长范围内检测到(例如,激发uv-635nm和发射385-800nm)并且含有已知浓度的微球。通过对微球与细胞的形态参数进行比较可以独立于门控策略进行细胞定量。例如,当血液样品(vs)和小珠溶液(vb)的初始量;小珠的浓度(cb);和所采集的细胞数(es)和小珠(eb)事件数已知时,可以根据下述公式计算所分析样品的细胞计数(cs):门控策略本发明人设计了可以与本发明的不同方面一起使用的门控策略。本申请所述的主要门控策略能够鉴定例如多达23种不同的造血细胞亚型。可以将主要门控策略用于分析样品中的所有造血细胞亚型。因此,门控策略对于提供造血状态的一般情况是有用的。门控策略可以包括下述步骤:1)排除双联体(doublet)和死细胞2)鉴定白细胞区室(cd45+)3)区分两种主要的成熟区室,淋巴细胞和骨髓细胞4)将每个区室拆解(dissect)成其主要亚群5)混合骨髓定向祖细胞和lin-cd34+细胞6)鉴定造血干细胞和祖细胞(hspc)子集主要门控策略还可以包括附加步骤,例如实施例1中所示的步骤。在某些临床方案中,仅基于cd34标记物的表达鉴定祖细胞(例如,在离体造血干细胞/祖细胞基因治疗中)。本发明人设计了一种替代的门控策略,其可以用于更加详细地分析祖细胞区室(cd34+细胞)。可以将替代的门控策略用于鉴定lin-cd34+子集(hspc)和lin+cd34+(即,仍表达cd34标记物的分化的细胞)。这种替代的门控策略可以基于下述步骤:(a)排除双联体和死细胞;(b)鉴定cd34+细胞(祖细胞);(c)鉴定cd45+细胞(白细胞);(d)从cd34+cd45+细胞群,鉴定hspc子集和lin+cd34+子集。替代的门控策略还可以包括附加步骤,例如实施例1中所述的一个或多个步骤。细胞聚集体(也称为双联体)可以在称为双联体鉴别的过程中与单细胞相区分,这是本领域所熟知的。可以使用荧光细胞活力标记物将死细胞与活细胞相区分。可以基于cd33和cd66b的表达鉴定和区分骨髓细胞群和淋巴细胞群。例如,骨髓细胞可以是cd33+和/或cd66b+,而淋巴细胞是cd33-和cd66b-。如在本申请中所使用的,术语“谱系阳性(lin+)细胞”指表达至少一种谱系成熟标记物(例如,cd3、cd19或cd14)的造血细胞亚型。因此,可以基于至少一种谱系成熟标记物(例如,cd3、cd19或cd14)的表达鉴定和区分lin+细胞。另一方面,术语“谱系阴性(lin-)细胞”指不表达任何谱系成熟标记物的造血细胞亚型。缺乏谱系标记物的表达表明该群处于不成熟的状态。有利地,本申请所述的门控策略能够分析所有主要谱系阳性成熟细胞、未成熟祖细胞和hspc。也可以将替代的门控策略用于本发明的方法中(例如,用于特定目的)。本发明的方法还可以包括使用实施例1中所述的门控策略或其变体。红细胞红细胞(也称为红细胞(erythrocyte))是丰度最高的造血细胞亚型。红细胞的存在能够降低同一样品中其他荧光染料标记的造血细胞亚型的相对信号强度。因此,为了提高流式细胞数据采集和分析的准确度,可以在数据采集之前从样品中除去红细胞。因而,在一些实施方式中,本发明的方法还包括下述步骤:(i)裂解样品中的红细胞;和(ii)将样品中的未裂解细胞与裂解的红细胞相分离。可以通过本领域公知的任意适宜方法进行裂解样品中的红细胞的步骤,例如通过将样品与红细胞裂解缓冲液接触。红细胞裂解缓冲液可以包含氯化铵(nh4cl)。将样品与红细胞裂解缓冲液接触后,可以搅拌样以有效裂解,例如通过涡旋。可以使用本领域公知的适宜方法进行将样品中未裂解的细胞与裂解的红细胞分离的步骤,例如通过离心,其中未裂解的细胞形成球团,然后可以将上清液中裂解的红细胞弃去。样品本发明涉及确定造血细胞亚型和/或淋巴细胞亚型的相对频率。如在本申请中所使用的,应将相对频率理解为样品中特定造血细胞和/或淋巴细胞亚型的相对比例,例如样品中的特定造血细胞和/或淋巴细胞亚型相对于总造血细胞和/或淋巴细胞群的百分比。然而,还可以将本发明用于对造血细胞和/或淋巴细胞亚型内的细胞数进行定量。本发明能够对分离样品中的造血细胞和/或淋巴细胞亚型进行鉴定,确定分离样品中的造血细胞和/或淋巴细胞亚型的相对频率和/或对造血细胞和/或淋巴细胞亚型内的细胞数进行定量。样品可以是全血样品。如在本申请中所使用的,可以将术语“全血样品”理解为当进行本发明的方法时采集时存在于样品中的基本上所有造血细胞亚型仍存在的样品,即未对样品进行处理以分离特定亚型。在全血样品中可以存在抗凝剂。全血样品可以获自外周血(pb)。如在本申请中所使用的,术语“外周血”指从循环系统获得的血液,并且不是从例如骨髓(bm)、淋巴细胞(例如,淋巴结)、脾脏或肝脏中螯合的血液中获得的。或者,血液样品可以从骨髓(bm)、脐带血(cb)、动员的pb(mpb)、人向小鼠的异种移植取样或从体外人细胞悬液获得。在一个实施方式中,样品是分离的人样品。本发明有利地能够将最小样品体积用于鉴定分离样品中的造血细胞和/或淋巴细胞亚型,确定其相对频率和/或对其中的细胞亚型数进行定量。样品体积可以是10-5000μl;优选地50-1000μl,更优选地100-500μl。体积可以是约10μl、约20μl、约30μl、约40μl、约50μl、约60μl、约70μl、约80μl、约90μl、约100μl、约150μl、约200μl、约250μl、约300μl、约350μl、约400μl、约450μl、约500μl、约750μl、约1000μl、约2000μl、约3000μl、约4000μl;或约5000μl。当样品从bm获得时,可以使用更小的样品体积。例如,bm样品体积可以是50-200μl。或者,当样品从pb获得时,可以使用更大样品体积。例如,pb样品体积可以是200-500μl。此前用于鉴定造血细胞和/或淋巴细胞的方法通常需要将样品分成很多子样品,然后将其与不同抗体的组合接触,随后再对每个子样品进行单独的数据采集。这是不利的,因为对于经过培训的操作者来说这也是耗时的并且需要更大体积的初始样品。而相比之下,本发明能够使用在一个试管中制备的样品进行一次数据采集检测例如多达23种不同的造血细胞亚型。这显著减少了初始原料并节省了经过培训的操作者的时间。因此,可以在单一容器中进行将细胞与本发明的抗体接触的步骤。当进行鉴定造血细胞和淋巴细胞亚型、确定其相对频率和/或对其中的细胞数进行定量的表征时,通常将样品分开,将一部分用于造血细胞亚型的表征,另一部分用于淋巴细胞亚型的表征。样品覆盖率本发明能够在单一样品中鉴定例如多达23种不同的造血细胞亚型。本发明还能够确定单一样品中的例如多达23种不同造血细胞亚型的相对频率。本发明还能够对例如单一样品中多达23种不同造血细胞亚型内的细胞数进行定量。这代表了比由此前方法提供的更好的样品覆盖率。特别地,由本发明提供的样品覆盖率优于由现有技术方法提供的样品覆盖率,现有技术方法依赖于将样品分成小份并在多次实验中分析若干有限的细胞标记物子集。类似地,相对于对所关注的单一细胞类型进行鉴定和定量的现有技术方法,本发明提供了更优异的造血细胞亚型覆盖率。因此,在一些实施方式中,鉴定了样品中超过95%的造血细胞亚型,优选地鉴定了样品中超过99%的造血细胞亚型,更优选地鉴定了样品中超过99.5%的造血细胞亚型,以及甚至更优选地鉴定了样品中超过99.7%、99.8%或99.9%的细胞亚型。试剂盒在另一个方面中,本发明提供了一种试剂盒,所述试剂盒包含(i)抗-cd3抗体、(ii)抗-cd56抗体、(iii)抗-cd14抗体、(iv)抗-cd38抗体、(v)抗-cd45抗体、(vi)抗-cd90抗体、(vii)抗-cd135抗体、(viii)抗-cd10抗体、(ix)抗-cd11c抗体、(x)抗-cd19抗体、(xi)抗-cd34抗体、(xii)抗-cd45ra抗体、(xiii)抗-cd7抗体、(xiv)抗-cd71抗体、(xv)抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体、(xvi)抗-cd33抗体和/或抗-cd66b抗体,所述试剂盒用于鉴定分离样品中的造血细胞亚型,确定分离样品中造血细胞亚型的相对频率和/或对分离样品中造血细胞亚型内的细胞数进行定量,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。可以将所述试剂盒用于鉴定造血细胞亚型,确定其相对频率和/或对其中的细胞数进行定量。在一个实施方式中,所述试剂盒还包含(b-i)抗-cd3抗体、(b-ii)抗-cd56抗体、(b-iii)抗-cd45抗体、(b-iv)抗-cd19抗体、(b-v)抗-cd45ra抗体、(b-vi)抗-cd33抗体和/或抗-cd66b抗体、(b-vii)抗-cd4抗体、(b-viii)抗-cd8抗体、(b-ix)抗-cd95抗体、(b-x)抗-tcrγδ抗体、(b-xi)抗-cd127抗体、(b-xii)抗-cd62l抗体、(b-xiii)抗-cd25抗体,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在另一个方面中,本发明提供了一种试剂盒,所述试剂盒包含(b-i)抗-cd3抗体、(b-ii)抗-cd56抗体、(b-iii)抗-cd45抗体、(b-iv)抗-cd19抗体、(b-v)抗-cd45ra抗体、(b-vi)抗-cd33抗体和/或抗-cd66b抗体、(b-vii)抗-cd4抗体、(b-viii)抗-cd8抗体、(b-ix)抗-cd95抗体、(b-x)抗-tcrγδ抗体、(b-xi)抗-cd127抗体、(b-xii)抗-cd62l抗体、(b-xiii)抗-cd25抗体,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。可以将所述试剂盒用于鉴定淋巴细胞亚型,确定其相对频率和/或对其中的细胞数进行定量。任选地,试剂盒还可以包含微球,优选地应该标记的微球,用于提供内部计数标准品。如本申请所公开的,可以向样品中加入已知数量的此类微球,以使得能够对样品内的细胞数进行定量。任选地,试剂盒还可以包含红细胞裂解缓冲液。在一些实施方式中,试剂盒还包含荧光细胞活力标记物。荧光细胞活力标记物可以对死细胞或活细胞具有特异性。在一个优选的实施方式中,荧光细胞活力标记物对死细胞具有特异性。荧光细胞活力标记物对死细胞具有特异性。在一些实施方式中,荧光细胞活力标记物选自碘化丙啶(pi)、叠氮溴化丙啶、叠氮溴化乙锭、钙黄绿素am、7-氨基放线菌素(7-aad)、4',6-二脒基-2-苯基吲哚(dapi)及其衍生物。在一个优选的实施方式中,荧光细胞活力标记物是碘化丙啶(pi)。试剂盒的抗体可以在适宜容器中提供。试剂盒的抗体可以单独包装和标记。或者,试剂盒的一种或多种抗体可以以抗体混合物形式包装(例如,抗体混合物(antibodycocktail))。抗体混合物可以包含两种或多种所述抗体。试剂盒还可以包含使用说明书。组合物在另一个方面中,本发明提供了一种用于鉴定造血细胞亚型、确定其相对频率和/或对其中的细胞数进行定量的组合物,所述组合物包含(i)抗-cd3抗体、(ii)抗-cd56抗体、(iii)抗-cd14抗体、(iv)抗-cd38抗体、(v)抗-cd45抗体、(vi)抗-cd90抗体、(vii)抗-cd135抗体、(viii)抗-cd10抗体、(ix)抗-cd11c抗体、(x)抗-cd19抗体、(xi)抗-cd34抗体、(xii)抗-cd45ra抗体、(xiii)抗-cd7抗体、(xiv)抗-cd71抗体、(xv)抗cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体、(xvi)抗-cd33抗体和/或抗-cd66b抗体,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。在一个实施方式中,所述组合物还包含(b-i)抗-cd3抗体、(b-ii)抗-cd56抗体、(b-iii)抗-cd45抗体、(b-iv)抗-cd19抗体、(b-v)抗-cd45ra抗体、(b-vi)抗-cd33抗体和/或抗-cd66b抗体、(b-vii)抗-cd4抗体、(b-viii)抗-cd8抗体、(b-ix)抗-cd95抗体、(b-x)抗-tcrγδ抗体、(b-xi)抗-cd127抗体、(b-xii)抗-cd62l抗体、(b-xiii)抗-cd25抗体,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在另一个方面中,本发明提供了一种用于鉴定淋巴细胞亚型、确定其相对频率和/或对其中的细胞数进行定量的组合物,所述组合物包含(b-i)抗-cd3抗体、(b-ii)抗-cd56抗体、(b-iii)抗-cd45抗体、(b-iv)抗-cd19抗体、(b-v)抗-cd45ra抗体、(b-vi)抗-cd33抗体和/或抗-cd66b抗体、(b-vii)抗-cd4抗体、(b-viii)抗-cd8抗体、(b-ix)抗-cd95抗体、(b-x)抗-tcrγδ抗体、(b-xi)抗-cd127抗体、(b-xii)抗-cd62l抗体、(b-xiii)抗-cd25抗体,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。任选地,组合物还包含微球,优选地荧光标记的微球,用于提供内部计数标准品。在一些实施方式中,组合物还包含荧光细胞活力标记物。荧光细胞活力标记物可以对死细胞或活细胞具有特异性。在一个优选的实施方式中,荧光细胞活力标记物对死细胞具有特异性。在一些实施方式中,荧光细胞活力标记物选自碘化丙啶(pi)、叠氮溴化丙啶、叠氮溴化乙锭、钙黄绿素am、7-氨基放线菌素(7-aad)、4',6-二脒基-2-苯基吲哚(dapi)及其衍生物。在一个优选的实施方式中,荧光细胞活力标记物是碘化丙啶(pi)。组合物还可以包含缓冲剂、盐、抗衡离子、稀释剂和/或赋形剂。用于诊断血液病症的抗体本发明的另一个方面提供了抗-cd90抗体(i)用于诊断血液病症的用途,其中将抗-cd90抗体(i)与抗-cd3抗体(ii)、抗-cd56抗体(iii)、抗-cd14抗体(iv)、抗-cd38抗体(v)、抗-cd45抗体(vi)、抗-cd135抗体(vii)、抗-cd10抗体(viii)、抗-cd11c抗体(ix)、抗-cd19抗体(x)、抗-cd34抗体(xi)、抗-cd45ra抗体(xii)、抗-cd7抗体(xiii)、抗-cd71抗体(xiv)、抗cd41/cd61复合抗体或抗-cd61抗体和/或抗-cd41抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。本发明的另一个方面提供了抗-cd3抗体(i)用于诊断血液病症的用途,其中将抗-cd3抗体(i)与抗-cd90抗体(ii)、抗-cd56抗体(iii)、抗-cd14抗体(iv)、抗-cd38抗体(v)、抗-cd45抗体(vi)、抗-cd135抗体(vii)、抗-cd10抗体(viii)、抗-cd11c抗体(ix)、抗-cd19抗体(x)、抗-cd34抗体(xi)、抗-cd45ra抗体(xii)、抗-cd7抗体(xiii)、抗-cd71抗体(xiv)、抗cd41/cd61复合抗体或抗-cd61抗体和/或抗-cd41抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。本发明的另一个方面提供了抗-cd56抗体(i)用于诊断血液病症的用途,其中将抗-cd56抗体(i)与抗-cd90抗体(ii)、抗-cd3抗体(iii)、抗-cd14抗体(iv)、抗-cd38抗体(v)、抗-cd45抗体(vi)、抗-cd135抗体(vii)、抗-cd10抗体(viii)、抗-cd11c抗体(ix)、抗-cd19抗体(x)、抗-cd34抗体(xi)、抗-cd45ra抗体(xii)、抗-cd7抗体(xiii)、抗-cd71抗体(xiv)、抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。本发明的另一个方面提供了抗-cd14抗体(i)用于诊断血液病症的用途,其中将抗-cd14抗体(i)与抗-cd90抗体(ii)、抗-cd3抗体(iii)、抗-cd56抗体(iv)、抗-cd38抗体(v)、抗-cd45抗体(vi)、抗-cd135抗体(vii)、抗-cd10抗体(viii)、抗-cd11c抗体(ix)、抗-cd19抗体(x)、抗-cd34抗体(xi)、抗-cd45ra抗体(xii)、抗-cd7抗体(xiii)、抗-cd71抗体(xiv)、抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。本发明的另一个方面提供了抗-cd38抗体(i)用于诊断血液病症的用途,其中将抗-cd38抗体(i)与抗-cd90抗体(ii)、抗-cd3抗体(iii)、抗-cd56抗体(iv)、抗-cd14抗体(v)、抗-cd45抗体(vi)、抗-cd135抗体(vii)、抗-cd10抗体(viii)、抗-cd11c抗体(ix)、抗-cd19抗体(x)、抗-cd34抗体(xi)、抗-cd45ra抗体(xii)、抗-cd7抗体(xiii)、抗-cd71抗体(xiv)、抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。本发明的另一个方面提供了抗-cd45抗体(i)用于诊断血液病症的用途,其中将抗-cd45抗体(i)与抗-cd90抗体(ii)、抗-cd3抗体(iii)、抗-cd56抗体(iv)、抗-cd14抗体(v)、抗-cd38抗体(vi)、抗-cd135抗体(vii)、抗-cd10抗体(viii)、抗-cd11c抗体(ix)、抗-cd19抗体(x)、抗-cd34抗体(xi)、抗-cd45ra抗体(xii)、抗-cd7抗体(xiii)、抗-cd71抗体(xiv)、抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。本发明的另一个方面提供了抗-cd135抗体(i)用于诊断血液病症的用途,其中将抗-cd135抗体(i)与抗-cd90抗体(ii)、抗-cd3抗体(iii)、抗-cd56抗体(iv)、抗-cd14抗体(v)、抗-cd38抗体(vi)、抗-cd45抗体(vii)、抗-cd10抗体(viii)、抗-cd11c抗体(ix)、抗-cd19抗体(x)、抗-cd34抗体(xi)、抗-cd45ra抗体(xii)、抗-cd7抗体(xiii)、抗-cd71抗体(xiv)、抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。本发明的另一个方面提供了抗-cd10抗体(i)用于诊断血液病症的用途,其中将抗-cd10抗体(i)与抗-cd90抗体(ii)、抗-cd3抗体(iii)、抗-cd56抗体(iv)、抗-cd14抗体(v)、抗-cd38抗体(vi)、抗-cd45抗体(vii)、抗-cd135抗体(viii)、抗-cd11c抗体(ix)、抗-cd19抗体(x)、抗-cd34抗体(xi)、抗-cd45ra抗体(xii)、抗-cd7抗体(xiii)、抗-cd71抗体(xiv)、抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。本发明的另一个方面提供了抗-cd11c抗体(i)用于诊断血液病症的用途,其中将抗-cd11c抗体(i)与抗-cd90抗体(ii)、抗-cd3抗体(iii)、抗-cd56抗体(iv)、抗-cd14抗体(v)、抗-cd38抗体(vi)、抗-cd45抗体(vii)、抗-cd135抗体(viii)、抗-cd10抗体(ix)、抗-cd19抗体(x)、抗-cd34抗体(xi)、抗-cd45ra抗体(xii)、抗-cd7抗体(xiii)、抗-cd71抗体(xiv)、抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。本发明的另一个方面提供了抗-cd19抗体(i)用于诊断血液病症的用途,其中将抗-cd19抗体(i)与抗-cd90抗体(ii)、抗-cd3抗体(iii)、抗-cd56抗体(iv)、抗-cd14抗体(v)、抗-cd38抗体(vi)、抗-cd45抗体(vii)、抗-cd135抗体(viii)、抗-cd10抗体(ix)、抗-cd11c抗体(x)、抗-cd34抗体(xi)、抗-cd45ra抗体(xii)、抗-cd7抗体(xiii)、抗-cd71抗体(xiv)、抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。本发明的另一个方面提供了抗-cd34抗体(i)用于诊断血液病症的用途,其中将抗-cd34抗体(i)与抗-cd90抗体(ii)、抗-cd3抗体(iii)、抗-cd56抗体(iv)、抗-cd14抗体(v)、抗-cd38抗体(vi)、抗-cd45抗体(vii)、抗-cd135抗体(viii)、抗-cd10抗体(ix)、抗-cd11c抗体(x)、抗-cd19抗体(xi)、抗-cd45ra抗体(xii)、抗-cd7抗体(xiii)、抗-cd71抗体(xiv)、抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。本发明的另一个方面提供了抗-cd45ra抗体(i)用于诊断血液病症的用途,其中将抗-cd45ra抗体(i)与抗-cd90抗体(ii)、抗-cd3抗体(iii)、抗-cd56抗体(iv)、抗-cd14抗体(v)、抗-cd38抗体(vi)、抗-cd45抗体(vii)、抗-cd135抗体(viii)、抗-cd10抗体(ix)、抗-cd11c抗体(x)、抗-cd19抗体(xi)、抗-cd34抗体(xii)、抗-cd7抗体(xiii)、抗-cd71抗体(xiv)、抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。本发明的另一个方面提供了抗-cd7抗体(i)用于诊断血液病症的用途,其中将抗-cd7抗体(i)与抗-cd90抗体(ii)、抗-cd3抗体(iii)、抗-cd56抗体(iv)、抗-cd14抗体(v)、抗-cd38抗体(vi)、抗-cd45抗体(vii)、抗-cd135抗体(viii)、抗-cd10抗体(ix)、抗-cd11c抗体(x)、抗-cd19抗体(xi)、抗-cd34抗体(xii)、抗-cd45ra抗体(xiii)、抗-cd71抗体(xiv)、抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。本发明的另一个方面提供了抗-cd71抗体(i)用于诊断血液病症的用途,其中将抗-cd71抗体(i)与抗-cd90抗体(ii)、抗-cd3抗体(iii)、抗-cd56抗体(iv)、抗-cd14抗体(v)、抗-cd38抗体(vi)、抗-cd45抗体(vii)、抗-cd135抗体(viii)、抗-cd10抗体(ix)、抗-cd11c抗体(x)、抗-cd19抗体(xi)、抗-cd34抗体(xii)、抗-cd45ra抗体(xiii)、抗-cd7抗体(xiv)、抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。本发明的另一个方面提供了抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(i)用于诊断血液病症的用途,其中将抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(i)与抗-cd90抗体(ii)、抗-cd3抗体(iii)、抗-cd56抗体(iv)、抗-cd14抗体(v)、抗-cd38抗体(vi)、抗-cd45抗体(vii)、抗-cd135抗体(viii)、抗-cd10抗体(ix)、抗-cd11c抗体(x)、抗-cd19抗体(xi)、抗-cd34抗体(xii)、抗-cd45ra抗体(xiii)、抗-cd7抗体(xiv)、抗-cd71抗体(xv)、抗-cd33抗体和/或抗-cd66b抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(i)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。本发明的另一个方面提供了抗-cd33抗体和/或抗-cd66b抗体(i)用于诊断血液病症的用途,其中将抗-cd33抗体和/或抗-cd66b抗体(i)与抗-cd90抗体(ii)、抗-cd3抗体(iii)、抗-cd56抗体(iv)、抗-cd14抗体(v)、抗-cd38抗体(vi)、抗-cd45抗体(vii)、抗-cd135抗体(viii)、抗-cd10抗体(ix)、抗-cd11c抗体(x)、抗-cd19抗体(xi)、抗-cd34抗体(xii)、抗-cd45ra抗体(xiii)、抗-cd7抗体(xiv)、抗-cd71抗体(xv)、抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体(xvi)联用,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(i)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xvi)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体。在另一个方面中,本发明提供了抗-cd3抗体(b-i)用于诊断血液病症的用途,其中将抗-cd3抗体(b-i)与抗-cd56抗体(b-ii)、抗-cd45抗体(b-iii)、抗-cd19抗体(b-iv)、抗-cd45ra抗体(b-v)、抗-cd33抗体和/或抗-cd66b抗体(b-vi)、抗-cd4抗体(b-vii)、抗-cd8抗体(b-viii)、抗-cd95抗体(b-ix)、抗-tcrγδ抗体(b-x)、抗-cd127抗体(b-xi)、抗-cd62l抗体(b-xii)、抗-cd25抗体(b-xiii)联用,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在另一个方面中,本发明提供了抗-cd56抗体(b-i)用于诊断血液病症的用途,其中将抗-cd56抗体(b-i)与抗-cd3抗体(b-ii)、抗-cd45抗体(b-iii)、抗-cd19抗体(b-iv)、抗-cd45ra抗体(b-v)、抗-cd33抗体和/或抗-cd66b抗体(b-vi)、抗-cd4抗体(b-vii)、抗-cd8抗体(b-viii)、抗-cd95抗体(b-ix)、抗-tcrγδ抗体(b-x)、抗-cd127抗体(b-xi)、抗-cd62l抗体(b-xii)、抗-cd25抗体(b-xiii)联用,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在另一个方面中,本发明提供了抗-cd45抗体(b-i)用于诊断血液病症的用途,其中将抗-cd45抗体(b-i)与抗-cd56抗体(b-ii)、抗-cd3抗体(b-iii)、抗-cd19抗体(b-iv)、抗-cd45ra抗体(b-v)、抗-cd33抗体和/或抗-cd66b抗体(b-vi)、抗-cd4抗体(b-vii)、抗-cd8抗体(b-viii)、抗-cd95抗体(b-ix)、抗-tcrγδ抗体(b-x)、抗-cd127抗体(b-xi)、抗-cd62l抗体(b-xii)、抗-cd25抗体(b-xiii)联用,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在另一个方面中,本发明提供了抗-cd19抗体(b-i)用于诊断血液病症的用途,其中将抗-cd19抗体(b-i)与抗-cd56抗体(b-ii)、抗-cd45抗体(b-iii)、抗-cd3抗体(b-iv)、抗-cd45ra抗体(b-v)、抗-cd33抗体和/或抗-cd66b抗体(b-vi)、抗-cd4抗体(b-vii)、抗-cd8抗体(b-viii)、抗-cd95抗体(b-ix)、抗-tcrγδ抗体(b-x)、抗-cd127抗体(b-xi)、抗-cd62l抗体(b-xii)、抗-cd25抗体(b-xiii)联用,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在另一个方面中,本发明提供了抗-cd45ra抗体(b-i)用于诊断血液病症的用途,其中将抗-cd45ra抗体(b-i)与抗-cd56抗体(b-ii)、抗-cd45抗体(b-iii)、抗-cd19抗体(b-iv)、抗-cd3抗体(b-v)、抗-cd33抗体和/或抗-cd66b抗体(b-vi)、抗-cd4抗体(b-vii)、抗-cd8抗体(b-viii)、抗-cd95抗体(b-ix)、抗-tcrγδ抗体(b-x)、抗-cd127抗体(b-xi)、抗-cd62l抗体(b-xii)、抗-cd25抗体(b-xiii)联用,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在另一个方面中,本发明提供了抗-cd33抗体和/或抗-cd66b抗体(b-i)用于诊断血液病症的用途,其中将抗-cd33抗体和/或抗-cd66b抗体(b-i)与抗-cd56抗体(b-ii)、抗-cd45抗体(b-iii)、抗-cd19抗体(b-iv)、抗-cd45ra抗体(b-v)、抗-cd3抗体(b-vi)、抗-cd4抗体(b-vii)、抗-cd8抗体(b-viii)、抗-cd95抗体(b-ix)、抗-tcrγδ抗体(b-x)、抗-cd127抗体(b-xi)、抗-cd62l抗体(b-xii)、抗-cd25抗体(b-xiii)联用,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在另一个方面中,本发明提供了抗-cd4抗体(b-i)用于诊断血液病症的用途,其中将抗-cd4抗体(b-i)与-cd56抗体(b-ii)、抗-cd45抗体(b-iii)、抗-cd19抗体(b-iv)、抗-cd45ra抗体(b-v)、抗-cd33抗体和/或抗-cd66b抗体(b-vi)、抗-cd3抗体(b-vii)、抗-cd8抗体(b-viii)、抗-cd95抗体(b-ix)、抗-tcrγδ抗体(b-x)、抗-cd127抗体(b-xi)、抗-cd62l抗体(b-xii)、抗-cd25抗体(b-xiii)联用,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在另一个方面中,本发明提供了抗-cd8抗体(b-i)用于诊断血液病症的用途,其中将抗-cd8抗体(b-i)与抗-cd56抗体(b-ii)、抗-cd45抗体(b-iii)、抗-cd19抗体(b-iv)、抗-cd45ra抗体(b-v)、抗-cd33抗体和/或抗-cd66b抗体(b-vi)、抗-cd4抗体(b-vii)、抗-cd3抗体(b-viii)、抗-cd95抗体(b-ix)、抗-tcrγδ抗体(b-x)、抗-cd127抗体(b-xi)、抗-cd62l抗体(b-xii)、抗-cd25抗体(b-xiii)联用,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在另一个方面中,本发明提供了抗-cd95抗体(b-i)用于诊断血液病症的用途,其中将抗-cd95抗体(b-i)与抗-cd56抗体(b-ii)、抗-cd45抗体(b-iii)、抗-cd19抗体(b-iv)、抗-cd45ra抗体(b-v)、抗-cd33抗体和/或抗-cd66b抗体(b-vi)、抗-cd4抗体(b-vii)、抗-cd8抗体(b-viii)、抗-cd3抗体(b-ix)、抗-tcrγδ抗体(b-x)、抗-cd127抗体(b-xi)、抗-cd62l抗体(b-xii)、抗-cd25抗体(b-xiii)联用,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在另一个方面中,本发明提供了抗-tcrγδ抗体(b-i)用于诊断血液病症的用途,其中将抗-tcrγδ抗体(b-i)与抗-cd56抗体(b-ii)、抗-cd45抗体(b-iii)、抗-cd19抗体(b-iv)、抗-cd45ra抗体(b-v)、抗-cd33抗体和/或抗-cd66b抗体(b-vi)、抗-cd4抗体(b-vii)、抗-cd8抗体(b-viii)、抗-cd95抗体(b-ix)、抗-cd3抗体(b-x)、抗-cd127抗体(b-xi)、抗-cd62l抗体(b-xii)、抗-cd25抗体(b-xiii)联用,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在另一个方面中,本发明提供了抗-cd127抗体(b-i)用于诊断血液病症的用途,其中将抗-cd127抗体(b-i)与抗-cd56抗体(b-ii)、抗-cd45抗体(b-iii)、抗-cd19抗体(b-iv)、抗-cd45ra抗体(b-v)、抗-cd33抗体和/或抗-cd66b抗体(b-vi)、抗-cd4抗体(b-vii)、抗-cd8抗体(b-viii)、抗-cd95抗体(b-ix)、抗-tcrγδ抗体(b-x)、抗-cd3抗体(b-xi)、抗-cd62l抗体(b-xii)、抗-cd25抗体(b-xiii)联用,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在另一个方面中,本发明提供了抗-cd62l抗体(b-i)用于诊断血液病症的用途,其中将抗-cd62l抗体(b-i)与抗-cd56抗体(b-ii)、抗-cd45抗体(b-iii)、抗-cd19抗体(b-iv)、抗-cd45ra抗体(b-v)、抗-cd33抗体和/或抗-cd66b抗体(b-vi)、抗-cd4抗体(b-vii)、抗-cd8抗体(b-viii)、抗-cd95抗体(b-ix)、抗-tcrγδ抗体(b-x)、抗-cd127抗体(b-xi)、抗-cd3抗体(b-xii)、抗-cd25抗体(b-xiii)联用,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。在另一个方面中,本发明提供了抗-cd25抗体(b-i)用于诊断血液病症的用途,其中将抗-cd25抗体(b-i)与抗-cd56抗体(b-ii)、抗-cd45抗体(b-iii)、抗-cd19抗体(b-iv)、抗-cd45ra抗体(b-v)、抗-cd33抗体和/或抗-cd66b抗体(b-vi)、抗-cd4抗体(b-vii)、抗-cd8抗体(b-viii)、抗-cd95抗体(b-ix)、抗-tcrγδ抗体(b-x)、抗-cd127抗体(b-xi)、抗-cd62l抗体(b-xii)、抗-cd3抗体(b-xiii)联用,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体。如在本申请中所使用的,术语“血液病症”指与造血细胞亚型不平衡分布相关的疾病或病况。造血细胞亚型的不平衡分布可以在pb和/或bm中。细胞的不平衡分布指造血细胞亚型的相对频率明显不同于在相应健康对照样品中观察到的相对频率。因此,本发明可以用于诊断此类血液病症,因为其能够确定从pb或bm样品中分离的样品中造血细胞的相对频率。还可以使用本发明通过对样品中造血细胞亚型内的细胞数进行定量诊断血液病症。例如,绝对细胞定量能够检测是否每种细胞区室均在正常细胞范围内(例如,通过对所观察到的细胞性与相应健康对照样品进行比较)。在一些实施方式中,将用于诊断血液病症的抗体与从处于血液病症风险中,疑似患有血液病症,或患有血液病症或既往患有血液病症的个体获得的分离样品接触。个体可能处于缓解期。在一些实施方式中,如果造血细胞亚型的相对频率显著不同于对照,则可以将个体诊断为患有血液病症。在一些实施方式中,如果一种或多种造血细胞亚型的细胞数显著不同于对照,则可以将个体诊断为患有血液病症。对照可以是对照样品。例如,对照样品可以从年龄匹配的健康个体获得。或者,对照可以是包含此前已针对健康个体或健康个体的群体确定的造血细胞亚型内细胞的相对频率或绝对数量的数据集。如果一种或多种下述造血细胞亚型内细胞的相对频率或绝对数量与对照相比增加或减少,则可以将个体诊断为患有血液病症:未成熟多形核白细胞(ipmn)、多形核白细胞(pmn)、单核细胞、树突状细胞(dc)/dc祖细胞、成髓细胞、t细胞、自然杀伤t细胞(nkt)、自然杀伤细胞(nk)、b-细胞、前-b细胞、原-b细胞、原淋巴细胞、原成红细胞、成红细胞、造血干细胞(hsc)、多能祖细胞(mpp)、多能淋巴祖细胞(mlp)、早期t祖细胞(etp)、前-b/自然杀伤细胞(pre-b/nk)、共同骨髓祖细胞(cmp)、粒细胞/巨噬细胞祖细胞(gmp)和巨核细胞/红细胞祖细胞(mep)。在一些实施方式中,血液病症是血癌;优选地血癌是白血病。在一个优选的实施方式中,血液病症是急性髓性白血病(aml)或急性淋巴细胞白血病(all)。在一些实施方式中,血液病症不是血癌。在一些实施方式中,血液病症是原发性免疫缺陷(pid)。在一个实施方式中,pid是腺苷脱氨酶重度联合免疫缺陷(ada-scid)或wiskottaldrich综合征(was)。血液病症可以是β地中海贫血、慢性肉芽肿病(cgd)、x连锁的重度联合免疫缺陷(x-scid)、其他pid或其他造血障碍。血液病症可以是慢性淋巴细胞白血病(cll)、慢性髓性白血病(cml)或多发性骨髓瘤(mm)。血液病症可以是其他类型的血癌。血液病症可以处于治疗开始时、治疗过程中或治疗后,或者处于复发时。可以将本发明用于监测或诊断微小残留病变(mrd)。mrd指(例如,针对血癌的)治疗后仍在患者中的病变或异常细胞。这种剩余的细胞群可以以非常低的频率存在,并且因此难以使用常规技术检测。然而,如果此类细胞的频率增加,则这种残留细胞群可能会导致患者复发。由于可以将本申请所述的用途、方法、试剂盒、组合物和抗体用于确定造血细胞类型的相对频率,因而可以将本发明用于监测mrd。因此,在另一个方面中,本发明提供了一种用于在患者中监测微小残留病变(mrd)的方法,所述方法包括下述步骤:(a)将来自患者的分离样品与(i)抗-cd3抗体、(ii)抗-cd56抗体、(iii)抗-cd14抗体、(iv)抗-cd38抗体、(v)抗-cd45抗体、(vi)抗-cd90抗体、(vii)抗-cd135抗体、(viii)抗-cd10抗体、(ix)抗-cd11c抗体、(x)抗-cd19抗体、(xi)抗-cd34抗体、(xii)抗-cd45ra抗体、(xiii)抗-cd7抗体、(xiv)抗-cd71抗体、(xv)抗-cd41/cd61复合抗体或抗-cd41抗体和/或抗-cd61抗体、(xvi)抗-cd33抗体和/或抗-cd66b抗体接触,其中使用不同荧光染料标记(i)至(xvi)的每一个,其中当(xvi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体,和其中当(xv)是抗-cd41抗体和抗-cd61抗体时,使用相同荧光染料标记抗-cd41抗体和抗-cd61抗体;(b)检测荧光染料标记的造血细胞。在一个实施方式中,所述方法还可以包括下述步骤:(c)提供所述样品的另一部分,该部分未在步骤(a)和/或(b)中使用;(d)将步骤(c)的样品与(b-i)抗-cd3抗体、(b-ii)抗-cd56抗体、(b-iii)抗-cd45抗体、(b-iv)抗-cd19抗体、(b-v)抗-cd45ra抗体、(b-vi)抗-cd33抗体和/或抗-cd66b抗体、(b-vii)抗-cd4抗体、(b-viii)抗-cd8抗体、(b-ix)抗-cd95抗体、(b-x)抗-tcrγδ抗体、(b-xi)抗-cd127抗体、(b-xii)抗-cd62l抗体、(b-xiii)抗-cd25抗体接触,其中使用不同荧光染料标记(b-i)至(b-xiii)的每一个,其中当(b-vi)是抗-cd33抗体和抗-cd66b抗体时,使用相同荧光染料标记抗-cd33抗体和抗-cd66b抗体;(e)检测荧光染料标记的淋巴细胞。患者可能处于缓解期。患者可能此前已经针对血液病症进行了治疗。在一些实施方式中,鉴定了一种或多种下述造血细胞亚型:未成熟多形核白细胞(ipmn)、多形核白细胞(pmn)、单核细胞、树突状细胞(dc)/dc祖细胞、成髓细胞、t细胞、自然杀伤t细胞(nkt)、自然杀伤细胞(nk)、b-细胞、前-b细胞、原-b细胞、原淋巴细胞、原成红细胞、成红细胞、造血干细胞(hsc)、多能祖细胞(mpp)、多能淋巴祖细胞(mlp)、早期t祖细胞(etp)、前-b/自然杀伤细胞(pre-b/nk)、共同骨髓祖细胞(cmp)、粒细胞/巨噬细胞祖细胞(gmp)和巨核细胞/红细胞祖细胞(mep)。上述说明书中提及的所有出版物均通过引用并入本申请。在不脱离本发明的范围和精神的情况下,所描述的本发明的各种修改和变化对于本领域技术人员来说是显而易见的。尽管已结合具体优选的实施方式对本发明进行了描述,但是应当理解的是不应将要求保护的发明不适当地限定为此类具体的实施方式。实际上,对于细胞生物学、分子生物学、组织学、免疫学、肿瘤学或相关领域的技术人员来说显而易见的用于实施本发明的所述模式的各种修改均旨在落入所附权利要求的范围内。现在将通过非限制性实施例描述本发明的各种优选特征和实施方式。实施例实施例1确定分离样品中存在的造血细胞亚型的相对频率的方案试剂制备·rbc裂解缓冲液:将nh4cl(sigma,终浓度:0,15m),khco3(flukabiochemika,终浓度10mm)和edta四钠(flukabiochemika,终浓度:0.10mm)溶于h2o中。使用0.2μm膜滤器过滤溶液并且在+4℃下贮存达3个月。·pbs-facs:向不含钙和镁的pbs(gibco)中加入牛血清白蛋白(bsa)(roche)0.3%和na-n3(sigma)0.1%制备溶液。使用0.2μm膜滤器过滤溶液并且在+4℃下贮存。·工作溶液(ws):制备补充了10%fbs(euroclone)、1%pen/strep和1%l-谷氨酰胺(lonza)的rpmi(corning)培养基。以1:1的比例使用不含钙和镁的pbs稀释完全培养基。加入hepes(sigma)至终浓度25mm。使用0.2μm膜滤器过滤溶液并且在+4℃下贮存。染色方案为制备用于facs采集的样品,请按照下述步骤操作。1.在facs管中收集100μl来自bm的wb或500μl来自pb的wb。2.加入1ml(bm)或3ml(pb)冷的rbc裂解缓冲液。涡旋样品以有效进行rbc裂解。3.将样品在室温(rt)下放置5分钟。4.使用2mlpbs1x洗涤。5.在rt下1500rpm离心5分钟并除去上清液。6.使用1mlpbs-facs洗涤样品。1500-rpmrt离心5分钟并除去上清液。7.将细胞球团重悬于100μlpbs-facs中。8.向细胞悬液中加入荧光染料标记抗体的混合物(表2)。吹打几次小心地混合。9.在rt下避光孵育30分钟。10.使用2mlpbs-facs洗涤。11.在rt下1500rpm离心5分钟并除去上清液。12.将样品重悬于100μlpbs-facs中。13.加入5μl碘化丙啶,使其终浓度为0.25μg/ml。混合细胞悬液。14.在rt下避光孵育15分钟。15.加入300μlpbs-facs。16.将样品避光保持在+4℃直至进行采集。17.使用lsr-fortessa(bd)细胞仪对样品进行采集。表2.总结抗体标记物的特异性及其荧光染料标记的表标记物荧光染料cd3bv605cd56pe-cy5cd14bv510cd33bb515cd61/41pe-cy7cd66bbb515cd38buv737cd45buv395cd90apccd135pecd10bv786cd11cbv650cd19apc-r700cd34bv421cd45raapc-cy7cd7percp-cy5.5cd71bv711流式细胞数据采集采集单色小珠以设置pmt电压并建立补偿矩阵(cm)以避免光谱重叠和不需要的荧光溢出。在cm产生之后,需要进行滴定测试以定义最佳荧光染料标记的抗体浓度并运行荧光扣除(fmo)对照以设置用于下游数据分析的正确的正门。彩虹珠(rb)校正完成仪器设置并在对每个样品采集之前进行rb采集以便在不同实验之间提供可重复的仪器设置。在彩虹珠(spherotech)校正后通过bdlsr-fortessa(spherotech)细胞荧光计对所有样品进行采集,并通过diva软件(bdbiosciences)收集原始数据。随后使用flowjo软件9.3.2版(treestar)进行数据分析,并通过prism6.0c(graphpad软件)自动生成图形输出。主门控策略数据采集后,根据下述门控策略使用flowjo(treestar)或类似软件导出并分析fcs文件(图6):1.创建点图fsc-h/fsc-a以识别单细胞(g1)。2.创建g1点图ssc-a/fsc-a以识别细胞尺寸的群(g2)。3.创建g2点图pi-a/fsc-a以选择活细胞(低pi-a)(g3)。从现在起,必须根据其各自的fmo对照对每个门进行设置。4.创建g3点图ssc-a/buv395-a以评价cd45标记物的表达并创建阳性事件(g4)和阴性事件(g5)的门。5.创建g4点图bv711-a/pe-cy7-a以评价cd71和cd41/61标记物的表达。创建cd71+(g6;成红细胞)、cd41/61+(g7;血小板)和双重阴性事件(g8)的门。6.创建g5点图ssc-a/bb515-a以评价cd33/cd66b标记物的表达。创建阴性事件(g9;非骨髓细胞)和阳性事件(g10;骨髓细胞)的门。7.创建g10点图ssc-a/bv510-a以评价cd14标记物的表达和细胞粒度(ssc-a)。创建cd14+(g11;单核细胞)、高粒度事件(g12)和阴性事件(g13)的门。8.创建g12点图bv786-a/bv650-a以评价cd10和cd11c标记物的表达,并创建双重阳性事件(g14;pmn)和剩余事件(g15;ipmn)的门。9.创建g13点图ssc-a/bv650-a以评价cd11c标记物的表达,并创建阳性事件(g16;dc)和阴性事件(g17)的门。10.创建g17点图buv737-a/bv421-a以评价cd38和cd34标记物的表达。创建cd34阴性事件(g18;成髓细胞)和cd34阳性事件(g19;骨髓定向祖细胞)的门。11.创建g9点图ssc-a/bv605-a以评价cd3标记物的表达,并创建阳性事件(g20)和阴性事件(g21)的门。12.创建g20点图ssc-a/pe-cy5-a以评价cd56的表达,并创建阳性事件(g22;nkt)和阴性事件(g23;t细胞)的门。13.创建g21点图ssc-a/apc-r700-a以评价cd19标记物的表达,并创建阳性事件(g24;cd19+淋巴细胞)和阴性事件(g25)的门。14.创建g24点图bv785-a/bv421-a以评价cd10和cd34标记物的表达,并创建双重阳性事件(g26;原-b)、双重阴性事件(g27;b细胞)、仅cd10+事件(g28;前-b)和仅cd34+事件(g29)的门。15.创建g25点图ssc-a/pe-cy5-a以评价cd56标记物的表达,并创建阳性事件(g30;nk)和阴性事件(g31;lin-)的门。16.创建g31点图buv737-a/bv421-a以评价cd38和cd34标记物的表达,并创建cd34+(g32)和cd34-(g33)事件的门。17.创建g33点图bv711-a/pe-cy7-a以评价cd71和cd41/61标记物的表达,并创建双重阴性事件(g34)、仅cd71+事件(g35;原-成红细胞)和仅cd41/61+事件(g36;未成熟血小板)的门。18.创建g34点图bv785-a/percp-cy5.5-a以评价cd10和cd7标记物的表达,并创建双重阴性事件(g37)、仅cd10+事件(g38)和仅cd7+事件(g39)的门。g38+g39::原-淋巴细胞。19.创建重叠的g19+g32点图bv785-a/cd421-a以评价cd38和cd34标记物的表达。所有事件应为cd34+。创建cd38+事件(g40)和cd38-事件(g41)的门。20.创建g41点图apc-a/apc-cy7-a以评价cd90和cd45ra标记物的表达,并创建仅cd90+事件(g42;hsc)、双重阴性事件(g43;mpp)和cd45ra+事件(g44;mlp)的门。21.创建g40点图ssc-a/percp-cy5.5-a以评价cd7标记物的表达,并创建cd7+事件(g45;etp)和cd7-事件(g46)的门。22.创建g46点图bv785-a/apc-cy7-a以评价cd10和cd45ra标记物的表达,并创建cd10+事件(g47;前-b/nk)和cd10-事件(g48)的门。23.创建g48点图pe-a/apc-cy7-a以评价cd135和cd45ra标记物的表达,并创建仅cd135+事件(g49;cmp)、双重阳性事件(g50;gmp)和双重阴性事件(g51;mep)的门。24.创建一个表格,其中包含所有门占其母门百分比,并计算占总cd45+细胞(门g5)的总体百分比。25.使用prism6.0c(graphpad软件)生成图形输出,设置所有细胞群的“整体的部分”环形图,占总cd45+细胞的百分比,以及hspc亚群的“分组”条形图,占总cd34+lin-细胞的百分比。替代的门控策略数据采集后,根据下述门控策略使用flowjo(treestar)或类似软件导出并分析fcs文件:1.创建点图fsc-h/fsc-a以识别单细胞(g1)。2.创建g1点图ssc-a/fsc-a以识别细胞尺寸的群(g2)。3.创建g2点图pi-a/fsc-a以选择活细胞(低pi-a)(g3)。从现在起,必须根据其各自的fmo对照对每个门进行设置。4.创建g3点图buv737-a/bv421-a以评价cd38和cd34标记物的表达,并创建阴性事件(g4)和阳性事件(g5)的门。5.创建g5点图ssc-a/buv395-a以评价cd45标记物的表达。创建cd45阴性事件(g6)和cd45阳性事件(g7)的门。6.创建g7点图ssc-a/bb515-a以评价cd33/cd66b标记物的表达。创建阴性事件(g8;非骨髓祖细胞)和阳性事件(g9;骨髓祖细胞)的门。7.创建g9点图ssc-a/bv510-a以评价cd14标记物的表达和细胞粒度(ssc-a)。创建cd14+事件(g10)、高粒度事件(g11)和阴性事件(g12)的门。8.创建g11点图bv786-a/bv650-a以评价cd10和cd11c标记物的表达,并创建双重阳性事件(g13)和剩余事件(g14)的门。9.创建g12点图ssc-a/bv650-a以评价cd11c标记物的表达,并创建阳性事件(g15)和阴性事件(g16)的门。10.创建g16点图buv737-a/bv421-a以评价cd38和cd34标记物的表达。创建cd34阳性事件(g17;骨髓定向祖细胞)的门。检查该点图中的所有事件是否随后均进入g17门。11.创建g8点图ssc-a/bv605-a以评价cd3标记物的表达,并创建阳性事件(g18)和阴性事件(g19)的门。12.创建g18点图ssc-a/pe-cy5-a以评价cd56的表达,并创建阳性事件(g20)和阴性事件(g21)的门。13.创建g19点图ssc-a/apc-r700-a以评价cd19标记物的表达,并创建阳性事件(g22)和阴性事件(g23)的门。14.创建g22点图bv785-a/bv421-a以评价cd10和cd34标记物的表达,并创建双重阳性事件(g24;原-b)和仅cd34+事件(g25)的门。检查该点图中的所有事件是否随后均进入g24或g25门。15.创建g23点图ssc-a/pe-cy5-a以评价cd56标记物的表达,并创建阳性事件(g26)和阴性事件(g27)的门。16.创建g27点图buv737-a/bv421-a以评价cd38和cd34标记物的表达,并创建cd34+(g28,lin-祖细胞)的门。检查该点图中的所有事件是否随后均进入g28门。17.创建重叠的g17+g28点图bv785-a/cd421-a以评价cd38和cd34标记物的表达。所有事件均应为cd34+。创建cd38+事件(g29)和cd38-事件(g30)的门。18.创建g30点图apc-a/apc-cy7-a以评价cd90和cd45ra标记物的表达,并创建仅cd90+事件(g31;hsc)、双重阴性事件(g32;mpp)和cd45ra+事件(g33;mlp)的门。19.创建g29点图ssc-a/percp-cy5.5-a以评价cd7标记物的表达,并创建cd7+事件(g34;etp)和cd7-事件(g35)的门。20.创建g35点图bv785-a/apc-cy7-a以评价cd10和cd45ra标记物的表达,并创建cd10+事件(g36;前-b/nk)和cd10-事件(g37)的门。21.创建g37点图pe-a/apc-cy7-a以评价cd135和cd45ra标记物的表达,并创建仅cd135+事件(g38;cmp)、双重阳性事件(g39;gmp)和双重阴性事件(g40;mep)的门。22.创建一个表格,其中包含所有门占其母门百分比,并计算占总cd34+细胞(门g5)的总体百分比。23.使用prism6.0c(graphpad软件)生成图形输出,设置所有细胞群的“整体的部分”环形图,占总cd34+细胞的百分比。实施例2从健康供体分离的bm和pb样品的表征为了检测根据本发明的方法在人bm和pb中成功鉴定血液造血细胞亚型和可重现地确定其相对频率的有效性,对来自19名成人(ad)健康供体(hd)的5个bm和14个pbwb样品进行了分析(图1b-e和7,以及表3-4)。表3.在健康供体中骨髓和外周血造血细胞亚型的频率,以占总cd45+细胞的百分比计。平均百分比±标准偏差表示占总cd45-(成红细胞)和占总cd45+(白细胞)细胞的造血细胞频率。(*=p<0,05;**=p<0,01;***=p<0,001;mann-whitney检验)。表4.按照相对区室的在健康供体中骨髓和外周血造血细胞亚型的频率。平均百分比±标准偏差表示在主要造血细胞区室中的造血细胞亚型。(*=p<0,05;**=p<0,01;***=p<0,001;mann-whitney检验)。从评价cd45标记物开始,bm和pm之间细胞组成的差异是明显的。与pb样品相比,在bm样品中,含有cd45+部分的细胞亚型具有更加多样化的cd45表达水平,其中绝大多数细胞由于其处于成熟的分化状态是cd45高的。在bm的cd45-部分中,鉴定出了大量的cd71+成红细胞(通常占cd45-细胞的84.1%),而相反的是其在pb样品中几乎是检测不到的(通常占cd45-细胞的0.03%;p<0.001mann-whitney检验)。根据骨髓(cd45+/cd33+/cd66b+)和非骨髓(cd45+/cd33-/cd66b-)群中cd33和cd66b标记物的表达情况划分cd45+细胞。在骨髓区室内,我们区分了单核细胞(ssc-a中/cd14+)和粒细胞(ssc-a高/cd14-)。然后,将粒细胞进一步划分为具有不同成熟程度的两个群:成熟(cd10+/cd11c+)和未成熟(ipmn;cd10-和/或cd11c-)。在ssc-a低/cd14-部分中,根据cd11c的表达情况对dc进行鉴定,同时将阴性事件分为骨髓前体细胞(成髓细胞;cd34-)和骨髓定向祖细胞(cd34+)(表1)。正如所预期的那样,观察到与pb样品相比在bm中ipmn的相对贡献更大(通常在cd45+细胞中,在bm中ipmn:46.6%,在pb中ipmn:2.9%,p<0.001;mann-whitney检验)。然而,观察到在骨髓区室中成髓细胞的相对频率没有任何差异(图7b和表3-4)。在非骨髓区室内,对t-细胞(cd3+/cd56-)、nkt细胞(cd3+/cd56+)、b-细胞(成熟:cd19+/cd10-/cd34-;前-b细胞:cd19+/cd10+/cd34-和原-b细胞:cd19+/cd10+/cd34+)、nk细胞(cd3-/cd19-/cd56+)和lin-cd34+细胞进行了区分(表1)。观察到与在bm样品中(通常占总cd45+细胞,t-细胞12.9%和nkt细胞0.5%)相比在pb样品中(通常占总cd45+细胞,t-细胞28.9%和nkt细胞1.7%)成熟t-细胞和nkt细胞具有显著更高的丰度(bm对比pbt-细胞:p<0.1;bm对比pbnkt细胞:p<0.01;mann-whitney检测;表3-4)。此外,根据从b细胞分化的生物学所预期的,在bm样品中仅能够特异性地鉴定出未成熟的b-细胞(通常在淋巴细胞中,前-b14.9%和原-b3.1%;图7c-d和表3-4)。在根据cd33、cd66b、cd14、cd11c、cd3、cd19和cd56标记物排除lin+细胞后,对lin-区室进行了评价。在cd45+/lin-/cd34-细胞中,我们区分了原-成红细胞(cd71+)、未成熟的血小板(cd41/61+),在cd71-和cd41/61-区室,我们鉴定了两个淋巴细胞定向子集(cd10+或cd7+)(表1)。正如所预期的那样,观察到与pb样品相比在bm中未成熟lin-细胞具有更高的频率(通常在cd45+细胞中,在bm中为2.2%对比在pb中为0.19%;p<0.05,mann-whitney检验;图7a和表3-4)。有趣的是,仅在bm样品中发现了原-成红细胞(通常在cd45+lin-细胞中:在bm中为20.6%对比在pb中为1.7%;p<0.001,mann-whitney检验;图7e和表3-4)。然后,将cd45+/lin-/cd34+细胞和cd45+/cd33+cd66b+/cd34+群混合,以分析整个hspc区室。鉴定了作为hsc(cd90+/cd45ra-)、mpp(cd90-/cd45ra-)和mlp(cd45ra+)的最原始子集(cd34+/cd38-)。定向的祖细胞(cd34+/cd38+)可以分成etp(cd7+)、前-b/nk(cd7-/cd10)、cmp(cd7-/cd10-/cd135+/cd45ra-)、gmp(cd7-/cd10-/cd135+/cd45ra+)和mep(cd7-/cd10-/cd135-/cd45ra-)(表1)。重要的是,通过使用实施例1中的方案,可以检测到pb中的循环hspc(通常占cd45+/lin-细胞的25.7%,表3-4),但是正如所预期的那样,与其bm对应物相比,其具有更低的水平(通常占cd45+/lin-细胞的61.7%;bm对比pb=p<0.001,mann-whitney检验,表3-4)。表3-4中报告了bm和pb细胞群频率和比较统计检验结果的完整列表。总之,通过使用根据本发明的方案可以对23种不同造血细胞亚型进行单一分类,其一般覆盖了bm样品中存在的亚型的99.8%和pb样品中存在的亚型的99.6%。实施例3通过形态学测定的验证为了检测根据本发明的方案是否能够正确地鉴定每种造血细胞亚型,进行了5个独立地facs分选实验。将与实施例1中所述相同的门控策略用于从bm中分离不同的推定细胞亚群,因为bm是造血细胞子集最多样化成分的来源。然后,在盲态检测中分选所分选细胞的形态,以评估其是否与其原始类别相匹配(图2b-d)。图2a中报告了5次facs分选使用的标记物列表,细胞分离和形态学评价方案的详情如材料和方法部分所述。重要的是,对所有分选的骨髓细胞和淋巴细胞谱系的形态学评价均证实了通过使用根据本发明的方案进行的表型表征的结果均是正确的——见图2b-c。值的注意的是,对该方案的形态学验证能够表征目前描述不充分的细胞亚型。事实上,鉴定了由表型cd45+/cd33-cd66b-/lin-/cd34-/cd71-/cd10+和cd45+/cd33-cd66b-/lin-/cd34-/cd71-/cd7+定义的另外两个血细胞亚群。最初推测这些子集属于淋巴细胞区室,因为在其表面上存在cd10和cd7标记物。然而,在经过形态学评价后,实际上证实了这些细胞显示出淋巴细胞样外观,即具有薄的细胞质边缘的小圆形细胞(图2d)。值得注意的是,使用根据本发明的方案揭示了尽管具有明确的表型定义(表1),但是ipmn区室似乎实际上由处于不同分化阶段的形态学上混合的未成熟粒细胞群组成(图2b)。实施例4对来自儿童健康供体和pid患者的全血样品中存在的造血细胞亚型的相对频率的比较已经验证了实施例1的方案正确鉴定来自hd的正常bm和pb中不同细胞亚群的能力,对该方案检测血液病症患者中已知的异常造血细胞组成的效能进行了评价。为了达到这一目的,在来自患有不同疾病的28个个体的样品中进行了实施例1的方案,所述疾病包括免疫缺陷(was、ada-scid、cgd)、mld和血液系统肿瘤(all、aml和mm)——见表5和6。表5was、ada-scid、cgd和mld患者的临床特征表6.白血病患者的临床特征考虑到个体的年龄在生理上影响造血细胞群的组成,除了我们的成人hd队列以外,还对来自5名儿童(ped)hd的bm样品进行了分析,以进一步评估我们技术的重现性和以获得用于对hd与患者样品进行比较的年龄匹配的参照数据集。尽管在pedhd和adhd中观察到了不同白细胞区室之间具有相似的细胞分布(图3b,和8a-b),但是正如所预期的在淋巴细胞区室中观察到了差异,与adhd相比,pedhd的成熟(cd19+细胞占总淋巴细胞的50.5%对比39%)和未成熟b细胞(前-b细胞占cd19+淋巴细胞的28.5%对比17.4%)具有更高的频率(图8d-e;表7和8)。表7.在健康供体和患者中骨髓亚群的相对频率,以总cd45+细胞的百分比计。平均百分比±标准偏差表示在成人和儿童健康供体中以及在患有mld、was和ada-scid以及cgd的个体中的bm造血细胞。表8.按照特定区室的在健康供体和患者中的骨髓造血细胞亚型的相对频率。平均百分比±标准偏差表示针对所分析个体所有组别的主要造血细胞区室中的造血细胞亚群。然后,将实施例1的方案用于从7名腺苷脱氨酶-重度联合免疫缺陷(ada-scid)患者,6名wiskottaldrich综合征(was)患者(3名儿童和3名成人)收集得到的bm样品。有2名原发性免疫缺陷pid的患者,在此前的研究中已对其进行了很好的表征,所述患者具有改变的或部分受损的造血功能。ada-scid患者显示出中枢和外周b细胞耐受缺陷,与年龄匹配的健康供体相比,所述患者在bm中具有更高水平的未成熟cd19+cd10+b细胞并且其成熟的b细胞(cd19+)几乎耗竭。而相反的是,缺乏功能性was蛋白导致was病,该疾病严重影响了b细胞分化,使得来自bm的未成熟b细胞频率降低以及未成熟b细胞过早地被排出。在分析来自ada-scid和was个体的bm样品时,证实了与健康供体相比在这两种类型的pid患者中淋巴细胞区室均减少,如图3c中所示。重要的是,本发明的方法在突出ada-scid和was患者中b-细胞区室组分的不平衡方面非常有效。特别地,本发明使得在儿童ada-scid患者中观察到与在b-细胞成熟中的特征性阻断一致的异常群体频率成为可能。与年龄匹配的hd(5)相比,这些患者显示出更高的未成熟b-细胞的含量(在ada-scid和pedhd中分别占前b细胞的79.4%和53.9%,p<0,01,mann-whitney检验;图3c和图8d-e;表7-8),并且当针对cd19+细胞、总淋巴细胞和cd45+细胞计算时,成熟b细胞的频率更低。在我们混合的成人和儿童was患者群中,该方案突出了预期的与hd组(ad+ped)相比在淋巴细胞区室内cd19+淋巴细胞(c19+细胞占总cd45+细胞的4.7%对比11.5%,p<0,05,mann-whitney检验)和未成熟前-b细胞子集(占总淋巴细胞的7.2%对比21.7%,p<0,01,mann-whitney检验;图3c,图8d-e;表7-8)具有更低的频率。重要的是,由于方案能够同时分析所有主要血细胞群,因而我们能够获取pid患者bm的新信息。在我们的was对象队列中我们能够揭示与hd相比单核细胞(占总cd45+细胞的7.3%对比3.3%;p<0,001,mann-whitney检验)和nk细胞(占总淋巴细胞的20%对比6.7%;p<0,01,mann-whitney检验)(图3c,图8c-d;表7-8)具有相对更高的百分比和降低的hspc含量(占总cd45+细胞的0.6%对比1.3%;p<0,01,mann-whitney检验;图3c,图8a和表7-8),而在ada-scid患者中我们发现与pedhd相比原始hsc显著减少(在ada-scid和pedhd中hsc分别占hspc的0.7%对比2.7%;p<0,01,mann-whitney检验;图3c,图8g和表7-8)。我们还利用该方案分析了慢性肉芽肿病(cgd)患者的bm样品,这是一种其中骨髓细胞不能通过吞噬作用杀死细菌的pid。与其中淋巴细胞子集是最严重受损亚群的ada-scid和was免疫缺陷不同的是,cgd患者显示出骨髓细胞功能的缺陷。当我们分析来自cgd患者的bm样品时,该特征是显而易见的。事实上,我们发现了骨髓细胞子集的相对扩增,绝大多数成熟cd45+细胞属于骨髓细胞区室(ipmn和pmn)(图3c,图8a-c和表7-8)。此外,我们还观察到hspc主要由骨髓祖细胞(cmp和gmp)组成,显著缺乏preb/nk祖细胞,导致前-b和原-b淋巴细胞的丧失(图3c,图8d、e和g;表7-8)。作为非血液病患者的附加对照,分析了6名出现症状前的异染性脑白质营养不良(mld)患者的bm组成。mld是由芳基硫酸酯酶a(arsa)缺陷引起的遗传性溶酶体贮积病,并且尚未对出现症状前的mld患者的造血细胞改变进行过描述。如图3d中所示,观察到mld患者的血细胞组成与pedhd类似,仅cd19+淋巴细胞的贡献略高,这很可能是由于这些患者的年龄非常小导致的(在mld和pedhd中,cd19+细胞分别占cd45+细胞的20.2%对比13.4%;表7-8)。实施例5急性髓性和淋巴细胞白血病样品的分析为了对根据本发明的方法检测血液肿瘤中失衡的能力进行定量评价,在来自急性淋巴细胞白血病(all;n=1)和急性髓性白血病(aml;n=6)患者的4个bm样品中对该方案的效能进行了检测(图4-5和表6)。对来自诊断/复发患者的bm样品进行分析,其中扩增的克隆占分析材料的80-90%,并且来自化疗后患者的3个bm样品,其中仅可检测到异常克隆的残余部分。如图4中所示,在所分析的所有bm样品中,使用本发明均突出显示了造血细胞区室的异常组成和存在显示低水平cd45标记物的未成熟母细胞(图4-5)。事实上,根据带有骨髓细胞(aml-1-3,图4b-c)或淋巴细胞(all,图4d)标记物的母细胞的累积,可以区分髓性和淋巴细胞白血病。通过分析cd33联合cd34标记物的表达实现了对髓性或淋巴细胞白血病的分类(图5)。同时在hd中,对造血细胞分化的两个主要分支进行了鉴定(图5a,未成熟的非骨髓偏向[q1]和未成熟的骨髓偏向[q2]祖细胞,成熟的非骨髓细胞[q3]和成熟的骨髓细胞[q4])。在急性白血病样品中,观察到了向单一分化途径的倾斜和向特定成熟阶段的累积。而且,考虑到通过使用根据本发明的方法能够同时检测较多数量的标记物和细胞子集,因而能够评估异常白血病克隆的分化水平。特别地,通过分析两个急性髓性白血病样品的组成,观察到aml-1和aml-4显示出较低分化的“gmp-样”群的累积,而aml-2和aml-3显示出更成熟的成髓细胞样表型(图4b)。而且,为了评价方案的灵敏度,对来自治疗后根据此前的标准诊断检测预计携带约10%残留的白血病母细胞的患者的3个样品进行了分析(表6)。如图4c-d中所示,通过使用根据本发明的方案,可以检测这些样品中的异常血液成分。重要的是,通过全血详细研究(wbd)测量的推定母细胞的频率与此前的诊断完全一致(在aml-5、aml-6和all中分别为cd45+细胞的12%、8.2%和15.7%)。最后,我们有机会对新诊断为低分化多发性骨髓瘤(mm)患者的bm进行了分析。有趣的是,如图4e中所示,我们能够检测到属于未分配事件分数的占总bm19.3%的细胞群,其通常仅占正常bm样品的0.2%(图3和图8a)。引人注明的是,通过针对所有其他方案标记物的表达对该群体进行表征,我们发现93.8%的这些事件对于cd38标记物是强阳性的(图5e)。这表明通过该方案我们很可能在该个体的bm中鉴定出浸润的浆母细胞(通常标识为cd45中cd38高)的累积,其占总cd45+细胞的18.1%。实施例6着眼于hspc:针对全血详细研究(wbd)方案的替代门控策略hspc代表了在诊所中广泛利用的基本细胞来源,因为其在维持造血系统体内平衡中具有重要作用。因而,多年来我们特别注意深入研究hspc亚群的生物学及其在应激条件下(如移植或基因治疗)的维持情况。此外,对hspc在患病状态下或在生命的不同阶段的表征将能够揭示需要纠正的功能缺陷。为了着眼于hspc亚群,我们采用了我们方案的门控策略以便在pb和bm样品中评估cd34+细胞的组成(图9)。在对活细胞进行门控后,我们鉴定了富含造血祖细胞的cd34+群。然后我们应用了与经典门控策略中使用的相同门和群标记物定义(图1和表1)以分析所有lin+cd34+和hspc子集的组成。为了在我们的健康供体和患者队列中表征cd34+细胞,我们利用适宜的门控策略分析此前已描述的相同bm样品(图3和图10)。正如所预期的那样,除了cgd患者以外,原-b细胞构成了所有组中的绝大多数lin+cd34+细胞,cgd患者表现出lin+cd34+区室主要由ipmn和pmn组成(图10)。实施例7精确计数小珠tm能够对通过全血详细研究(wbd)分析的细胞进行绝对定量为了从定量的角度改进我们的分析,我们加入精确计数小珠tm进行检测以便能够对所鉴定的不同造血细胞亚群进行绝对定量。我们通过使用pbs对3个hdpb进行系列稀释评价了我们的细胞计数的可靠性。如图11a中所示,我们发现在从所有3个生物重复样品中获得的细胞计数均具有显著的线性回归(r2>0,99)。我们还在5名ada-scid、2名was和3名mld患者中分析了来自同一患者的pb和bm样品。获得的不同细胞计数和组成符合两种血液来源的预期差异(图11b),因而,证明本发明的方案不仅能够提供定性评价,而且还能够对构成给定血液样品的细胞亚群的绝对数值进行定量。实施例8对在异种移植小鼠中人移植物的分析鉴于该方案是人特异性设计的,我们将人向小鼠移植的背景确定为本发明最相关的应用之一。为了评价在异种移植物中使用本发明方案的可行性,我们将人脐带血(cb)来源的hspc移植入经亚致死剂量照射的nsg小鼠中(nsgn=3和sgm3n=3)。已知nsg小鼠优先支持b-细胞淋巴样分化,研发sgm3小鼠以克服这种局限,其还能够允许骨髓细胞分化。我们分析了6周(fu1)和13周(fu2)后进入pb的人造血细胞(图12a)。在第16周时(fu3)处死存活小鼠,收集pb、spl和bm(图12a-b)。如图12c所示,我们能够以高特异性在不同随访期检测人细胞,因为在未经处理小鼠的pb中未检测到任何人抗体的非特异性结合。通过本发明的方案我们能够评价所分析的所有时间点中在pb中的植入水平以及在不同血液/细胞来源中人细胞的不同含量。分析随着时间推移的植入,尽管我们观察到在移植小鼠的pb中人细胞百分比的减少,但是人细胞的绝对数量似乎随着时间的推移而增加,因而表明人细胞含量百分比的降低是由于接替了小鼠的造血功能导致的(图12d)。本发明的方案能够全面地研究移植小鼠的pb中造血细胞重建的动态过程,而不需要大量的血液样品。事实上,我们能够在这两个小鼠模型中评估移植hspc的输出,预期与经典nsg小鼠相比在sgm3小鼠中有更高的短期骨髓细胞输出(图12-14),以及评估b和t淋巴细胞的回收率。着眼于hspc区室,通过本发明的方案我们还评价了处死时循环hspc的分布以及在小鼠bm中hspc的组成(图13f和14f)。重要的是,在方案的设计中加入计数小珠能够获得造血细胞动态的信息,不仅是相对频率,还有绝对数量,增加在异种移植中方案应用的效力(图12d和图15)。实施例9全血详细研究(wbd)技术的另一个重要方面是可以将其用于对特定细胞区室进行附加表征的初始分析。例如,t细胞包含具有不同免疫功能的几个亚群。因而,为了在不损失由wbd提供的全面信息的前提下获得血液样品免疫学信息,我们以与同鉴定淋巴细胞区室的wbd背景下使用的相同门控策略和标记物开始,设计了另外一组标记物-荧光染料。如图16中所示,在ad和pedhd中,我们能够区分淋巴细胞区室中的b细胞、t细胞和nkt细胞,以及其他t细胞亚群(treg、cd4+t细胞和cd8+t细胞)及其分化状态(幼稚、记忆)。因为我们是从与鉴定wbd相同的门开始的,因而我们还能够通过将来自wbd与来自该附加染色的信息组合评估每个亚群总样品的绝对数量和频率。实施例10研究设计以及材料和方法研究设计为了对来自健康供体(hd)的bm和pb进行表型分型,由成人和儿童hd的数量确定样本量,在获得sanraffaelescientificinstitute伦理委员会批准的研究方案的知情同意后可获得多余材料。其目的是对于每个组从至少4个不同健康供体收集样品。为了在米兰ospedalesanraffaele的诊断目的,经知情同意后,从wiskott-aldrich综合征(was)、腺苷脱氨酶-重度联合免疫缺陷(ada-scid)和异染性脑白质营养不良(mld)患者采集样品。对所有未经治疗的患者进行了表征,这些患者的体内生物材料在2015-2016年期间采集。在分析中总是包含技术验证结果,并且未应用异常值的排除标准。参与分选的血细胞亚群形态学评价的血液学家对所分析的细胞类型是盲态的。患者和健康供体的特征成人和儿童hd的组由5名成人hd(adhd)和5名儿童hd(pedhd)组成,其平均年龄分别为25岁和10岁。ada-scid患者的组由7名ada-scid患者组成(平均年龄=3岁)。还分析了不同年龄(范围:2.5-34岁)和疾病表型的6名was对象。mld患者的组由6名出现症状前的幼儿儿童患者组成(范围:7-11个月)。有关患者特征的其他详细信息亦参见表5。分析了来自白血病患者的4个样品:分析的急性髓性白血病(aml)患者1为诊断时(占母细胞的93%);分析的aml患者2为复发时(占母细胞的66%)。分析的aml患者3和急性淋巴细胞白血病(all)患者为化疗后(分别占母细胞的9.9%和10%)(亦参见表6)。生物样品来自患者,其已经sanraffaelescientificinstitute的伦理委员会批准并经家长或受试者的知情同意。细胞染色和数据采集使用含有k2edta5.4mg的真空采血管(bectondickinson(bd)真空refno.8019839)收集外周血和骨髓抽吸样品。根据实施例1的方案进行细胞染色、数据采集和分析。简言之,裂解rbc后,使用针对cd3、cd56、cd14、cd61/41、cd135、cd34、cd45ra(biolegend)和cd33、cd66b、cd38、cd45、cd90、cd10、cd11c、cd19、cd7和cd71(bdbiosciences)的荧光抗体标记样品。进行滴定测定以评估最佳抗体浓度。进行表面标记后,使用碘化丙啶(biolegend)孵育细胞以染色死细胞。经rainbow小珠(spherotech)校正后通过bdlsr-fortessa(bdbioscience)细胞荧光计采集所有样品,通过diva软件(bdbiosciences)收集原始数据。细胞分选和形态学评价为了分离不同造血细胞亚型进行形态学验证,我们设置了五种不同的分选策略。进行分选1以分离t、nkt、nk和所有cd19+细胞。进行分选2以分离成熟b细胞、前-b和原-b前体细胞。进行分选3以分离pmn、ipmn、单核细胞和dc。进行分选4以分离成红细胞和成髓细胞。进行分选5以分离原-成红细胞和淋巴定向祖细胞(原-淋巴细胞)。每个分选系列中使用的标记物列表如图2a中所示。在来自hd的bm样品上进行形态学验证。根据实施例1中所述的步骤1-12制备样品,但分选3除外,因为单核细胞对操作非常敏感并且需要使用不同的方案对其进行分离。单核细胞分离方案需要在裂解步骤之后通过在rt下以160rcf离心10分钟进行两轮以消除血小板。此外,为了保持单核细胞存活,在所有步骤中使用ws缓冲液代替pbs-facs,并且在冰上操作。通过moflo-xdp细胞分选仪(beckmancoulter)对所有样品进行facs纯化。通过细胞离心涂片器(cytospin3,shandon)离心在分选后将细胞立即固定到玻璃显微镜载玻片上,然后使用may-grunwald/giemsa(sigma)染色着色。使用axioskop40显微镜和axiocammrc5照相机收集图像,并通过axiovision4.8软件(zeiss)进行分析。由专业血液学家在盲态下进行形态学评价。精确计数小珠验证为了对构成所分析样品的细胞进行定量,在进行裂解步骤之前,加入50μl精确计数小珠tm(biolegend)。当采集的血液样品(vs)初始量,小珠溶液(vb),小珠浓度(cb),细胞数(es)和小珠事件(eb)已知时,根据下式,可以计算所分析样品的细胞计数(cs)。为了对进行绝对细胞数测量使用的计数小珠进行验证,我们在3名健康供体的pb样品上进行了检测,向使用pbs系列稀释的全血pb中加入相同量的计数小珠,并且我们计算了线性回归的r2。人向小鼠的hspc移植nod.cg-prkdcscidil2rgtm1wjl/szj(nsg)小鼠和nod-scidil2rgnull-3/gm/sf(sgm3)小鼠购自jacksonlaboratory(charlesriveritalia,lecco,italy),并且将其保持在charlesriver动物房的无特定病原体的条件下。由于产生植入所需的细胞数较少,因而将人cd34+脐带血(cd)来源的细胞用于体内分析。将冷冻的cbcd34+细胞(lonza)复苏,并且重悬在不含钙和镁的无菌pbs(gibco)中,以使其终浓度为3x106个细胞/ml。移植前3小时,以175rad的亚致死剂量照射8周龄nsg(n=3)和3sgm(n=3)小鼠。通过尾静脉施用300.000个cd34+细胞/小鼠,并在移植后6周(fu1)和13周(fu2)采集外周血。在16周(fu3)时,处死小鼠并采集外周血、脾脏(spl)和骨髓。使用氯化铵溶液(ack)裂解缓冲液(stemcell)裂解pb、spl和bm样品,并根据实施例1的方案染色。在加入人抗体混合物之前,在室温下使用小鼠纯化的rat抗-小鼠cd16/cd32(小鼠bdfcblocktm)溶液(bdbioscience)孵育裂解样品10分钟,以避免与小鼠细胞的非特异性结合。统计学分析使用prism6.0c(graphpad软件)进行统计学分析。除非另有说明,否则数据以平均值±s.e.m.表示。显示造血细胞亚型频率的表以平均值±s.d.报告。使用mann-whitney检验对各组间的统计学显著性进行分析检验(p值在每个图例中显示)。讨论由于一些人类血液病症与pb和bm中造血细胞的不平衡分布相关,因而产生用于分析造血系统组成的工具仍是了解血液系统疾病的病因,设计新的治疗方法以及检测其有效性的一个重要目标。过去已开发了17-多参数测定,以详细分析pb成熟细胞。然而,这种早期方案不能区分祖细胞,因而无法将其应用扩展到bm样品。此外,此前的测定不能从荧光染料设计的最新进展中获益,荧光染料的设计使得本发明的方案利用了到目前为止的最新技术,这有利于其未来的开发。需要较低量的血液就能获得给定样品血液细胞组成的全面图像,这使得当可用初始材料的量有限时,本发明的方案适于进行临床筛选。当对来自成人和儿童健康供体的样品进行检测时,证实了本发明方案的灵敏度。尽管我们在成人(ad)和儿童(ped)健康供体(hd)的不同白细胞区室中观察到相似的细胞分布(图3b和图8a-b),但是我们能够检测出造血细胞组成中已知的细微年龄相关差异,特别是针对淋巴未成熟b细胞谱系(在pedhd中和在adhd中的淋巴细胞中前-b细胞分别为28.5%对比17.4%,图3b和图8d)。在患有mld的非常年轻个体中发现的这种差异更加明显(图3d和图8d),其中我们发现了与adhd相比未成熟b细胞的含量更高(图8d-e)。我们还检测了该方案的应用,在使用cbhspc移植的nsg和sgm3小鼠中全面分析了人向小鼠的移植物。通过分析移植小鼠的pb、spl和bm,我们能够评估由植入的hspc产生的人造血细胞的组成和绝对数量(图13-15)。此外,存在hspc特异性标记物还能够对循环和bm驻留hspc进行测量(图13e-f,图14f和15f)。该信息与成熟人细胞动力学的组合使得本发明的方案成为全面研究动物模型中人hspc行为的独特工具,是评估治疗的安全性和有效性以及研究人造血系统生物学的基础。为了进一步验证该方案在临床相关背景下检测造血系统改变的有效性,我们分析了来自ada-scid和was患者的bm样品。我们可以证明该方案不仅能够证实此前已描述的在这些个体中出现的造血系统改变,还能够提供关于这些疾病造血系统情况的新信息。事实上,连同在b细胞贡献中的已知缺陷(图3c和图8d-e,表7-8),我们能够观察到hspc区室中的改变,这支持这些pid功能损害的原因也影响非常原始的干细胞区室的概念(图8g和表7-8)。这些发现支持可以将该技术作为首次鉴定免疫缺陷的筛选工具,以指导选择针对特定细胞区室的其他测定。在这方面,该方案还能够提供用于在输注之前评价供体移植物bm组成的相关工具,并且能够用于在施用动员剂之后鉴定包括pb的富含hspc的其他细胞来源。此外,我们的方案适于对同种异体移植或gt后的pid患者进行临床监测,以便同时评价重建的成熟血细胞和长期保持的所有hspc群的水平,并且用于研究造血系统重构的动力学。最后,我们在来自诊断/复发时和治疗后的白血病患者的样品中对我们的技术进行了检测(表6)。即使在样品具有较低的母细胞含量时,我们也能够明确鉴定母细胞群并对白血病类型进行分类。事实上,我们发现处于急性期的4个白血病样品与hd相比显示出非常不同的组成以及清楚的髓样表型(图4-5)。另一方面,在化疗后分析的样品中,我们能够鉴定出残留的骨髓和淋巴细胞白血病的母细胞并评价其贡献,其水平与通过标准诊断测定做出的评价相当(图4c-d,表6)。此外,本发明的方案能够检测出在mmbm样品中具有“浆母细胞样”表型的大部分先前未鉴定的细胞的存在(图4e-5e),这表明本发明的技术能够提供对白血病患者bm的首次鉴定,这能够指导研究者进行更详细的下游分析。重要的是,存在对hspc亚型具有特异性的抗体代表了与标准表型表征相比本发明具有显著的优点,其能够以更高的精度鉴定白血病母细胞的成熟水平。事实上,通过本发明的方案,我们发现了与aml-2和aml-3相比,aml-1和aml-4显示出更不成熟的表型(图4b-5b)。因而,这种技术可在不到两小时的时间内提供重要且及时的读取,用于指导住院患者的治疗策略。值的注意的是,通过分析化疗后两种不同aml患者(aml-5和aml-6,图4)中残留母细胞的表型,我们能够观察到化疗抗性母细胞不同程度的分化,aml-5显示出“cmp样”表型,而aml-6显示出“hsc/mpp-样”表型。能够推测本发明的方案可以提供用于检测白血病干细胞(lsc)的工具,所述lsc代表了显示出早期干细胞/祖细胞表型的aml细胞的子集,其具有保持白血病群体并在治疗后产生复发的潜能。本发明的方案在经过化疗或bmt的患者中检测残留克隆的能力表明还可以将该技术用于监测最小残留病灶(mrd)。目前通过在诊断时评估所谓的白血病相关异常免疫表型并在治疗后患者随访期间对其进行监测来进行mrd追踪,但是该方法的主要缺点是目前在各中心之间进行的该检测缺乏统一性。一旦实施,本发明方案的标准化和可重现的性质能够克服这些内在的束缚,从而提供将实验室之间的变异性降至最低的共同平台。总之,我们相信本发明的方案能够同时分析23种不同的细胞类型,包括所有主要成熟谱系区室,处于不同成熟阶段的祖细胞和hspc的稀有子集,其构成了用于分析pb和bm样品的新的相关工具。该方法与基于cd34+分离和纯化的现有技术相比对hspc区室的分析方面具有显著的优势,后者可能引入了分析偏倚以及对细胞产率的负面影响。通过本发明的方案以非常少量的bm或pb开始同时分析hspc和成熟细胞的可能性能够在不同实验背景下研究人造血祖细胞的组成,如在稳态造血或在应激条件下,如与造血系统缺陷、血液肿瘤、药理学治疗、骨髓移植和基因疗法相关的条件。重要的是,本发明的方案能够代表涉及使用人源化动物模型的临床前研究的有用工具,其中研究者可能旨在分析治疗后bm和pb人血细胞组成的较小变化。最后,有必要强调方案设计的可塑性。可以利用方案中存在的较大数量的标记物以研究若干可能的门控策略和标记物组合以关注特定区室。一个实施例是图9中描述的替代门控策略,其关注cd34+群并且能够详细研究lin+cd34+和hspc子集(图10)。此外,通过本发明的方案还能够克服造血细胞子集定义的连续更新。事实上,最近的工作描述了使用cd71标记的新型红细胞祖细胞和具有可通过cd41标记物鉴定的巨核细胞潜能的cmp子集。由于在标记物系列中存在cd71和抗-cd41/cd61抗体,因而我们能够提出使用本发明的方案能够鉴定这些新描述的亚群,并更新组成hspc区室的祖细胞的定义。总之,本发明的方案能够以可重现的、标准化的、具有成本和时间效率的方式明确地鉴定组成血液样品的>99%的细胞亚集。这种技术代表了分析人类造血功能的强大工具,其具有广泛的潜在临床前和临床应用前景。参考文献1.e.g.vanlochem,v.h.j.vandervelden,h.k.wind,j.g.temarvelde,n.a.c.westerdaal,j.j.m.vandongen,immunophenotypicdifferentiationpatternsofnormalhematopoiesisinhumanbonemarrow:referencepatternsforage-relatedchangesanddisease-inducedshifts.,cytometryb.clin.cytom.60,1–13(2004).2.f.e.craig,k.a.foon,flowcytometricimmunophenotypingforhematologicneoplasms,blood111,3941–3967(2008).3.b.cham,m.a.bonilla,j.winkelstein,neutropeniaassociatedwithprimaryimmunodeficiencysyndromes.,semin.hematol.39,107–112(2002).4.s.g.apasov,m.r.blackburn,r.e.kellems,p.t.smith,m.vsitkovsky,adenosinedeaminasedeficiencyincreasesthymicapoptosisandcausesdefectivetcellreceptorsignaling,j.clin.invest108,131–141(2001).5.a.vsauer,h.morbach,i.brigida,y.ng,a.aiuti,e.meffre,defectivebcelltoleranceinadenosinedeaminasedeficiencyiscorrectedbygenetherapy,122,2141–2152(2012).6.i.brigida,a.vsauer,f.ferrua,s.giannelli,s.scaramuzza,v.pistoia,m.c.castiello,b.h.barendregt,m.p.cicalese,m.casiraghi,c.brombin,j.puck,k.muller,l.d.notarangelo,d.montin,j.m.vanmontfrans,m.g.roncarolo,e.traggiai,j.j.m.vandongen,m.vanderburg,a.aiuti,b-celldevelopmentandfunctionsandtherapeuticoptionsinadenosinedeaminase–deficientpatients,j.allergyclin.immunol.133,799–806(2014).7.k.l.simon,s.m.anderson,e.k.garabedian,d.moratto,r.a.sokolic,f.candotti,molecularandphenotypicabnormalitiesofblymphocytesinpatientswithwiskott-aldrichsyndrome.,j.allergyclin.immunol.133,896–899.e4(2014).8.h.d.ochs,s.j.slichter,l.a.harker,w.e.vonbehrensm,r.a.clark,r.j.wedgwood,thewiskott-aldrichsyndrome:studiesoflymphocytes,granulocytes,andplatelets,blood55,243–252(1980).9.j.y.park,m.kob,a.p.prodeus,f.s.rosen,a.shcherbina,e.remold-o’donnell,earlydeficitoflymphocytesinwiskott-aldrichsyndrome:possibleroleofwaspinhumanlymphocytematuration,clin.exp.immunol.136,104–110(2004).10.m.j.massaad,n.ramesh,r.s.geha,wiskott-aldrichsyndrome:acomprehensivereview,ann.n.y.acad.sci.1285,26–43(2013).11.i.dekouchkovsky,m.abdul-hay,“acutemyeloidleukemia:acomprehensivereviewand2016update,”bloodcancerj.e441,1–10(2016).12.e.jabbour,s.o’brien,m.konopleva,h.kantarjian,newinsightsintothepathophysiologyandtherapyofadultacutelymphoblasticleukemia,cancer,2517–2528(2015).13.s.p.hunger,c.g.mullighan,acutelymphoblasticleukemiainchildren,n.engl.j.med.373,1541–1552(2015).14.d.bhojwani,j.j.yang,c.-h.pui,biologyofchildhoodacutelymphoblasticleukemia,pediatr.clin.northam.62,47–60(2015).15.e.oliveira,t.s.bacelar,j.ciudad,m.c.m.ribeiro,d.r.n.garcia,l.sedek,s.f.maia,d.b.aranha,i.c.machado,a.ikeda,b.f.baglioli,n.lopez-duarte,l.a.c.teixeira,t.szczepanski,m.l.m.silva,m.g.p.land,a.orfao,e.s.costa,alteredneutrophilimmunophenotypesinchildhoodb-cellprecursoracutelymphoblasticleukemia,oncotarget7,24664–24676(2016).16.m.r.o’donnell,c.n.abboud,j.altman,f.r.appelbaum,d.a.arber,e.attar,u.borate,s.e.coutre,l.e.damon,s.goorha,j.lancet,l.j.maness,g.marcucci,m.m.millenson,j.o.moore,f.ravandi,p.j.shami,b.d.smith,r.m.stone,s.a.strickland,m.s.tallman,e.s.wang,m.naganuma,k.m.gregory,acutemyeloidleukemia,natl.compr.cancernetw.10,984–1021(2012).17.a.porwit,a.rajab,flowcytometryimmunophenotypinginintegrateddiagnosticsofpatientswithnewlydiagnosedcytopenia:onetube10-color14-antibodyscreeningpaneland3-tubeextensivepanelfordetectionofmds-relatedfeatures,int.j.lab.hematol.37,133–143(2015).18.m.-c.jacob,a.souvignet,j.pont,f.solly,j.mondet,s.kesr,m.pernollet,c.dumestreerard,l.campos,j.-y.cesbron,onetubewitheightantibodiesfor14-partbonemarrowleukocytedifferentialusingflowcytometry.,cytometryb.clin.cytom.00,1–11(2016).当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1