使用抗人BNP片段(4-32)抗体的免疫测定方法与流程
本发明涉及利用免疫反应的、人bnp片段的测定方法和测定试剂。更具体而言,涉及使用抗人bnp片段(4-32)特异性抗体的人bnp片段的测定方法和测定试剂。
背景技术:
bnp是脑利钠肽(brainnatriureticpeptide)的缩写,是由在心脏中合成并分泌的32个氨基酸组成的激素。已知当心脏负荷增加或心肌肥大发生时,bnp在血液中的浓度会增加。目前,bnp作为心力衰竭的生化标志物在临床现场中被广泛使用,bnp浓度的测定在心脏病的筛查、心力衰竭严重程度的评价、心力衰竭的治疗效果的判定,或者作为心力衰竭患者的预后预测指标方面被认为是有用的。
专利文献1、非专利文献1中公开了通过测定血液中的bnp来诊断心肌缺血状态的方法。具体而言,用特异性抗体对血液样品中的bnp及其处理产物(人bnp片段(3-32)、人bnp片段(4-32)、人bnp片段(5-32)等)进行选择性浓缩,之后,通过质谱仪检测每种处理产物,以确定特定的处理产物的比例与再狭窄的有无之间的关系。
另外,专利文献2中公开了一种使用人bnp片段(3-32)特异性的抗体来对人bnp片段(3-32)进行特异性测定的方法,该抗体具有与人bnp片段(3-32)反应而不与全长的人bnp及人probnp反应的特征。并且该方法暗示了在诸如高血压、心脏功能/肾功能的诊断等以人bnp(3-32)的增减为指标的疾病诊断方面的有用性。
现有技术文献
专利文献
专利文献1:国际公开第wo2010/023749号小册子
专利文献2:日本特开2014-91719号公报
非专利文献
非专利文献1:clinicalchemistry59:9(2013),p1-8
技术实现要素:
发明所要解决的问题
在专利文献1、非专利文献1的方法中,使用与人bnp(1-32)、bnp(3-32)、bnp(4-32)、bnp(5-32)中的任一种均反应的抗体,对样品中的bnp片段进行浓缩,然后进行质谱分析,根据所得ms谱的信号强度比计算各自的丰度比。因此,在该方法中,由于使用质谱仪分别检测每个bnp片段,因此装置配置变大,操作复杂,不适合快速处理大量样品。
在专利文献2的方法中,公开了一种与人bnp片段(3-32)反应而不与全长的人bnp及人probnp反应的抗体。然而,没有公开该抗体是否与其他片段即人bnp(4-32)和bnp(5-32)反应,也就是说没有公开是否仅与人bnp片段中的人bnp片段(3-32)特异性反应。另外,既没有记载也没有暗示能够特异性检测人bnp片段(3-32)以外的片段的抗体。
如上所述,到目前为止,尚没有建立仅通过免疫分析就能够测定bnp和bnp片段的方法。
本发明的目的在于,仅通过免疫分析,对各种人bnp片段进行检测,并测定人bnp片段比例,从而容易地提供对心脏疾病的诊断、预测有用的信息,以提供一种能够通过特异性抗体来测定目前为止未被关注的人bnp片段(4-32)的方法为课题。
用于解决问题的手段
为了解决上述问题,本发明的发明人努力进行了能够特异性地仅检测人bnp片段(4-32)的抗体的探索,结果是首次成功获得了多种该抗体,并使用该抗体验证了对样品中的人bnp片段(4-32)的特异性检测,从而完成了本发明。
即,本发明具有以下结构。
<1>
样品中的人bnp片段(4-32)的免疫测定方法,其特征在于,该免疫测定方法使用与人bnp片段(4-32)反应且不与人全长bnp(1-32)、人bnp片段(3-32)及人bnp片段(5-32)反应的抗体。
<2>
<1>所述的免疫测定方法,其中,与人bnp片段(4-32)反应且不与人全长bnp(1-32)、人bnp片段(3-32)及人bnp片段(5-32)反应的抗体为与含有人bnp片段(4-32)的n末端的位点反应的抗体。
<3>
<1>或<2>所述的免疫测定方法,其中,与人bnp片段(4-32)反应且不与人全长bnp(1-32)、人bnp片段(3-32)及人bnp片段(5-32)反应的抗体为与人bnp片段(4-10)反应的抗体。
<4>
<1>至<3>中任一项所述的免疫测定方法,其中,与人bnp片段(4-32)反应且不与人全长bnp(1-32)、人bnp片段(3-32)及人bnp片段(5-32)反应的抗体为单克隆抗体。
<5>
一种人bnp片段(4-32)的免疫测定试剂,其特征在于,该免疫测定试剂使用与人bnp片段(4-32)反应且不与人全长bnp(1-32)、人bnp片段(3-32)及人bnp片段(5-32)反应的抗体。
<6>
<5>所述的免疫测定试剂,其中,与人bnp片段(4-32)反应且不与人全长bnp(1-32)、人bnp片段(3-32)及人bnp片段(5-32)反应的抗体为与含有人bnp片段(4-32)的n末端的位点反应的抗体。
<7>
<5>或<6>所述的免疫测定试剂,其中,与人bnp片段(4-32)反应且不与人全长bnp(1-32)、人bnp片段(3-32)及人bnp片段(5-32)反应的抗体为与人bnp片段(4-10)反应的抗体。
<8>
<5>至<7>中任一项所述的免疫测定试剂,其中,与人bnp片段(4-32)反应且不与人全长bnp(1-32)、人bnp片段(3-32)及人bnp片段(5-32)反应的抗体为单克隆抗体。
<9>
一种抗体,其与人bnp片段(4-32)反应且不与人全长bnp(1-32)、人bnp片段(3-32)及人bnp片段(5-32)反应。
<10>
<9>所述的抗体,其与含有人bnp片段(4-32)的n末端的位点反应。
<11>
<9>或<10>所述的抗体,其与人bnp片段(4-10)反应。
<12>
<9>至<11>中任一项所述的抗体,其为单克隆抗体。
发明效果
根据本发明,能够特异性地免疫学测定样品中的人bnp片段(4-32)。因此,即使在含有bnp及各种人bnp片段的样品中,也能够仅对人bnp片段(4-32)进行免疫学测定。另外,通过与本发明的抗体以外的能够特异性检测各片段的抗体进行组合,可以免疫学测定各片段的丰度比,能够有助于实现以该比率为指标的疾病的预测。
附图说明
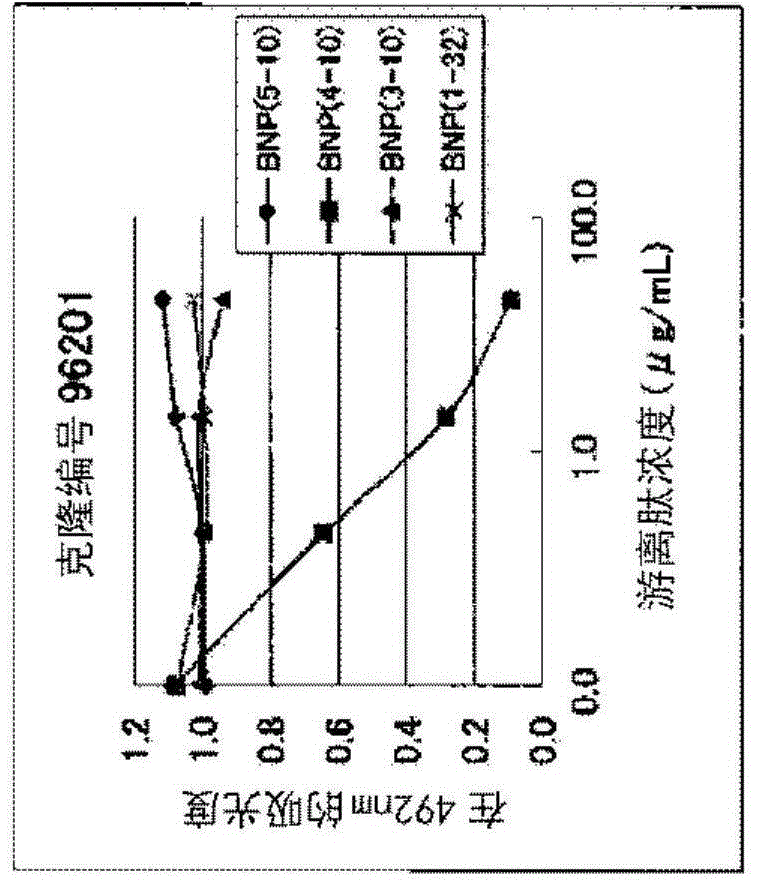
图1是示出通过竞争elisa法确认本发明的三种抗体与各浓度的合成肽(bnp(1-32)、bnp(3-10)、bnp(4-10)、bnp(5-10))的反应性的结果的图。1a:96201抗体,1b:96204抗体,1c:96207抗体
图2是示出通过蛋白质印迹法(westernblotting)确认各抗体与各合成肽((1)bnp(1-32)、(2)bnp(4-32)、bnp(5-32))的反应性的结果的电泳图。2a:本发明的三种抗体(96201抗体、96204抗体、96207抗体);2b:识别人bnp的环状位点的抗体(a);2c:作为阴性对照的igg抗体(b)
图3是示出通过夹心elisa法确认各抗体的组合对人bnp(1-32)及人bnp片段(4-32)的反应性的结果的图。一次抗体:本发明的抗体96207抗体;二次抗体:识别人bnp(26-32)的抗体33236抗体。
图4是示出通过改变人bnp片段(4-32)的浓度并利用夹心elisa法确认各抗体的组合对人bnp片段(4-32)的反应性的结果的图。一次抗体:本发明的抗体96207抗体,二次抗体:识别人bnp(26-32)的抗体33236抗体。
图5是示出通过竞争elisa法确认本发明的三种抗体与各种浓度的合成肽(bnp(4-6)、bnp(4-7)、bnp(4-8)、bnp(4-9)和bnp(4-10))的反应性的结果的图。5a:96201抗体,5b:96204抗体,5c:96207抗体
图6是示出通过蛋白质印迹法确认各抗体与各合成肽((1)bnp(1-32)、(2)bnp(3-32)、(3)bnp(4-32)、(3)bnp(5-32))的反应性的结果的电泳图。6a:本发明的三种抗体(96201抗体、96204抗体、96207抗体),6b:识别人bnp的环状位点的抗体(a),6c:作为阴性对照的igg抗体(b)。
图7是示出通过改变人bnp片段(4-32)及(1-32)的各浓度并通过夹心elisa法确认各抗体的组合对人bnp片段(4-32)及(1-32)的反应性的结果的图。7a一次抗体:本发明的抗体96201抗体,二次抗体:识别人bnp(26-32)的抗体33236抗体,7b一次抗体:本发明的抗体96204抗体,二次抗体:识别人bnp(26-32)的抗体33236抗体,7c一次抗体:本发明的抗体96207抗体,二次抗体:识别人bnp(26-32)的抗体33236抗体。
具体实施方式
在本说明书中,与人bnp或人bnp片段(也统称为人bnp等)“反应”、“识别”、“结合”、“显示交叉反应性”可互换使用。然而,本发明不限于这些示例,需要以最广泛的含义进行解释。抗体是否与人bnp等抗原(化合物)“反应”的确认,可以通过后述的抗原固相化elisa法、蛋白质印迹法、竞争elisa法、夹心elisa法等进行,此外,也可以通过利用了表面等离子体共振(surfaceplasmonresonance)原理的方法(spr法)等进行。关于spr法,可以使用以biacore(注册商标)名称市售的装置、传感器、试剂类进行。
本发明的抗体与某化合物“不反应”是指,本发明的抗体与某化合物基本上不反应,“基本上不反应”是指,例如,基于上述elisa方法,对本发明的抗体进行固定化并测定时,未确认到本发明的抗体的反应性增强的情况。具体而言是指,抗体和化合物的反应性与对照(未添加化合物)的反应性没有显著差异的情况。当然,也可以通过上述elisa方法之外的其他的本领域技术人员已知的方法和手段来确认“基本上不反应”。
在本发明中,人bnp(1-32)是由32个氨基酸组成的成熟的人b型利尿钠激素,由以下部分构成:由存在于第7和第23氨基酸中的半胱氨酸残基通过分子内二硫键构成的17个氨基酸组成的环状部分、由9个氨基酸组成的n-末端部分、以及由6个氨基酸组成的c-末端部分。另外,它还对应于由108个氨基酸组成的人b型利尿钠激素前体(有时称为人probnp)的氨基酸序列77-108。
本发明的bnp片段(3-32)是通过处理bnp(1-32)的n末端的两个氨基酸(以大写字母表示为sp)而产生的片段,bnp片段(4-32)是bnp(1-32)的n-末端的三个氨基酸(spk)被处理所生成的片段,bnp片段(5-32)是bnp(1-32)的n-末端的四个氨基酸(spkm)被处理所生成的片段。此外,在本说明书中,诸如人bnp片段(4-32)的描述与诸如人bnp(4-32)的描述可互换使用,除非另有说明。
本发明的抗体是与人bnp片段(4-32)反应而不与人全长bnp(1-32)反应的抗体。优选为与含有人bnp片段(4-32)的n末端的位点反应的抗体,与人bnp片段(4-10)反应的抗体。更优选为与人bnp片段(3-32)及人bnp片段(5-32)均不反应的抗体。
本发明的抗体可以是多克隆抗体或单克隆抗体,优选为单克隆抗体。
作为单克隆抗体的具体实例,可以举例出通过杂交瘤96201(nitebp-02331)、96204(nitebp-02332)、96207(nitebp-02333)而产生的单克隆抗体(在下文中,有时分别称为96201抗体、96204种抗体、96207抗体),并且,具有与96201抗体、96204抗体、96207抗体交叉反应性的单克隆抗体或者竞争的单克隆抗体也包括在本发明的抗体的范围内。96201抗体、96204抗体、96207抗体包括能够特异性识别与该抗体相同的表位(抗原决定簇)的氨基酸序列(人bnp(4-10))的抗体。与96201抗体、96204抗体、96207抗体竞争的单克隆抗体包括与该抗体竞争人bnp(4-10)的单克隆抗体,竞争抑制程度为50%以上,优选为80%以上,更优选为90%以上。
作为本发明的抗体,不仅可以使用整个抗体分子,也可以使用具有抗原抗体反应活性的抗体的功能性片段,除了通过前述对动物的免疫过程而获得的抗体之外,也可以使用通过基因工程技术而获得的抗体、使用嵌合抗体。作为抗体的功能性片段,例如可以举出f(ab’)2和fab’等,能够通过利用蛋白水解酶(例如,胃蛋白酶、木瓜蛋白酶等)处理前述获得的抗体来制备这些功能性片段。
在本发明的单克隆抗体的制备中,作为抗原(免疫原),使用了合成的含有人bnp(4-32)的n末端的肽。只要是含有n末端的肽即可,没有特殊限制,例如,可以使用与人bnp的4-26位氨基酸残基相当的肽、或者可以直接使用人bnp片段(4-32)。具体地,通过将对应于人bnp(4-32)的n-末端的肽,优选对应于人bnp的4-10位氨基酸残基(下文称为人bnp(4-10))的肽溶解在诸如磷酸盐缓冲生理盐水等溶剂中,并将该溶液给予动物进行免疫来制备。与牛血清白蛋白(bsa)、卵清蛋白(ova)或钥孔血蓝蛋白(称为klh)等缀合以增强免疫原性,并根据需要向所得缀合物中适当添加佐剂,之后,使用乳液进行免疫。作为佐剂,除了广泛使用的佐剂如油包水乳剂、水包油包水乳剂、水包油乳剂、脂质体、氢氧化铝凝胶等以外,也可以使用衍生自生物组分的蛋白质或肽物质。例如,可以适当地使用弗氏不完全佐剂或弗氏完全佐剂。佐剂的给药途径、剂量、给药时间没有特别限制,但是优选进行适当选择,以在抗原免疫的动物中增强所需的免疫应答。
用于免疫的动物类型也没有特别限制,但优选哺乳动物,例如,可以使用小鼠、大鼠、牛、兔、山羊、绵羊等,更优选使用小鼠。可以根据一般方法进行动物免疫,例如,可以通过将抗原溶液,优选与佐剂的混合物注射到皮下、皮内、静脉内或腹腔内来进行免疫。由于免疫应答通常根据待免疫动物的种类及系统的不同而不同,因此优选根据所用动物而适当地设定免疫方案。优选在第一次免疫后重复几次给予抗原。
在获得单克隆抗体的情况下,继续进行以下操作,但本发明不限于此。对于单克隆抗体本身的制备方法,例如,可以按照antibodies,alaboratorymanual(coldspringharborlaboratorypress,(1988))中描述的方法进行。
最终免疫后,从免疫动物中摘出作为抗体生成细胞的脾脏细胞或淋巴结细胞,并与具有高增殖能力的骨髓瘤细胞进行细胞融合,从而能够制备杂交瘤。优选使用具有高抗体产生能力(质量及数量)的细胞用于细胞融合,另外,骨髓瘤细胞优选与产生该待融合的、抗体产生细胞的动物具有相容性。细胞融合可以根据本领域公知的方法进行,例如,可以采用聚乙二醇法、使用仙台病毒的方法、利用电流的方法等。可以根据公知的方法培养所得的杂交瘤,可以在确认所产生的抗体的性质的同时选择所需的杂交瘤。杂交瘤的克隆可以通过公知的方法进行,例如极限稀释法、软琼脂法。
考虑到使用待产生的抗体进行实际测定的条件,可以在选择阶段有效地进行杂交瘤的选择。例如,能够通过elisa法、ria法、蛋白质印迹法等,选择用于产生与人bnp片段反应的抗体的杂交瘤。具体地,基于培养单一杂交瘤产生的培养物上清液,利用以人bnp(1-32)、人bnp(4-32)及人bnp(5-32)作为检测用抗原样品的蛋白质印迹法,能够获得用于产生仅特异性识别人bnp(4-32)的单克隆抗体的杂交瘤。或者也可以通过使用了人bnp(3-10)、人bnp(4-10)、人bnp(5-10)、人bnp(1-32)、人bnp(3-32)、人bnp(4-32)、人bnp(5-32)等的竞争elisa法获得。
通过大规模培养这样选择出来的杂交瘤,能够制备具有期望特性的单克隆抗体。大规模培养的方法没有特别限制,例如,能够举例出在适当的培养基中培养杂交瘤,使单克隆抗体在培养基中产生的方法、或者将杂交瘤注入哺乳动物的腹腔并繁殖,使抗体在腹水中产生的方法等。单克隆抗体的纯化可以通过适当组合例如阴离子交换色谱、亲和色谱、硫酸铵分级分离方法、peg分级分离方法、乙醇分级分离方法等来进行。
这样,在本发明中,获得了单克隆抗体96201、96204、96207。如后述的实施例所示,该抗体与人bnp(4-10)反应,但不与人bnp(3-10)、人bnp(5-10)反应,因此是针对含有人bnp(4-32)的n末端的位点的特异性抗体。
本发明进一步提供如下方法:在用蛋白质变性剂处理样品后,使用上述对人bnp(4-32)特异性的抗体(第一单克隆抗体)、以及对人bnp(4-32)的识别位点与第一单克隆抗体不同的抗体(第二抗体)来测定人bnp(4-32)。
第二抗体可以是抗血清、多克隆抗体和单克隆抗体中的任一种,也可以是嵌合抗体或保留免疫学特性的抗体片段。其中,优选单克隆抗体,例如可以举例出,本领域技术人员通过用人bnp的c末端区域的7个残基肽免疫小鼠来制备单克隆抗体的常用方法(kohler和milstein's方法(nature,第256卷,第495页(1975年)等)所获得的识别人bnp(26-32)的抗人bnp(26-32)单克隆抗体(克隆编号33236)。另外,也可以使用例如识别人bnp的环状位点的单克隆抗体。
第一或第二单克隆抗体可以一种或者两种固定在不溶性载体上而作为固定(固相)化抗体使用,或者利用后述的本领域技术人员已知的常用标记物质进行标记而作为标记抗体进行使用。例如,可以通过将单克隆抗体物理吸附在不溶性载体上或化学结合(也可以借助适当的间隔物)在不溶性载体上来制备固定化抗体。作为不溶性载体,可以使用由聚苯乙烯树脂等聚合物基质、玻璃等无机基质、纤维素、琼脂糖等多糖类基质等构成的不溶性载体,其形状没有特别限定,可以选择诸如板状(例如,微孔板、膜)、珠子或微颗粒状(例如,乳胶颗粒、金胶体颗粒)、筒状(例如,试管)等任意形状。
通过使用能够与本发明的第一或第二单克隆抗体结合的标记抗体、标记蛋白a或标记蛋白g等,能够测定样品中的人bnp片段(4-32)。作为用于产生标记抗体的标记物质,例如可以举例出酶、荧光物质、化学发光物质、生物素、抗生物素蛋白或放射性同位素、金胶体颗粒、有色乳胶等。作为将标记物质与抗体结合的方法,能够使用本领域技术人员可利用的戊二醛法、马来酰亚胺法、吡啶二硫化物法或者高碘酸法等方法,但是固定化抗体和标记抗体的类型及其制造方法不限于上述示例。例如,当使用诸如过氧化物酶或碱性磷酸酶等酶作为标记物质时,能够使用该酶的特定底物(当酶是辣根过氧化物酶(下文称为hrp)时,例如使用邻苯二胺(以下称为opd)或3,3',5,5'-四甲基联苯胺,在酶是alp的情况下,可以使用对硝基苯基磷酸酯等)来测定酶活性,在使用生物素作为标记物质时,通常至少使之与抗生物素蛋白或酶修饰的抗生物素蛋白进行反应。
在本说明书中,有时将“不溶性载体”表述为“固相”,将抗原或抗体物理地或化学地担载在不溶性载体上或担载的状态表述为“固定”、“固定化”、“固相化”、“敏化”或“吸附”。另外,术语“检测”或“测定”应在包括人bnp片段(4-32)的存在证明和/或定量等在内的最广泛意义上进行解释,在任何意义上都不应限制性地解释其含义。
在本发明的方法中,优选用蛋白质变性处理剂作用于样品,以使测定对象的人bnp片段变性。即,优选,用蛋白质变性处理剂处理样品之后,再使用本发明的与人bnp片段(4-32)反应而不与人全长bnp(1-32)反应的抗体来测定人bnp片段的方法。
这里,“变性”是指改变该bnp片段的三维结构以暴露蛋白质内侧的至少一部分。作为蛋白质变性处理剂,只要具有使蛋白质变性的作用即可,例如可以举例出表面活性剂、离液剂、酸、有机溶剂。这些蛋白质变性处理剂可以单独使用,也可以组合使用多种蛋白质变性处理剂。
作为上述表面活性剂,可以举例出阴离子表面活性剂、阳离子表面活性剂、非离子表面活性剂等表面活性剂,优选阴离子表面活性剂,更优选十二烷基硫酸钠(sds)。
作为上述离液剂,可以举例出尿素和胍等。
作为上述酸,可以举例出无机酸、有机酸,作为有机酸,可以举例出乙酸、甲酸、丙酸、丁酸、异丁酸及其混合物。优选为乙酸。
作为用蛋白质变性处理剂进行的处理,可以举例出在15℃至100℃下处理1分钟至60分钟。
关于蛋白质变性处理剂的使用量,能够通过适当选择提高免疫测定的测定灵敏度的量,并根据各蛋白质变性处理剂而适当地设定,但通常优选最终浓度为0.01重量%以上,免疫测定时的浓度优选为0.1重量%以下。
优选在使蛋白质变性处理剂作用时进行加热。通过加热,能够容易地促进蛋白质变性。即,作为处理条件,优选在60℃以上,更优选约100℃,处理约5秒至20分钟,更优选处理约5分钟至15分钟。
另外,还可以与变性剂一起使用还原剂。作为优选的还原剂的例子,可以举例出但不限于二硫苏糖醇(dtt)、nabh4、nabh3cn等。另外,还原剂的浓度优选为约0.001m至1.0m作为最终浓度。此外,还原剂处理可以与蛋白质变性处理剂处理同时进行,但也可以在蛋白质变性处理剂处理之前进行。在这种情况下,优选使上述还原剂以上述浓度在室温下作用约20分钟至1小时。
作为在使用本发明的抗体的测定方法中的检测对象的“样品”,主要可以举例出源自活生物体(生物)的体液。具体而言,能够举例出血液(全血)、血清、血浆、尿液、唾液、痰、胰脏提取液、眼泪、耳漏或前列腺液等,但不限于此。
作为本发明提供的测定试剂的实施方式,只要是能够测定人bnp片段(4-32)的试剂即可。在下文中,以代表性的标记免疫测定方法即elisa法、免疫色谱法、以及代表性的粒子凝集免疫测定法即胶乳免疫凝集法(下文称为ltia法)为例,分别进行说明。
<标记免疫测定法:elisa法>
作为用于检测样品中存在的人bnp片段(4-32)的测定用试剂的实施方式,可以举例出以下要素:
(a)固定化有第一单克隆抗体的固相(诸如平板等);以及
(b)被标记物质标记的第二单克隆抗体。
固定化有第一单克隆抗体的固相将样品中的人bnp片段(4-32)捕获,形成人bnp(4-32)抗体复合物。被标记物质标记的第二单克隆抗体与该人bnp(4-32)抗体复合物反应形成夹心,并使用与标记物质相应的方法测定标记物质的量,从而能够测定样品中的人bnp(4-32)。关于构建测定试剂的具体方法诸如将第一单克隆抗体固定的固定化方法、用标记物质标记第二单克隆抗体的方法等,除了本说明书中记载的方法之外,可以使用本领域技术人员已知的方法而没有限制。在该构成的情况下,可以构建为均匀的测定系统,但是优选构建为非均匀测定系统。
另外,考虑到测定试剂的灵敏度和特异性,也可以采用与上述相反的构成:
(a)被标记物质标记的第一单克隆抗体;以及
(b)固定化有第二单克隆抗体的固相(诸如平板等)。
在该结合的情况下,优选地,将被测样品与含有被标记物质标记的第一单克隆抗体溶液混合,以在溶液中预先形成人bnp(4-32)抗体复合物,然后添加至固定化有第二单克隆抗体的固相中。
<标记免疫测定法:免疫色谱法>
在通常的免疫色谱法中,在诸如膜等片状的固相载体上,使被测样品溶液在长度方向上,基于毛细管现象从一端连续移动依次经过以下位点:“1.被测样品供给位点”、“2.标记试剂位点,其为使含有第一单克隆抗体的标记试剂(第一单克隆抗体被标记物质如金胶体颗粒等标记)可展开地保持在膜上的位点”、“3.捕获试剂位点,其为固定化有第二单克隆抗体的位点,该第二单克隆抗体用于捕获被标记物质标记的第一单克隆抗体与人bnp(4-32)形成的复合物。
具体而言,首先,当将预定量的含有人bnp(4-32)的被测样品添加到被测样品供给位点时,样品在固相载体中展开移动的过程中侵入标记试剂位点,人bnp(4-32)与标记试剂(含有第一单克隆抗体)结合,形成人bnp(4-32)标记试剂复合物。人bnp(4-32)标记试剂复合物直接在膜上展开并移动,当侵入膜上的含有第二单克隆抗体的捕获试剂位点时,被固定化在固相载体上的捕获试剂捕获,并在捕获试剂位置处形成捕获试剂(第二单克隆抗体)-人bnp(4-32)标记试剂(第一单克隆抗体)的复合物。然后,通过任意方法(在可见的金胶体颗粒的情况下,通过其凝集图像,在酶的情况下,通过添加底物进行显色反应)来检测标记试剂,从而能够确定被分析物的存在。
此外,为了便于理解,“1.被测样品供给位点”和“2.标记试剂位点,其为使含有第一单克隆抗体的标记试剂(第一单克隆抗体被标记物质如金胶体颗粒等标记)可展开地保持在膜上的位点”记载为分别独立地位于被测样品的移动方向上,但是本领域技术人员可以理解,也能够采用从上至下依次层叠“1”、“2”的结构等本领域技术人员已知的方式和结构。
另外,作为本发明的测定试剂盒,除了上述基本的试剂构成之外,还可以举例出与蛋白质变性处理剂的组合等。
在下文中,将通过实施例更详细地描述本发明,但是本发明不限于此。
实施例
〔试验例1〕本发明的单克隆抗体的制备方法
1.合成肽的制备
(1)人bnp片段(下文缩写为人bnp)(4-10)、人bnp(3-10),人bnp(5-10)
肽合成外包给外部供应商。
(2)人bnp(4-32)
肽合成外包给外部供应商。
2.其他材料
(1)弗氏完全佐剂:由和光纯药工业株式会社生产,014-09541
(2)骨髓瘤细胞(sp2/o)
(3)rpmi1640,glutamax:由gibco公司生产,61870-036
(4)胎牛血清(fbs):由biologicalindustries公司生产,04-001-1a
(5)聚乙二醇溶液(peg):sigma,p7306
(6)hat培养基:cosmobio公司生产,16213004
(7)96孔板:nunc,167008
(8)hrp标记的山羊抗小鼠igg(γ)抗体:southernbiotech公司生产,1030-05
3.免疫用缀合物溶液的制备
将含有人bnp(4-10)片段的溶液(10mg/ml,溶于磷酸盐缓冲生理盐水(pbs)中)与马来酰亚胺活化的klh或ova溶液(10mg/ml,溶于pbs中)以1:1的体积比混合,并在室温下搅拌反应2小时。此后,将反应混合物在4℃下用pbs透析2天,获得免疫用缀合物溶液。
4.产生抗人bnp(4-32)单克隆抗体的杂交瘤的制备
(1)对动物的免疫
使用将上述免疫用缀合物溶液(0.2至1mg/ml)与弗氏完全佐剂以等量混合制备的乳剂,以每匹20至30μg的量经皮下或足垫注射至雌性balb/c小鼠。并且,以一周的间隔重复注射该乳液7至8次。通过后述的抗原固相化elisa法测定从小鼠尾静脉采集血液而获得的抗血清中的抗体滴度。
(2)一次筛选(抗原固相化elisa法)
利用将人bnp(4-10)与bsa的缀合物溶液固相化的elisa法(抗原固相化elisa法)来确认所述小鼠抗血清中的抗人bnp(4-10)抗体的存在,其中,人bnp(4-10)与bsa的缀合物溶液的制备使用与免疫用缀合物溶液同样的方法。抗原固相化elisa方法的细节如下。
(2-1)抗原固相化elisa用板的制备
将人bnp(4-10)和bsa的缀合物溶液溶解于含有150mm氯化钠的20mm磷酸盐缓冲液(ph7.2;下文称为pbs)中,使其为1μg/ml,将50μl该溶解液分配到96孔微量培养板的各孔中,并在4℃下静置过夜。
用400μl的含0.05%tween(注册商标)20的pbs(以下称为pbst)清洗孔3次后,加入100μl含1%牛血清白蛋白的pbst(以下称bsa-pbst)并在室温下进行1小时的封闭(blocking)。将其作为elisa用板。
(2-2)抗原固相化elisa法
用400μl的pbst清洗所述elisa用板3次后,向所述各孔中添加50μl的用bsa-pbst稀释500至13500倍的小鼠抗血清,并在室温下静置1小时。将所述各孔用400μl的pbst清洗3次,然后将50μl的用bsa-pbst稀释5000倍的hrp标记山羊抗小鼠igg(γ)分配到所述各孔中,并在室温下静置1小时。用400μl的pbst清洗所述各孔3次后,加入50μl的含有0.2%邻苯二胺和0.02%过氧化氢的柠檬酸盐缓冲溶液(ph5.0),并在室温下放置10分钟,加入50μl的4.5n硫酸以终止酶反应,测定波长492nm的吸光度。作为测定结果,从高抗体滴度的小鼠中摘出脾脏或淋巴结,制备源自脾脏的细胞或源自淋巴结的细胞并用于细胞融合。
(3)细胞融合
将所述源自脾脏的细胞或源自淋巴结的细胞中任一者与骨髓瘤细胞以6比1的细胞数比混合,并添加peg使细胞融合。将融合细胞悬浮在hat培养基中,在co2培养箱中于37℃,5%co2培养8天,得到融合细胞(杂交瘤)。
(4)杂交瘤的选择(抗原固相化elisa法)
进行了与上述抗原固相化elisa方法相同的方法,除了使用融合细胞的培养上清液代替小鼠抗血清外。作为测定的结果,选择具有高吸光度的孔作为存在有产生抗人bnp(4-10)抗体的杂交瘤的孔(阳性孔)。
(5)二次筛选(蛋白质印迹法)
作为抗bnp(4-32)抗体产生细胞的二次筛选,对上述第一次筛选选择出来的抗体产生细胞进行培养,并使用培养上清液通过蛋白质印迹法进行再次选择。
首先,将人bnp(1-32)、人bnp(4-32)、人bnp(5-32)以60μg/ml溶解于pbs中,并与含有巯基乙醇的sds处理溶液(科斯莫生物公司生产,产品编号423437)以1:1混合后,在95℃下处理10分钟。接下来,将10μl该溶液逐个加入到multigelminiii(科斯莫生物公司生产,产品编号424916)的各泳道中,按照常规方法进行sds-page。随后,将电泳后的凝胶浸入半干印迹试剂的阴极溶液中并振荡约10分钟,然后使用半干印迹装置按照常规方法进行了向pvdf膜(由科斯莫生物公司生产,产品编号423536)的转移。切割pvdf膜后,将其在bsa-pbst中浸泡1小时进行封闭,然后将用bsa-pbst稀释至适当浓度的融合细胞的培养上清液加到切割的pvdf膜上,并在室温下保持1小时。将该膜浸入pbst中,振荡清洗后,浸入用bsa-pbst稀释5000倍的hrp标记山羊抗小鼠igg(γ)中,并在室温下振荡1小时。进一步,浸入pbst中,振荡清洗后,浸入稀释至0.2mg/ml的dab溶液(由同仁化学研究所生产,产品编号347-00904)中,静置10分钟后转移至纯化水中以停止反应。作为dab检测的结果,选择当转移人bnp(1-32)溶液及人bnp(5-32)溶液时未检测到条带、但转移人bnp(4-32)溶液时检测到条带的培养上清液的孔作为抗人bnp(4-32)抗体产生的阳性孔。
(6)克隆和单克隆抗体收集
使用在上述一次筛选和二次筛选中选择出来的抗人bnp(4-32)抗体产生菌株杂交瘤,进行了杂交瘤的单克隆化和单克隆抗体的纯化。
单克隆化通过常规方法(极限稀释法)进行,并且通过与上述抗原固相化elisa方法相同的方法选择阳性孔,最后得到了三种产生抗人bnp(4-32)单克隆抗体的杂交瘤。将约105个的各细胞给予经姥鲛烷预处理的小鼠的腹腔,分别收集产生的腹水。通过离心从每个收集的腹水中除去不溶物,加入等量的饱和硫酸铵溶液,边搅拌边放置过夜,然后通过离心回收沉淀物。将收集的沉淀物溶解于20mmtris缓冲液(ph8.0)中并用相同的缓冲液透析。将透析内容物分别吸附在用相同缓冲液平衡化后的deae-sepharose柱中,分别通过相同缓冲液中的0-300mm浓度的氯化钠梯度洗脱,得到的igg级分用50mm甘氨酸缓冲液透析,从而得到三种抗体。
〔试验例2〕本发明的单克隆抗体的表位分析(1)
1.试验方法
通过如下所述的竞争elisa法确定与96201、96204、96207抗体反应的人bnp(4-32)的表位。首先,通过与上述抗原固相化elisa法相同的方法制备elisa用板。各孔用400μl的pbst清洗3次,然后将溶解于pbs中的人bnp(1-32)、人bnp(3-10)、人bnp(4-10)、人bnp(5-10)用bsa-pbst稀释至20、2、0.2μg/ml,并以25μl/孔分配至elisa用板中。然后,从其上将用bsa-pbst稀释至0.1μg/ml的96201、96204、96207抗体以25μl/孔分配,并在室温下静置1小时。将所述各孔用400μl的pbst清洗3次后,将50μl的用bsa-pbst稀释5000倍的hrp标记山羊抗小鼠igg(γ)分配到所述各孔中,并在室温下静置1小时。进而,在用400μl的pbst清洗各孔3次后,加入50μl的含有0.2%邻苯二胺和0.02%过氧化氢的柠檬酸盐缓冲溶液(ph5.0),并在室温下静置10分钟后,加入50μl的4.5n硫酸以终止酶反应,测定波长492nm的吸光度。
2.试验结果
结果如图1所示。根据图1可知,当添加了人bnp(1-32)、人bnp(3-10)或人bnp(5-10)时,未观察到吸光度的降低。另一方面,当添加了人bnp(4-10)时,吸光度以浓度依赖性地降低。在该测定系统中,吸光度取决于,与固定化在板上的人bnp(4-10)和bsa的缀合物进行结合的抗体的量。也就是说,因添加人bnp(4-10)导致荧光强度降低的事实表明,溶液中的游离人bnp(4-10)会抑制96201、96204、96207抗体与固相化的缀合物的结合。因此,揭示了96201、96204、96207抗体识别含有人bnp(4-10)的n末端的位点。
〔试验例3〕本发明的单克隆抗体的表位分析(2)
1.试验方法
通过上述的蛋白质印迹法来分析96201、96204、96207抗体的表位。具体地,进行了与上述蛋白质印迹法相同的方法,除了使用以下抗体代替融合细胞的培养上清液之外。即,在通过上述方法将人bnp(1-32)、人bnp(4-32)及人bnp(5-32)转移至pvdf膜,并进行封闭之后,将本发明的抗体(单克隆抗体96201、96204、96207)、识别人bnp的环状位点的抗体(单克隆抗体(a))、作为阴性对照的不识别人bnp(1-32)、人bnp(4-32)、人bnp(5-32)的抗体(单克隆抗体(b))分别用bsa-pbst稀释至5μg/ml的溶液添加到切割的pvdf膜上。
2.试验结果
结果如图2所示。根据图2可以确定,96201、96204、96207抗体不与人bnp(1-32)及人bnp(5-32)反应,仅特异性地与人bnp(4-32)反应。
〔试验例4〕使用单克隆抗体的人bnp(4-32)、人bnp(1-32)的夹心elisa法(1)
1.试验方法
通过将96207抗体在pbs中稀释至5μg/ml的溶液以50μl/孔分配至96孔微量培养板,并在4℃下静置过夜。然后,用400μl的pbst清洗各孔3次后,加入100μl的bsa-pbst,在室温下封闭1小时,将其作为elisa用板。用400μl的pbst清洗所述elisa用板的各孔3次后,将以50μg/ml溶解在pbs中的人bnp(1-32)或人bnp(4-32)与1%sds(十二烷基硫酸钠)-50mmdtt(二硫苏糖醇)-0.2mpbph8.5处理液以1:9进行混合,在95℃处理10分钟,然后用bsa-pbst稀释至50ng/ml,并以50μl/孔分配至elisa用板中。用400μl的pbst清洗该elisa板3次后,将识别人bnp(26-32)的、生物素标记化33236抗体用bsa-pbst稀释至1μg/ml的溶液以50μl/孔分配,在室温静置1个小时。进一步用400μl的pbst清洗3次后,将immunopure(注册商标)链霉抗生物素蛋白hrp缀合物(pierce公司生产,产品编号21126)用bsa-pbst稀释至0.2μg/ml的溶液以50μl/孔分配,并在室温下静置30分钟。用400μl的pbst清洗所述各孔3次后,加入50μl含有0.2%邻苯二胺和0.02%过氧化氢的柠檬酸盐缓冲溶液(ph5.0),并在室温下放置10分钟后,加入50μl的4.5n硫酸以终止酶反应,测定波长492nm的吸光度。
2.试验结果
结果如图3所示。根据图3,当添加了人bnp(4-32)时,与添加了人bnp(1-32)相比,显示出非常高的吸光度。这表明,固相化的96207抗体与变性及还原处理后的人bnp(4-32)结合但不与人bnp(1-32)结合。也就是说,揭示了96207抗体是对人bnp(4-32)特异性的抗体,通过使用本抗体,能够构建对人bnp(4-32)特异性的测定方法。在未进行变性或还原的情况下,在人bnp(1-32)、(4-32)中均未观察到发色现象(结果未显示)。这表明,人bnp(4-32)中的抗体结合位点通过变性或还原处理而变成容易被抗体识别的状态,可以说变性或还原处理对于人bnp(4-32)的特异性测定而言是有用的。
〔试验例5〕使用单克隆抗体的人bnp(4-32)、人bnp(1-32)的夹心elisa法(2)
1.试验方法
以与上述夹心elisa(1)相同的方法制备了elisa用板。在用400μl的pbst清洗各孔3次后,将溶解在pbs中的200μg/ml的人bnp(4-32)以1:9与1%sds-0.2mpbph8.5处理液混合,并在95℃下处理10分钟后,用bsa-pbst稀释至200、100、50、25、12.5ng/ml,并以50μl/孔分配到elisa用板中。
2.试验结果
结果如图4所示。根据图4,当添加了用1%sds处理后的人bnp(4-32)时,显示出依赖于人bnp(4-32)的浓度的高的吸光度,由此可见,通过对人bnp(4-32)进行变性处理,能够获得高灵敏度。
〔试验例6〕本发明的单克隆抗体的表位分析(3)
1.试验方法
为了具体确认与96201、96204和96207抗体反应的人bnp(4-32)的表位,实施了竞争elisa法。首先,通过与上述抗原固相化elisa方法相同的方法制备了elisa用板。将各孔用400μl的pbst清洗3次,然后将溶解在pbs中的人bnp(4-6)、人bnp(4-7)、人bnp(4-8)、人bnp(4-9)或人bnp(4-10)的各合成肽(均是通过将合成外包给外部供应商而获得)用bsa-pbst稀释至20、2、0.2μg/ml,并以25μl/孔分配至elisa用板。后续步骤以与〔试验例2〕“本发明的单克隆抗体的表位分析(1)”相同的方法进行。
2.试验结果
结果如图5所示。根据图5a和c,对于96201和96207抗体,在添加了人bnp(4-6)、人bnp(4-7)、人bnp(4-8)或人bnp(4-9)时,未观察到吸光度的降低,仅在添加了人bnp(4-10)时,吸光度以浓度依赖性地降低。因此,揭示了96201和96207抗体识别含有人bnp(4-32)的n-末端的第7个氨基酸的位点。另一方面,关于96204抗体,根据图5b,当添加了任一肽抗原时,吸光度均以浓度依赖性地降低。因此,揭示了96204抗体识别含有人bnp(4-32)的n末端的第3个氨基酸的位点。
〔试验例7〕本发明的单克隆抗体的表位分析(4)
1.试验方法
通过上述蛋白质印迹法进一步分析96201、96204和96207抗体的表位。具体地,除了使用人bnp(1-32)、人bnp(3-32)、人bnp(4-32)及人bnp(5-32)之外,进行了与〔试验例3〕“本发明的单克隆抗体的表位分析(2)”相同的方法。
2.试验结果
结果如图6所示。根据图6可知,96201、96204和96207抗体不与人bnp(1-32)、bnp(3-32)及人bnp(5-32)反应,仅与人bnp(4-32)特异性反应。
〔试验例8〕使用单克隆抗体的人bnp(4-32)、人bnp(1-32)的夹心elisa法(3)
1.试验方法
将96201、96204、96207抗体、或与人bnp(1-32)及人bnp(4-32)均不反应的抗体(小鼠单克隆抗体(c))在pbs中稀释至5μg/ml。将该溶液以50μl/孔分配到96孔微量培养板中,并在4℃下静置过夜。然后,用400μl的pbst清洗各孔3次后,加入100μl的bsa-pbst,在室温下封闭1小时,将其作为elisa用板。用400μl的pbst清洗所述elisa用板的各孔3次,然后将用bsa-pbst稀释至各浓度10、5、2.5、1.25、0.63、0.31、0.16μg/ml的人bnp(1-32)或人bnp(4-32)以50μl/孔分配到elisa用板中。用400μl的pbst清洗该elisa板3次,然后将识别人bnp(26-32)的、生物素标记33236抗体(2μg/ml)以50μl/孔分配,并在室温下静置1小时。在用400μl的pbst清洗3次后,分配50μl/孔的immunopure(注册商标)链霉抗生物素蛋白hrp缀合物(pierce制造的prod号21126)(0.2μg/ml),并在室温下放置30分钟。用400μl的pbst清洗各孔3次后,加入50μl含有0.2%邻苯二胺和0.02%过氧化氢的柠檬酸盐缓冲溶液(ph5.0)并在室温下放置10分钟后,加入50μl的4.5n硫酸以终止酶反应,测定波长492nm的吸光度。从使用96201、96204或96207抗体获得的吸光度中减去使用小鼠单克隆抗体(c)获得的吸光度,将由此获得的值作为由96201、96204或96207抗体的反应性引起的吸光度。
2.试验结果
结果如图7所示。根据图7可知,当添加了人bnp(4-32)时,与添加了人bnp(1-32)时相比,显示出非常高的吸光度,在96207抗体的情况中尤其显著。另外,在人bnp(4-32)中,观察到了浓度依赖性的反应性增加。因此,确认了能够构建人bnp(4-32)特异性的测定方法。在本试验例中,人bnp(4-32)未被变性或还原,但与试验例4或试验例5相比,反应的抗原量增加。这意味着,人bnp(4-32)中的抗体结合位点通过变性或还原处理而成为容易被抗体识别的状态,但即使在没有被变性或还原处理的情况下,也不是处于完全阻碍抗体结合的状态。这一点有可能在过去被忽略,因此可能是以往没有关于人bnp(4-32)的抗体获得的报道的原因。
产业上的可利用性
由于本发明的抗体是与人bnp片段(4-32)反应且不与人全长bnp(1-32)反应的抗体,因此能够特异性地且免疫学测定样品中的人bnp片段(4-32)。因此,即使在含有bnp及各种人bnp片段的样品中,也能够仅对人bnp片段(4-32)进行免疫学测定。
对保藏的生物材料的参考
(1)产生抗体编号96201的杂交瘤96201
i)保藏该生物材料的保藏机构的名称和地址:
独立行政法人制品评价技术基础机构
日本国千叶县木更津市kazusa镰足2-5-8(邮政编码292-0818)
ii)根据布达佩斯条约在i)中的保藏机构中生物材料保藏的日期:
2017年3月27日
iii)由i)中保藏机构分配的保藏登记号:
nitebp-02331
(2)产生抗体编号96204的杂交瘤96204
i)保藏该生物材料的保藏机构的名称和地址:
独立行政法人制品评价技术基础机构
日本国千叶县木更津市kazusa镰足2-5-8(邮政编码292-0818)
ii)根据布达佩斯条约在i)中的保藏机构中生物材料保藏的日期:
2017年3月27日
iii)由i)中保藏机构分配的保藏登记号:
nitebp-02332
(3)产生抗体编号96207的杂交瘤96207
i)保藏该生物材料的保藏机构的名称和地址:
独立行政法人制品评价技术基础机构
日本国千叶县木更津市kazusa镰足2-5-8(邮政编码292-0818)
ii)根据布达佩斯条约在i)中的保藏机构中生物材料保藏的日期:
2017年3月27日
iii)由i)中保藏机构分配的保藏登记号:
nitebp-02333
- 还没有人留言评论。精彩留言会获得点赞!