一种测定食物中亚硝酸钠含量的方法与流程
本发明属于亚硝酸钠的快速测定方法
技术领域:
,具体涉及一种测定食物中亚硝酸钠含量的方法,以过氧化氢与亚硝酸钠反应产生强氧化剂过氧亚硝酸氧化靛蓝褪色测定亚硝酸钠的可见分光光度法。
背景技术:
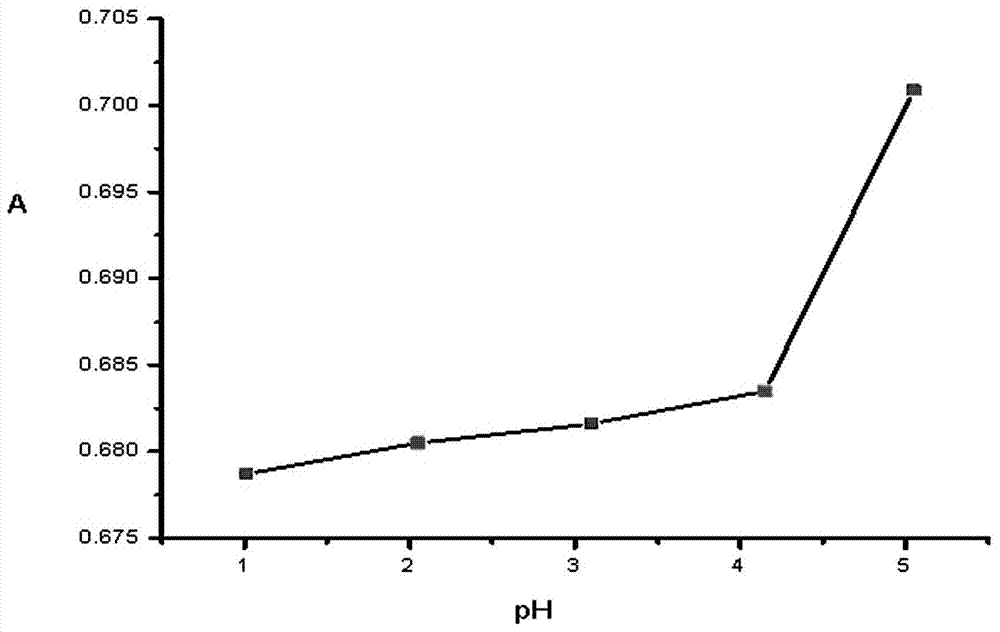
:亚硝酸钠是一种工业盐,与食盐氯化钠很像,但有毒,不能食用。亚硝酸钠有较强毒性,人食用0.2克到0.5克就可能出现中毒症状,如果一次性误食3克,就可能造成死亡。亚硝酸钠被广泛用于腌肉,按GB1907国标生产作为食品添加剂,按GB2760规定量添加,肉食中最大使用量是0.15g/kg,肉食中亚硝酸钠残留量在罐头中不得超过0.05g/kg;肉制品不得超过0.03g/㎏。新腌制的泡菜中也含有亚硝酸钠,另外亚硝酸钠在人体内也会生成致癌物质,因此快速测定亚硝酸钠的含量,对保障人民食品安全是十分必要的。目前,亚硝酸钠含量的测定方法主要有分光光度法和色谱法,光度法中盐酸萘乙二胺法为国标方法,最为常用,费用较低但灵敏度不高,检测周期较长。催化法:如在酸性条件下,溴酸钾氧化亮绿SF反应过程较为缓慢,亚硝酸根离子能够使溴酸钾氧化亮绿SF反应褪色,在波长530nm测定亚硝酸盐的产物含量。但该方法容易受到三价铁离子、二价铁离子、溴离子、碘离子、银离子、亚硫酸根离子等干扰。色谱法中离子色谱法:亚硝酸盐国标(GB5009.33.2010)第一法,离子色谱价格昂贵,且易受氯离子、硫酸根离子、磷酸根离子干扰,分析耗时。高效液相色谱法:高效液相色谱仪具有很高的灵敏度和精确度,可以自动大批量测定,样品经过提取、浓缩、净化、定容后,能够直接进样,约十分钟左右就能完成一个样品的测定,速度快、灵敏度高,缺点是有机溶剂毒性大,对人体造成伤害,污染环境。此外,还有荧光法、电化学法、示波极谱法、分子发射空穴分析法等方法。技术实现要素:本发明为了解决现有测定亚硝酸钠的方法存在的操作复杂繁琐、测定时间长、反应灵敏度低以及测定成本高等问题,提供了一种测定食物中亚硝酸钠含量的方法。本发明由如下技术方案实现的:一种测定食物中亚硝酸钠含量的方法,靛蓝与过氧化氢的混合溶液中加入亚硝酸钠溶液振摇反应,其中反应体系中:靛蓝浓度为00007M~0.0035M,过氧化氢浓度为0.0018M~0.0063M,亚硝酸钠浓度为0.07μM~0.07mM,体系pH值为1~4,反应后测定波长为695nm处的吸光度值,以亚硝酸钠浓度为横坐标,吸光度值为纵坐标建立标准曲线以及线性回归方程,然后在相同的靛蓝和过氧化氢混合体系中加入待测物溶液反应,测定波长为695nm处的吸光度值,通过线性回归方程和标准曲线获得待测物中亚硝酸钠含量。所述过氧化氢与亚硝酸钠溶液的体积比为5:1~15:1。优选过氧化氢与亚硝酸钠的物质的量比为10:1~13:1。加入亚硝酸钠或待测物后振摇反应时间为≥1min。所述亚硝酸钠溶液浓度为0.07、0.35、3.5、7、14、35、70μM。反应机理:申请号为201410595187.4,发明名称为:一种降解亚甲基蓝的方法,该专利中公开了:在酸性条件下,H2O2与NaNO2反应产生过氧亚硝酸,过氧亚硝酸ONOOH是氧化性非常强的一种自由基,可以由亚硝酸钠与H2O2在酸性条件下结合生成,在酸性条件下,生成的过氧亚硝酸非常不稳定,半衰期只有1~2s,很快异构化为硝酸,但过氧亚硝酸具有很强的氧化作用,短时间就能引发氧化-还原反应。本发明采用过氧化氢和亚硝酸钠在酸性条件下生成过氧化亚硝酸自由基,过氧化亚硝酸的强氧化能力,将溶液中的难分解的靛蓝迅速氧化降解,达到褪色作用,该氧化体系对靛蓝的降解能力与亚硝酸钠的浓度相关。本发明与现有测定方法相比,基于自由基的高级氧化技术,在酸性条件下,过氧化氢与亚硝酸钠反应生成过氧亚硝酸,生成的过氧亚硝酸能氧化靛蓝褪色,靛蓝褪色程度与加入亚硝酸钠的量相关,依据靛蓝在特定波长下的吸光度值来测定亚硝酸钠的含量。本发明不需要昂贵仪器设备及试剂,仅需一台价格低廉的紫外可见分光光度计即可满足测定要求,降低了测定成本。本方法可广泛用于食品中亚硝酸钠含量进行快速、简单、准确的检测。附图说明图1为体系在不同pH条件下的吸光度折线图;图2为过氧化氢和亚硝酸钠比例不同的折线图;图3为亚硝酸钠标准曲线图;图4为靛蓝紫外光谱图;图5为靛蓝随亚硝酸钠浓度增加的紫外光谱图。具体实施方式所述DL为靛蓝。实施例1:一种测定食物中亚硝酸钠含量的方法,靛蓝与过氧化氢的混合溶液中加入亚硝酸钠溶液振摇反应,其中反应体系中:靛蓝浓度为00007M~0.0035M,过氧化氢浓度为0.0008M~0.0063M,亚硝酸钠浓度为0.07μM~0.07mM,体系pH值为1~4,反应后测定波长为695nm处的吸光度值,以亚硝酸钠浓度为横坐标,吸光度值为纵坐标建立标准曲线以及线性回归方程,然后在相同的靛蓝和过氧化氢混合体系中加入待测物溶液反应,测定波长为695nm处的吸光度值,通过线性回归方程和标准曲线获得待测物中亚硝酸钠含量。具体制作标准曲线的步骤为:A、量取0.3mL的DL溶液加水至10mL,作为对照溶液。B、量取0.3mL的DL溶液,调节溶液pH值为1~4,加入0.5mL过氧化氢溶液,再加入不同浓度的亚硝酸钠溶液记为c,加水至10mL,测定该系列溶液在695nm波长处的吸光度值记为A。C、溶液振摇1~5分钟,使其充分反应后测定该系列溶液在695nm波长处的吸光度值。D、以亚硝酸钠的浓度(-logA)为横坐标,测定的吸光度值(-logc)为纵坐标,建立标准曲线及线性回归方程;DL母液浓度为0.0036M,过氧化氢母液浓度为0.0009M,亚硝酸钠母液浓度为0.0007M,不同浓度的亚硝酸钠浓度分别为0.07μM、0.35μM、3.5μM、7μM、14μM、35μM、70μM。将溶液pH值调为1~4,目的是为了在酸性条件下让亚硝酸钠转变为亚硝酸。亚硝酸钠标准曲线图见图3。靛蓝紫外光谱图见图4。实验例1:不同pH值下对溶液吸光度的影响:在靛蓝浓度为0.108mM,过氧化氢的浓度为27μM,亚硝酸钠的浓度3.5μM时,调溶液pH分别为1.01、2.05、3.10、4.15、5.05,特定波长下溶液的吸光度A如下表:表1体系在不同pH条件下的吸光度折线图见图1。由表1数据和图1可知,当体系的pH大于5时,溶液的吸光度值增大,故将体系的pH定为1~4。实验例2:过氧化氢和亚硝酸钠比例不同时对溶液吸光度的影响:在靛蓝浓度为108μM,调溶液pH为1.01,当加入过氧化氢和亚硝酸钠比例不同时,特定波长下溶液的吸光度如表2所示。过氧化氢和亚硝酸钠比例不同的折线图见图2,靛蓝随亚硝酸钠浓度增加的紫外光谱图见图5。由图5可知随亚硝酸钠浓度的增加,溶液的吸光度值下降。结果显示:当过氧化氢和亚硝酸钠的比例为10:1~13:1时体系的吸光度值较其它比例的吸光度小,故将体系中过氧化氢和亚硝酸钠的比例定为10:1~13:1。表2通过对靛蓝溶液中加入亚硝酸钠进行单因素考察实验,确定了最佳的实验条件,其中溶液的pH值为1~4,过氧化氢和亚硝酸钠的最佳比例为10:1~13:1。实验证明随着亚硝酸钠的浓度增加,该体系降解靛蓝溶液的能力增加。且亚硝酸钠的浓度与靛蓝溶液的特征吸收波长处的吸光度呈良好的线性关系。该方法可用于广泛用于食品中亚硝酸钠含量进行快速、简单、准确的检测,值得推广。实验例3:测定榨菜中亚硝酸钠的含量。将榨菜打碎后取榨菜汁1mL,加水5mL溶解,离心取上清液1mL,按照含量测定方法测定溶液在695nm波长处的吸光度A=0.6674。计算含亚硝酸钠为0.04g/kg。实验例4:测定自制腌制40天后的蔬菜中亚硝酸钠的含量。取腌制蔬菜汁离心后过滤,取滤液1mL,按照含量测定方法测定溶液在695nm波长处的吸光度A=0.7250。计算含亚硝酸钠为0.0006mg/kg。实验例5:精密度试验。取亚硝酸钠,配制6份相同浓度的溶液(42.0μM),照上述测定方测定溶液在695nm波长处的吸光度。试验结果表明,6份溶液的吸光度RSD值为0.18%,说明本方法精密度良好。结果见表3。表3.样品溶液123456RSD%吸光度0.65470.65350.65430.65270.65330.65600.18重复性试验:取亚硝酸钠,配制样品溶液,(21.0μM)照上述测定方法测定溶液在695nm波长处的吸光度6次。试验结果表明,样品溶液6次吸光度RSD值为0.70%,说明本方法精密度良好。见表4.表4.样品溶液123456RSD%吸光度0.67440.67310.67210.67020.66820.66130.70实验例6:回收率试验。取上述榨菜汁离心后溶液1mL,分别加入标示量80%、100%、120%的亚硝酸钠,用水溶解并稀释成线性范围内高、中、低三种浓度的供试液(5.6μM、7.0μM、8.4μM),各三份,照含量测定方法测定,计算回收率。试验结果表明,亚硝酸钠平均回收率均为94.66%,RSD为4.53%,说明本方法准确度良好。见表5.表5.当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1