一种利用蛋白芯片对囊胚质量判断的方法与流程
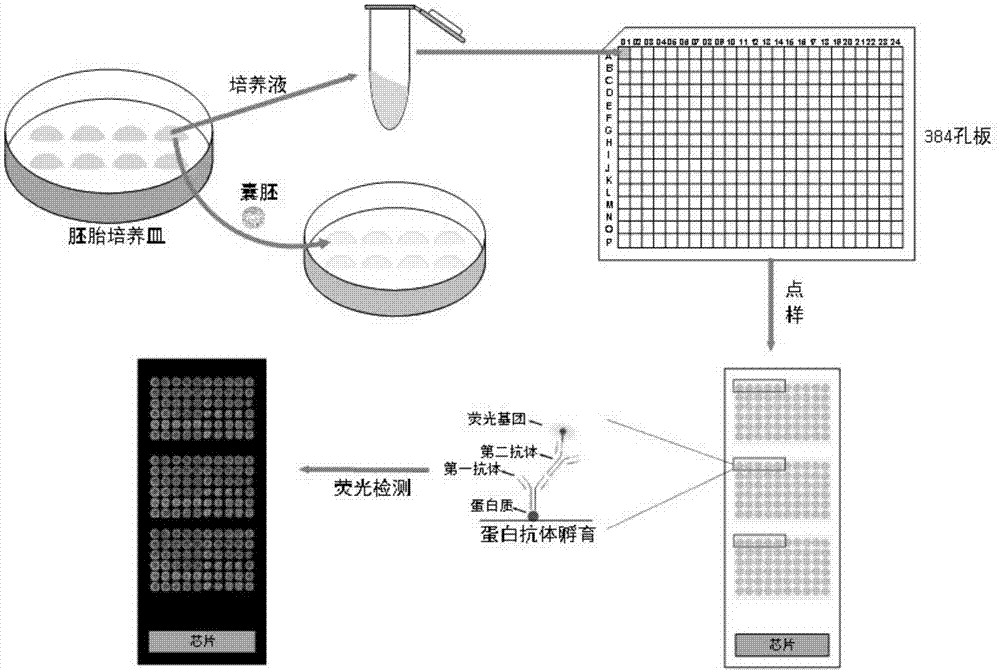
本发明属于囊胚发育情况评价技术领域,具体是涉及一种利用蛋白芯片对囊胚质量判断的方法。
背景技术
据世界卫生组织统计,不育症的人群发病率达10%~15%,且呈上升趋势。目前,治疗不孕症最重要且高效的手段就是体外受精-胚胎移植(invitrofertilization-embryotransfer,ivf-et)技术,即试管婴儿。该技术是将人类精子及卵子在体外受精、胚胎体外培养、胚胎移植回子宫的一系列人工助孕技术。
在ivf-et技术中,往往需要对每位患者的多个胚胎进行筛选,选择出最具备种植发育潜能的胚胎进行移植,其中高质量的囊胚期胚胎(囊胚)具有较高的种植发育潜能。其次,为了提高ivf-et成功率并降低多胎妊娠等并发症,单囊胚移植日渐成为大势所趋。因此,如何挑选出高质量的、具备种植发育潜能的囊胚已成为关键因素。
在胚胎发育过程中会从培养液中吸收营养物质以满足细胞的生长和分化,同时也会向培养液中分泌代谢产物,因此,通过测定胚胎培养液中这些营养物质和代谢物的含量变化可以判断胚胎的活力和发育潜能。胚胎分泌蛋白质的测定已是多年来胚胎筛查的方向,已发现人类胚胎会分泌可溶性人类白细胞抗原-g(shla-g)、载脂蛋白-1(lipocalin-1)、血小板活性因子(paf)、胰岛素样生长因子(igf)、泛素(ubiquitin)等蛋白质。囊胚在着床前,也会分泌大量蛋白因子参与母胎分子对话和信号交换,以使两者协调同步发育,并且识别子宫内膜,介导着床过程的完成。所以,通过对囊胚培养液中某些与囊胚质量特异相关的蛋白质进行含量检测,可以对囊胚的质量、种植发育潜能进行评价。
目前,对胚胎的筛选仍停留在形态学观察为主的阶段。形态学评分是根据胚胎在不同发育时期的形态特征进行评价,主要分为原核期评分、卵裂期评分和囊胚期评分。形态学评分具有明显的阶段性,每个阶段的评分标准不同,但评分指标均为目测判断,主观性强。
常规是在受精后胚胎培养至第5~6日(囊胚期)进行形态观察,根据形态特征进行评分,然后选择评分高的囊胚进行移植。尽管考虑到目前已知的所有形态学参数,但仍然无法确定哪些囊胚会着床发育。再者,囊胚是立体的、动态发展的,且细胞较多、细胞间隙不明显,人眼通过显微镜观察到的图像会有偏差,加之不同人的主观臆断就会使偏差放大,所以往往不同人的评分结果不同,可能会对囊胚质量造成误判。
近年来胚胎时差成像技术兴起,通过结合胚胎分裂模式及分裂时间来评估胚胎质量,但其对临床妊娠率的改善仍有争议。所以,形态学评分筛查囊胚质量存在明显不足,难以客观定量,尚无准确、可靠、定量的筛选方法。
蛋白质是调节细胞生物学功能的关键因子,可以更加灵敏地反映胚胎的生理和病理状态。建立筛选囊胚的蛋白质含量检测芯片,可为ivf-et中囊胚筛选提供客观的、量化的检测指标。为此,设计一种利用蛋白芯片对囊胚质量判断的方法是很有必要的。
技术实现要素:
本发明的目的在于克服上述现有技术中的不足,提供一种利用蛋白芯片对囊胚质量判断的方法,其能无创的、客观的、定量的评价囊胚发育情况,可用以筛选质量高、具备种植潜能的囊胚,帮助提高对囊胚质量筛选的准确性,其筛选准确度提高5%~10%。
为实现上述目的,本发明采用的技术方案是:一种利用蛋白芯片对囊胚质量判断的方法,其特征在于,包括以下步骤:
步骤一、将需要质量判断的胚胎放置在胚胎培养皿中进行胚胎培养,在胚胎发育到囊胚阶段即受精后第5~6天时,将囊胚转移到另一个胚胎培养皿的培养液滴中;
步骤二、将步骤一中转移走囊胚后的胚胎培养皿内的培养液滴吸取至样品管中,并在样品管中加入蛋白酶抑制剂后,将这两者混合均匀制成待测样品;所述样品管中加入的培养液滴和蛋白酶抑制剂的体积之比为6:1~9:1,所述蛋白酶抑制剂为10×蛋白酶抑制剂;
步骤三、将步骤二中制成的待测样品加入到384孔板中,384孔板的每个孔对应一样品管待测样品,并在每个孔中加入点样液后,将这两者混合均匀制成待点样样品;所述384孔板的每个孔中加入的待测样品和点样液的体积之比为1:1,所述点样液为灭菌过的1×磷酸盐缓冲液;
步骤四、通过点样仪将步骤三中384孔板的孔内的待点样样品点到芯片上,每个孔内的待点样样品至少点6张芯片,将点好样的芯片在室温下的湿盒中放置1.5~2.5小时后,再放到温度为37℃的烘箱中烘干;
步骤五、对步骤四中烘干后的芯片进行蛋白抗体的孵育,制成蛋白芯片;每张芯片上孵育一种特定蛋白抗体,总共孵育六种特定蛋白抗体,六种特定蛋白抗体对应的六种蛋白质分别为:载脂蛋白a2、载脂蛋白h、血红蛋白β亚基、血清类黏蛋白1、视黄醇结合蛋白4和丝氨酸蛋白酶抑制蛋白g1;
步骤六、采用芯片扫描仪对步骤五中制成的每张蛋白芯片进行荧光检测,即可得到每张蛋白芯片上的每个微滴的荧光强度,代表每个微滴中特定蛋白质的含量;最后对每个囊胚的每种蛋白质的含量进行统筹计算,首先在某一张蛋白芯片上某个囊胚对应的15个微滴的荧光发光量中,选中位数代表这一囊胚的某一种蛋白质的含量,如此便可得到每个囊胚的6种蛋白质分别的含量;将得到的每个囊胚的六种蛋白质的含量分别与这六种蛋白质的标准含量进行比较,阳性结果越多的则代表此囊胚的发育质量越高;六种蛋白质的标准含量具体如下:载脂蛋白a2的荧光强度>220为阳性,载脂蛋白h的荧光强度>150为阳性,血红蛋白β亚基的荧光强度<540为阳性,血清类黏蛋白1的荧光强度>240为阳性,视黄醇结合蛋白4的荧光强度>950为阳性,丝氨酸蛋白酶抑制蛋白g1的荧光强度<1600为阳性。
上述的一种利用蛋白芯片对囊胚质量判断的方法,其特征在于:步骤一中所述胚胎培养皿内含有成分相同的8个培养液滴,每个培养液滴的体积为40微升,每个胚胎对应一个培养液滴。
上述的一种利用蛋白芯片对囊胚质量判断的方法,其特征在于:步骤二中所述的样品管和培养液滴一一对应,每个样品管中加入的培养液滴的体积为35微升、加入的蛋白酶抑制剂的体积为5微升。
上述的一种利用蛋白芯片对囊胚质量判断的方法,其特征在于:步骤二中所述的10×蛋白酶抑制剂是事先将蛋白酶抑制剂片剂溶于1.5毫升的1×磷酸盐缓冲液中制成的,所述蛋白酶抑制剂片剂为罗氏公司的不含edta的迷你包装产品。
上述的一种利用蛋白芯片对囊胚质量判断的方法,其特征在于:步骤三中所述的384孔板的每个孔中加入的待测样品的体积为20微升、加入的点样液的体积为20微升。
上述的一种利用蛋白芯片对囊胚质量判断的方法,其特征在于:步骤四中所述的点好样的芯片在室温下的湿盒中放置的时间为2小时。
上述的一种利用蛋白芯片对囊胚质量判断的方法,其特征在于:步骤四中所述的每个孔内的待点样样品点6张芯片或12张芯片,每张芯片上分三个阵列,每个阵列里每孔样品点5个微滴,即每孔待点样样品在每张芯片上一共点15个微滴,所述芯片为博奥生物有限公司生产的光学级环氧基片。
上述的一种利用蛋白芯片对囊胚质量判断的方法,其特征在于:步骤五中所述的对烘干后的芯片进行蛋白抗体的孵育,包括以下步骤:
步骤501、首先将烘干后的芯片放到1×含吐温-20的磷酸盐缓冲液中,轻柔清洗4分钟后,再放到1×磷酸盐缓冲液中,轻柔清洗4分钟,然后瞬时离心甩干芯片;
步骤502、在步骤501中所述的瞬时离心甩干的芯片上滴加含5%牛血清白蛋白的1×含吐温-20的磷酸盐缓冲液,即抗体稀释液,然后在温度为30℃的环境下孵育1小时,然后再依次进行清洗和甩干;
步骤503、在步骤502中所述的甩干的芯片上滴加稀释过的第一抗体,所述第一抗体为与步骤五中要检测的蛋白质相结合的抗体;在30℃环境下孵育3小时,然后再依次进行清洗和甩干;
步骤504、在步骤503中所述甩干的芯片上滴加稀释过的第二抗体,第二抗体为能与步骤502中所述第一抗体相结合的抗体;在30℃环境下孵育1小时,然后再依次进行清洗和甩干,即制成蛋白芯片。
上述的一种利用蛋白芯片对囊胚质量判断的方法,其特征在于:步骤503中所述的第一抗体采用武汉三鹰生物技术有限公司生产的产品,步骤504中所述的第二抗体采用jacksonimmunoresearch公司的结合cy3荧光基团的产品。
本发明与现有技术相比具有以下优点:
1、本发明是利用几种蛋白质芯片,通过对囊胚培养液中的这几种蛋白质含量的检测,进而对该囊胚的发育质量进行评价,从而筛选出质量高、具备种植潜能的囊胚作为移植备选;可筛选质量高、具备种植潜能的囊胚,帮助提高对囊胚质量筛选的准确性,其筛选准确度提高5%~10%。
2、本发明只吸取废弃的囊胚培养液用于检测,对囊胚本身不带来任何实质性伤害。
3、本发明得到的检测结果是量化的,可以更客观的评价囊胚的发育质量,避免了传统的人眼形态学观察带来的主观误差。
4、本发明有助于提高对囊胚质量筛选的准确性,间接增加患者的妊娠几率,减少患者的额外支出。
5、本发明的主要技术手段是蛋白芯片的制备及检测,该技术操作流程简单,易于学习,很多步骤由机器替代,可避免人工操作失误,也可避免了重复性差的风险。
6、本发明提供的是一种无创的、客观的囊胚发育情况评价方法,辅助试管婴儿中的囊胚筛选,帮助提高试管婴儿的妊娠结国;结果统计方法简单,易于分析。
下面通过附图和实施例,对本发明做进一步的详细描述。
附图说明
图1为本发明以一个囊胚的培养液检测方法为例的流程图。
图2为本发明载脂蛋白a2(apoa2)的蛋白含量箱式图。
图3为本发明载脂蛋白h(apoh)的蛋白含量箱式图。
图4为本发明血红蛋白β亚基(hbb)的蛋白含量箱式图。
图5为本发明血清类黏蛋白1(orm1)的蛋白含量箱式图。
图6为本发明视黄醇结合蛋白4(rbp4)的蛋白含量箱式图。
图7为本发明丝氨酸蛋白酶抑制蛋白g1(serping1)的蛋白含量箱式图。
图8为本发明载脂蛋白a2(apoa2)蛋白含量的roc曲线图。
图9为本发明载脂蛋白h(apoh)蛋白含量的roc曲线图。
图10为本发明血红蛋白β亚基(hbb)蛋白含量的roc曲线图。
图11为本发明血清类黏蛋白1(orm1)蛋白含量的roc曲线图。
图12为本发明视黄醇结合蛋白4(rbp4)蛋白含量的roc曲线图。
图13为本发明丝氨酸蛋白酶抑制蛋白g1(serping1)蛋白含量的roc曲线图。
具体实施方式
如图1所示,以一个囊胚培养液的检测方法为例来进行说明,本发明的一种利用蛋白芯片对囊胚质量判断的方法,包括以下步骤:
步骤一、将需要质量判断的胚胎放置在胚胎培养皿中进行胚胎培养,在胚胎发育到囊胚阶段即受精后第5~6天时,将囊胚转移到另一个胚胎培养皿的培养液滴中;
步骤二、将步骤一中转移走囊胚后的胚胎培养皿内的培养液滴吸取至样品管中,并在样品管中加入蛋白酶抑制剂后,将这两者混合均匀制成待测样品;所述样品管中加入的培养液滴和蛋白酶抑制剂的体积之比为6:1~9:1,所述蛋白酶抑制剂为10×蛋白酶抑制剂;
步骤三、将步骤二中制成的待测样品加入到384孔板中,384孔板的每个孔对应一样品管待测样品,并在每个孔中加入点样液后,将这两者混合均匀制成待点样样品;所述384孔板的每个孔中加入的待测样品和点样液的体积之比为1:1,所述点样液为灭菌过的1×磷酸盐缓冲液(pbs);
步骤四、通过点样仪将步骤三中384孔板的孔内的待点样样品点到芯片上,每个孔内的待点样样品至少点6张芯片,将点好样的芯片在室温下的湿盒中放置1.5~2.5小时后,再放到温度为37℃的烘箱中烘干;
步骤五、对步骤四中烘干后的芯片进行蛋白抗体的孵育,制成蛋白芯片;每张芯片上孵育一种特定蛋白抗体,总共孵育六种特定蛋白抗体,六种特定蛋白抗体对应的六种蛋白质分别为:载脂蛋白a2、载脂蛋白h、血红蛋白β亚基、血清类黏蛋白1、视黄醇结合蛋白4和丝氨酸蛋白酶抑制蛋白g1;
步骤六、采用芯片扫描仪对步骤五中制成的每张蛋白芯片进行荧光检测,即可得到每张蛋白芯片上的每个微滴的荧光强度,代表每个微滴中特定蛋白质的含量;将得到的每个囊胚的六种蛋白质的含量分别与这六种蛋白质的标准含量进行比较,阳性结果越多的则代表此囊胚的发育质量越高;六种蛋白质的标准含量具体如下:载脂蛋白a2(apoa2)的荧光强度>220为阳性,载脂蛋白h(apoh)的荧光强度>150为阳性,血红蛋白β亚基(hbb)的荧光强度<540为阳性,血清类黏蛋白1(orm1)的荧光强度>240为阳性,视黄醇结合蛋白4(rbp4)的荧光强度>950为阳性,丝氨酸蛋白酶抑制蛋白g1(serping1)的荧光强度<1600为阳性。
本实施例中,步骤一中所述胚胎培养皿内含有成分相同的8个培养液滴,每个培养液滴的体积为40微升,每个胚胎对应一个培养液滴。一般一个胚胎培养皿里做八个液滴,一个患者有多少个胚胎就放到多少个液滴里,少于八个就用一个胚胎培养皿,多了就再用一个胚胎培养皿,患者想检测几个胚胎就检测几个,一个也行,检测多个也行。
本实施例中,步骤二中所述的样品管和培养液滴一一对应,每个样品管中加入的培养液滴的体积为35微升、加入的蛋白酶抑制剂的体积为5微升。
本实施例中,步骤二中所述的10×蛋白酶抑制剂是事先将蛋白酶抑制剂片剂溶于1.5毫升的1×磷酸盐缓冲液(pbs)中制成的,所述蛋白酶抑制剂片剂为罗氏公司的不含edta的迷你包装产品(complete,mini,edia-free,rochetm)。
本实施例中,步骤三中所述的384孔板的每个孔中加入的待测样品的体积为20微升、加入的点样液的体积为20微升。
本实施例中,步骤四中所述的点好样的芯片在室温下的湿盒中放置的时间为2小时。
本实施例中,步骤四中所述的每个孔内的待点样样品点6张芯片或12张芯片,一次点样至多点60孔待点样样品,每张芯片上分三个阵列,每个阵列里每孔样品点5个微滴,即每孔待点样样品在每张芯片上一共点15个微滴,所述芯片为博奥生物有限公司生产的光学级环氧基片。
本实施例中,步骤五中所述的对烘干后的芯片进行蛋白抗体的孵育,包括以下步骤:
步骤501、首先将烘干后的芯片放到1×含吐温-20的磷酸盐缓冲液(pbst)中,轻柔清洗4分钟后,再放到1×磷酸盐缓冲液(pbs)中,轻柔清洗4分钟,然后瞬时离心甩干芯片;
步骤502、在步骤501中所述的瞬时离心甩干的芯片上滴加含5%(质量浓度)牛血清白蛋白(bsa)的1×含吐温-20的磷酸盐缓冲液(pbst),即抗体稀释液,然后在温度为30℃的环境下孵育1小时,然后再依次进行清洗和甩干;
步骤503、在步骤502中所述的甩干的芯片上滴加稀释过的第一抗体,所述第一抗体为与步骤五中要检测的蛋白质相结合的抗体,用灭菌过的含5%(质量浓度)牛血清白蛋白(bsa)的1×含吐温-20的磷酸盐缓冲液(pbst)稀释,按抗体说明书中最低稀释倍数稀释;在30℃环境下孵育3小时,然后再依次进行清洗和甩干;
步骤504、在步骤503中所述甩干的芯片上滴加稀释过的第二抗体,第二抗体为能与步骤502中所述第一抗体相结合的抗体,用灭菌过的含5%(质量浓度)牛血清白蛋白(bsa)的1×含吐温-20的磷酸盐缓冲液(pbst)稀释,按抗体说明书中最低稀释倍数稀释;在30℃环境下孵育1小时,然后再依次进行清洗和甩干,即制成蛋白芯片。
本实施例中,步骤503中所述的第一抗体采用武汉三鹰生物技术有限公司生产的产品,步骤504中所述的第二抗体采用jacksonimmunoresearch公司的结合cy3荧光基团的产品。
图2至图6依次为载脂蛋白a2(apoa2)、载脂蛋白h(apoh)、血红蛋白β亚基(hbb)、血清类黏蛋白1(orm1)、视黄醇结合蛋白4(rbp4)和丝氨酸蛋白酶抑制蛋白g1(serping1)的蛋白含量箱式图。
这六副图中,纵坐标为蛋白芯片的荧光量,代表蛋白质含量;横坐标为根据囊胚形态学评分的囊胚培养液分组,从左至右依次为高质量囊胚到低质量囊胚。由图可知,这六种蛋白质在培养液中的含量与囊胚发育质量是呈正相关或负相关的,因此通过对这六种蛋白质含量的统筹分析便可判别囊胚的发育质量。
图8至图13依次为载脂蛋白a2(apoa2)、载脂蛋白h(apoh)、血红蛋白β亚基(hbb)、血清类黏蛋白1(orm1)、视黄醇结合蛋白4(rbp4)和丝氨酸蛋白酶抑制蛋白g1(serping1)蛋白含量的roc曲线图。
这六副图中,纵坐标为敏感度(代表蛋白含量真实反映囊胚质量的程度),横坐标为1-特异度(代表蛋白含量错误反映囊胚质量的程度)。将每种蛋白质的roc曲线上各点的纵坐标减去横坐标,得到的所有值中的最大值即为该蛋白质的标准含量。
本发明只吸取废弃囊胚培养液用于检测,对囊胚本身不带来任何实质性伤害。得到的检测结果是量化的,可以更客观的评价囊胚的发育质量,有助于提高对囊胚质量筛选的准确性,增加患者的妊娠几率,减少患者的额外支出。
以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制,凡是根据本发明技术实质对以上实施例所作的任何简单修改、变更以及等效结构变换,均仍属于本发明技术方案的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!