一种细胞毒性检测试剂组合物的制作方法
本发明涉及生物技术领域,具体涉及一种细胞毒性检测试剂组合物。
背景技术
细胞毒性(cytotoxicity)检测广泛应用于生物学、临床和药学研究中。细胞毒性检测任何由生物学活性的物质通过生物学相关机制诱发的细胞死亡,以此来筛选候选分子的文库、鉴定反应机制、表征药物产品的生物学活性等。在免疫治疗中,免疫细胞如nk细胞、t细胞等从血浆中被分离、在体外扩增和/或激活并回输给病人。然而目前即使操作方法相同,回输后的效果也经常不一致。因此在进行免疫治疗前,对免疫效应细胞(immuneeffectorcell)通过细胞毒性检测来确定其细胞活力和活性是必不可少的步骤。
解离性增强镧系元素荧光免疫检测(dissociativeenhancedlanthanidefluoro-immunoassay,delfia)技术在二十世纪80年代由soini和
然而在实际使用中,batda在细胞内经过酯酶被水解为tda后,tda的亲水性不足,其虽然在理论上穿透细胞膜的能力较弱,但在实际应用中发现释放自靶细胞的配合物水平仍然非常高,使背景的自发性荧光水平也很高,并且这种自发性释放的高水平荧光与细胞种类有关。在有些情况下,自发性释放的荧光几乎与加入裂解样品后的特异性增强的荧光水平相当(us20180051317a1)。这种高本底水平的自发性释放荧光导致测量的结果因细胞的状态不同而产生大幅度的波动,严重地影响了这种方法测量细胞毒性的准确性。在perkinelmer公司所提供的产品(产品号:ad0116)说明书中建议使用一种多药物耐药转运体(multi-drugresistancetransporter,mdrtransporter)抑制剂(probenecid,sigmap8761),提示其能够降低自发性释放荧光的水平。但实际操作中加入该试剂后对于降低自发性释放荧光的效果并不理想。因此,针对基于delfia技术的镧系元素自发荧光检测细胞毒性的方法现在还需要进一步改进,以有效降低该方法中的自发性释放荧光的水平,提高细胞毒性检测的准确率。
技术实现要素:
本发明所要解决的技术问题是为了克服目前已有荧光增强配体双(乙酰氧基甲基)2,2':6',2”-三联吡啶-6,6”-二羧酸(bis(acetoxymethyl)2,2':6',2”-terpyridine-6,6”-dicarboxylate,batda)在delfia技术检测细胞毒性的用途中用于增强镧系元素铕的自发荧光时本底水平过高、可重复性差、影响了细胞毒性检测结果的准确性与可靠性的问题,提供了一种改进的细胞毒性检测试剂组合物。所述细胞毒性检测试剂组合物包括batda、铕的化合物和白蛋白。所述细胞毒性检测试剂组合物在现有的基于delfia技术的以batda作为荧光增强配体的细胞毒性检测试剂盒的基础上引入了白蛋白,明显地降低了现有的细胞毒性检测试剂中释放自batda的荧光增强配体tda对镧系元素铕的自发荧光非特异性地增强,进而显著地降低了高水平的自发荧光本底对细胞毒性检测结果的干扰,有效地提高了使用基于delfia技术的镧系元素铕结合batda荧光增强配体检测细胞毒性的方法的重复性和准确性。
因此,本发明一方面提供了一种细胞毒性检测试剂组合物,其组分包括铕的化合物、双(乙酰氧基甲基)2,2':6',2”-三联吡啶-6,6”-二羧酸和白蛋白。
在一优选实施方案中,所述铕的化合物为选自氯化铕、硫酸铕、硝酸铕、乙酸铕和磷酸铕中的一种或多种。
在一优选实施方案中,所述铕的化和物以溶液形式存在或以固体形式存在。
在一优选实施方案中,所述铕的化合物为乙酸铕,以溶液形式存在,且所述溶液的ph为3-6;优选地,所述溶液的ph=4。
在一优选实施方案中,所述双(乙酰氧基甲基)2,2':6',2”-三联吡啶-6,6”-二羧酸以溶液形式存在或以固体形式存在;优选地,以溶液形式存在;更优选地,所述溶液的溶剂为dmso;最优选地,所述溶液的溶剂为dmso且所述溶液的浓度与perkinelmer货号为ad0116的产品中的delfiabatda试剂的浓度相同。
在一优选实施方案中,所述白蛋白为选自人血白蛋白、牛血白蛋白和羊血白蛋白中的一种或多种;优选地,为人血白蛋白或牛血白蛋白;更优选地,为人血白蛋白。
在一优选实施方案中,所述白蛋白以溶液形式存在或以固体形式存在;优选地,以固体形式存在。
在一优选实施方案中,所述白蛋白为人血白蛋白,以固体形式存在。
在一优选实施方案中,所述细胞毒性检测试剂组合物还包括细胞裂解液;优选地,所述细胞裂解液包括质量体积百分比为0.01%-0.05%的洋地黄皂苷和体积百分比为10%-25%的dmso,余下为水。
在一优选实施方案中,所述细胞裂解液包括质量体积百分比为0.02%-0.05%的洋地黄皂苷和体积百分比为10%-19%的dmso,余下为水。
在一优选实施方案中,所述细胞裂解液包括质量体积百分比为0.03%的洋地黄皂苷和体积百分比为19%的dmso,余下为水。
本发明另一方面提供了前文所述细胞毒性检测试剂组合物的使用方法,其依次包括以下步骤:
1)将待检测细胞接触所述双(乙酰氧基甲基)2,2':6',2”-三联吡啶-6,6”-二羧酸、洗涤,然后悬于含有所述白蛋白的体系;
2)用细胞毒性试剂处理1)中悬于含有所述白蛋白的体系的待检测细胞,得细胞毒性试剂处理后产物;
3)将2)中所述细胞毒性试剂处理后产物接触所述铕的化合物,检测荧光值。
在一优选实施方案中,1)中所述待检测细胞为肿瘤细胞,如淋巴瘤细胞、卵巢癌细胞、肝癌细胞或胃癌细胞。
在一优选实施方案中,1)中所述待检测细胞为淋巴瘤细胞;优选地,所述淋巴瘤细胞为raji细胞。
在一优选实施方案中,1)中所述接触为孵育;优选地,所述孵育的温度为37℃;优选地,所述孵育的时间为30分钟。
在一优选实施方案中,1)中所述洗涤为离心洗涤;优选地,所述离心洗涤的转速为1500转/分钟;优选地,所述离心洗涤的时间为3分钟;优选地,所述离心洗涤的次数为3次。
在一优选实施方案中,1)中所述含有所述白蛋白的体系为细胞培养基;优选地,所述细胞培养基为含有10%胎牛血清的rpmi培养基,所述百分比为体积百分比。
在一优选实施方案中,2)中所述细胞毒性试剂为选自具有细胞毒性的小分子化合物、生物大分子和效应细胞中的一种或多种;优选地,为细胞毒性的效应细胞,如免疫效应细胞,优选地为选自car-t细胞、car-nk细胞和tcr-t细胞中的一种或多种。
在一优选实施方案中,2)中所述免疫效应细胞悬于含2%sr、50iu/mlil-2的aim-vcts细胞培养基,所述百分比为体积百分比,所述iu指国际单位。
在一优选实施方案中,2)中所述处理为孵育;优选地,所述孵育的温度为37℃;优选地,所述孵育的时间为4小时;优选地,所述孵育的co2浓度为5%。
在一优选实施方案中,2)中含有所述白蛋白的体系中所述白蛋白的终浓度为3%-25%;优选地,为5%-15%,如10%,所述百分比为质量体积百分比。
在一优选实施方案中,2)中所述白蛋白为牛血白蛋白、羊血白蛋白或人血白蛋白;优选地,为牛血白蛋白或人血白蛋白。
在一优选实施方案中,3)中所述接触为孵育;优选地,所述孵育的时间为5分钟;优选地,所述孵育的温度为25℃;优选地,所述孵育为震荡孵育。
本发明另一方面提供了一种检测细胞毒性的试剂盒,其包括前述细胞毒性检测试剂组合物。
在一优选实施方案中,所述检测细胞毒性的试剂盒还包括多孔板和使用说明书,所述使用说明书记载了前述细胞毒性检测试剂组合物的使用方法。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明的积极进步效果在于:本发明提供的细胞毒性检测试剂组合物在现有的基于delfia技术的以batda作为荧光增强配体的细胞毒性检测试剂盒的基础上引入了白蛋白,明显地降低了现有的细胞毒性检测试剂中释放自batda的荧光增强配体tda对镧系元素铕的自发荧光非特异性地增强,进而显著地降低了高水平的自发荧光本底对细胞毒性检测结果的干扰,有效地提高了使用基于delfia技术的镧系元素铕结合batda荧光增强配体检测细胞毒性的方法的重复性和准确性。
附图说明
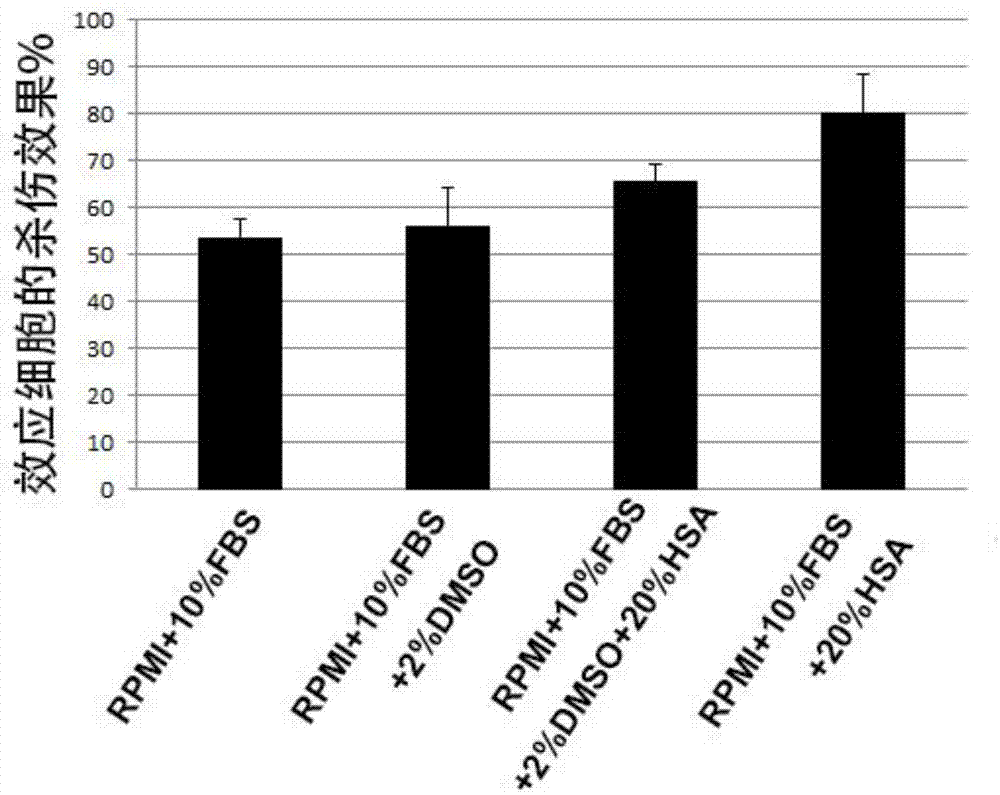
图1:rpmi+10%fbs、rpmi+10%fbs+2%dmso、rpmi+10%fbs+20%hsa、rpmi+10%fbs+2%dmso+20%hsa四种培养基条件下cd19car-t细胞对raji细胞的杀伤效果。
图2:rpmi+10%fbs、rpmi+10%fbs+2%dmso、rpmi+10%fbs+20%hsa、rpmi+10%fbs+2%dmso+20%hsa四种培养基条件下杀伤raji细胞的自发荧光水平。
图3:rpmi+10%fbs和rpmi+10%fbs+50%hsa两种培养基条件下cd19car-t细胞对raji细胞的杀伤效果。
图4:rpmi+10%fbs、rpmi+10%fbs+50%hsa两种培养基条件下杀伤raji细胞的自发荧光水平。
图5:rpmi+10%fbs、rpmi+10%fbs+10%bsa和rpmi+10%fbs+30%bsa三种培养基条件下cd19car-t细胞对raji细胞的杀伤效果。
图6:rpmi+10%fbs、rpmi+10%fbs+10%bsa和rpmi+10%fbs+30%bsa三种培养基条件下cd19car-t细胞杀伤raji细胞的自发荧光水平。
图7:rpmi+10%fbs和rpmi+10%fbs+6%gsa两种培养基条件下cd19car-t细胞对raji细胞的杀伤效果。
图8:rpmi+10%fbs和rpmi+10%fbs+6%gsa两种培养基条件下cd19car-t细胞杀伤raji细胞的自发荧光水平。
图9:rpmi+10%fbs、rpmi+10%fbs+10%hsa和rpmi+10%fbs+1mm丙磺舒洗涤三种条件下cd19car-t细胞对raji细胞的杀伤效果。
图10:rpmi+10%fbs、rpmi+10%fbs+10%hsa和rpmi+10%fbs+1mm丙磺舒洗涤三种条件下cd19car-t细胞杀伤raji细胞的自发荧光水平。
具体实施方式
除非另有注释,本申请依照常规用法使用技术术语。分子生物学中的常用术语的定义可以在benjaminlewin,genesx,publishedbyjones&bartlettpublishers,2009;和meyersetal.(eds.),theencyclopediaofcellbiologyandmolecularmedicine,publishedbywiley-vchin16volumes,2008和其它类似参考文献中找到。
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
实施例中所述的“室温”是指进行试验的操作间的温度,一般为25℃。
本发明所使用的部分试剂和仪器如下:
aim-vcts培养基:购自gibco;
rpmi培养基购自gehealthcare的hyclone,货号:sh3080901
胎牛血清(fetalbovineserum,fbs):购自gibco;
raji细胞:购自atcc,货号:raji
人血白蛋白(humanserumalbumin,hsa)购自:baxter,货号160369;
牛血白蛋白(bovineserumalbumin,bsa)购自:sigmaaldrich,货号a1933;
羊血白蛋白(goatserumalbumin,gsa)购自:sigmaaldrich,货号a2514;
sr:血清替代物,购自thermofisher,货号:a2596101(ctstmimmunecellsr);
丙磺舒(probenecid):购自sigma,货号:sigmap8761。
以下百分比中fbs和dmso的百分比为体积百分比,各种血清白蛋白(hsa、bsa和gsa)的百分比为质量体积百分比。
所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1、cd19car-t细胞的制备
本发明所使用的cd19car-t细胞按照cn105330750a中所公开的制备car1920-2-t的方法制得,其通过引用被整体纳入本文。
实施例2、人血白蛋白对cd19car-t细胞杀伤靶细胞的检测效果的影响
1、培养基与检测试剂的准备:将
2、靶细胞加载荧光增强配体batda:将raji细胞培养液放置离心机1500rpm离心4分钟,去上清,加入1ml含10%fbs的rpmi无血清细胞培养基(rpmi+10%fbs)重悬细胞后计数,根据计数结果用含10%fbs的rpmi培养基调整raji细胞密度到1×106个/ml;取2ml的raji细胞加入5μl的荧光增强配体(batda),并在37℃水浴中孵育30min。孵育后的raji细胞用含10%fbs的rpmi细胞培养基重悬,1500rpm离心3分钟,去上清,重复离心清洗3次。raji细胞清洗后,分别用如下4种培养基重悬细胞:rpmi+10%fbs、rpmi+10%fbs+2%dmso、rpmi+10%fbs+20%hsa、rpmi+10%fbs+2%dmso+20%hsa,并计数,根据计数结果用相应的细胞培养基调整raji细胞密度至1×105个/ml,用移液枪分别吸取重悬于上述4种培养基的raji细胞悬液各100μl滴在u型底的96孔板上铺孔,每种培养基的细胞悬液铺3个孔(即3个平行副孔),此12个孔即为样品孔;另取raji细胞悬液分别在u型底96孔板中的6个孔进行铺孔,每孔中同样加入上述细胞悬液100μl,其中3个孔的细胞用于测量自发荧光值,作为自发荧光值组,3个孔的细胞用于测量最大荧光值,作为最大荧光值组;另取部分raji细胞悬液,1500rpm离心3分钟沉淀细胞,取上清液铺3个孔,每孔加入rpmi+10%fbs上清液100μl,此3个孔作为背景本底组;
3、效应细胞的稀释:将实施例1制得的cd19cdar-t细胞1500rpm离心4分钟,去上清,用1ml含2%sr、50iuil-2的aim-vcts细胞培养基重悬细胞后计数,所述百分比为体积百分比,根据计数结果和阳性率调整阳性细胞量密度到8×105个/ml(实际细胞密度=8×105/阳性率个/ml),用移液枪分别吸取100μl加入到步骤2中u型底96孔板的4个样品孔中,混匀,此测试组的e:t=6:1;
同时,按照
背景本底值(不含效应细胞与靶细胞):每孔中加入100μl含2%sr、50iuil-2的aim-vcts培养基;
自发荧光值(不含效应细胞):每孔中加入100μl含2%sr、50iuil-2的aim-vcts培养基;
最大荧光值(=裂解的靶细胞):每孔中加入10μldelfia裂解缓冲液和90μl含2%sr、50iuil-2的aim-vcts培养基;
4、效应细胞对靶细胞的杀伤:将步骤3中u型底的96孔板放置在37℃、5%二氧化碳培养箱孵育4h。孵育结束后,整板500g离心5min。轻取20ul的上清,移到平底的读取96孔板上。每孔加入180μl的delfiaeuropiumsolution。在震荡器上孵育5min反应。用envision多功能酶标仪设定时间分辨荧光delfia模式读取荧光值,每隔5分钟读取一次值,读取3遍,计算各样品的平均值,按以下公式计算效应细胞的杀伤效果:
公式1:
自发荧光水平按以下公式计算:
公式2:
结果如图1和图2所示。图1显示了rpmi+10%fbs、rpmi+10%fbs+2%dmso、rpmi+10%fbs+20%hsa、rpmi+10%fbs+2%dmso+20%hsa四种培养基条件下实施例1制备的cd19car-t细胞的杀伤效果检测结果。图2显示了上述四种培养基条件下的自发荧光水平值。从图1可以看出,加入2%dmso(即终浓度为1%dmso)能够提高效应细胞的杀伤效果数值,这与本领域的常规认识一致,因为dmso为常用的细胞膜通透剂,能够使膜内的tda更多地释放到细胞外与铕形成配合物,进而增强其荧光。而加入20%人血白蛋白(hsa,终浓度为10%,以下相同不再重复)后也明显地增加了效应细胞的杀伤效果。并且加入hsa至终浓度为10%的条件下,自发荧光水平与未加入hsa的样品相比明显下降,如图2所示。以上结果表明,在检测体系中加入人血白蛋白(hsa)能够有效地降低检测体系中自发荧光对检测结果的干扰,更加真实、准确和稳定地获得效应细胞对靶细胞的杀伤效果的量化数值。
实施例3、人血白蛋白对cd19car-t细胞杀伤靶细胞的检测效果的影响
参照实施例2,去除体系中加入了dmso的两组样品,步骤2中仅设置rpmi+10%fbs和rpmi+10%fbs+50%hsa,步骤3中将效靶比调整为e:t=8:1,其余同实施例2,计算cd19car-t细胞的杀伤效果和自发荧光水平。
结果如图3和图4所示。图3显示了rpmi+10%fbs和rpmi+10%fbs+50%hsa两种培养基条件下实施例1制备的cd19car-t细胞的杀伤效果检测结果对应的效应细胞杀伤靶细胞raji细胞的荧光水平值。从图3可以看出,加入培养基中50%hsa(即终浓度为25%)后效应细胞的杀伤效果的水平明显提高。并且在加入hsa至终浓度为25%的条件下,自发荧光水平与未加入hsa的样品相比明显下降,如图4所示。以上结果表明,在检测体系中加入hsa能够有效地降低检测体系中自发荧光对检测结果的干扰,更加真实、准确和稳定地获得效应细胞对靶细胞的杀伤效果的量化数值。
实施例4、牛血白蛋白对cd19car-t细胞杀伤靶细胞的检测效果的影响
参照实施例2,去除体系中加入了dmso的两组样品,步骤2中仅设置rpmi+10%fbs、rpmi+10%fbs+10%bsa和rpmi+10%fbs+30%bsa,步骤3中将效靶比调整为e:t=8:1,其余同实施例2,计算cd19car-t细胞的杀伤效果和自发荧光水平。
结果如图5和图6所示。图5显示了rpmi+10%fbs、rpmi+10%fbs+10%bsa和rpmi+10%fbs+30%bsa三种培养基条件下实施例1制备的cd19car-t细胞的杀伤效果检测结果。图5显示了上述三种培养基条件下的效应细胞杀伤靶细胞raji细胞的荧光水平值。从图5可以看出,培养基加入浓度至10%的牛血白蛋白(即bsa终浓度为5%)或浓度至30%的牛血白蛋白(即bsa终浓度为15%)后效应细胞cd19car-t的杀伤效果的水平明显提高。并且在加入bsa至终浓度为5%和15%的条件下,自发荧光水平与未加入bsa的样品相比明显下降,如图6所示。以上结果表明,在检测体系中加入bsa能够有效地降低检测体系中自发荧光对检测结果的干扰,更加真实、准确和稳定地获得效应细胞对靶细胞的杀伤效果的量化数值。
实施例5、羊血白蛋白对cd19car-t细胞杀伤靶细胞的检测效果的影响
参照实施例2,去除体系中加入了dmso的两组样品,步骤2中仅设置rpmi+10%fbs和rpmi+10%fbs+6%gsa,步骤3中将效靶比调整为e:t=4:1,其余同实施例2,计算cd19car-t细胞的杀伤效果和自发荧光水平。
结果如图7和图8所示。图1显示了rpmi+10%fbs和rpmi+10%fbs+6%gsa两种培养基条件下实施例1制备的cd19car-t细胞的杀伤效果检测结果。图7显示了上述两种培养基条件下的效应细胞杀伤靶细胞raji细胞的荧光水平值。从图7可以看出,加入培养基中6%羊血白蛋白(即gsa终浓度为3%)后效应细胞的杀伤效果的水平明显提高。并且在加入gsa至终浓度为3%的条件下,自发荧光水平与未加入gsa的样品相比明显下降,如图8所示。以上结果表明,在检测体系中加入gsa能够有效地降低检测体系中自发荧光对检测结果的干扰,更加真实、准确和稳定地获得效应细胞对靶细胞的杀伤效果的量化数值。
对比例1、人血白蛋白和丙磺舒(probenecid)洗涤对cd19car-t细胞杀伤靶细胞检测效果的影响的比较
参照实施例2,去除体系中加入了dmso的两组样品,步骤2中设置rpmi+10%fbs、rpmi+10%fbs+20%hsa和rpmi+10%fbs+1mm丙磺舒洗涤,步骤3中将效靶比调整为e:t=8:1,其余同实施例2,计算cd19car-t细胞的杀伤效果和自发荧光水平。
结果如图9和图10所示。图9显示了rpmi+10%fbs、rpmi+10%fbs+10%hsa和rpmi+10%fbs+1mm丙磺舒洗涤三种条件下实施例1制备的cd19car-t细胞的杀伤效果检测结果对应的效应细胞杀伤靶细胞raji细胞的荧光水平值,其中rpmi+10%fbs+1mm丙磺舒洗涤为在实施例2第2步用batda孵育细胞后,在进行离心洗涤的rpmi+10%fbs培养基中加入终浓度至1mm的丙磺舒。从图9可以看出,加入培养基中10%hsa(即终浓度为5%)后效应细胞的杀伤效果的水平较不加has和加入1mm丙磺舒的条件有明显提高,并且在加入hsa至终浓度为5%的条件下,自发荧光水平与未加入hsa的样品相比明显下降,如图10所示。但根据perkinelmer货号为ad0116的
以上结果表明,在检测体系中加入丙磺舒并不能有效地降低自发荧光水平和有效地降低检测体系中自发荧光对检测结果的干扰;与之相比,加入白蛋白能够更加真实、准确和稳定地获得效应细胞对靶细胞的杀伤效果的量化数值并降低自发荧光水平。
应理解,在阅读了本发明的上述内容之后,本领域技术人员可以对本发明的相关条件作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!