一种碳酸酐酶诱导碳酸钙沉积实验方法与流程
本发明属于微生物灌浆加固土壤技术领域,涉及一种碳酸酐酶诱导碳酸钙沉积实验方法。
背景技术
微生物诱导碳酸钙沉积过程是一个不断变化的过程,沉积过程一般分为化学沉积—沉积物分解—生物诱导沉积三个过程,并持续循环进行,过程中受很多因素影响,如微生物产生的酶种类、周围环境的温度、营养盐的种类、营养盐的浓度、ph等因素。沉积物的晶型晶貌与沉积量等结果更是直接受到以上因素的影响。实验所用碳酸酐酶矿化菌能产生加速二氧化碳水合反应生成碳酸根离子的碳酸酐酶,不同的温度环境下,酶活性会产生变化,水合反应的加速程度也会随之变化。而营养盐的种类会更为直接的影响沉积物的晶型,营养盐的浓度直接影响碳酸钙的沉积量。
技术实现要素:
本发明的目的在于提供一种碳酸酐酶诱导碳酸钙沉积实验方法。该方法在实验室环境下模拟碳酸酐酶诱导碳酸钙沉积过程,通过设置不同的钙源沉积体系、不同温度沉积体系、不同营养盐浓度沉积体系,探究不同的沉积条件对碳酸酐酶矿化菌诱导碳酸钙沉积过程ph与电导率、沉积物的晶型晶貌与沉积量的影响,同时为后续固化砂土强度变化提供更多分析参考依据。
其具体技术方案为:
一种碳酸酐酶诱导碳酸钙沉积实验方法,包括以下步骤:
步骤1、溶液配制方法
培养基配制:实验采用牛肉膏蛋白胨液体培养基,种子液与实验用菌液培养,制作牛肉膏蛋白胨液体培养基,调节ph为7,分装于锥形瓶后,每瓶100ml,放于高温灭菌锅中灭菌。待培养基温度降至室温后,挑取一环菌种接种于种子液培养基中,于30摄氏度,120r/min振荡培养箱培养24小时后制成种子液。再按1%(v/v)的接种量,从种子液中移取1ml,接种于新鲜牛肉膏蛋白胨液体培养基中,再于30摄氏度,120r/min振荡培养箱培养24小时,制成待测菌液。
钙源沉积体系胶结液配制:氯化钙溶液、硝酸钙溶液、醋酸钙溶液与碳酸氢钠溶液配制:
温度沉积体系胶结液配制:氯化钙溶液与碳酸氢钠溶液行配制;
浓度沉积体系胶结液配制:氯化钙溶液与碳酸氢钠溶液配制。
步骤2沉积体系设置
2.1钙源沉积体系
各取100ml的已培养24小时的培养液,0.5m的碳酸氢钠溶液与0.5m的氯化钙、硝酸钙、醋酸钙溶液,放入塑料广口瓶中,在30摄氏度培养箱中进行模拟矿化沉积实验。每个样品重复一次,空白对照采用去离子水。所有材料使用前均经高温灭菌锅在121℃下灭菌20分钟。实验周期为72h,前12小时每隔3小时测定一次ph与电导率值,12小时后每隔12小时测定一次,记录数据并整理。
沉积实验结束后,将广口瓶中上清液缓慢倒出,用去离子水清洗沉积物2~3次,放入烘箱中烘干后称量瓶与沉积物总重m0,再用水反复冲洗2~3次,将沉积物洗出并用1m盐酸将瓶洗净,然后将瓶与沉积物放于60℃烘箱中烘干,烘干后称取空瓶mp,碳酸钙沉积量即为m0-mp。烘干的沉积物备用,用于x射线衍射实验与电子扫描显微镜实验。
2.2温度沉积体系
各取100ml的已培养24小时的培养液,0.5m的碳酸氢钠溶液与0.5m的氯化钙溶液,放入锥形瓶中,在10℃、20℃、30℃、40℃、50℃恒温培养箱中进行模拟矿化沉积实验。
2.3不同胶结液浓度体系
各取100ml的已培养24小时的培养液,0.5m、1m、1.5m、2m的碳酸氢钠溶液与氯化钙溶液,放入锥形瓶中,在30摄氏度培养箱中进行模拟矿化沉积实验。余下处理同3.2.2.1钙源沉积体系。
步骤3、x射线衍射实验(xrd)
x射线衍射相分析(phaseanalysisofxraydiffraction)利用x射线在晶体物质中的衍射效应进行物质结构分析的技术,通过测定衍射峰可以进行样品的定性分析。本文中将沉积所得碳酸钙清洗两到三次后于烘箱中烘干,进行x射线衍射实验,衍射角度为3°~80°,得到衍射图谱后用“粉末衍射标准联合会(jcpds)”负责编辑出版的“粉末衍射卡片(pdf卡片)”进行物相分析,得到沉积所得碳酸钙晶型。
步骤4、扫描电子显微镜实验(sem)
扫描电子显微镜是一种利用电子束对样品表面进行扫描从而获得样品形貌等信息的电子显微镜,它能产生样品表面的高分辨率图像,且图像呈三维,扫描电子显微镜能被用来鉴定样品的表面结构,能更直观的表现样品的形态。本文中将烘干的碳酸钙粉末进行扫描电子显微镜实验,在不同的电镜倍数下观察不同条件下生成的实验组与空白组碳酸钙形貌。
进一步,步骤1中,牛肉膏蛋白胨液体培养基的成分为:
牛肉膏3g
蛋白胨10
nacl5g
去离子水1l。
进一步,步骤2.2中,温度沉积体系中,温度为30℃。
进一步,步骤2.3中,胶结液浓度体系中,浓度为1.5m。
与现有技术相比,本发明的有益效果为:
本发明经过对比沉积过程ph、电导率变化情况与碳酸钙沉积量,以及沉积物晶型晶貌的对比分析,发现在钙源沉积体系中,氯化钙与硝酸钙均适宜碳酸钙的沉积,在温度沉积体系中,30℃最适宜沉积,在浓度沉积体系中,1.5m浓度最适宜碳酸酐酶诱导沉积碳酸钙。在碳酸酐酶矿化菌的参与下,生成的碳酸钙不仅有方解石晶型,还诱导产生球霰石晶型。
附图说明
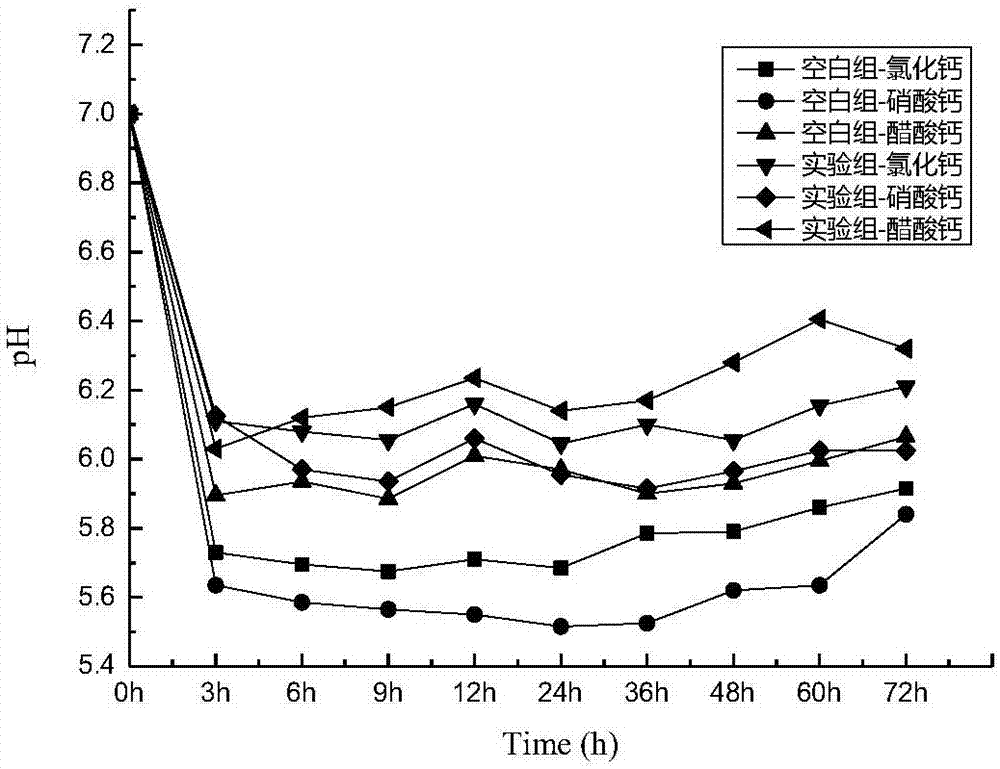
图1是不同处理下ph随时间变化图;
图2是电导率随时间变化图;
图3是不同钙源下碳酸钙沉积量;
图4是不同钙源条件下沉积产物的xrd图谱,其中,a)氯化钙,b)硝酸钙,c)醋酸钙,d)三种钙源对比;
图5是不同钙源条件下沉积产物的扫描电镜图片,其中,a)氯化钙(空白组),b)氯化钙(实验组),c)硝酸钙(空白组),d)硝酸钙(实验组),e)醋酸钙(空白组),f)醋酸钙(实验组);
图6是氯化钙做钙源时沉积体系ph值在不同温度下的变化图,a)10℃,b)20℃,c)30℃,d)40℃,e)50℃,f)所有温度汇总图
图7是氯化钙做钙源时沉积体系电导率在不同温度下的变化图,a)10℃,b)20℃,c)30℃,d)40℃,e)50℃,f)所有温度汇总图;
图8是氯化钙做钙源时不同温度下碳酸钙沉积量;
图9是氯化钙做钙源时碳酸钙沉积量随温度变化图;
图10是氯化钙做钙源时不同温度下沉积的碳酸钙xrd图谱;a)10℃,b)20℃,c)30℃,d)40℃,e)50℃,f)所有温度汇总图;
图11是氯化钙做钙源时不同温度下沉积物扫描电镜照片,其中,a)10℃,b)10℃(3kx),c)20℃,d)20℃(3kx),e)30℃,f)30℃(3kx),g)40℃,h)40℃(3kx),i)50℃,j)50℃(3kx);
图12是不同胶结液浓度下ph随时间变化图,a)0.5m,b)1.0m,c)1.5m,d)2.0m,e)不同浓度汇总图;
图13是不同胶结液浓度下电导率随时间变化图,a)0.5m,b)1.0m,c)1.5m,d)2.0m,e)不同浓度汇总图;
图14是不同胶结液浓度下碳酸钙沉积量;
图15是碳酸钙沉积量随胶结液浓度变化图;
图16是不同胶结液浓度下沉积产物xrd图谱;
图17是不同胶结液浓度下沉积产物扫描电镜照片,a)0.5m,b)1.0m,c)1.5m,d)2.0m。
具体实施方式
下面结合附图和具体实施例对本发明的技术方案作进一步详细地说明。
1实验材料
1.1菌株及其培养
供试菌种由前章筛选得到,选用4号土壤芽孢杆菌。培养采用牛肉膏蛋白胨液体培养基,在30摄氏度,120rpm的恒温培养箱中培养24小时待用。
1.2主要试剂及仪器
(1)实验试剂:牛肉膏、蛋白胨、nacl、氯化钙(白色颗粒状)、硝酸钙(白色结晶)、醋酸钙(白色粉末状)、碳酸氢钠、氢氧化钠等分析纯药品。
(2)实验仪器:电导率仪、ph计、称量天平、日本理学d/max2200vpc型x射线衍射仪(xrd)、德国carlzeissntsgmbhuitra55型扫描电子显微镜(sem)。
2实验方法
2.1溶液配制方法
培养基配制:实验采用牛肉膏蛋白胨液体培养基。
钙源沉积体系胶结液配制:氯化钙溶液、硝酸钙溶液、醋酸钙溶液与碳酸氢钠溶液按照表1胶结液用量配比表进行配制:
表1不同钙源溶液配制用量表
温度沉积体系胶结液配制:氯化钙溶液与碳酸氢钠溶液按照表2胶结液用量配比表进行配制:
表2不同温度胶结液配制用量表
浓度沉积体系胶结液配制:氯化钙溶液与碳酸氢钠溶液按照表3胶结液用量配比表进行配制:
表3不同浓度胶结液用量表
2.2沉积体系设置方法
2.2.1钙源沉积体系
各取100ml的已培养24小时的培养液,0.5m的碳酸氢钠溶液与0.5m的氯化钙、硝酸钙、醋酸钙溶液,放入塑料广口瓶中,在30摄氏度培养箱中进行模拟矿化沉积实验。每个样品重复一次,空白对照采用去离子水。所有材料使用前均经高温灭菌锅在121℃下灭菌20分钟。实验周期为72h,前12小时每隔3小时测定一次ph与电导率值,12小时后每隔12小时测定一次,记录数据并整理。
沉积实验结束后,将广口瓶中上清液缓慢倒出,用去离子水清洗沉积物2~3次,放入烘箱中烘干后称量瓶与沉积物总重m0,再用水反复冲洗2~3次,将沉积物洗出并用1m盐酸将瓶洗净,然后将瓶与沉积物放于60℃烘箱中烘干,烘干后称取空瓶mp,碳酸钙沉积量即为m0-mp。烘干的沉积物备用,用于x射线衍射实验与电子扫描显微镜实验。
2.2.2温度沉积体系
各取100ml的已培养24小时的培养液,0.5m的碳酸氢钠溶液与0.5m的氯化钙溶液,放入锥形瓶中,在10℃、20℃、30℃、40℃、50℃恒温培养箱中进行模拟矿化沉积实验。
2.2.3不同胶结液浓度体系
各取100ml的已培养24小时的培养液,0.5m、1m、1.5m、2m的碳酸氢钠溶液与氯化钙溶液,放入锥形瓶中,在30摄氏度培养箱中进行模拟矿化沉积实验。余下处理同3.2.2.1钙源沉积体系。
2.3x射线衍射实验(xrd)
x射线衍射相分析(phaseanalysisofxraydiffraction)利用x射线在晶体物质中的衍射效应进行物质结构分析的技术,通过测定衍射峰可以进行样品的定性分析。本文中将沉积所得碳酸钙清洗两到三次后于烘箱中烘干,进行x射线衍射实验,衍射角度为3°~80°,得到衍射图谱后用“粉末衍射标准联合会(jcpds)”负责编辑出版的“粉末衍射卡片(pdf卡片)”进行物相分析,得到沉积所得碳酸钙晶型。
2.4扫描电子显微镜实验(sem)
扫描电子显微镜是一种利用电子束对样品表面进行扫描从而获得样品形貌等信息的电子显微镜,它能产生样品表面的高分辨率图像,且图像呈三维,扫描电子显微镜能被用来鉴定样品的表面结构,能更直观的表现样品的形态。本文中将烘干的碳酸钙粉末进行扫描电子显微镜实验,在不同的电镜倍数下观察不同条件下生成的实验组与空白组碳酸钙形貌。
3结果与分析
3.1钙源对碳酸钙沉积的影响
经过72小时的模拟矿化沉积后,得到图1与图2不同钙源环境下沉积过程的ph与电导率变化随时间变化图。
3.1.1沉积过程ph与电导率变化
从图1可看出空白组与实验组在沉积过程中的ph均呈现先下降后缓慢回升至稳定的变化过程。实验组最后稳定在了6.0~6.4之间,空白组稳定在了5.8~6.2之间。在整个沉积与分解的过程中,在前3个小时内,ph均发生下降,且下降趋势明显,这是由于前3个小时内沉积速度较快,碳酸氢钠电离出较多h+与co32-,而溶液中的ca2+迅速结合co32-形成碳酸钙沉淀,溶液中就留下较多的游离的h+,因此ph会急剧下降,呈酸性状态。而后过程中,碳酸钙不断的分解又沉积,所以ph也随之发生变化,处于一种不断的上升又下降的状态。而三种钙源下,实验组初始ph均低于空白组,而在3h之后的ph均高于空白组,表明碳酸酐酶矿化菌积极的参与在整个沉积过程,调节溶液环境中的ph为其适宜生长的值,最后实验组的ph值稳定在了6~7之间,符合第二章中得到的结论。
在碳酸酐酶矿化菌诱导碳酸钙沉积过程中,不仅ph随着时间不断变化,电导率也在时刻发生着变化,溶液中离子的变化主要是由于碳酸钙沉积过程溶液中的ca2+与co32-的结合与分离引起,可用来表征碳酸钙沉积速度。从上图2可看出,0~3h内,电导率下降速度极快,表明不同钙源环境下均发生迅速沉降,但此时更多是化学沉积,3h之后,形成的碳酸钙沉积不断发生分解,而后重新进行生物沉积,因此电导率在3h之后呈现不断上升又下降的变化。在图2中,硝酸钙环境下沉积过程中,空白组与实验组电导率值一直处于一种相差极小的状态,表明了在硝酸钙为钙源时,碳酸酐酶矿化菌对矿化沉积的促进效果不佳。
3.1.2沉积过程碳酸钙沉积量测定结果
由图3可看出,无论在哪一种钙源环境下,空白组的碳酸钙沉积量均明显多于实验组,表明在溶液环境中,碳酸酐酶发挥了其加速碳酸根水合可逆反应的作用,在碳酸酐酶矿化菌的参与下,三种钙源环境下沉积的碳酸钙均能快速的沉积与分解,发现醋酸钙环境下,其空白组的沉积量与实验组的沉积量差值最大,表明碳酸酐酶对醋酸钙作为钙源时形成碳酸钙沉积与分解过程的促进效果更为明显。对比实验组,浓度相同时,三种钙源条件下沉积的碳酸钙量相差不大。
3.1.3沉积物碳酸钙xrd图谱分析与扫描电镜图片观察
碳酸钙晶型一般分为方解石、文石与球霰石,方解石热力学状态最为稳定,而其他两种晶型性质不稳定,极易发生转变,成为方解石。从图4xrd图谱中看出,空白组均生成了方解石,而实验组中不仅生成了方解石,还生成了球霰石。而且无论哪一种钙源条件下,实验组沉积的碳酸钙均有方解石与球霰石两种晶型。醋酸钙作为钙源时,在xrd图谱中球霰石的峰及其显著,表明碳酸酐酶矿化菌诱导醋酸钙生成的碳酸钙主要为球霰石。
从扫描电镜图片也看到,氯化钙与硝酸钙为钙源时,空白组生成的方解石形貌相同,均为正方体形,实验组组有花团簇状、正方体状、球状三种形态,且有大量菌体附着在晶体表面与内部。醋酸钙作为钙源时,空白组生成了大量无定型方解石,实验组生成了大量球状球霰石。
3.2温度对碳酸钙沉积的影响
3.2.1沉积过程ph与电导率变化
将氯化钙作为钙源设置的沉积体系置于10℃、20℃、30℃、40℃、50℃沉积72h后,得到不同温度下,沉积体系ph与电导率变化,以及碳酸钙沉积量。
碳酸酐酶属于生物催化剂,温度对其酶活影响极大。由图6ph随时间变化图可看出,在10℃与20℃下沉积时,ph值先下降,然后在6.0~6.2之间保持稳定,整个周期变化平缓。而30℃、40℃、50℃条件下,ph值先下降,后上升,且随着温度的升高,ph值的上升趋势更加明显。
30℃之后,随温度的升高,空白组与实验组的电导率值趋于一致,可能是随着温度的升高,菌体碳酸酐酶活性降低,也可能温度超出菌体生长承受范围,酶蛋白质变性失活,菌体对co2的水合作用的催化效果减弱。同时菌体生长到衰亡期后,沉积环境中生成了大量的胞外产物以及生长废物,这些可能限制酶活,因此到实验周期后期空白组与实验组的ph趋于一致。
从图7电导率随时间变化图中可看到,在所有温度条件下,电导率在3h内下降最快,3h后虽在不断的升降,但总体呈下降趋势,可能是沉积环境内h+减少,ph值便不断上升。随着温度的升高,空白组与实验组也渐渐发生重合,说明温度高于30℃后,矿化菌生长速度减缓,碳酸酐酶的作用在减弱,这些原因使得后期空白组与实验组电导率变化趋于相同。
3.2.2沉积过程碳酸钙沉积量测定结果
沉积完成后,测得不同温度下沉积的碳酸钙沉积量与沉积量随温度变化图,见图8不同温度下碳酸钙沉积量与图9碳酸钙沉积量随温度变化图。
由图9可看出无论在哪一种温度条件下,空白组的碳酸钙沉积量均高于实验组,表明在产碳酸酐酶矿化菌参与下,碳酸钙的沉积与溶解过程加快,化学沉积的碳酸钙沉积后,在催化作用下,又再次分解,再发生生物矿化过程,重新生成生物作用下的碳酸钙。
从图9也看出随着温度的升高,碳酸钙生成量先变多后减少,空白组与实验组数值均在30℃达到峰值,而30℃也是矿化菌最适合生长的温度,在实验周期内,酶催化作用可以发挥到最大。
3.2.3沉积物碳酸钙xrd图谱分析与扫描电镜图片观察
从图10xrd图谱中看出,空白组生成的碳酸钙均为方解石晶型,而实验组中生成了方解石与球霰石。而且无论哪一种温度条件下,实验组沉积的碳酸钙均有方解石与球霰石两种晶型,说明在矿化菌的参与下,会生成球霰石晶型。从图11扫描电镜图片中看到,不同温度实验组中有三种形状的晶体存在,片层状正方体形、颗粒簇状形、球形,晶体上表面均有矿化菌形成的菌坑同时还附着有矿化菌,而且也能清晰的看到晶体上破碎的菌壳。从图中观察到,晶体的尺寸相差不大,并且均有小颗粒的晶体存在,表明温度对晶型晶貌的影响不显著。
3.3胶结液浓度对碳酸钙沉积的影响
设置不同的胶结液浓度的沉积体系,得到沉积过程中的ph与电导率变化图、碳酸钙沉积量图、xrd分析图谱以及不同浓度下碳酸钙晶体形貌图,见图12至图17。
3.3.1沉积过程ph与电导率变化
在图12不同浓度条件下ph随时间变化图中,整个沉积过程ph值呈先下降后回升的变化趋势,且实验组的ph一直高于空白组,在总的浓度变化图中看出,ph值随着浓度的增加而下降。
在图13电导率变化图中,不同浓度的沉积体系的电导率虽均呈下降的变化,但在0.5m浓度时,电导率在3小时后不断上升与下降,但整体呈下降趋势,但当浓度为1m,1.5m,2m时,3小时后的电导率变化呈现先下降后上升的变化趋势,且与空白组变化曲线重合,表明矿化菌在沉积过程会不断调节环境中的ph以适应其生长,但当浓度变大时,会抑制酶活性,导致矿化菌调节环境ph与催化二氧化碳水合反应的能力大大降低。
3.3.2沉积过程碳酸钙沉积量测定结果
图14与图15中,空白组的碳酸钙沉积量在实验设置的所有浓度下均高于实验组,这是因为实验组中碳酸酐酶促进碳酸钙不断沉积与分解,使得化学沉积碳酸钙转为生物沉积,而浓度为1.5m,2m时,空白组与实验组碳酸钙沉积量差值逐渐减小,说明随着胶结液浓度的增加,碳酸酐酶酶活性降低,催化作用大大减弱。并且随着胶结液浓度的增加,碳酸钙的沉积量减少趋势明显。在浓度为1.5m之后,沉积量呈下降趋势,同样也说明了高浓度胶结液对酶活性与矿化菌生长的抑制。
3.3.3沉积物碳酸钙xrd图谱分析与扫描电镜图片观察
从图16xrd图谱中可看出,不论在哪一种胶结液浓度下,碳酸酐酶矿化菌在沉积体系中均诱导生成了方解石与球霰石两种碳酸钙晶型,再一次验证了矿化菌能诱导球霰石晶型的产生。
从图17扫描电镜照片可看出,晶体表面疏松多孔且均有菌体溶蚀作用留下的菌坑,同时在实验设置的所有浓度下,均有球状的球霰石,在0.5m浓度下可看到分散的小颗粒正方体形方解石,但随着浓度的增加,分散小颗粒晶体数量减少,反而出现了大量聚集体形式出现的晶体,在1.5m与2m浓度下大部分晶体是无定型方解石包裹着球霰石的形态。说明了在浓度逐渐增大的情况下,碳酸钙沉积量同时增多,晶体与晶体之间会逐渐产生粘结作用,形成颗粒粒径更大的聚集体。同时在相同放大倍数以及工作距离的条件,1.5m浓度下生成的晶体聚集体尺寸更大,胶结在一起的颗粒更多。
4小结
本发明主要进行了溶液环境下的矿化沉积,探究了不同钙源、不同温度、不同胶结液浓度等条件下沉积过程中ph与电导率变化情况,碳酸钙沉积量以及碳酸钙的晶型晶貌,得到以下结论:
(1)在不同条件的沉积体系中,实验组的ph值始终高于空白组,说明碳酸酐酶矿化菌在沉积过程中会自发性的调节环境ph以适宜自身生长。沉积过程中电导率值呈先急剧下降,后不断上升又下降的变化趋势,ph呈现先急剧下降而后缓慢回升的变化趋势,这是因为初始电导率与ph下降为化学沉积,后由于碳酸酐酶催化co2水合反应,促使化学沉积的碳酸钙不断溶解而后形成生物沉积碳酸钙。
(2)在碳酸酐酶矿化菌的参与下,生成的碳酸钙不仅有方解石晶型,还产生了球霰石晶型。钙源沉积体系中,氯化钙与硝酸钙的空白组均呈六面晶形,醋酸钙呈无定型方解石,实验组中氯化钙与硝酸钙均有颗粒簇状方解石与表面附着菌体的六面晶型方解石,醋酸钙中出现大量球状球霰石。温度沉积体系实验组有颗粒簇状方解石与表面附着菌体的六面晶型方解石,也有球状球霰石。浓度沉积体系中,随着浓度的增加,出现了大量晶体聚集体,以方解石包裹着球状球霰石的形态呈现,浓度为1.5m时生成了较大尺寸的颗粒聚集体。
(3)经过沉积过程ph电导率变化、碳酸钙沉积量以及沉积物晶型晶貌的对比分析,发现在钙源沉积体系中,氯化钙与硝酸钙均适宜碳酸钙的沉积,在温度沉积体系中,30℃最适宜沉积,在浓度沉积体系中,1.5m浓度最适宜碳酸酐酶诱导沉积碳酸钙。
以上所述,仅为本发明较佳的具体实施方式,本发明的保护范围不限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,可显而易见地得到的技术方案的简单变化或等效替换均落入本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!