一种参芪扶正注射液有关成分的分离和检测方法与流程
本发明属于分析化学和天然产物化学
技术领域:
,具体涉及参芪扶正注射液相关成分的分离和检测方法。
背景技术:
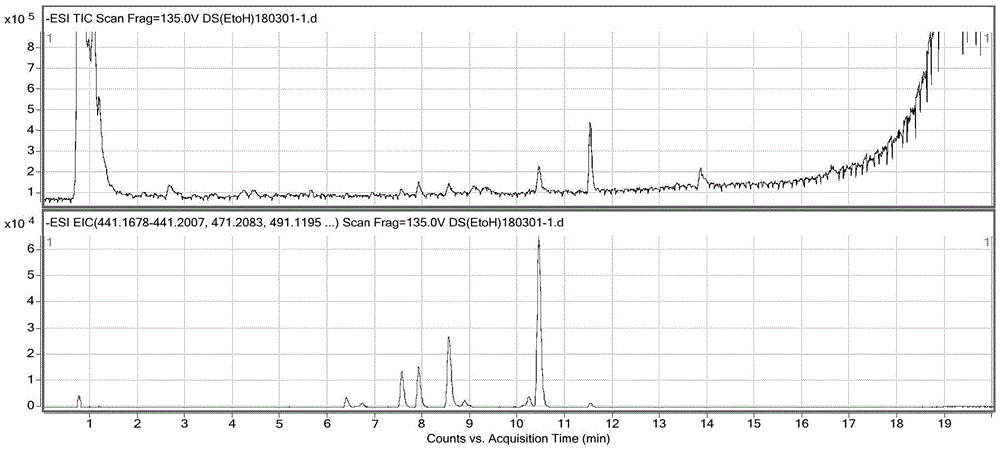
:党参(radixcodonopsis)药性平和,用途广,具有多方面的药理活性,不仅对消化、心血管系统有作用,还能调节免疫系统功能,增强机体的抵抗力,毒性甚微。黄芪(radixastragalus)是补气主药,能明显增加巨噬细胞的吞噬功能,与党参合用,能使巨噬细胞吞噬有害物质的作用增强。参芪扶正注射液是利民制药厂独家中药品种,是由党参、黄芪经提取制成的纯中药制剂,以益气扶正为主。党参和黄芪两种药物的性味及归经一致,功效基本相同,两者相加,起到君臣佐使、相使的协同作用,明显增强了临床疗效。然而,近年来,中药注射液一直饱受争议,其临床使用范围也受到限制。究其原因,可能是中药含成分复杂、难以定量定性分析。针对此问题,参芪扶正注射液研发人员提出了数字化中药的概念,即以传统中医辨证施治为指导,采用现代计算机技术、植物化学、分析化学、药理学等学科的理论和方法,对中药的种植、提取、制备及检测等全过程进行数字化控制,使其质量稳定可控,保证临床安全有效。目前,参芪扶正注射液虽然已经建立了多种质量控制和检测方法;但是多数仅检测其中的党参或黄芪一味药材的指标性成分,缺乏对党参和黄芪成分以及黄芪中黄酮类、皂苷类成分的快速、有效、全面的分离进而评价方法。技术实现要素:针对现有技术存在的问题,本发明建立了一种参芪扶正注射液有关成分的快速分离和检测方法。该方法可以同时分离出参芪扶正注射液来自于党参和黄芪的成分,以及黄芪中的黄酮类和皂苷类成分,操作方便快捷,能够为更好地控制药品质量提供基础。为了实现上述技术效果,本发明采用了如下技术方案:一种参芪扶正注射液有关成分的快速分离和评价方法,包括:所述参芪扶正注射液先经过聚酰胺层析,然后利用lc-ms进行成分分离和评价。一种参芪扶正注射液有关成分的快速分离和评价方法,具体包括如下步骤:(1)称取聚酰胺,95%(v/v)乙醇湿法装柱,得到聚酰胺层析柱;(2)精密量取的参芪扶正注射液,直接上样至步骤(1)得到的聚酰胺层析柱;(3)分别以3~5倍柱体积的水、20%乙醇、60%乙醇为洗脱液,顺序洗脱;(4)接收各洗脱液的流出液,水浴蒸干,残渣分别进行溶解,得到供试品;(5)利用lc-ms对步骤(4)得到的供试品进行成分分离和评价。其中,色谱条件为:固定相:键合硅胶c18;流动相:以0.1%(v/v)甲酸水溶液为流动相a,0.1%甲酸(v/v)乙腈溶液为流动相b,梯度洗脱;洗脱程序如下表所示:洗脱梯度时间(min)流动相a(%,v/v)流动相b(%,v/v)0~0.59550.5~1095→755→2510~1575→4525→5515~1845→055→10018~20010020~20.10→95100→520.1~25955柱温:40℃;流速:0.35ml/min;进样量:5μl。质谱条件为:离子源:esi源,负离子方式检测;雾化气压力:35psi;干燥气温度:350℃;干燥气流速:10l/min;vcap毛细管电压:3500v;fragmentor:135v。评价方法:从总离子流色谱图(tic)中用精确分子量441.1678、441.2007、471.2083、491.1195、507.1508、633.2553、829.4591、871.4697、913.4650和991.5119提取出提取离子图(eic),分别积分。优选的,所述聚酰胺的分子量为14000~17000,比表面积5~10m2/g。所述步骤(2)中,参芪扶正注射液的上样量为本领域的常规量。优选的,所述的步骤(1)中,聚酰胺湿法装柱后,以1~3倍柱体积的5%(w/v)氢氧化钠、2~5倍柱体积的10%(v/v)冰醋酸顺序对聚酰胺柱进行活化,然后用水洗至中性,备用。优选的,所述的步骤(3)中,分别以4倍柱体积的水、20%乙醇、60%乙醇为洗脱液,顺序洗脱。步骤(3)中的洗脱液顺序不可调换,因参芪扶正注射液溶剂为水,同时含有氯化钠等盐类成分,先以水洗脱有利于去除杂质;鉴于党参与黄芪中黄酮类、皂苷类成分的极性差异,先以水洗脱,逐步增加乙醇浓度有利于相关成分的分离。优选的,所述的步骤(4)中,水洗脱液及20%乙醇洗脱液的流出液残渣以水溶解并稀释至所述步骤(2)中参芪扶正注射液的取样量,60%乙醇洗脱液的流出液以60%乙醇溶解并稀释至所述步骤(2)中参芪扶正注射液的取样量。优选的,所述步骤(5)中,色谱柱为agilentzorbaxeclipseplusc18柱,2.1×100mm,1.8μm。发明人以黄芪提取物(含醇)、党参提取物(含醇)样品为参考,分别自其总离子流色谱图中筛选出上述精确分子量,对通过本发明所述方法制备得到的参芪扶正注射液的各供试品的总离子流色谱图(tic)进行提取,得到提取离子图。其中以491.1195和507.1508提取出黄芪黄酮类成分,用精确分子量829.4591、871.4697、913.4650和991.5119提取出黄芪皂苷类成分,用精确分子量441.1678、441.2007、471.2083和633.2553提取出党参中成分。本发明方法通过以代表性成分定位指认,确定党参、黄芪指标性成分在制剂中的分布情况;并且可以直观地示出黄芪皂苷类(以黄芪甲苷为代表)与黄酮类(以毛蕊异黄酮葡萄糖苷)成分的分离情况。本方法能够对党参和黄芪的成分,以及黄芪中的黄酮类与皂苷类成分在制剂成品中进行分离并在色谱图中进行分类。操作简单、反应快速、重复性稳定,可作为一种对参芪扶正注射液相关成分进行快速分离和检测的方法。附图说明下面结合附图,对本发明做进一步说明。除图13外,下列每幅附图均有两张图谱构成,其中,上图是供试样品的质谱总离子流色谱图(tic),下图是用精确分子量(441.1678、441.2007、471.2083、491.1195、507.1508、633.2553、829.4591、871.4697、913.4650和991.5119)提取出的提取离子图(eic)。图1示出了党参提取物(含醇)图谱。图2示出了黄芪提取物(含醇)图谱。图3示出了毛蕊异黄酮葡萄糖苷对照图谱。图4示出了党参炔苷对照图谱。图5示出了黄芪甲苷对照图谱。图6示出了参芪扶正注射液的图谱。图7示出了d101大孔树脂吸附水洗脱液的图谱。图8示出了d101大孔树脂吸附20%乙醇洗脱液的图谱。图9示出了聚酰胺吸附水洗脱液的图谱。图10示出了聚酰胺吸附20%乙醇洗脱液的图谱。图11示出了参芪扶正注射液聚酰胺吸附水洗脱液的图谱。图12示出了参芪扶正注射液聚酰胺吸附20%乙醇洗脱液的图谱。图13示出了参芪扶正注射液聚酰胺吸附30%乙醇洗脱液的图谱;其中上图为供试样品的质谱总离子流色谱图(tic),中图为441.1678、441.2007、471.2083、633.2553提取出的提取离子图(eic),下图为491.1195、507.1508、829.4591、871.4697、913.4650和991.5119提取出的提取离子图(eic)。图14示出了参芪扶正注射液聚酰胺吸附40%乙醇洗脱液的图谱。图15示出了参芪扶正注射液聚酰胺吸附60%乙醇洗脱液的图谱。图16示出了参芪扶正注射液聚酰胺吸附80%乙醇洗脱液的图谱。图17示出了参芪扶正注射液聚酰胺吸附95%乙醇洗脱液的图谱。图18示出了参芪扶正注射液聚酰胺吸附20%乙醇40ml洗脱液的图谱。图19示出了参芪扶正注射液聚酰胺吸附20%乙醇60ml洗脱液的图谱。图20示出了参芪扶正注射液聚酰胺吸附20%乙醇80ml洗脱液的图谱。图21示出了参芪扶正注射液聚酰胺吸附20%乙醇100ml洗脱液的图谱。图22示出了参芪扶正注射液批号180211聚酰胺吸附水洗脱液的图谱。图23示出了参芪扶正注射液批号180211聚酰胺吸附20%乙醇洗脱液的图谱。图24示出了参芪扶正注射液批号180211聚酰胺吸附60%乙醇洗脱液的图谱。具体实施例以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的药材原料、试剂材料等,如无特殊说明,均为市售购买产品。其中,部分试剂和仪器购买情况如下:参芪扶正注射液:丽珠集团利民制药厂;党参炔苷:中国食品药品检定研究院,批号:111732-201607;毛蕊异黄酮葡萄糖苷:中国食品药品检定研究院,批号:111920-201606;黄芪甲苷:中国食品药品检定研究院,批号:110781-201717;lc-ms:agilent1290—q-tof6520;聚酰胺:沧州宝恩吸附材料科技有限公司。规格:层析用聚酰胺树脂;分子量:14000~17000;比表面积:5~10m2/g;ph值:6~7;乙醇、氢氧化钠、冰醋酸、乙腈、甲酸:均为市售,色谱级;纯化水:自制。实施例1党参提取物(含醇)总离子流色谱图(tic)和提取离子图(eic)取党参药材约10g,分别以100ml、80ml、70ml水,加热提取1h、1h、0.5h。合并3次提取液,浓缩后分别以75%、85%乙醇,醇沉2次,即得。称取聚酰胺约5g,95%乙醇脱气后湿法装柱(柱高约10cm,内径1cm)。依次以5%氢氧化钠40ml、10%冰醋酸80ml进行活化后,以注射用水洗至中性。精密量取25ml上述制备的党参提取液上样至已活化的聚酰胺层析柱,依次以水80ml、20%乙醇80ml及60%乙醇80ml洗脱。接收60%乙醇洗脱液,水浴蒸干,残渣以60%乙醇溶解并稀释至25ml。用lc-ms进行成分分析:色谱条件:色谱柱:agilentzorbaxeclipseplusc18柱(2.1×100mm,1.8μm);柱温:40℃;流动相:以0.1%甲酸水溶液为流动相a;0.1%甲酸乙腈溶液为流动相b,洗脱梯度如下表:洗脱梯度流速0.35ml/min;进样量5μl;质谱条件:离子源为esi源,负离子方式检测。雾化气压力:35psi,干燥气温度:350℃,干燥气流速:10l/min,vcap毛细管电压:3500v,fragmentor:135v。测定法:精密吸取供试品溶液5μl,注入液质联用仪,测定,记录图谱,见图1。以本实施例得到的党参提取物(含醇)样品总离子流图(见图1上图)对比实施例2得到的黄芪提取物(含醇)总离子图(见图2上图),筛选党参特有峰,并提取其精确分子量,分别为441.1678、441.2007、471.2083和633.2553,得到党参提取物的提取离子图(eic)(见图1下图)。实施例2黄芪提取物的质谱总离子流色谱图(tic)和提取离子图(eic)取黄芪药材约10g,分别以100ml、80ml、70ml水,加热提取1h、1h、0.5h。合并3次提取液,浓缩后分别以75%、85%乙醇,醇沉2次,即得。称取聚酰胺约5g,95%乙醇脱气后湿法装柱(柱高约10cm,内径1cm)。依次以5%氢氧化钠40ml、10%冰醋酸80ml进行活化后,以注射用水洗至中性。精密量取25ml上述制备的黄芪提取液上样至已活化的聚酰胺层析柱,依次以水80ml、20%乙醇80ml及60%乙醇80ml洗脱。接收60%乙醇洗脱液,水浴蒸干,残渣以60%乙醇溶解并稀释至25ml。利用lc-ms进行成分分析:色谱条件、质谱条件和测定法:同实施例1;图谱见图2。以本实施例得到的黄芪提取物(含醇)样品总离子流图(见图2上图)对比实施例1得到的党参提取物(含醇)总离子图(见图1上图)筛选黄芪特有峰,并提取其精确分子量,以491.1195和507.1508提取出黄芪黄酮类成分,用精确分子量829.4591、871.4697、913.4650和991.5119提取出黄芪皂苷类成分,得到黄芪提取物的提取离子图(eic)(见图2下图)。实施例3黄芪、党参代表性成分的tic和eic图谱精密称取党参炔苷约5mg、毛蕊异黄酮葡萄糖苷12.5mg和黄芪甲苷10mg分别用水、30%甲醇、甲醇溶解配制成1mg/ml、5μg/ml、0.01mg/ml的溶液。利用lc-ms进行成分分析:色谱条件、质谱条件和测定法:同实施例1;图谱分别见图3、图4和图5。实施例4参芪扶正注射液的相关评价成分选取称取聚酰胺约5g,95%乙醇脱气后湿法装柱(柱高约10cm,内径1cm)。依次以5%氢氧化钠40ml、10%冰醋酸80ml进行活化后,以注射用水洗至中性。精密量取25ml参芪扶正注射液(批号180211)上样至已活化的聚酰胺层析柱,依次以水80ml、20%乙醇80ml及60%乙醇80ml洗脱。接收各洗脱液的流出液,水浴蒸干,水洗脱液及20%乙醇洗脱液的流出液残渣以水溶解并稀释至25ml,60%乙醇洗脱液的流出液以60%乙醇溶解并稀释至25ml。按照实施例1所述的条件和方法,用lc-ms进行成分分析,得到总离子流图谱(见图6的上图)。将该总离子流图谱与图1示出的党参提取物(含醇)、图2示出的黄芪提取物(含醇)、图3示出的毛蕊异黄酮葡萄糖苷、图4示出的党参炔苷、图5示出的黄芪甲苷的质谱总离子流色谱图(tic)及提取离子图(eic)进行对比,以党参炔苷为党参代表成分,毛蕊异黄酮葡萄糖苷为黄酮类代表成分,黄芪甲苷为皂苷类代表成分进行定位;并且进一步的,根据对比结果,从图6的总离子流色谱图(tic)中用精确分子量491.1195和507.1508分别提取出2个黄酮类成分,用精确分子量991.5119、829.4591、871.4697和913.4650提取出9个皂苷类成分,用精确分子量633.2553、471.2083、441.1678和441.2007提取出4个党参中成分,从而得到参芪扶正注射液的提取离子图(eic),见图6的下图。实施例5不同吸附剂的对比考察通过实验对比聚酰胺与d101大孔树脂对参芪扶正注射液相关成分的吸附情况。取预处理过的大孔树脂d101适量(大孔树脂的预处理:加入足量的水,使大孔树脂溶胀至体积不再增加为止,然后倒入层析柱内,使柱内树脂量不要超过柱长的1/2,除去悬浮于水溶液面上的树脂颗粒,再用95%乙醇洗柱,直至流出液加2倍水混合后不呈白色浑浊为止,最后用水洗涤除尽乙醇备用。)湿法装柱,得到d101大孔树脂柱(柱高约15cm,内径1cm),备用。25ml参芪扶正注射液(批号180211)上样至上述d101大孔树脂柱。依次以水80ml、20%乙醇80ml洗脱。分别接收上述各洗脱液的流出液,水浴蒸干,残渣以水溶解并稀释至25ml,利用lc-ms进行成分分析:色谱条件、质谱条件和测定法同实施例1。图谱分别见图7和图8。按照实施例1所述湿法装柱并活化,得到聚酰胺柱,备用。参芪扶正注射液(批号180211)25ml上样至已活化的聚酰胺层析柱。依次以水80ml和20%乙醇80ml洗脱。分别接收上述各洗脱液的流出液,水浴蒸干,残渣以水溶解并稀释至25ml。利用lc-ms进行成分分析:色谱条件、质谱条件和测定法同实施例1。图谱见图9和图10。结果显示,d101大孔树脂上样后,在进行水洗与20%乙醇洗脱时,监测成分已经被洗脱,无法达到分离。而聚酰胺树脂对相关成分的吸附作用明显优于d101大孔树脂,确定聚酰胺树脂可能用于对参芪扶正注射液成分进行分离。实施例6乙醇洗脱浓度考察按照实施例1所述湿法装柱并活化,得到聚酰胺柱,备用。参芪扶正注射液(批号180211)25ml上样至已活化的聚酰胺层析柱。依次以2倍柱体积水、20%、30%、40%、60%、80%乙醇洗脱,分别接收上述各洗脱液的流出液,水浴蒸干,残渣加水适量溶解,0.22μm滤膜滤过,即得。利用lc-ms进行成分分析:色谱条件、质谱条件和测定法同实施例1。图谱见图11~图17。结果显示:用于分离的最佳洗脱溶剂分别为,水、20%乙醇、60%乙醇。水洗脱液主要为党参的水溶性较强成分;20%乙醇洗脱液主要为黄芪中以毛蕊异黄酮葡萄糖苷、紫檀烷苷为代表的黄酮类成分,60%乙醇洗脱液主要为黄芪中以黄芪甲苷为代表的皂苷类成分。而以30%乙醇洗脱时,可见毛蕊异黄酮葡萄糖苷、紫檀烷苷及黄芪甲苷同时被洗脱;40%乙醇洗脱液的情况与30%乙醇洗脱液的情况相似。经过60%乙醇洗脱后,80%、95%乙醇洗脱液已基本无可检出成分。故确定最佳洗脱溶剂依次为水、20%乙醇、60%乙醇。实施例7洗脱溶剂用量考察利用上述所确定最佳洗脱浓度,分别考察2倍、3倍、4倍、5倍柱体积洗脱溶剂洗脱完全情况及分离效果。即:分别以40ml、60ml、80ml、100ml20%乙醇为洗脱液进行洗脱。利用lc-ms进行各供试品的成分分析:色谱条件、质谱条件和测定法同实施例1。图谱见图18~图21。选取党参、黄芪中的黄酮类、皂苷类代表成分的峰面积为评价指标,通过与参芪扶正注射液原液进行对比,积分结果见表2。表2峰面积积分结果保留时间参芪扶正注射液40ml60ml80ml100ml7.9686413677760347416871526976687612.95812189921201410119860512177651254676结果,当洗脱溶剂用量为80ml时,各指标峰的峰面积已与参芪扶正注射液原液相近,且洗脱溶剂量为100ml,各指标峰的峰面积未见明显增加。故确定最佳洗脱溶剂用量为80ml。即,用于最佳洗脱溶剂用量为4倍柱体积。实施例8实验重现性考察:按照实施例1所述湿法装柱并活化,得到聚酰胺柱,备用。参芪扶正注射液(批号180211)上样至已活化的聚酰胺层析柱。依次以水80ml、20%乙醇80ml及60%乙醇80ml洗脱。分别接收上述各洗脱液的流出液,水浴蒸干,水洗脱液及20%乙醇洗脱液的流出液残渣以水溶解并稀释至25ml,60%乙醇洗脱液的流出液以60乙醇溶剂并稀释至25ml。利用lc-ms进行成分分析:色谱条件、质谱条件和测定法:同实施例1。各洗脱部分的总离子流图谱(tic)见图22~图24的上图。从图22~图24的总离子流色谱图(tic)中用精确分子量(491.1195、507.1508)分别提取出2个黄酮类成分提取离子图(eic),用精确分子量(991.5119、829.4591、871.4697、913.4650)合并提取出9个皂苷类成分提取离子图(eic),用精确分子量(633.2553,471.2083,441.1678,441.2007)提取出4个党参中成分提取离子图(eic),见图22~图24的下图,分别积分,结果见表3。表3参芪扶正注射液180211批峰面积结果:结论:通过上述方法,可以明确参芪扶正注射液能够很好的保留党参、黄芪中的相关成分,使得参芪扶正注射液能够充分发挥党参、黄芪之药效。本发明提供的方法,利用聚酰胺能够完成对参芪扶正注射液中来源自党参与黄芪的成分进行分离。同时,能够对黄芪中的黄酮类与皂苷类成分进行分离。且本方法操作简单,可作为一种对参芪扶正注射液相关成分进行快速分离方法。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1