基于氧化石墨烯的荧光增强型适配体传感器及其制备方法和应用与流程
本发明涉及生物检测技术,具体涉及基于氧化石墨烯的荧光增强型适配体传感器及其制备方法和应用。
背景技术:
随着世界渔业的快速发展及水产养殖环境的日益恶化,致病菌引起的各种鱼类疾病已成为影响水产养殖业的重要威胁因素。嗜水气单胞菌(a.hydrophila)和迟缓爱德华氏菌(e.tarda)作为水产养殖中的常见病原菌,不仅给水产养殖业带来巨大经济损失,而且还会对鱼类和人类造成疾病。因此,发明一种快速,灵敏,高特异性,低成本的检测鱼类病原菌(如a.hydrophila和e.tarda)的方法具有重要意义。传统的鱼类病原菌的检测方法,如生化培养,pcr和免疫诊断技术,都受到过程或样品制备过程复杂,分析时间长,成本高和低特异性等缺点的限制。近年来,将生物分子识别元件(如酶、抗体、噬菌体、适配体等)结合荧光、电化学、比色等信号转换系统构建生物传感器用于检测病原菌的分析方法引起了许多研究者的兴趣。在上述可能的识别检测的策略中,基于抗体识别的方法简单且具有高度选择性,但是依赖于动物中产生的抗体,其成本较昂贵并且重复性差。因此,迫切需要开发一种基于新型分子探针的简单方法,用于快速,高灵敏地检测鱼类病原菌。
适配体,被称为“人工抗体”,与天然抗体相比具有明显的优势,如结构简单,成本低,不易变性和失活。因此,许多研究人员使用适配体作为新的识别元件结合不同的分析方法来检测细胞、细菌和肿瘤标志物等分子。王周平等人将适配体作为识别分子与信号转换系统相结合,如表面增强拉曼散射(sers)和上转换荧光分析,构建了适用于检测鼠伤寒沙门氏菌(salmonellatyphimurium)、金黄色葡萄球菌(staphylococcusaureus)和副溶血弧菌(vibrioparahaemolyticus)的适配体传感器平台。郑磊等人开发了一种基于催化发夹组装(cha)和双功能适配体检测癌细胞的荧光方法。这些基于适配体识别和检测的方法在生物分析和早期诊断方面具有巨大潜力。尽管已经有一些检测鱼类病原菌(如副溶血性弧菌和哈维氏弧菌)的文章。然而,却没有关于使用适配体结合纳米材料检测a.hydrophila和e.tarda的报道。氧化石墨烯(go)是一种新型的碳二维纳米材料,易于合成,具有优异的光学和胶体稳定性以及高消光系数等特性。go具有较高的比表面积和丰富的表面官能团,使其具有良好的亲水性和相容性,光响应性能,小尺寸效应等特性。此外,氧化石墨烯及其衍生物已广泛应用于生物传感、生物成像、药物靶向运输、组织工程等领域。
技术实现要素:
为了解决现有技术的不足本发明提供了一种基于氧化石墨烯的荧光增强型适配体传感器用于快速检测嗜水气单胞菌(a.hydrophila)和迟缓爱德华氏菌(e.tarda)。
本发明的技术方案是:基于氧化石墨烯的荧光增强型适配体传感器的制备方法,以go作为猝灭剂,猝灭用羧基荧光素fam标记的适配体aptamer1和aptamer2的荧光后制得。
本发明的进一步改进包括:
将0.02mg/ml氧化石墨烯与200nm适配体apt1和apt2,在结合缓冲液即50mmtris-hcl,100mmnacl,5mmkcl,1mmmgcl2,ph7.4中混合反应8min即得。
本发明的另一目的在于提供了基于氧化石墨烯的荧光增强型适配体传感器的制得方法。
本发明还提供了具有fam标记的两种适配体aptamer1和aptamer2作为荧光探针在制备基于氧化石墨烯的荧光增强型适配体传感器中的应用。
所述具有fam标记的适配体aptamer1和aptamer2作为荧光探针在检测a.hydrophila和e.tarda中的应用。
所述的应用,以go作为猝灭剂,猝灭用羧基荧光素fam标记的适配体aptamer1和aptamer2的荧光,通过监测荧光信号变化来分别检测a.hydrophila和e.tarda。
由于go上吸附适配体的荧光标记染料与go之间的有效荧光共振能量转移,go可以猝灭用羧基荧光素(fam)标记的适配体aptamer1(apt1)和aptamer2(apt2)的荧光。加入a.hydrophila和e.tarda后,原本吸附在go表面上的特异性识别病原菌的适配体从go表面释放,荧光得到明显恢复。基于该原理,可构建基于氧化石墨烯的荧光增强型适配体传感器,并用于快速检测鱼类病原菌。我们的方法为鱼类病原菌的快速识别与检测提供新手段、新方法,为未来实现现场的快速检测提供理论依据。
本发明基于氧化石墨烯和适配体识别的的荧光增强型适配体传感器,用于a.hydrophila和e.tarda的快速检测和成像。fam标记的适配体荧光可以被go猝灭,因为go吸附适配体上的荧光标记物fam与go之间有效的荧光共振能量转移(fret)。加入a.hydrophila和e.tarda后,最初吸附在go表面上的适配体特异性识别病原菌(a.hydrophila和e.tarda),然后从go表面释放,导致荧光恢复。此外,我们的方法可用于鲫鱼体内a.hydrophila和e.tarda的检测和成像。并且我们的方法可以为鱼类病原菌的快速鉴定和成像提供一种新方法,这为将来开发用于病原菌的追踪,诊断和治疗的新型纳米生物传感系统提供了机会。
附图说明
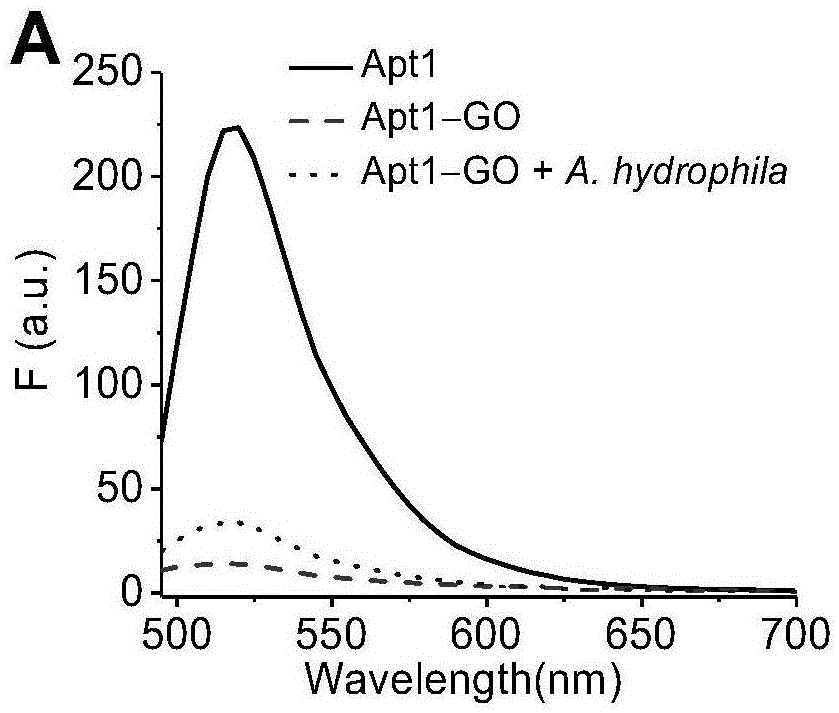
图1a是fam标记的适配体apt1在不同条件下的荧光发射光谱。
图1b是fam标记的适配体apt2在不同条件下的荧光发射光谱。
图1c是apt1与go的最佳配比。
图1d是apt2与go的最佳配比。
图2a是go的sem图像
图2b是go的afm图像和高度分析。
图2c是适配体apt1-go复合物的afm图像和高度分析。
图2d是适配体apt2-go复合物的afm图像和高度分析。
图3a是go(a),apt1(b),apt2(c),apt1-go复合物(d),apt2-go复合物(e)的uv-vis吸收光谱。
图3b是go,apt1-go复合物,apt1-go和a.hydrophila混合物,apt2-go复合物,apt2-go和e.tarda混合物的zeta电位图。
图3c是和go,apt1-go复合物,apt1-go和a.hydrophila混合物,apt2-go复合物,apt2-go和e.tarda混合物的水合粒径分布分析。
图4a是apt1-go复合物(200nm:0.02mg/ml)在不同浓度的a.hydrophila存在下的荧光发射光谱(0,0.1,12.5,1.3×103,6.3×104,1.3×105cfu/ml)。
图4b是从图a的光谱获得的校准曲线,其显示荧光强度的变化与嗜水气单胞菌浓度在基数10的对数呈线性依赖性(log10c,cfu/ml)。
图4c是在不同浓度(0,0.1,1.3,12.5,1.3×102,1.3×103,2.5×103,6.3×103,1.3×104cfu/ml)的e.tarda存在下apt2-go复合物的荧光发射光谱。
图4d是从图4c的光谱获得的校准曲线,显示荧光强度变化对迟缓爱德华氏菌浓度的线性依赖性。
图4e是apt1和apt2在存在和不存在go时对对应鱼类病原菌的荧光响应对比。
图5a是apt1-go复合物(a)对不同细菌的荧光响应。
图5b是apt2-go复合物(b)对不同细菌的荧光响应。
具体实施方式
下面结合附图对本发明做详细说明。
实验部分
材料和试剂
文中所用到核酸适配体全部由生工生物工程(上海)股份有限公司合成,荧光素标记单链dna的序列如表1。氧化石墨烯是从先丰纳米材料科技有限公司购买的(南京,中国)。tris、醋酸、氯化钠(nacl)、氯化镁(mgcl2)、盐酸(hcl)为分析纯,均购自阿拉丁试剂有限公司(中国上海)。氯化钾(kcl)购自麦克林试剂有限公司(中国)。胰蛋白胨和酵母提取物由oxoid有限公司提供。所有水溶液均用milli-q系统(美国,18.2mω·cm)产生的双蒸水制备。
表1.核酸适配体序列及修饰
仪器
使用在se(u)模式下以2.0kv操作的su8010扫描电子显微镜(日立,日本)收集扫描电子显微镜(sem)图像。在brukermultimode8afm/spm(布鲁克,德国)系统上获得原子力显微镜图像,并通过免费软件gwyddion2.30(http://gwyddion.net/)进行分析。在哈希多参数水质仪dr6000(美国)上记录uv-vis吸收光谱。使用美国分子公司spectramaxm5多功能酶标仪进行荧光测量,在485nm的激发波长下测量荧光发射光谱。在zetasizernanozs(马尔文仪器有限公司,英国)上实现水合粒径和zeta电位表征。通过小动物活体成像系统(ivisspectrum,caliper-pe,荧光激发500nm,荧光发射540nm)记录鱼类病原菌在鱼体内荧光成像。使用livingimage软件4.3.1创建感兴趣区域(roi)来分析图像的特定区域。
细菌培养和计数
细菌在37℃下在lb培养基中生长,培养过夜,然后通过结合缓冲液(50mmtris-hcl,100mmnacl,5mmkcl,1mmmgcl2,ph7.4)离心洗涤三次(12000rpm/5min)。根据常规的琼脂平板计数方法,在37℃温育18小时后,计数平板上的菌落以确定每毫升菌落形成单位的数目(cfu/ml),最终获得107cfu/ml的菌液。
适配体-go复合物的制备及病原菌的检测
适配体-go复合物(apt-go)的制备:用结合缓冲液(50mmtris-hcl,100mmnacl,5mmkcl,1mmmgcl2,ph7.4)稀释适配体溶液。然后将go(0.02mg/ml)与适配体溶液(200nm)在室温下孵育8分钟以形成适配体-go复合物。
apt-go对病原菌的检测:分别将制备好的不同浓度的a.hydrophila(0,0.1,12.5,1.3×103,6.3×104,1.3×105cfu/ml)和e.tarda0,0.1,1.3,12.5,1.3×102,1.3×103,2.5×103,6.3×103,1.3×104cfu/ml)加入到上述其对应的apt-go复合物的溶液中并在室温下孵育30分钟,使用美国分子酶标仪在激发波长为485nm,在495到700nm范围内收集混合物的荧光发射光谱。对照组中apt-go复合物和非靶标菌(e.coli,b.subtilis,erwinia,a.caviae和a.veronii)的结合步骤与上述步骤相同。
嗜水气单胞菌和迟缓爱德华氏菌感染的鲫鱼荧光成像。
为了研究适配体-go复合物用于体内荧光检测和成像鱼类病原体(a.hydrophila和e.tarda)的可行性,200μl不同浓度的a.hydrophila(105和106cfu/ml)和e.tarda(104和105cfu/ml)通过腹腔注射入鲫鱼体内。过夜感染后,然后将2ml的适配体-go复合物(200nm:0.02mg/ml)腹腔注射入相同位置。孵育6小时后,通过注射三卡因(50mg/l)麻醉鲫鱼,然后用ivis光谱成像系统(caliper,ma)进行成像。所有动物实验均遵循美国国立卫生研究院实验动物护理和使用指南,并经湖南师范大学动物伦理委员会批准。
鱼类病原菌的检测策略和机制研究
为了验证适配体结合go用于鱼类病原菌检测的可行性,我们首先研究了不同条件下fam标记适配体的荧光变化(序列和修饰在表1中)。如图1所示,fam标记的适配体在520nm处显示出强的荧光发射。在go存在下,适配体的荧光(apt1靶向a.hydrophila和apt2靶向e.tarda)显着降低(图1a,b,短线)并在8分钟后达到平衡,这是因为go上适配体的fam标记与go之间的有效的荧光共振能量转移。加入a.hydrophila和e.tarda后,适配体-go复合物的荧光明显恢复(图1a,b,点线)并在约30分钟后达到平衡。当go浓度为0.02mg/ml(适配体为200nm)时,apt1的荧光猝灭率达到85.37%,apt2的荧光猝灭率达到87.15%,并且适配体-go的复合物与病原菌的荧光变化达到最大值(图1c,d)。因此,使用0.02mg/ml作为go的最佳浓度。
为了研究适配体-go复合物用于检测病原菌的机制,我们使用sem,afm,uv-vis光谱仪,ζ-电位来表征反应过程。如图2a所示,go的sem图像显示出典型的轻微褶皱和卷曲形态。进一步的afm结果(图2b)显示go具有相对均匀的厚度分布,并且其厚度约为1.6nm。而适配体-go复合物的厚度显着大于go的厚度(apt1-go的最大值约为8.48nm,apt2-go的最大值约为16.69nm),表明go表面吸附了适配体(方案1a)。通过uv-vis吸收光谱法进一步研究了适配体与go之间的相互作用(图3a)。如图3a所示,观察到go在230nm处的强吸收峰(曲线a),这归因于芳环中c=c的π-π*跃迁。另外,在295nm处的肩峰表明c=o基团的n-π*跃迁。在260nm(对应dna)和485nm(对应fam标记)处观察到apt1(曲线b)和apt2(曲线c)的吸收峰。如曲线d所示,apt-go复合物在485nm处具有强烈的fam标记特征吸收峰在235nm处相对于go具有轻微红移,这表明适配体已成功的吸附到go的表面。此外,图2c,d中的afm图像,与病原菌孵育后适配体-go复合物的厚度显着降低(a.hydrophila约为6.85nm,e.tarda约为7.70nm),表明适配体可能由于病原体与适配体的特异性的竞争性结合从go表面释放。
如图3b所示,go分散液具有最高的负ζ-电位(约27.77mv),这归因于石墨烯在氧化期间晶格处形成的负电性官能团的存在。而适配体-go复合物表现出降低的负ζ-电位(约-25.43和-23.00mv),这是因为go的表面被适配体分子覆盖。此外,病原菌的存在导致负ζ-电位显着降低(从约-25.43到-19.83mv,从约-23.00到-10.08mv),表明适配体-go复合物与病原菌之间的强相互作用。同时,动态光散射显示go的平均尺寸随着适配体吸附而增加(图3c)。适配体-go复合物的水合粒径为约702nm(对于apt1-go)和508nm(对于apt2-go),而go的水合粒径为约229nm。此外,病原菌的存在导致水合粒径显着增加(a.hydrophila约为1924nm,e.tarda约为1937nm)。
荧光增强型适配体传感器用于检测鱼类病原菌的灵敏度和选择性
为了评估适配体-go复合物的检测效果,将一系列不同浓度的嗜水气单胞菌和迟缓爱德华氏菌分别与apt1-go复合物和apt2-go复合物一起孵育,然后测定每个样品的荧光信号。如图4a,c中所示,apt1-go复合物和apt2-go复合物的荧光强度随着病原菌浓度的增加逐渐增加。病原菌的浓度与增加的荧光信号成比例(图4b,d,(f-f0)/f0,其中f和f0分别是存在和不存在靶细菌时的荧光强度)。如图4b,d所示,对于嗜水气单胞菌的回归方程为y=0.02533x+0.0667(r=0.97657),,而对于迟缓爱德华氏菌的回归方程为y=8.4245×10-5x+0.45354(r=0.99097),。然而,单独适配体的荧光在靶细菌存在下猝灭,证明go在降低荧光背景和提高系统中的灵敏度和信噪比方面发挥作用(图4e)。
在自然环境中,a.hydrophila和e.tarda通常可能伴有其他细菌,包括革兰氏阳性(g+)和革兰氏阴性(g-)细菌。因此,通过比较该方法对目标细菌和其他干扰细菌的荧光强度变化,考察嗜水气单胞菌和迟缓爱德华氏菌的荧光增强型适配体传感器的选择性。如图5a,b所示,与干扰细菌相比,包括escherichiacoli(e.coli,g-),erwinia(g-),aeromonascaviae(a.caviae,g-),andaeromonasveronii(a.veronii,g-),bacillussubtilis(b.subtilis,g+),只有目标细菌表现出明显的荧光强度增加。观察结果表明,适配体-go复合物对靶病原体具有高度特异性。此外,荧光显微镜图像的结果也证明了我们的方法具有良好的特异性。
a.hydrophila和e.tarda感染的鲫鱼活体的荧光成像
为了研究适配体-go复合物检测在鱼体内病原菌的可行性,我们在鲫鱼体内分别腹腔注射200μl不同浓度的a.hydrophila(105和106cfu/ml)和e.tarda(104和105cfu/ml)。感染过夜后,然后将2ml适配体-go复合物腹腔注射入鱼的相同位置。在注射后6h后,鱼体表现出荧光。随着病原菌浓度的增大,鱼体的荧光强度成比例地增加。此外,处死鱼并收获主要器官(心脏,肾脏,脾脏,性腺,肝脏或肠)用于荧光成像。只有性腺,肝脏和肠道有明显的荧光信号,随着病原体浓度的增加,它们的荧光强度也逐渐增加。被105cfu/ml的e.tarda感染的性腺具有更强和更集中的荧光,这可能归因于e.tarda的特殊定植。这些结果表明,适配体-go复合物具有在鱼体内检测和成像嗜水气单胞菌和迟缓爱德华氏菌的潜在能力。
本发明公开了一种基于go的简单灵敏的荧光增强型适配体传感器,用于快速检测和成像鱼体内的嗜水气单胞菌和迟缓爱德华氏菌。与先前报道的用于检测其他鱼类病原体的方法相比,我们设计的方法简单,快速,并且具有宽检测范围,高灵敏度和选择性。该基于适配体特异性识别的检测系统不仅为鱼类病原菌的体内检测和成像提供了新的荧光检测方法,而且可能为理解鱼类病原菌的作用提供了一个分析平台,通过改变能够特异性识别目标病原菌的适配体,可以广泛应用于其他鱼类病原体的检测。未来,通过与纳米酶和工具酶相结合,将设计和开发新型信号放大平台,实现更高灵敏度的病原体检测和成像。
以上显示和描述了本发明的基本原理和主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!