基于拉曼增强的金属-包裹物-抗体复合纳米粒子定量检测肿瘤标记物的方法与流程
本发明涉及物理领域,尤其涉及光学检测技术,特别涉及拉曼光谱检测技术,具体的是一种基于拉曼增强的金属-包裹物-抗体复合纳米粒子定量检测肿瘤标记物的方法。
背景技术:
目前,癌症已经严重威胁人类的健康,并成为主要死因之一。世界卫生组织(who)发布的《世界癌症报告2014》估计,2030年全世界癌症死亡人数将达到1300万人。同时,世界卫生组织提供的数据也显示,三分之一癌症患者通过早期发现和早期治疗,可以得到根治,如i期的乳腺癌、鼻咽癌和喉癌等5年存活率接近100%。而现在临床检测发现的患者往往己经处于癌症中晚期而无法痊愈,甚至存活期不到1年。因此,开展癌症的早期诊断技术研究,对于人民健康、社会和谐和经济持续发展,具有重大意义。
近年来,随着分子生物学的发展,人们对癌症病因和病理的认识不断深化,特别是肿瘤标志物的发现,对癌症的早期诊断、预后和疗效评价以及高危人群随访等都具有极大的实用价值。目前,肿瘤标志物的检测主要是通过放射免疫分析、金标记免疫技术、荧光免疫分析、酶免疫测定来实现。放射免疫分析虽然灵敏度高,具有抗原-抗体反应本身所具有的特异性,但其所用的标记物-反射性同位素不断衰变,不能久存,又对人体及被测生物大分子具有损害,同时检测用的仪器(如液体闪烁谱仪)昂贵,维护成本高,操作费时,结合和游离的抗体分离困难,对临床大批量样品的检测极为不便。荧光检测会受到样品自身荧光的干扰以及光漂白效应和荧光染色剂少等。这些方法不同程度存在着操作复杂、费时费力等缺点。另外,同一种肿瘤可含多种肿瘤标志物,不同肿瘤或同一肿瘤的不同组织类型既可有共同的标志物,也可有不同的标志物。需要对于肿瘤标记物可以一次性多通道检测。
基于金属纳米粒子表面增强拉曼散射(以下简称sers)特性的生物传感技术,因其具有更高的空间分辨率和灵敏度,可以达到单分子检测水平,显示出良好的应用前景。基于金属纳米粒子sers特性的肿瘤标志物免疫检测技术已成为当前的研究热点。但现有技术进行sers应用有很大的缺点:胶体的稳定性较差、其本身很容易聚沉、随着测量过程的进行sers谱图变化较快。尤其是不能定量、不能针对生物样品进行多通道肿瘤标志物测量,这给sers的实际应用都带来很大的不便。
技术实现要素:
本发明的目的在于提供基于拉曼增强的金属-包裹物-抗体复合纳米粒子定量检测肿瘤标记物的方法,所述的这种基于拉曼增强的金属-包裹物-抗体复合纳米粒子定量检测肿瘤标记物的方法要解决现有技术中样品处理繁琐、易干扰、不能定量和不能针对生物样品进行多通道肿瘤标志物测量的技术问题。
本发明提供了一种基于拉曼增强的金属-包裹物-抗体复合纳米粒子定量检测肿瘤标记物的方法,包括如下步骤:
步骤1,将全部或部分包裹在无机物或有机物或聚合物或贵金属内部的金属纳米粒子分散到缓冲液中并加入抗体反应,使抗体全部或部分包裹金属纳米粒子最外层得到金属-包裹物-抗体复合纳米粒子,清洗后分散到缓冲液中,得到金属-包裹物-抗体复合纳米粒子溶液;
步骤2,重复步骤1制备多种含有不同抗体的金属-包裹物-抗体复合纳米粒子,并清洗后分散到缓冲液中得到不同浓度的金属-包裹物-抗体复合纳米粒子溶液;
步骤3,各取步骤1和2制备的含有不同抗体的金属-包裹物-抗体复合纳米粒子溶液混合均匀,得到含有至少两种金属-包裹物-抗体复合纳米粒子的混合液备用;
步骤4,从患者处取得含有肿瘤标志物的体液,并对体液进行提纯;
步骤5,将上述步骤提纯后的样品和步骤3所述的混合液混合,反应后得到抗体抗原特异性结合后形成的新的金属-包裹物-抗体-抗原复合纳米粒子;
步骤6,通过清洗和离心浓缩得到金属-包裹物-抗体-抗原复合纳米粒子固相物,进行透射拉曼光谱分析和检测,通过模型计算得到体液中各种肿瘤标志物含量。
进一步的,所述体液为尿液或血液或唾液或汗液或体内积液。
进一步的,步骤4中,在体液提纯的过程中,采用离心或过滤或萃取或沉淀或浓缩的方法,去除体液中的细胞和组织碎片。
进一步的,步骤1中,金属纳米粒子为金或银纳米粒子,优选银纳米粒子;包裹物为二氧化硅或氨基酸或蛋白质或dna或聚乙烯吡咯烷酮或吐温或聚乙二醇或曲拉通或三乙醇胺,优选聚乙烯吡咯烷酮或聚乙二醇或二氧化硅;
进一步的,所述金属纳米粒子的平均粒径小于100纳米。
进一步的,所述步骤6中,进行透射拉曼光谱检测时,样品上光斑直径在0.01毫米到12毫米之间,优选0.1毫米到1毫米之间。
本发明还提供了一种金属-包裹物-抗体复合纳米粒子的制备方法,将全部或部分包裹在无机物或有机物或聚合物或贵金属内部的金属纳米粒子分散到缓冲液中并加入抗体反应,使抗体全部或部分包裹金属纳米粒子最外层得到金属-包裹物-抗体复合纳米粒子,清洗后分散到缓冲液中,得到金属-包裹物-抗体复合纳米粒子溶液。
进一步的,所述的聚合物为聚乙烯吡咯烷酮。
进一步的,所述的抗体为前列腺特异性抗体或者甲胎蛋白抗体。
进一步的,所述的缓冲液为磷酸缓冲液。
本发明原理:利用表面包裹无机物或有机物或聚合物或金属的金属纳米粒子与生物分子良好的亲和作用,将特异性的抗体吸附在平均粒径小于100nm的金属纳米粒子上形成金属-包裹物-抗体复合纳米粒子。金属粒子表面包裹无机物或有机物或聚合物或其它金属,增加了复合粒子制备和检测的功能性和多样性,从而适应不同的检测环境,并且在室温及中性水溶液中更加稳定。当金属-包裹物-抗体复合纳米粒子与相应的抗原特异性结合后,会形成金属-包裹物-抗体-抗原复合纳米粒子。通过清洗和离心浓缩得到金属-包裹物-抗体-抗原复合纳米粒子固相物,进行透射拉曼光谱分析和检测。依据表面增强拉曼光谱增强的机理,只有和金属表面发生相互作用的基团才会被增强,表面增强拉曼光谱对肿瘤标志物的增强具有选择性,只有露在分子的外侧与金属纳米粒子直接发生作用的基团才会被增强,而这些部位通常就是分子中具有显著生物学特征的部位,正是抗体抗原的活性位置。因此,利用表面增强拉曼光谱检测肿瘤标志物有独特的优势。
由于获得样品中抗原或抗体的信息典型的拉曼振动峰半峰宽约为0.5nm,理论上在200cm-1-2000cm-1的拉曼光谱检测范围内,可选择1000个具有不同拉曼特征振动的分子,即使考虑谱带的重叠问题,可选范围缩小10倍,仍可标记识别100种抗原抗体。因此,通过表面增强拉曼光谱标记方法可以实现对多种肿瘤标记物检测,同时具有高敏感性和反应的强特异性,在多通道免疫检测领域具有巨大的应用潜力,它的开展无疑在临床免疫医学诊断领域开辟了一条崭新的途径。
本发明和已有技术相比,其技术效果是积极和明显的。本发明结合了表面增强拉曼光谱技术和抗原抗体特异性结合技术,在研究肿瘤标志物方面发挥出巨大作用,显示出独特的优势:第一,应用表面增强拉曼光谱技术可以得到比常规拉曼光谱大106倍的增强系数,这样就可以使肿瘤标志物的探测浓度降低到一般的生理环境下的浓度,是研究在生理环境下肿瘤标志物特征信息的一种有效方法。第二,针对抗体抗原的活性位置进行选择性拉曼增强。由于拉曼光谱在研究生物分子方面具有许多独特优势,这一技术将发展成为研究肿瘤标志物的有利力工具。
附图说明
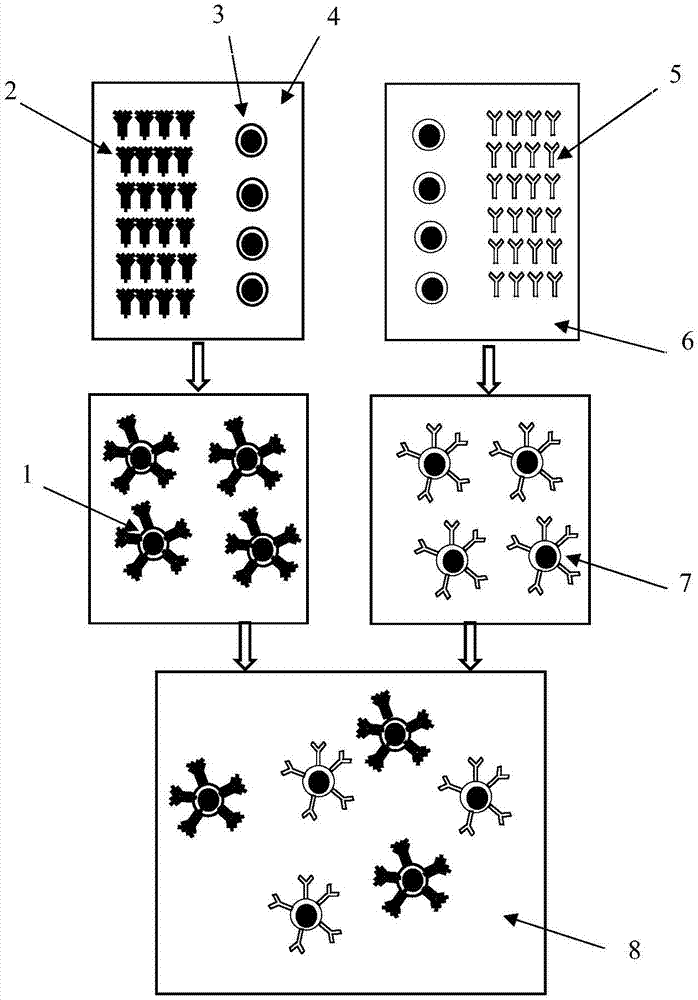
图1是本发明的基于拉曼增强的金属-包裹物-抗体复合纳米粒子定量检测肿瘤标记物前列腺特异性抗原psa的方法的流程图,其中1:第一金属-包裹物-抗体复合纳米粒子;2:第一抗体;3:第一金属-包裹物纳米粒子;4:第一缓冲液;5:第二抗体;6:第二缓冲液;7:第二金属-包裹物-抗体复合纳米粒子;8:混合液;
图2是本发明的基于拉曼增强的金属-包裹物-抗体复合纳米粒子定量检测肿瘤标记物甲胎蛋白afp的方法的流程图;其中,9:蛋白质;10:第一抗原;11:第二抗原;12:第一金属-包裹物-抗体-抗原复合纳米粒子;13:第二金属-包裹物-抗体-抗原复合纳米粒子;14:金属-包裹物-抗体-抗原复合纳米粒子固相物
图3是本发明的基于拉曼增强的金属-包裹物-抗体复合纳米粒子定量检测肿瘤标记物的方法的透射拉曼光谱测试装置如下:
21:光谱仪;22:光纤;23:耦合镜;24:滤光片;25:散射光聚集器;26:容器;27:载物台;28:光束整形系统;29:拉曼光谱激发光源;30:金属-包裹物-抗体-抗原复合纳米粒子固相物。
具体实施方式
实施例1
如图1、2和3所示,本发明基于拉曼增强的金属-包裹物-抗体复合纳米粒子定量检测肿瘤标记物的方法包括三个过程:
1:金属-包裹物-抗体复合纳米粒子制备过程是:
首先用量筒量取60ml的0.01mol/l硝酸银溶液,并添加氨水制成银氨溶液,再称取0.1g聚乙烯吡咯烷酮(pvp)溶于该银氨溶液中;随后在另一烧杯中将0.21g抗坏血酸溶于60ml水中配成抗坏血酸溶液,并在该溶液中加入0.01g水合肼。最后在35度下将所制备的银氨溶液和抗坏血酸溶液同时逐滴滴加到用磁力搅拌500ml烧杯中。待还原反应结束后继续陈化15分钟,制备出平均粒径50nm银粒子。将溶液置入离心管进行高速离心分离,清除除上清液,加入去离子水离心清洗三次。最后将包裹pvp的纳米银粒子3分散到10毫升ph值为7.3的0.01m的磷酸缓冲液4中备用。然后,取95μg前列腺特异性抗体(anti-psa)2加入上述缓冲液中,在4℃下反应12小时得到银-pvp-前列腺特异性抗体复合纳米粒子1,离心、洗涤后分散到10毫升ph值为7.3的0.01m的磷酸缓冲液中备用。
首先用量筒量取60ml的0.01mol/l硝酸银溶液,并添加氨水制成银氨溶液,再称取0.1gpvp溶于该银氨溶液中;随后在另一烧杯中将0.21g抗坏血酸溶于60ml水中配成抗坏血酸溶液,并在该溶液中加入0.01g水合肼。最后在35度下将所制备的银氨溶液和抗坏血酸溶液同时逐滴滴加到用磁力搅拌500ml烧杯中。待还原反应结束后继续陈化15分钟,制备出平均粒径50nm银粒子。将溶液置入离心管进行高速离心分离,清除除上清液,加入去离子水离心清洗三次。最后将包裹pvp的纳米银粒子3分散到10毫升ph值为7.3的0.01m的磷酸缓冲液6中备用。然后,取95μg甲胎蛋白抗体(anti-afp)5加入上述缓冲液中,在4℃下反应12小时得到银-pvp-甲胎蛋白抗体(anti-afp)复合纳米粒子7,离心、洗涤后分散到10毫升ph值为7.3的0.01m的磷酸缓冲液中备用。
最后,各取5ml银-pvp-前列腺特异性抗体复合纳米粒子溶液和银-pvp-甲胎蛋白抗体(anti-afp)复合纳米粒子溶液均匀混合,得混合液8作为检测试剂备用。
2:前列腺肿瘤标志物(前列腺特异性抗原psa)和肝癌标志物(甲胎蛋白afp)检测过程
本发明检测的过程是:对5名疑似肿瘤病人肿瘤标志物检测分析。首先抽取病人的血液15毫升,通过离心、萃取和过滤取得血清样品,所述的血清样品中,包括蛋白质9、前列腺特异性抗原(psa)10和甲胎蛋白抗原11;然后用注射器将血清样品取10毫升加入上述检测试剂8,通过震动使血清样品和复合纳米粒子溶液8混合均匀。在室温下反应10分钟,通过洗涤和高速离心在容器底部形成一定厚度的含有银-pvp-前列腺特异性抗体-抗原复合纳米粒子固相物12和银-pvp-甲胎蛋白抗体-抗原复合纳米粒子固相物13的金属-包裹物-抗体-抗原复合纳米粒子固相物14。
3:拉曼光谱分析和检测过程为:
如图3所示,本发明提供了基于拉曼增强的金属-包裹物-抗体复合纳米粒子定量检测肿瘤标记物的装置,包括:载物台27、拉曼光谱激发光源29和光谱仪21,其中,拉曼光谱激发光源29位于载物台27下方;光谱仪21位于载物台27上方;
在所述的拉曼光谱激发光源29发射激光照射样品的光路中,设置有一个光束整形系统28。
在所述的光谱仪21的收集拉曼散射光的方向上依次设置有一个散射光聚集器25,滤光片24,耦合镜23和光纤22,所述的光纤22连接所述的光谱仪1和所述的耦合镜23。
把容器26垂直放在载物台上,开始进行透射拉曼光谱测量,拉曼光谱激发光源29使用1064nm激光激发源,激光功率700毫瓦。通过光束整形系统28使直径0.5毫米激光光斑照射到银-pvp-抗体-抗原复合纳米粒子固相物30上。透射拉曼散射光通过一个散射光聚集器25、滤光片24、耦合镜23和光纤22进入光谱仪。整个拉曼光谱积分时间为10秒,获得拉曼光谱。通过分析前列腺特异性抗原的特征峰1078cm-1的强度和甲胎蛋白的特征峰1589cm-1的强度,并比对标准分析物浓度所对应的拉曼光谱特征峰的强度,得到前列腺特异性抗原和甲胎蛋白浓度。
具体的,所述的光束整形系统28是焦距20mm的准直透镜;
具体的,所述的散射光聚集器25是一个焦距30mm直径25mm的非球面透镜;
具体的,所述的偶合镜23是一个焦距5mm直径10mm的非球面透镜;
具体的,所述的光纤2是一根直径100um的石英光纤;
表1是本发明检测血清前列腺特异性抗原和甲胎蛋白浓度结果。
前列腺特异性抗原(psa)血清正常值0-4ng/ml。psa敏感性高,所以定量测定psa可作为前列腺癌早期诊断的一个参考指标。当前列腺特异性抗原(psa)>10ng/ml,无论直肠指诊是否正常都应高度怀疑前列腺癌的可能。
甲胎蛋白一般通过抽血检查,最常用的检测方法为放射免疫法(正常值为0—25ng/ml),若超过25ng/ml为阳性,若在25-400ng/ml之间为低浓度阳性,超过400ng/ml即为高浓度阳性。80%原发性肝癌病人血清中甲胎蛋白升高。
使用表面增强透射拉曼光谱测量肿瘤标志物的浓度,准确性高,检测方法简便、快速,是一个非常有前景的肿瘤标志物浓度检测技术。
表1
尽管描述了本发明的优选实施例,但是对于本领域技术人员来说显而易见的是,在不脱离本发明的精神或范围的情况下,可以在本发明中进行各种修改和变化。因此,本发明旨在覆盖落入所附权利要求及其等同物的范围内的本发明的修改和变化。
- 还没有人留言评论。精彩留言会获得点赞!