基于磁分离的时间分辨荧光免疫分析方法与流程
本发明属于生物分析化学、纳米生物
技术领域:
,特别涉及一种基于磁分离的时间分辨荧光免疫分析分析方法。
背景技术:
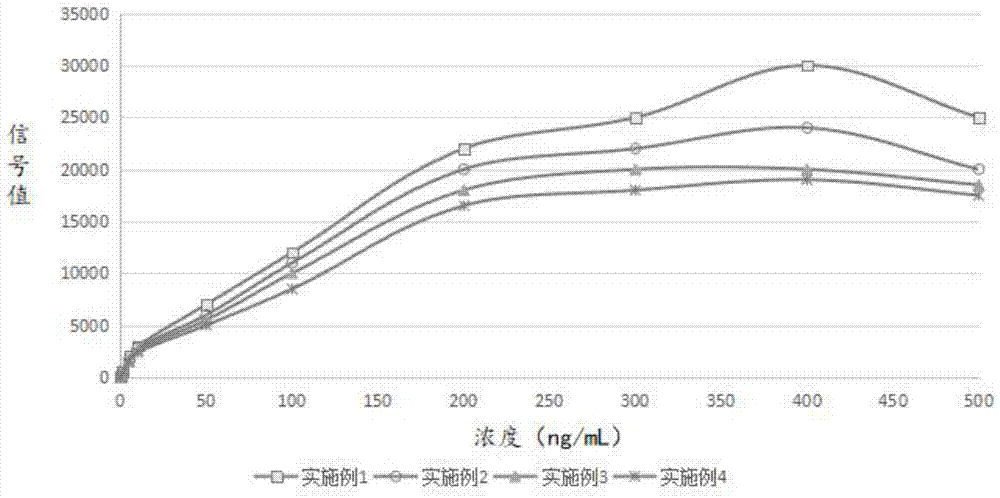
:临床对新蛋白指标的检测一般采用酶联免疫吸附测定法(elisa)。elisa一般灵敏度、检测范围均有所局限,且存在需要专业人员操作,步骤繁琐,耗时较长等缺陷。尤其对新指标的检测,缺乏数据的全面性,不能为临床医生提供精准的定量数据,对临床治疗的指导意义有所欠缺。化学发光免疫分析(clia),是将具有高灵敏度的化学发光测定技术与高特异性的免疫反应相结合,用于各种抗原、半抗原、抗体、激素、酶、脂肪酸、维生素和药物等的检测分析技术。是继放免分析、酶免分析、荧光免疫分析之后发展起来的一项免疫测定技术。clia与其它传统的标记技术相比有以下优点:第一,检测过程无放射性辐射,不会对人体有危害;第二,拥有较高的灵敏度和较宽的线性范围;第三,一般采用自动化仪器进行操作,无需专业操作人员,排除人为操作干扰,稳定性好;第四,该方法学应用场景广,可检测不同分子大小的抗原、半抗原和抗体,又可以用于核酸探针的检测。但clia的部分缺点限制了其在免疫诊断领域的应用发展,如:发光时效短,单个样品只能检测一次,有些项目本底较高且容易受环境物质干扰等。目前国内大部分在使用进口厂家的试剂,如罗氏、雅培、贝克曼等。时间分辨荧光免疫分析法(trfia)是目前与化学发光、电化学发光并驾齐驱的三种超敏免疫分析方法之一。其原理是采用较长荧光半衰期的稀土离子作标记物,由于这种标记物stokes位移大(>150nm)且荧光寿命比本底物质荧光寿命高5~6个数量级,因此,测定时只要延缓测量时间,待本底物质的荧光充分衰减后再测定标记物的信号就可有效地消除各种非特异性荧光的干扰,获得很高的灵敏度。技术实现要素:技术问题:为了解决现有技术的缺陷,本发明提供了一种基于磁分离的时间分辨荧光免疫分析分析方法。技术方案:本发明通过将磁珠与抗体偶联形成复合物,得到免疫磁珠;同时将时间分辨荧光微球与抗体偶联形成免疫荧光微球;两者与样本中抗原在反应管中经过震荡孵育后形成免疫磁珠-抗原-免疫荧光微球复合物;在360nm的激发光下发射出610nm的荧光,用时间分辨仪器测定其荧光强度;荧光强度与样品中的抗原浓度成正比,对照标准曲线即可确定样品中抗原的量。本发明提供的基于磁分离的时间分辨荧光免疫分析方法基于磁分离的时间分辨荧光免疫分析方法,包括以下步骤:步骤1:将磁珠活化后与单克隆抗体偶联,封闭,洗涤,得到免疫磁珠,保存待用;步骤2:将时间分辨荧光微球活化后与单克隆抗体偶联,封闭,洗涤,得到免疫荧光微球,保存待用;步骤3:用分析缓冲液分别稀释免疫磁珠和免疫荧光微球至适宜浓度,再向稀释后的免疫磁珠中依次加入待测抗原和稀释后的免疫荧光微球,将得到的混合液进行震荡孵育后得到免疫磁珠-抗原-免疫荧光微球复合物;步骤4:将免疫磁珠-抗原-免疫荧光微球复合物用洗涤液洗涤后,将其置于360nm的激发光下进行激发,用时间分辨荧光检测仪测定其发出的荧光强度;步骤5:根据标准品和荧光强度绘制标准曲线,由荧光强度和标准曲线确定待测抗原含量。作为一种优化方案:步骤3中所述免疫磁珠和免疫荧光微球均分别使用分析缓冲液按体积进行70倍稀释后使用,震荡孵育的温度和时间为室温5min。作为进一步优化方案:偶联抗体的磁珠粒径为100nm-5μm,表面修饰为羧基、羟基或链霉亲和素中的任意一种。作为进一步优化方案:偶联抗体的时间分辨荧光微球粒径为100nm-500nm,表面修饰为羧基、羟基或链霉亲和素中的任意一种。作为进一步优化方案:磁珠活化具体步骤为:加入nhs旋涡混合,再加入edc,旋涡混合;摇床100-500r/min,30-37℃反应10-30min;其中nhs:edc的质量浓度比为25:10。作为进一步优化方案:磁珠与单克隆抗体偶联具体步骤为:离心后去除上清,再加入超纯水,超声复溶,重复离心复溶两次,加入单克隆抗体,旋涡混合,摇床100-500r/min,30-37℃反应1-3h;磁珠与抗体的标记比例为(50-150):1。作为进一步优化方案:时间分辨荧光微球活化具体步骤为:加入nhs旋涡混合,再加入edc,旋涡混合;摇床100-500r/min,30-37℃反应10-30min;其中nhs:edc的质量浓度比为25:10;作为进一步优化方案:时间分辨荧光微球与单克隆抗体偶联具体步骤为:离心后去除上清,加入超纯水,超声复溶,重复离心复溶两次,加入单克隆抗体,旋涡混合,摇床100-500r/min,30-37℃反应1-3h;时间分辨荧光微球与抗体的标记比例为(50-150):1。作为进一步优化方案:分析缓冲液配方包括:10-50mmol/ltris-hcl、0.1-5%酪蛋白、1--5%bsa、0.01-1%proclin300、0.01%-1tween20、0.9%nacl,缓冲液调ph至7.2-7.4。作为进一步优化方案:洗涤液配方包括:10-50mmol/l的tris-hcl、0.01-1%的tween20和0.9%的nacl,缓冲液调ph至7.2-7.4。步骤3和步骤4的详细测定步骤为:在反应管中加入用分析缓冲液以体积比为1:70稀释的免疫磁珠100μl,然后加入待测物10μl,再加入用分析缓冲液以体积比为1:70稀释的时间分辨荧光微球标记抗体100μl;室温震荡孵育反应5min,运用磁性分离技术将免疫磁珠与上清分离并用洗涤液洗涤一次,最后每孔加入300μl分析缓冲液振摇后在时间分辨荧光检测仪上测定。有益效果:本发明提供的分析方法采用磁分离技术并结合时间分辨荧光微球技术,除拥有时间分辨荧光微球的灵敏度高、储存时间长、无放射性污染、标准曲线范围宽等诸多优点外,还通过免疫磁珠大大缩短反应时间,提高了检测的灵敏度。磁珠与抗体通过化学基团偶联,大大减少配对抗体用量以及提高检测的精密度。另外该技术容易实现自动化,克服了传统方法发光强度较弱且时间短的缺陷,实现了样本即时检测。附图说明图1为本发明实施例1-4的分析方法可测量的浓度范围示意图;图2为本发明实施例1-4的分析方法测量浓度的线性区间范围示意图;图3为本发明实施例1的分析方法在进行热破坏实验中荧光强度随时间变化幅度示意图;图4为本发明实施例1的分析方法与elisa分析方法的临床血样测值相关性示意图;图5为本发明生物化学反应原理示意图。具体实施方式下面结合附图和具体实施例,进一步阐明本发明,应理解这些实施例仅用于说明本发明而不用于限制本发明的范围,在阅读了本发明之后,本领域技术人员对本发明的各种等价形式的修改均落于本申请所附权利要求所限定的范围。由于本发明实施例的实验中,使用的抗体为抗cmybp-c抗体,所以实施例中所述的免疫磁珠全称为偶联抗cmybp-c抗体的磁珠;实施例中所述的免疫荧光微球全称为偶联抗cmybp-c抗体的时间分辨荧光微球。但是本发明一种基于磁分离的时间分辨荧光免疫分析方法基于磁分离的时间分辨荧光免疫分析方法,并不仅仅限于cmybp-c抗原的检测。实施例1本发明一种基于磁分离的时间分辨荧光免疫分析方法基于磁分离的时间分辨荧光免疫分析方法的具体操作步骤:步骤1:将磁珠活化后与单克隆抗体偶联,封闭,洗涤,得到免疫磁珠,保存待用;具体步骤如下:预处理:取1%固含量粒径为1μm表面羧基修饰的磁珠25μl于2ml进口离心管中,加入50mmol/lph6.0的mes溶液500μl,旋涡混合,15000rpm,10min,4℃离心,去除上清,加入50mmol/lph6.0的mes溶液500μl,超声复溶;活化:加入25mg/ml的nhs(50mmol/lph6.0的mes配置)2μl,旋涡混合,再加入10mg/ml的edc(50mmol/lph6.0的mes配置)2μl,旋涡混合,摇床250r/min,37℃反应15min;偶联:15000rpm,10min,4℃离心,去除上清,加入500μl超纯水,超声复溶,重复离心复溶两次,第三次复溶使用50mmol/lph8.0的hepes500μl;加入25μg抗心脏肌球蛋白结合蛋白c(cmybp-c)抗体,旋涡混合,摇床250r/min,37℃,反应2h;封闭:加入50μl封闭液(50mmol/lph8.0tris+10%bsa+0.1%t-20+0.1%proclin300),摇床250转,37℃,反应2h;洗涤:15000rpm,10min,4℃离心,去上清,500μl保存液(50mmol/lph8.0hepes+5%bsa+0.5%peg+0.1%t-20+0.1%proclin300)重悬,超声;保存待用:4℃保存。步骤2:将时间分辨荧光微球活化后与单克隆抗体偶联,封闭,洗涤,得到免疫荧光微球,保存待用;具体步骤如下:预处理:取1%固含量粒径为300nm表面羧基修饰的时间分辨微球25μl于2ml进口离心管中,加入50mmol/lph6.0的mes溶液500μl,旋涡混合,15000rpm,10min,4℃离心,去除上清。加入50mmol/lph6.0的mes溶液500μl,超声复溶;活化:加入25mg/ml的nhs(50mmol/lph6.0的mes配置)2μl,旋涡混合,再加入10mg/ml的edc(50mmol/lph6.0的mes配置)2μl,旋涡混合,摇床250r/min,37℃反应15min;偶联:15000rpm,10min,4℃离心,去除上清,加入500μl超纯水,超声复溶,重复离心复溶两次,第三次复溶使用50mmol/lph8.0的hepes500μl;加入25μg抗cmybp-c抗体,旋涡混合,摇床250r/min,37℃,反应2h;封闭:加入50μl封闭液(50mmol/lph8.0tris+10%bsa+0.1%t-20+0.1%proclin300),摇床250转,37℃,反应2h;洗涤:15000rpm,10min,4℃离心,去上清,500μl保存液(50mmol/lph8.0hepes+5%bsa+0.5%peg+0.1%t-20+0.1%proclin300)重悬,超声;保存待用:4℃保存。步骤3:用分析缓冲液分别稀释免疫磁珠和免疫荧光微球按体积进行70倍稀释,再向稀释后的免疫磁珠中依次加入待测抗原和稀释后的免疫荧光微球,将得到的混合液进行室温震荡孵育5min后得到免疫磁珠-抗原-免疫荧光微球复合物。步骤4:将上述步骤得到的免疫磁珠-抗原-免疫荧光微球复合物用洗涤液洗涤数次后,将其置于360nm激发光下进行激发,用时间分辨荧光检测仪测定其发出的荧光强度。步骤5:绘制标准曲线,由荧光强度和标准曲线确定待测抗原含量。所述各种溶液配制过程如下:校准品的配置:用含2%bsa及0.01%叠氮钠的50mmol/lph7.4pbs缓冲液,将cmybp-c抗原(南京金斯瑞生物科技有限公司生产)配制成0、1、5、10、100、500ng/ml系列浓度的校准溶液,备用。分析缓冲液的配置:在ph7.4、20mmol/ltris-hcl中,加入5%酪蛋白、1%bsa、0.1%proclin300、0.1%tween20、0.9%nacl,搅拌并充分溶解。洗涤液的配置:在ph7.4、10mmol/ltris-hcl溶液中、加入0.05%tween20、0.9%nacl,搅拌并充分溶解。保存液的配置:在50mmol/lph8.0hepes溶液中加入5%bsa、0.5%peg、0.1%t-20和0.1%proclin300搅拌并充分溶解。封闭液的配置:在50mmol/lph8.0tris溶液中加入质量浓度为10%的bsa、0.1%tween20、0.1%proclin300搅拌并充分溶解。准确度:根据《体外诊断试剂分析性能评估(准确度-回收实验)》中的方法及计算公式,用1ng/ml的校准品作为基质α,按照1∶9分别添加5、10、100ng/ml的抗原,检测浓度记为γ,添加浓度记为β,每个测试重复3次,求均值,按照公式:(90×β+10×α)/(100×γ)计算回收率,数据见表1所示。实施例2本发明一种基于磁分离的时间分辨荧光免疫分析分析方法的具体操作步骤:步骤1:将磁珠活化后与单克隆抗体偶联,封闭,洗涤,得到免疫磁珠,保存待用;具体步骤如下:预处理:取1%固含量粒径为2μm表面羧基修饰的磁珠25μl于2ml进口离心管中,加入20mmol/lph6.0的mes溶液500μl,旋涡混合,15000rpm,10min,4℃离心,去除上清,加入20mmol/lph6.0的mes溶液500μl,超声复溶;活化:加入15mg/ml的nhs(20mmol/lph6.0的mes配置)2μl,旋涡混合,再加入10mg/ml的edc(20mmol/lph6.0的mes配置)2μl,旋涡混合,摇床250r/min,37℃反应15min;偶联:15000rpm,10min,4℃离心,去除上清,加入500μl超纯水,超声复溶,重复离心复溶两次,第三次复溶使用20mmol/lph8.0的hepes500μl;加入50μg抗cmybp-c抗体,旋涡混合,摇床250r/min,37℃,反应2h;封闭:加入50μl封闭液(20mmol/lph8.0tris+10%bsa+0.1%t-20+0.1%proclin300),摇床250转,37℃,反应2h;洗涤:15000rpm,10min,4℃离心,去上清,500μl保存液(20mmol/lph8.0hepes+5%bsa+0.5%peg+0.1%t-20+0.1%proclin300)重悬,超声;保存待用:4℃保存。步骤2:将时间分辨荧光微球活化后与单克隆抗体偶联,封闭,洗涤,得到免疫荧光微球,保存待用;具体步骤如下:预处理:取1%固含量粒径为100nm表面羧基修饰的时间分辨微球25μl于2ml进口离心管中,加入20mmol/lph6.0的mes溶液500μl,旋涡混合,15000rpm,10min,4℃离心,去除上清,加入20mmol/lph6.0的mes溶液500μl,超声复溶;活化:加入15mg/ml的nhs(20mmol/lph6.0的mes配置)2μl,旋涡混合,再加入10mg/ml的edc(20mmol/lph6.0的mes配置)2μl,旋涡混合,摇床250r/min,37℃反应15min;偶联:15000rpm,10min,4℃离心,去除上清,加入500μl超纯水,超声复溶,重复离心复溶两次,第三次复溶使用20mmol/lph8.0的hepes500μl;加入50μg抗cmybp-c抗体,旋涡混合,摇床250r/min,37℃,反应2h;封闭:加入50μl封闭液(20mmol/lph8.0tris+1%bsa+0.1%t-20+0.1%proclin300),摇床250r/min,37℃,反应2h;洗涤:15000rpm,10min,4℃离心,去上清,500μl保存液(20mmol/lph8.0hepes+1%bsa+0.5%peg+0.1%t-20+0.1%proclin300)重悬,超声;保存待用:4℃保存。步骤3:用分析缓冲液分别稀释免疫磁珠和免疫荧光微球按体积进行70倍稀释,再向稀释后的免疫磁珠中依次加入待测抗原和稀释后的免疫荧光微球,将得到的混合液进行室温震荡孵育5min后得到免疫磁珠-抗原-免疫荧光微球复合物。步骤4:将上述步骤得到的免疫磁珠-抗原-免疫荧光微球复合物用洗涤液洗涤数次后,将其置于360nm激发光下进行激发,用时间分辨荧光检测仪测定其发出的荧光强度。步骤5:绘制标准曲线,由荧光强度和标准曲线确定待测抗原含量。所述各种溶液配制过程如下:校准品的配置:用含2%bsa及0.01%叠氮钠的20mmol/lph7.4tris缓冲液,将cmybp-c抗原(南京金斯瑞生物科技有限公司生产)配制成0、1、5、10、100、500ng/ml系列浓度的校准溶液,备用。分析缓冲液的配置:在ph7.4、20mmol/ltris-hcl中,加入1%酪蛋白、0.5%bsa、0.1%proclin300、0.1%tween20和0.9%nacl,搅拌并充分溶解。洗涤液的配置:在ph7.4、20mmol/ltris-hcl溶液中、加入0.05%tween20、0.9%nacl,搅拌并充分溶解。保存液的配置:在20mmol/lph8.0hepes溶液中加入1%bsa、0.5%peg、0.1%t-20和0.1%proclin300搅拌并充分溶解。封闭液的配置:在20mmol/lph8.0tris溶液中加入1%bsa、0.1%tween20、0.1%proclin300搅拌并充分溶解。准确度:根据《体外诊断试剂分析性能评估(准确度-回收实验)》中的方法及计算公式,用1ng/ml的校准品作为基质α,按照1∶9分别添加5、10、100ng/ml的抗原,检测浓度记为γ,添加浓度记为β,每个测试重复3次,求均值,按照公式:(90×β+10×α)/(100×γ)计算回收率,数据见表1所示。实施例3本发明一种基于磁分离的时间分辨荧光免疫分析分析方法的具体操作步骤:步骤1:将磁珠活化后与单克隆抗体偶联,封闭,洗涤,得到免疫磁珠,保存待用;具体步骤如下:预处理:取1%固含量粒径为500nm表面羟基修饰的磁珠25μl于2ml进口离心管中,加入50mmol/lph6.0的mes溶液500μl,旋涡混合,15000rpm,10min,4℃离心,去除上清,加入50mmol/lph6.0的mes溶液500μl,超声复溶;活化:加入25mg/ml的nhs(50mmol/lph6.0的mes配置)2μl,旋涡混合,再加入10mg/ml的edc(50mmol/lph6.0的mes配置)2μl,旋涡混合,摇床100r/min,30℃反应30min;偶联:15000rpm,10min,4℃离心,去除上清,加入500μl超纯水,超声复溶,重复离心复溶两次,第三次复溶使用50mmol/lph8.0的hepes500μl;加入25μg抗cmybp-c抗体,旋涡混合,摇床100r/min,30℃,反应3h;封闭:加入50μl封闭液(50mmol/lph8.0tris+10%bsa+0.1%t-20+0.1%proclin300),摇床250转,37℃,反应2h;洗涤:15000rpm,10min,4℃离心,去上清,500μl保存液(50mmol/lph8.0hepes+5%bsa+0.5%peg+0.1%t-20+0.1%proclin300)重悬,超声;保存待用:4℃保存。步骤2:将时间分辨荧光微球活化后与单克隆抗体偶联,封闭,洗涤,得到免疫荧光微球,保存待用;具体步骤如下:预处理:取1%固含量粒径为500nm表面羟基修饰的时间分辨微球25μl于2ml进口离心管中,加入50mmol/lph6.0的mes溶液500μl,旋涡混合,15000rpm,10min,4℃离心,去除上清。加入50mmol/lph6.0的mes溶液500μl,超声复溶;活化:加入25mg/ml的nhs(50mmol/lph6.0的mes配置)2μl,旋涡混合,再加入10mg/ml的edc(50mmol/lph6.0的mes配置)2μl,旋涡混合,摇床100r/min,30℃反应30min;偶联:15000rpm,10min,4℃离心,去除上清,加入500μl超纯水,超声复溶,重复离心复溶两次,第三次复溶使用50mmol/lph8.0的hepes500μl;加入25μg抗cmybp-c抗体,旋涡混合,摇床100r/min,30℃,反应3h;封闭:加入50μl封闭液(50mmol/lph8.0tris+10%bsa+0.1%t-20+0.1%proclin300),摇床250转,37℃,反应2h;洗涤:15000rpm,10min,4℃离心,去上清,500μl保存液(10mmol/lph7.0hepes+5%酪蛋白+0.5%peg+0.1%t-20+0.01%叠氮钠)重悬,超声;保存待用:4℃保存。步骤3:用分析缓冲液分别稀释免疫磁珠和免疫荧光微球按体积进行70倍稀释,再向稀释后的免疫磁珠中依次加入待测抗原和稀释后的免疫荧光微球,将得到的混合液进行室温震荡孵育5min后得到免疫磁珠-抗原-免疫荧光微球复合物。步骤4:将上述步骤得到的免疫磁珠-抗原-免疫荧光微球复合物用洗涤液洗涤数次后,将其置于360nm激发光下进行激发,用时间分辨荧光检测仪测定其发出的荧光强度。步骤5:绘制标准曲线,由荧光强度和标准曲线确定待测抗原含量。所述各种溶液配制过程如下:校准品的配置:用含2%酪蛋白及0.01%叠氮钠的50mmol/lph7.4pbs缓冲液,将cmybp-c抗原(南京金斯瑞生物科技有限公司生产)配制成0、1、5、10、100、500ng/ml系列浓度的校准溶液,备用。分析缓冲液的配置:在ph7.2、10mmol/ltris-hcl中,加入0.1%酪蛋白、5%bsa、0.01%proclin300、0.01%tween20、0.9%nacl,搅拌并充分溶解。洗涤液的配置:在ph7.2、50mmol/ltris-hcl溶液中、加入0.01%tween20、0.9%nacl,搅拌并充分溶解。保存液的配置:在50mmol/lph7.0hepes溶液中加入5%bsa、0.5%peg、0.1%t-20和0.1%proclin300搅拌并充分溶解。封闭液的配置:在10mmol/lph7.0pbs溶液中加入质量浓度为15%的酪蛋白、0.1%tween20、0.01%叠氮钠搅拌并充分溶解。准确度:根据《体外诊断试剂分析性能评估(准确度-回收实验)》中的方法及计算公式,用1ng/ml的校准品作为基质α,按照1∶9分别添加5、10、100ng/ml的抗原,检测浓度记为γ,添加浓度记为β,每个测试重复3次,求均值,按照公式:(90×β+10×α)/(100×γ)计算回收率,数据见表1所示。实施例4本发明一种基于磁分离的时间分辨荧光免疫分析分析方法的具体操作步骤:步骤1:将磁珠活化后与单克隆抗体偶联,封闭,洗涤,得到免疫磁珠,保存待用;具体步骤如下:预处理:取1%固含量粒径为5μm表面链霉亲和素修饰的磁珠25μl于2ml进口离心管中,加入20mmol/lph6.0的mes溶液500μl,旋涡混合,15000rpm,10min,4℃离心,去除上清,加入20mmol/lph6.0的mes溶液500μl,超声复溶;活化:加入15mg/ml的nhs(20mmol/lph6.0的mes配置)2μl,旋涡混合,再加入10mg/ml的edc(20mmol/lph6.0的mes配置)2μl,旋涡混合,摇床500r/min,35℃反应10min;偶联:15000rpm,10min,4℃离心,去除上清,加入500μl超纯水,超声复溶,重复离心复溶两次,第三次复溶使用20mmol/lph8.0的hepes500μl;加入50μg抗cmybp-c抗体,旋涡混合,摇床500r/min,35℃,反应1h;封闭:加入50μl封闭液(20mmol/lph8.0tris+10%bsa+0.1%t-20+0.1%proclin300),摇床250转,37℃,反应2h;洗涤:15000rpm,10min,4℃离心,去上清,500μl保存液(20mmol/lph8.0hepes+5%bsa+0.5%peg+0.1%t-20+0.1%proclin300)重悬,超声;保存待用:4℃保存。步骤2:将时间分辨荧光微球活化后与单克隆抗体偶联,封闭,洗涤,得到免疫荧光微球,保存待用;具体步骤如下:预处理:取1%固含量粒径为5μm表面链霉亲和素修饰的时间分辨微球25μl于2ml进口离心管中,加入20mmol/lph6.0的mes溶液500μl,旋涡混合,15000rpm,10min,4℃离心,去除上清,加入20mmol/lph6.0的mes溶液500μl,超声复溶;活化:加入15mg/ml的nhs(20mmol/lph6.0的mes配置)2μl,旋涡混合,再加入10mg/ml的edc(20mmol/lph6.0的mes配置)2μl,旋涡混合,摇床500r/min,37℃反应10min;偶联:15000rpm,10min,4℃离心,去除上清,加入500μl超纯水,超声复溶,重复离心复溶两次,第三次复溶使用20mmol/lph8.0的hepes500μl;加入50μg抗cmybp-c抗体,旋涡混合,摇床500r/min,37℃,反应1h;封闭:加入50μl封闭液(20mmol/lph8.0tris+1%bsa+0.1%t-20+0.1%proclin300),摇床250r/min,37℃,反应2h;洗涤:15000rpm,10min,4℃离心,去上清,500μl保存液(20mmol/lph8.0hepes+1%bsa+0.5%peg+0.1%t-20+0.1%proclin300)重悬,超声;保存待用:4℃保存。步骤3:用分析缓冲液分别稀释免疫磁珠和免疫荧光微球按体积进行70倍稀释,再向稀释后的免疫磁珠中依次加入待测抗原和稀释后的免疫荧光微球,将得到的混合液进行室温震荡孵育5min后得到免疫磁珠-抗原-免疫荧光微球复合物。步骤4:将上述步骤得到的免疫磁珠-抗原-免疫荧光微球复合物用洗涤液洗涤数次后,将其置于360nm激发光下进行激发,用时间分辨荧光检测仪测定其发出的荧光强度。步骤5:绘制标准曲线,由荧光强度和标准曲线确定待测抗原含量。所述各种溶液配制过程如下:校准品的配置:用含2%bsa及0.01%叠氮钠的20mmol/lph7.4tris缓冲液,将cmybp-c抗原(南京金斯瑞生物科技有限公司生产)配制成0、1、5、10、100、500ng/ml系列浓度的校准溶液,备用。分析缓冲液的配置:在ph7.4、20mmol/ltris-hcl中,加入1%酪蛋白、0.5%bsa、1%proclin300、1%tween20和0.9%nacl,搅拌并充分溶解。洗涤液的配置:在ph7.4、20mmol/ltris-hcl溶液中、加入1%tween20、0.9%nacl,搅拌并充分溶解。保存液的配置:在20mmol/lph8.0hepes溶液中加入1%bsa、0.5%peg、1%t-20和1%proclin300搅拌并充分溶解。封闭液的配置:在20mmol/lph9.0tris溶液中加入1%bsa、1%tween20、1%proclin300搅拌并充分溶解。检定实施例1-4的分析方法的准确度:根据《体外诊断试剂分析性能评估(准确度-回收实验)》中的方法及计算公式,用1ng/ml的校准品作为基质α,按照1∶9分别添加5、10、100ng/ml的抗原,检测浓度记为γ,添加浓度记为β,每个测试重复3次,求均值,按照公式:(90×β+10×α)/(100×γ)计算回收率,数据见表1所示。表1:不同抗原添加浓度得到的回收率数据由以上数据可见,本发明提供的分析方法能够有效的对抗原进行测定,且实施例1中的数据显示了该分析方法的准确度可以达到较高的水平。将实施例1-4所述的分析方法进行性能评估:可测量范围和线性区间的评估用含2%bsa及0.01%叠氮钠的50mmol/lph7.4pbs缓冲液,将抗原(南京金斯瑞生物科技有限公司生产)配制成0、1、5、10、50、100、200、300、400、500ng/ml系列浓度的校准溶液。每个浓度重复测试3次,5min时,使用荧光分析仪读取数值;如图1所示,实施例1的分析方法可测量范围在(0-400ng/ml);实施例2的分析方法的测量范围在(0-400ng/ml);实施例3的分析方法可测量范围在(0-300ng/ml);实施例4的分析方法可测量范围在(0-300ng/ml);由以上测量数据可得出,本发明分析方法的可测量范围在0-400ng/ml;如图2所示,实施例1的分析方法线性区间在(0-200ng/ml);实施例2的分析方法线性区间在(0-200ng/ml);实施例3的分析方法线性区间在(0-200ng/ml);实施例4的分析方法线性区间在(0-200ng/ml);由以上测量数据可得出,本发明分析方法的线性区间在0-200ng/ml。重复性的评估将实施例1-4所述的分析方法分别测定5、10、100ng/ml浓度下的校准品,重复测定15次,计算其均值(m)、标准差(s)和变异系数(cv),数据如表2所示;计算公式为:cv=s/m×100%;式中:cv:变异系数;s:15次测定结果的标准差;m:15次测定结果的平均值。表2:不同浓度校准品测定多次后得出的均值(m)、标准差(s)和变异系数(cv)加速稳定性的评估选取实施例1进行加速稳定性评估:在37℃环境中对实施例1中的同一批试剂做持续20d(天)的热破坏实验,以检测持续高温下本发明方法的结果准确性;分别在0d、1d、3d、5d、10d、15d、20d时做检测,每个测试重复3次,并求均值;计算测定各浓度值的荧光强度变化幅度,计算公式△(0d-nd)/0d。由图3可见,本分析方法稳定性优良,可保证长期稳定性。特异性的评估取ctni、ctnt、ctnc、myo、ck-mb各指标的50ng/ml溶液加样测试本发明实施例1-4的分析方法得到的试剂盒,均不应该产生信号;经测试,以上类似物均未对本发明实施例1-4的分析方法本身产生阳性反应,故本分析方法特异性较好。正常值范围值的评估用本发明实施例1的分析方法对201例健康查体者(男103例,年龄5~75岁;女98例,年龄6~77岁)血清的水平检测表明,最低值为0ng/ml,最高值为116ng/ml,平均浓度为5ng/ml,如下表3所示,最适cutoff值为>0.5ng/ml(灵敏度86.36%,特异性100%);用本发明实施例2的分析方法对201例健康查体者(男103例,年龄5~75岁;女98例,年龄6~77岁)血清的水平检测表明,最低值为0ng/ml,最高值为(112)ng/ml,平均浓度为(5)ng/ml,如下表3所示,最适cutoff值为>(0.5)ng/ml(灵敏度(85.23)%,特异性100%);用本发明实施例3的分析方法对201例健康查体者(男103例,年龄5~75岁;女98例,年龄6~77岁)血清的水平检测表明,最低值为0ng/ml,最高值为(104)ng/ml,平均浓度为(5)ng/ml,如下表3所示,最适cutoff值为>(0.5)ng/ml(灵敏度(80.41)%,特异性100%);用本发明实施例4的分析方法对201例健康查体者(男103例,年龄5~75岁;女98例,年龄6~77岁)血清的水平检测表明,最低值为0ng/ml,最高值为(106)ng/ml,平均浓度为(5)ng/ml,如下表3所示,最适cutoff值为>(0.5)ng/ml(灵敏度81.78%,特异性100%),建议采用本试剂检测时,血清水平的正常参考值范围应定为0-0.5ng/ml。表3:本发明实施例1-4的分析方法cutoff值的确定数据临界值灵敏度特异性约登指数实施例1>0.586.36%100.00%0.8636实施例2>0.585.23%100.00%0.8523实施例3>0.580.41%100.00%0.8041实施例4>0.581.78%100.00%0.8178本发明分析方法在实际检测时,具体操作过程如下:步骤1:样本准备使用肝素钠采血管,采静脉血2ml,3000转离心5min,取上清加样;血清样品在2-8℃可以保存3天,如果需要长期保存,请在-80℃保存,避免反复冻融;样品运输需要保证冷藏状态下的冷链运输。步骤2:试剂准备所有试剂使用前,室温存放30min,恢复室温;试剂加样前,应震荡混匀。步骤3:加样检测在反应管中加入用分析缓冲液以体积比为1:70稀释的免疫磁珠100μl,然后加入校准品10μl,再加入用分析缓冲液以体积比为1:70稀释的免疫荧光微球100μl;室温震荡孵育反应15min,运用磁性分离技术将免疫磁珠与上清分离并用洗涤液洗涤一次,最后每孔加入300μl分析缓冲液振摇后在时间分辨荧光检测仪上测定。本发明分析方法与elisa方法临床血样测值比较选取实施例1的分析方法和自制elisa方法同时对100份血清样本进行检测。以实施例1测定血样的浓度结果为横坐标,以自制elisa方法的浓度结果为纵坐标做回归分析,相关方程为:y=1.0178x-0.6763,相关系数r2=0.9993,如图4所示,实施例1的分析方法与自制elisa方法的临床血样测值具有显著相关性。时间分辨荧光微球作为一种特殊的功能微球,每个微球中可包裹成千上万个荧光分子,大大提高了荧光的标记效率,有效提高了分析灵敏度;如图5所示,荧光微球表面修饰有合适密度的羧基或其它功能基团,用于与蛋白或抗体的共价偶联,提高了标记物的稳定性。更为重要的是由于微球包埋的稀土离子已经螯合,无需解离增强步骤;将时间分辨荧光微球用于微孔板/管式超敏定量检测技术平台,只需洗涤几次后即可进行荧光测定,操作步骤比解离增强镧系元素荧光免疫分析(delfia)简单很多,更容易实现自动化操作。免疫磁珠是近年发展起来的一项新的免疫学技术,它将固化试剂特有的优点与免疫学反应的高度特异性结合于一体,运用核-壳的合成方法合成含有超顺磁性物质的高分子表面覆盖的复合材料、稳定性好、能进行后期标记的物质,利用这些物质表面的功能集团如氨基、羧基、巯基等进行抗体的共价或者非共价偶联,可用于结合相应的抗原或抗体,这样在外加磁场的吸引下可做定向移动,从而达到分离,检测,纯化基因、蛋白质、细胞、微生物等的目的,其在免疫检测、细胞分离、生物大分子纯化和分子生物学等方面得到了越来越广泛的应用。磁珠与传统的微孔板相比具有以下的特点:表面积更大,能结合更多的蛋白分子,可以通过共价键与探针分子连接,比聚苯乙烯为材料的微孔板的物理吸附作用更牢固,是一种小型的、流动的固相载体,使反应能更快的达到动态平衡,从而加快反应速度。表面结合的密度高,使荧光信号更集中,可以和不同的探针分子结合,使检测同一样本中不同的待测物成为可能。磁珠的外观和包被过程的灵活性更大,可以根据不同的实验要求进行选择。磁珠的上述特点与时间分辨荧光微球结合后可以减少反应所需的样本量,加快反应时间,易自动化。目前免疫磁珠在化学发光免疫分析、核酸提取等领域已有广泛的应用,时间分辨荧光微球在免疫层析方向有较多的研究,但基于免疫磁珠结合时间分辨荧光微球在发光平台进行免疫分析检测心脏标志物尚无文献报道。本发明根据上述原理进行研究,获得了稳定的校准品及其稀释液,保证检测的可靠性,完善了免疫磁珠和时间分辨荧光微球的抗体标记工艺,可获得高活性、高荧光强度、易分离清洗的标记物和反应体系,使得检测方法简便、效率高、成本低、质量可靠。本发明公开了基于上述探索试验得到的各种试剂配方,包括:洗涤液配方、分析缓冲液配方,进一步公开了时间分辨微球标记抗体及免疫磁珠的制备过程。本发明的分析方法采用磁分离技术并结合时间分辨荧光微球技术,除拥有时间分辨荧光微球的灵敏度高、储存时间长、无放射性污染、标准曲线范围宽等诸多优点外,还通过免疫磁珠的富集作用以及磁珠在液体中充分扩散使得结合表面积扩大,大大缩短反应时间,提高检测灵敏度。磁珠与抗体通过化学基团偶联,大大减少配对抗体用量以及提高检测的精密度。另外本发明的技术容易实现自动化,克服了传统方法发光强度较弱且时间短的缺陷,实现了样本即时检测。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1