一种同时检测四环素类、林可霉素、氟苯尼考抗生素残留量的方法与流程
本发明属于药物残留检测技术,特别是涉及一种同时检测四环素类、林可霉素、氟苯尼考抗生素残留量的方法。
背景技术:
抗生素作为一种能够杀灭或抑制病原微生物的物质,广泛存在于人们的日常生活中。抗生素在很多产业有着大量的应用,比如乳制品业、养殖业、食品加工业等。随着这些产业的飞速发展,不可避免地导致了抗生素在食品中残留和存在抗生素滥用的现象。因此检测抗生素的残留量也变的很有意义。
目前,常见的抗生素残留包括四环素类、林可霉素、氟苯尼考等。四环素类(tetracycline,tc)是一种广谱高效的抗菌药物,广泛应用于革兰阳性和阴性细菌、细胞内支原体、衣原体和立克次氏体引起的感染,还被大量用作生长促进剂投喂给动物。林可霉素(lincomycin,lcm),是林可链霉菌发酵产生的林可酰胺类抗生素。林可霉素抑制细菌的蛋白质合成,对大多数革兰阳性菌和某些厌氧的革兰阴性菌有抗菌作用。氟苯尼考通过抑制肽酰基转移酶活性而产生广谱抑菌作用,包括各种革兰氏阳性、阴性菌和支原体等。研究证明如果在畜禽饲料中长期添加抗生素类促生长剂,可诱导某些茵群产生一定程度的耐药性。因此抗生素在食品中残留问题引起各国的广泛关注,对于这些抗生素的检测方法也有很多种,例如微生物法、高效液相色谱、免疫学法等。
微生物法其测定原理是根据抗生素对微生物的生理机能、代谢等的抑制作用,来定性或定量确定样品中抗微生物药物残留,如纸片法(pd)、试纸法(stop)等。这种方法的优点是费用低,一般实验室都能操作。缺点是时间长,显色状态判断通过肉眼判别易产生误差,对微量残留无法做出正确判断,特异性不够且操作复杂。液相色谱法、液相色谱-质谱联用法、气相色谱法等,这些方法的优点是能进行定性、定量的检测,具有较高的灵敏度,但缺点是前处理复杂,需要很高的成本,并且对于操作人员的技术要求也比较高,也无法做到快速检测,目前也没有相关的方法可以同时检测四环素类、林可霉素和氟苯尼考抗生素。酶联免疫分析法(elisa)作为一种快速、方便、低成本、高通量的筛选手段是近年来发展起来的检测动物源性食品中的抗生素残留的一种方法,但是一次实验没法同时检测多种抗生素残留。
技术实现要素:
本发明所要解决的技术问题是针对现有技术的不足,提供一种利用可视化蛋白芯片分析技术对待测样品中四环素类、林可霉素、氟苯尼考抗生素残留含量的同时检测方法。
为了解决上述技术问题,本发明采取的技术方案如下:
一种同时检测四环素类、林可霉素、氟苯尼考抗生素残留量的方法,包括如下步骤:
(1)制备蛋白芯片:将四环素类人工抗原、林可霉素人工抗原、氟苯尼考人工抗原在芯片载体上进行点样操作,恒温孵育固定,加入封闭剂继续恒温孵育,然后洗涤拍干;
(2)特异性结合反应:取步骤(1)制备所得蛋白芯片,向所有孔板内加入四环素类抗体、林可霉素抗体和氟苯尼考抗体的混合抗体进行反应;然后向部分反应孔内加入不同浓度梯度的混合标准品,剩余反应孔内加入待检测样品;再向所有孔板内加入纳米银标记的羊抗鼠igg,贴上盖板膜后恒温振荡孵育,孵育完成后洗涤拍干;
(3)显色反应:向步骤(2)孵育后的孔板内加入纳米银增强显色液,恒温振荡孵育,然后用超纯水洗涤拍干;
(4)处理分析:利用可视化生物芯片扫描仪对步骤(3)处理后的蛋白芯片进行扫描,并利用芯片分析软件进行结果处理分析。
进一步地,步骤(1)中,所述四环素类人工抗原、林可霉素人工抗原、氟苯尼考人工抗原是分别将四环素类,林可霉素,氟苯尼考小分子化合物通过共价键偶联到大分子上,所述大分子为牛血清白蛋白、鸡卵清白蛋白、血蓝蛋白或者高分子聚合物。
优选地,四环素类小分子化合物与大分子共价键偶联方法采用戊二醛法;林可霉素、氟苯尼考小分子化合物与大分子共价键偶联方法采用丁二酸酐法。
步骤(1)中,所述芯片载体采用微孔板、玻片、膜或者高分子片基,制备四环素类、林可霉素、氟苯尼考抗生素人工抗原矩阵,每样重复1-10个点。
所述四环素类人工抗原、林可霉素人工抗原、氟苯尼考人工抗原的固定浓度为1:1-1:100稀释,点样量为10-100nl/点。
步骤(2)中,所述混合抗体和纳米银标记的羊抗鼠igg每孔加入量为10-100μl,混合抗体浓度范围为1:10000-1:320000稀释,纳米银标记的羊抗鼠igg浓度范围为1:2-1:128稀释;所述混合标准品和待检测样品每孔加入量为10-100μl,混合标准品浓度范围为0.1-5ng/ml。
步骤(3)中,所述纳米银增强显色液由显色液a和显色液b按体积比1:1混合得到,现配现用,用量为10-100μl/孔。
优选地,步骤(1)恒温孵育条件为保持4-37℃孵育0.5-16h;步骤(2)和(3)恒温振荡孵育条件为保持4-37℃孵育5-60min。
优选地,步骤(1)和步骤(2)中,所述洗涤是指采用洗涤液洗涤2-4次,每次10-15s;步骤(3)中,所述洗涤是指采用超纯水洗涤2-4次,每次10-15s。
上述待检测样品为乳制品、饲料、尿液、动物组织、血清、蜂蜜、蜂皇浆、鸡蛋或水产品。
本发明采用间接竞争法反应原理,将四环素类、林可霉素、氟苯尼考的人工抗原以微阵列形式固定于微孔板底部,制备成微孔板生物芯片阵列,并依次与四环素类、林可霉素、氟苯尼考抗体和不同的标准品或样品反应,最后用银增强显色,并采用可视化芯片扫描仪对微孔板显色结果进行快速扫描成像,图像采用芯片分析软件处理。
有益效果:
相比较于现有技术,本发明方法采用固定制备的人工抗原和标记抗体的方法,极大地减短了检测时间,提高了灵敏度,实验操作简单,提高了检测效率,对四环素类、林可霉素、氟苯尼考药物残留分析方法研究具有重要意义和很好的应用推广价值,为食品中四环素类、林可霉素、氟苯尼考的残留检测提供一定的参考。解决了目前仪器方法要求样品前处理复杂,检测成本高昂,对于操作人员的技术要求也比较高,同时无法做到快速检测,并且目前也没有相关的仪器方法可以同时检测四环素类、林可霉素和氟苯尼考抗生素。
通过本发明方法检测四环素类、林可霉素、氟苯尼考的加标回收率分别在70%~120%之间,且相对标准偏差均在15%以内,能够用于四环素类、林可霉素、氟苯尼考药物的残留的同时快速初筛。同时用建立的方法应用于未知饲料样品的检测,结果与hplc-ms的方法一致,相关系数均大于0.99。
附图说明
下面结合附图和具体实施方式对本发明做更进一步的具体说明,本发明的上述和/或其他方面的优点将会变得更加清楚。
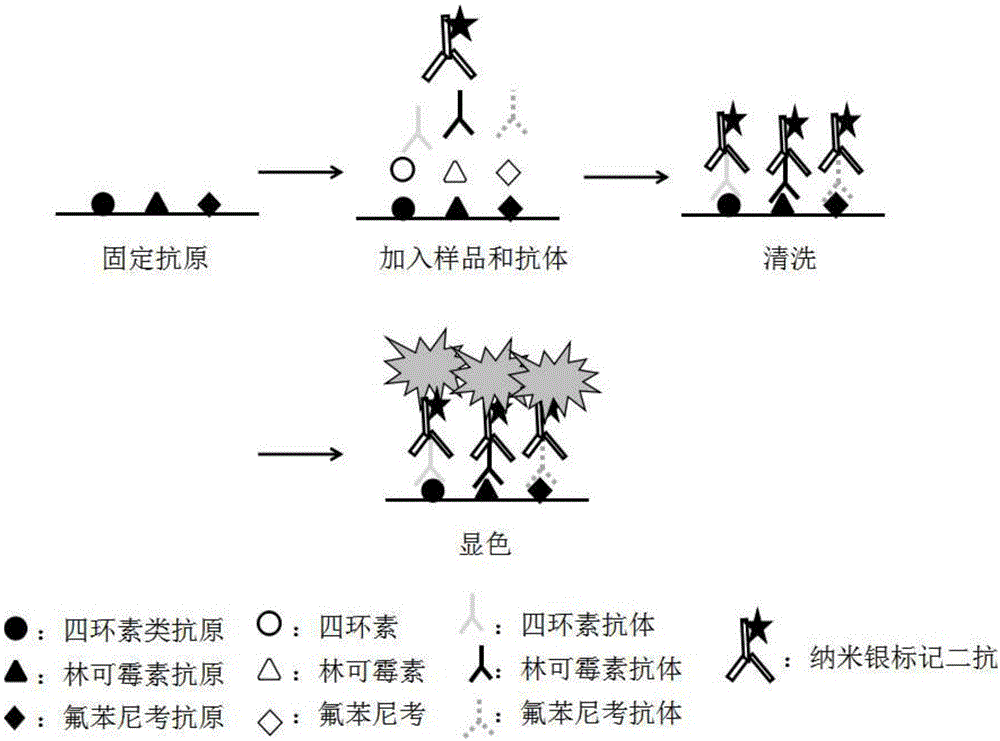
图1是本申请检测原理示意图;
图2是人工抗原合成路线图(a.四环素类b.林可霉素c.氟苯尼考);
图3是人工抗体偶联前后的紫外光谱图(a.四环素类b.林可霉素c.氟苯尼考);
图4是可视化蛋白芯片法检测饲料中四环素类、林可霉素、氟苯尼考的结果扫描图;注:从上往下,从左往右依次为:标准品1-6,阴性样本1及加标浓度1和2,阴性样本2及加标浓度1和2。
图5是可视化蛋白芯片法与hplc-ms法结果对照图(a.四环素类b.林可霉素c.氟苯尼考)。
具体实施方式
根据下述实施例,可以更好地理解本发明。
实施例所需试剂和设备来源:
四环素(美国amresco有限公司);林可霉素(上海阿拉丁试剂有限公司);氟苯尼考(上海阿拉丁试剂有限公司);牛血清白蛋白(美国sigma公司);丙酮(ar,上海凌峰化学试剂有限公司);二甲基亚砜(南京化学试剂股份有限公司);无水吡啶(南京化学试剂股份有限公司);25%戊二醛(ar,南京化学试剂股份有限公司);1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(上海阿拉丁试剂有限公司);n-羟基琥珀酰亚胺(上海阿拉丁试剂有限公司);氯化钠(ar,南京化学试剂股份有限公司);氯化钾(ar,南京化学试剂股份有限公司);无水磷酸氢二钠(ar,南京化学试剂股份有限公司),无水磷酸二氢钾(ar,南京化学试剂股份有限公司),微量测试孔(南京祥中生物科技有限公司);四环素、林可霉素、氟苯尼考抗体,纳米标记的羊抗小鼠-igg(南京祥中生物科技有限公司);显色液a、显色液b(南京祥中生物科技有限公司)。
dt系列电子天平(江苏省常熟市意欧仪器仪表有限公司);dmt-2500多管漩涡混合仪(上海柯淮仪器有限公司);摇床(海门市其林贝尔仪器制造公司);紫外可见分光光度计(日本岛津,uv-2401pc);微孔板恒温振荡仪(南京祥中生物科技有限公司);hx-4拍打式均质器(上海沪析实业有限公司);洗板机(南京祥中生物科技有限公司);芯片分析仪(南京祥中生物科技);聚苯乙烯离心管(1.5ml,2ml)(美国axygen),带盖离心管(15ml,50ml)(美国,corning);单道可调移液器(0.5-10μl,5-50μl,20-200μl,100-1000μl)(芬兰百得,genex)。
检测方法:用生物芯片点样仪将各抗生素人工抗原以微阵列的形式固定于微孔板的底部,每样重复3个点。经固定,封闭后。在每孔中分别加入混合抗体和混合标准品或样品,接着在每个孔内加入纳米标记的羊抗鼠igg,置于恒温振荡仪中反应,待反应结束后进行洗板并拍干。最后在每个孔里加入显色液(显色液a和b1:1混合),待反应结束后进行洗板并拍干。吹干后即可进行芯片扫描,并利用芯片分析软件进行数据分析及处理。随着样品浓度增高,抗体和固定抗原结合的越少,信号值越低。所以样品浓度和检测信号值呈负相关。检测原理示意图见图1。
实施例1
制备人工抗原:
(1)四环素类人工抗原制备
称取5.0mg盐酸四环素溶于100μlpbs缓冲溶液中,记为a液;称取10mgbsa溶于1mlpbs缓冲溶液中,记为b液;将a液缓慢加入到b液中,混合均匀。随后,再滴加10μl的25%戊二醛溶液,混合均匀,置于4℃的环境中反应12小时。反应结束后用pbs透析,每隔三小时换一次透析液,透析时间为2天。透析后的溶液4℃,5000rpm离心10min,4℃保存备用。制备合成路线如下图2-a所示。
(2)林可霉素人工抗原制备
称取4.5mg盐酸林可霉素溶于200μl无水吡啶中,记为a液;称取1mg琥珀酸酐溶于50μl无水吡啶中,记为b液;将a液缓慢加入到b液中,混合均匀,置于摇床上常温反应2小时。反应结束后氮吹至干,接着加入100μldmso溶解,分别加入溶于200μlpbs缓冲溶液中的4mg碳二亚胺(edc)和溶于100μlpbs缓冲溶液中的2mgn-羟基琥珀酰亚胺(nhs),混合均匀,置于摇床上常温反应1小时。反应结束后,加入溶解在1mlpbs缓冲溶液中的10mg牛血清白蛋白(bsa),混合均匀,置于4℃反应12小时。反应结束后用pbs透析,每隔三小时换一次透析液,透析时间为2天。透析后的溶液4℃,5000rpm离心10min,4℃保存备用。制备合成路线如下图2-b所示。
(3)氟苯尼考人工抗原制备
称取5mg氟苯尼考溶于100μl丙酮中,记为a液;称取4mg琥珀酸酐溶于100μl丙酮中,记为b液;将a液缓慢加入到b液中,再加入3μl的无水吡啶,混合均匀,置于摇床室温反应2小时。反应结束后氮吹至干,接着加入100μldmso溶解,分别加入溶于150μlpbs缓冲溶液中的3mg碳二亚胺(edc)和溶于100μlpbs缓冲溶液中的2mgn-羟基琥珀酰亚胺(nhs),混合均匀,置于摇床上室温反应1小时。反应结束后,加入溶解在1mlpbs缓冲溶液中的10mg牛血清白蛋白(bsa),混合均匀,置于4℃反应12小时。反应结束后用pbs透析,每隔三小时换一次透析液,透析时间为2天。透析后的溶液4℃,5000rpm离心10min,4℃保存备用。制备合成路线如下图2-c所示。
合成的人工抗原通过紫外分光光度法在200-400nm波长范围内进行扫描。由图3可知,在pbs缓冲液中,bsa的最大吸收波长是280nm,在300-400nm之间几乎无吸收,tc在275nm和365nm处有最大吸收,偶联后的四环素人工抗原的紫外光谱图有明显的叠加的特征,并且相同浓度的四环素人工抗原和bsa的紫外光谱图相比,吸光度明显增加,推其原因可能就是四环素和bsa偶联导致其吸光度增加。林可霉素的最大吸收波长在210nm,230nm之后几乎无吸收,林可霉素和bsa偶联后人工抗原的紫外光谱图与bsa和林可霉素相比发生了变化,既有bsa的紫外吸收特征,也具备林可霉素的紫外吸收特征,表明林可霉素与bsa已经偶联成功。氟苯尼考的最大吸收波长在265nm,与bsa偶联后的氟苯尼考最大吸收波长是275nm,与bsa相比发生了蓝移。表明氟苯尼考与bsa已经偶联成功。
实施例2
一种同时检测四环素类、林可霉素、氟苯尼考抗生素残留量的方法:
(1)蛋白芯片的制备:用生物芯片点样仪在96微孔板上制备矩阵,分别按顺序点四环素类、林可霉素、氟苯尼考人工抗原,点样量为50nl/点,每样分别重复3个点;点样结束后,放于37℃恒温箱里孵育2h,使抗体固定于板底;每孔加入200μl芯片封闭剂(bsa),放于37℃恒温箱里孵育2h,然后用洗涤缓冲液洗涤3次,每次10s,拍干,置于4℃冰箱待用;
(2)在步骤(1)制备好的孔板内每孔分别加入25μl四环素类、林可霉素、氟苯尼考抗体和不同浓度梯度的混合标准品或样品,再每孔加入25μl纳米银标记羊抗鼠igg,贴上盖板膜,放于37℃恒温孔板振荡仪里孵育30min,然后用洗涤液洗涤3次,每次15s,拍干;
(3)在步骤(2)处理后的芯片每孔中加入50μl的纳米银增强显色液,放入37℃恒温孔板振荡仪孵育12min,然后用超纯水洗3次,每次15s,拍干;
(4)利用可视化生物芯片扫描仪对步骤(3)处理后的蛋白芯片进行扫描,并利用芯片分析软件进行结果处理分析。
抗体抗原条件优化:
在免疫反应中,方法的灵敏度和抗原抗体的浓度有很大的关系,所以要优先优化抗原抗体的浓度。四环素类、林可霉素、氟苯尼考抗原的浓度分别均为:1:3,1:10,1:30;抗体浓度分别为:1:40000,1:80000,1:160000。综合考虑方法的灵敏度和检测范围,最后检测的信号值希望达到40000左右。因此,选择四环素类抗原浓度为:1:10,抗体浓度为:1:80000;林可霉素抗原浓度为:1:10,抗体浓度为:1:160000;氟苯尼考抗原浓度为:1:3,抗体浓度为:1:80000。
实施例3
抗体的特异性实验
在免疫反应中,主要利用抗原和抗体的特异性识别原理进行检测。因此在检测之前要考察方法的特异性。抗体的特异性通常使用竞争抑制曲线来判断交叉反应速率。使用不同浓度的被测物和干扰物作为竞争抑制曲线来计算它们各自的结合比(b/b0),并计算它们各自的ic50。根据下式(1)计算交叉反应率。
cr=[ic50(分析物)/ic50(干扰物)]×100%(1)
ic50是分析物或干扰物诱导信号抑制(b/b0)50%所必需的浓度。
用间接竞争法分别考察四环素类、林可霉素、氟苯尼考抗体与被测抗生素及其同类抗生素的交叉反应性,计算交叉反应率。蛋白芯片法检测时各种药物交叉反应率如表1:
表1各种药物交叉反应率
由表可知,四环素类抗体与四环素类药物之间有交叉,交叉反应率在58%~100%之间,说明四环素类抗体可以同时检测四环素、金霉素、土霉素、多西环素抗生素。与喹诺酮类、林可霉素、氟苯尼考、甲砜霉素、氯霉素之间的交叉反应率都小于1%,因此说明四环素的抗体特异性好,与其他类抗生素无交叉反应。此外,林可霉素、氟苯尼考抗体的特异性也很好,与其他抗生素均无交叉反应。因此,可以用蛋白芯片法同时进行检测,特异性好。
实施例4
四环素类、林可霉素、氟苯尼考的标准曲线的建立:
探索四环素类、林可霉素、氟苯尼考的标准曲线采用间接竞争法。每个抗原点3个阵列点,信号值取其平均值。在一定范围内,随着竞争标准品浓度的增加,固定的抗原结合的抗体含量会越少,因而检测到的信号值就会越低,超过一定的浓度范围后,检测信号值不随竞争标准品浓度的增加而变化。用四环素、林可霉素、氟苯尼考的标准溶液进行竞争抑制实验,结果如表2所示。
表2四环素类、林可霉素、氟苯尼考的线性回归方程、相关系数、线性范围
结果表明,四环素类、林可霉素、氟苯尼考的标准曲线线性关系很好,可以用于定量。
实施例5
饲料样品的加标回收率:
从不同市场上买来不同来源的饲料,挑选出hplc检测结果为阴性的2个样本进行加标。每个样本每个加标浓度各做3份,检测时每个份做复孔检测。按照样本前处理方法处理后的样本相当于被稀释了50倍。加标浓度和检测结果如表3-1至3-3所示,图4为检测单次实验检测结果扫描图。
表3-1四环素加标样品浓度和回收率
表3-2林可霉素加标样品浓度和回收率
表3-3氟苯尼考加标样品浓度和回收率
由表3-1,表3-2,表3.3可知,四环素类、林可霉素、氟苯尼考的样本加标回收率均在80%-120%之间。说明可视化蛋白芯片法的准确度较高,可以应用于饲料中四环素类、林可霉素、氟苯尼考的检测。
实施例6
可视化微阵列方法和hplc-ms法对照:
用可视化蛋白芯片法和hplc-ms分别检测市场上采购的24种不同来源饲料样本中的四环素类、林可霉素、氟苯尼考的含量,检测结果如图5所示。
由对比结果可知,可视化蛋白芯片法与hplc-ms法的线性关系和相关系数分别为:四环素类:y=1.0057x-0.8194,r2=0.9934;林可霉素:y=1.0201x+0.4012,r2=0.9966;氟苯尼考:y=1.1657x+0.1606,r2=0.9902。说明可视化蛋白芯片法可以同时用来检测饲料中四环素、林可霉素、氟苯尼考的含量,且结果准确。
本发明提供了一种同时检测四环素类、林可霉素、氟苯尼考抗生素残留量的方法的思路及方法,具体实现该技术方案的方法和途径很多,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。本实施例中未明确的各组成部分均可用现有技术加以实现。
- 还没有人留言评论。精彩留言会获得点赞!