多指标联用比较固定化链亲和素分离性能的方法与流程
本发明属于生物技术领域,涉及定量表征固定化链亲和素亲和分离性能的指标及其测定方法,是这类生物技术产品质量控制及指导其制备工艺优化的关键技术。本发明所述固定化链亲和素分离性能的主要指标及其定量测定方法,也适合表征标记用固定化链亲和素,如链亲和素与磁纳米粒或量子点的加合物,但对应指标反映间接亲和固定化生物素化成分的性能。分离用固定化链亲和素中所用固体材料本身对分离性能也有显著影响,但本发明不涉及对固体材料本身性能的测定和比较。
背景技术:
生物素的脂肪族羧基易于活化后修饰各类生物分子的脂肪族氨基。亲和素和链亲和素对游离生物素及生物素修饰(也称生物素化)成分有很高选择性结合能力即亲和力。亲和素是真核蛋白;链亲和素是一种原核蛋白,易于重组表达和纯化,其应用成本也更低,在生物技术领域应用也就更广。
将链亲和素固定在固体材料表面,尤其是微纳米材料表面,通过固定化链亲和素对生物素化目标分子的高亲和力结合,能实现生物素化目标分子基于亲和作用高选择性分离、间接固定化或间接偶联/标记;这是生物技术领域广泛应用的生物分子固定化、分离及标记/偶联技术,是构建各类高选择性分离分析系统的核心子系统。对应地,分离用固体材料和链亲和素的加合物即本发明所述固定化链亲和素就是重要的生物材料和生物技术产品;此类产品的典型代表,是链亲和素和超顺磁微米颗粒(磁珠)的共价加合物即链亲和素磁珠,这是单价超过黄金的生物亲和分离材料。
固定化链亲和素作为生物分离材料,其每批次产品的分离性能需严格一致才能保障其用于分离分析的重现性和结果可靠性。固定化链亲和素作为分离材料多数是混悬液,其有效成分的浓度是其分离性能的决定因素,但其有效成分的含量很难准确测量,尤其在使用中其分离性能还受到很多因素及亲和作用对象结构性质的影响。固定化链亲和素的生物亲和分离性能依赖于链亲和素对生物素化成分的结合;固定化链亲和素对选定生物素化分子探针的结合活性正比于样品中有效成分的含量,是表征其分离性能的基本指标。固定化链亲和素对生物素化分子亲和力比对游离生物素亲和力低,需要测定饱和结合活性才有较好重现性。然而,生物素化分子探针的体积大小对固定化链亲和素饱和结合活性有显著影响;单用固定化链亲和素对生物素化分子探针饱和结合活性无法可靠判断其分离性能,尤其是任何实验测定存在的误差会对产品分离性能判断造成很大不确定性。
理论上,对分离用固定化链亲和素,将有明确物理意义的多项独立指标及关联指标联用组成定量比较体系,并建立精确测量方法,基于多指标联用比较有望更精确地定量比较其分离性能和更严格地确认不同批次产品分离性能的一致性。显然,用于判断的部分指标应该与固定化链亲和素活性成分的含量或其浓度紧密相关,但也必须有部分与固定化链亲和素活性成分含量无关而对其结构性因素很敏感的指标用于比较。所以,建立用于定量比较固定化链亲和素分离性能的指标体系时,除了与样品中有效成分含量紧密相关的指标,还要有与样品中活性成分含量无关的指标。
每个完整链亲和素蛋白分子有四个相同的活性位点。有多种方法能在固体材料表面固定化链亲和素。非共价键固定化链亲和素依赖于原子之间在近距离内才有效的物理吸附;这种方式固定化链亲和素的活性位点周围有较大空间位阻,其对生物素化大分子结合活性通常较低,分离性能也低,尤其吸附固定化链亲和素会解离,造成产品储存稳定性及货架周期不足,故应用很少。在共价固定化方案中,链亲和素与固体材料本体间用共价键作为连接臂;如链亲和素与固体材料本体间的连接臂很短,则固定化链亲和素活性位点周围仍有较大位阻,其结合生物素化小分子探针的活性可以很高但结合生物素化大分子的活性就偏低。显然,链亲和素和固体材料本身之间共价连接臂应有适当长度。但是,即使用适当长度的共价连接臂,固定化链亲和素的不同亚基周围的空间位阻不同,也会影响不同亚基对生物素化成分的表观亲和力和结合活性,尤其是生物素化大分子探针的结合活性。另一方面,用于通过共价键连接固定化链亲和素的固体材料表面可用活泼官基团周围位阻常有差异,即这类固体材料表面不均匀。相应地,在固体材料表面不同位置固定化链亲和素分子对生物素化大分子探针表观亲和力不一致;这种不一致的表观亲和力对分离用固定链亲和素是性能缺陷,属于固定化链亲和素性能本身这种内因,只能通过优化固体材料表面结构来解决。更特殊的是,固定化链亲和素的不同分子及其不同亚基表观亲和力差异对过量生物素化大分子探针饱和结合活性影响较小,但对全分离设定量生物素化大最小需要量影响显著。因为,实现全分离时理论上没有任何成分是显著过量,但当固定化链亲和素的不同分子表观亲和力相差很大时,就会使得固定化链亲和素中小分子探针可结合的位点无法结合生物素化大分子探针,造成其分离性能降低。在固体材料表面采用较长柔性连接臂共价固定化链亲和素,其活性位点周围位阻就会显著降低而使其不同固定化链亲和素分子,甚至相同链亲和素分子的不同亚基,对生物素化大分子表观亲和力更一致,用于全分离设定量生物素化大分子的最小需要量就更小,分离性能更高而应用价值就更高。显然,理想的分离用固定化链亲和素,其对生物素化大分子探针结合活性应接近游离链亲和素,即其比活性应该与游离链亲和素尽可能接近;这是优化固定化链亲和素制备工艺的目标。另一方面,无论用何种测量方法都存在测定误差,单用任何指标比较固定化链亲和素分离性能的不确定度仍很高。用固定化链亲和素对生物素化大分子探针饱和结合活性、所含链亲和素活性蛋白量、固定化链亲和素比活性、全分离设定量生物素化大分子最小需要量这四个指标的部分或全部组合,联用于比较固定化链亲和素分离性能就是本发明的核心内容。理论上,固定化链亲和素比活性与其活性成分浓度无关,适合反映固定化链亲和素分离性能的内在结构性差异,也是判断样品中活性成分浓度差异的重要指标。
上述与固定化链亲和素分离性能相关的定量指标都需简便方法精确测定。测定固定化链亲和素所含活性蛋白量、对生物素化大分子探针饱和结合活性及对设定量生物素化大分子探针全分离的最小需要量,最经典方法是用放射性同位素标记的生物素化大分子及小分子生物素衍生物为探针。例如,用放射性同位素标记的生物素化寡核苷酸测定对生物素化大分子探针饱和结合容量,用放射性标记生物素或其小分子衍生物探针(分子量小于1000dalton)测定结合容量换算出活性亚基量及活性蛋白量,是固定化链亲和素产品分离性能的最常用测定方法。但是,放射性同位素对人体和环境危害都很大,其残留物难以处理,标记物比活性和标记信号浓度难以标定。用荧光或发光信号标记生物素化大分子或生物素化小分子作为探针也能测定上述指标,但需贵重专用仪器,这类标记物稳定性差且难以标定其含量。所以,需要建立更简便实用的方法测定上述分离性能相关指标。
光度法测量吸收简单可靠且易于标准化;水解酶催化显色底物反应的产物吸收能有效测定,其水解活性测定体系与多数固定化材料相容;显色探针浓度易于据其消光系数和吸收进行标定。显然,用设定量生物素化水解酶为探针测定其全分离时固定化链亲和素最小需要量更简便可行。选择用生物素化水解酶为探针显色测定固定化链亲和素对生物素化大分子饱和结合活性、用小分子显色探针测定固定化链亲和素活性蛋白量、据前两个指标推算固定化链亲和素活性蛋白比活性、用设定量生物素化水解酶为探针测定其全分离时固定化链亲和素最小需要量这四个指标作为定量参考品,就是本发明创新点的具体化和解决问题创造性所在。理论上,固定化链亲和素比活性一致而其余与有效成分含量/浓度相关指标明显不一致,则可能是样品活性成分浓度偏差造成;校正样品中的活性成分浓度偏差,是提供分离性能高度重现固定化链亲和素产品的关键环节之一。
生物素化牛小肠粘膜碱性磷酸酶(以下用缩写bio-ap)表面胺基被生物素修饰后具有与固定化链亲和素结合活性,是满足要求的生物素化大分子探针并且有商品供应,而bio-ap被固定化链亲和素吸附后仍然能显色测定其活性。游离生物素对链亲和素的亲和力非常高,但偶联在蛋白表面的生物素基团对固定化链亲和素的亲和力显著降低;bio-ap为生物素化大分子探针对链亲和素的亲和力会比游离生物素低几个数量级。用游离生物素与bio-ap竞争结合也能测定固定化链亲和素活性蛋白量,但这种竞争结合法的重现性差。对分离用固定化链亲和素,用水溶性生物素化小分子显色探针测定其活性蛋白量更简便可靠,探针浓度易于标定;此类探针灵敏度低但对固定化链亲和素产品质控并无成本负担。所以,水溶性生物素化小分子显色探针是本发明的另一个创造点。
用设定量生物素化水解酶为大分子探针测定其全分离所需固定化链亲和素最小需要量,可反映其分离效价;无论将大分子探针全分离定义在吸附探针量达到最大值的98%还是99%,所得到的固定化链亲和素最小需要量就都有较大误差。为提高该指标的测量精度,用三阶多项式拟合响应曲线,从拟合曲线上确定吸附探针最大量及达到所要求分离度时固定化链亲和素最小需要量。
本发明所提出的定量比较固定化链亲和素分离性能的相关指标及其测定原理,都适用于固定化亲和素,也适用于对生物素有显著亲和力的固定化链亲和素突变体、亲和素突变体。
技术实现要素:
本发明提供固定化链亲和素分离性能的定量比较方法,核心是选择四个分离性能相关指标及其光度测量方法,并选其中任意多个指标联用进行比较以判断分离性能是否一致;具体特征在于:
首先,选择如下四个指标表征固定化链亲和素的分离相关性能,具体是,固定化链亲和素对生物素化大分子探针饱和结合量、固定化链亲和素活性亚基量即其活性蛋白量、固定化链亲和素对生物素化大分子饱和结合量相对于其活性蛋白量的比值即其比活性、固定化链亲和素对设定量生物素化大分子探针全分离的最小需要量;
实践中,用生物素化牛小肠粘膜碱性磷酸酶为生物素化大分子探针,光度法测定固定化链亲和素对生物素化大分子探针饱和结合量、固定化链亲和素对设定量生物素化大分子探针全分离的最小需要量;用分子量1000dalton以下水溶性生物素化小分子显色探针,光度法测定固定化链亲和素活性蛋白量;据上述两种测量结果推算固定化链亲和素比活性;对固定化链亲和素的参考品和样品,在相同条件下分别测定各自上述四个指标的均值和标准差,并且参考品重复取样不少于5次进行测定,样品至少重复取样1次进行测定;
最后,按如下所述,判断固定化链亲和素的参考品与样品分离性能是否一致:
选上述四个指标中任两个、任三个或四个联用进行统计比较,如样品的每个所选指标与参考品的相同指标在p<0.05置信限水平都无统计差异,则二者分离性能一致;或者,选上述四个指标中任两个、任三个或四个联用进行简化比较,当样品每个所选指标两次测定相差小于10%、其均值与参考品相同指标均值的偏差都小于参考品标准差的2倍,则二者分离性能一致;如参考品与样品的比活性一致而其它任意指标有差异,则二者有效成分的浓度有差异,调整样品的稀释度或浓缩度获得与参考品分离效价一致的样品。
进一步,光度法测定固定化链亲和素分离性能的四个指标,特征如下:
固定化链亲和素对生物素化大分子饱和结合量:用生物素化牛小肠粘膜碱性磷酸酶为生物素化大分子探针并缩写为bio-ap;结合反应体系ph6.5~8.5,bio-ap相对于固定化链亲和素结合容量过量至少1倍,达到平衡后分离出吸附bio-ap;用4-硝基苯基磷酸酯或4-硝基-1-萘基磷酸酯为显色底物,反应设定时间后碱终止反应,去除固定化链亲和素,测定产物吸收确定bio-ap活性;据相同条件下设定量bio-ap全吸附的活性,换算出bio-ap饱和结合量为对生物素化大分子饱和结合量;
固定化链亲和素活性蛋白量:用显色团、单个生物素基团、磺酸或/和羧酸、柔性骨架连接成分子量1000dalton以下的水溶性生物素化小分子显色探针;吸附反应体系ph6.5~8.5,用该生物素化小分子显色探针过量10%以上与固定化链亲和素反应,达平衡后去除固定化链亲和素及其所吸附显色探针;据去除吸附探针前后吸附反应体系探针吸收之差和显色探针消光系数,换算成固定化链亲和素对生物素化小分子显色探针结合容量,按1:1化学计量关系换算成固定化链亲和素活性蛋白量;显色探针在吸附反应体系所用浓度使其可见光区吸收峰下吸收不低于0.120,加入固定化链亲和素吸附并除去吸附探针后吸收下降至少0.050但剩余探针的吸收需大于0.050;
固定化链亲和素比活性:以其对生物素化大分子饱和结合量相对其活性蛋白量的比值为固定化链亲和素比活性,该指标理论上与固定化链亲和素产品中活性成分浓度无关;
固定化链亲和素对设定量生物素化大分子探针全分离的最小需要量:以bio-ap为生物素化大分子探针并固定其用量,与不同量固定化链亲和素在ph6.5~8.5结合达平衡;分离吸附bio-ap,用显色底物测定结合bio-ap活性;三阶线性多项式拟合吸附bio-ap活性对吸附反应体系固定化链亲和素用量的响应曲线,确定分离98%或99%的bio-ap时固定化链亲和素的最小需要量。
进一步,光度法测定固定化链亲和素分离性能的四个指标,所用生物素化大分子探针及生物素化小分子显色探针,特征如下:
生物素化大分子探针,为生物素化修饰、水解显色底物生成的可见光区有强吸收显色团产物的水解酶及其突变体,其最适ph下室温最大比活性不低于10ku/g;
生物素化小分子显色探针,含有在可见光区吸收峰下毫摩尔消光系数不低于8.0(mmol/l)-1·cm-1的显色团、室温下在ph6.5~8.5缓冲液中溶解度不低于15μmol/l。
附图说明
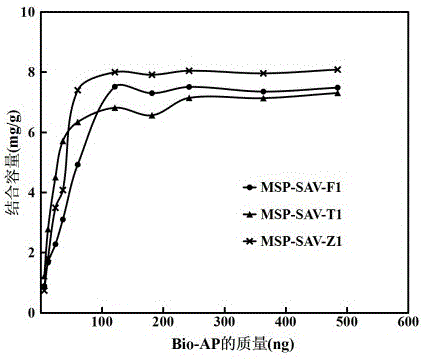
图1.链亲和素磁珠结合bio-ap活性对反应体系bio-ap量的响应曲线
图2.对80ngbio-ap,吸附分离结合酶活性对链亲和素磁珠量响应曲线
具体实施方式
实施例中所用试剂及溶液如下:
显色底物溶液:1.0m二乙醇胺-盐酸缓冲液,ph10.0,含对硝基苯基磷酸酯5.0mm
bio-ap结合缓冲液和洗涤缓冲液:ph7.4,1.0mtris-hcl
生物素化小分子探针结合缓冲液和洗涤缓冲液:ph7.8,0.10mtris-hcl
链亲和素磁珠msp-sav-z1:详见http://www.fbdbio.com/html/fwzx/wjxz/
链亲和素磁珠msp-sav-f1:详见http://www.fbdbio.com/html/fwzx/wjxz/
msp-sav-t1:美国热电公司销售dynabeadsmyone链亲和素磁珠t1,粒径1.0μm
msp-sav-bangs:美国bangslaboratory销售的链亲和素磁珠,粒径1.0μm;
msp-sav-jsr:日本jsr公司免费赠送的链亲和素磁珠产品,粒径1.5μm;
msp-sav-be:国内江苏省某生物技术有限公司销售的链亲和素磁珠产品,粒径1.0μm;
生物素化牛小肠碱性磷酸酶bio-ap:来自北京博奥森生物技术有限公司销售的产品;
bio-ap显色底物:4-硝基苯基磷酸酯,上海阿拉丁生化公司销售的产品;
生物素化小分子探针:见中国发明专利申请号201811606187.4所述显色团2f的生物素衍生物;
磁分离架:江苏无锡百运纳米科技有限公司提供,八孔磁分离架销售的产品。
实施例1.分离链亲和素磁珠吸附bio-ap并测定吸附酶活性的操作
将链亲和素磁珠充分温和弹匀,取磁珠(10g/l)10.0μl,置于磁力架上基于磁分离用1.0mtris-hcl(ph7.4)洗涤3次,随后加入250μl的1.0mtris-hcl(ph7.4)混匀,记作磁珠1,浓度为0.40g/l。
进一步,分别向1-3号ep试管中加入10.0μl磁珠1,即每管加入链亲和素磁珠4.0μg;测定对设定量bio-ap全分离的最小需要量时,加入不同体积的磁珠悬液。
进一步,取10.0μl的bio-ap商品溶液(北京博奥森产品),加90μl的tris-hcl(1.0mph7.4)摇匀,记为bio-ap0,其浓度为100.0mg/l;进一步取10μl的bio-ap0,加用tris-hcl(1.0mph7.4)190μl,摇匀,得bio-ap1,浓度5.0mg/l。
进一步,分别向1-3号管中加bio-ap1各20.0μl合计为100ng,将液体充分温和混匀进行吸附反应。
进一步,在27°c水浴恒温吸附反应10分钟并计时,期间每隔2~3分钟温和混匀一次。
进一步,吸附反应达到预定时间后,用tris-hcl(1mph7.4)洗涤磁珠3次,最后尽可能去上清液,分别迅速向1-3号ep试管中加600μl1.0mtris-hcl(ph7.4),温和混匀,并取出10.0μl加入到对应编号的新1-3号ep管中;记作底物反应ep管1-3。
进一步,准备阳性和阴性对照,从bio-ap1中取出10.0μl加入490μl的tris-hcl(1mph7.4)记作bio-ap2;向4、5号阳性对照管中各加10.0μlbio-ap2,对应总量是1.0ng;向4、5号阳性管中分别加入吸附容量大于3.0ng的链亲和素磁珠(实际加入4.0μg,吸附容量大于20ng);操作流程同上,吸附后分离链亲和素磁珠吸附的bio-ap并用tris-hcl(1.0mph7.4)洗涤磁珠3次后,转移到底物反应管4和5中,尽量去上清液并迅速进行如下操作(测定吸附酶活性)。
进一步,将显色底物4-硝基苯基磷酸酯pnpp母液(1.0m,蒸馏水),在开始bio-ap在磁珠上吸附反应前就在270c水浴中开始解冻;完全解冻后,取40μl底物加入7960μl的二乙醇胺-hcl缓冲液(1.0m,ph9.8;简称dea缓冲液),并旋剧烈涡震荡摇匀,得稀释底物液,5.0mm。
进一步,分别向1-5号ep管中加入790μl的稀释底物pnpp,6号ep管中仅加800μl稀释底物pnpp;各管涡旋震荡后,在27°c水浴恒温反应30分钟并计时,每隔2-3分钟涡旋混合一次。
进一步,酶催化反应达到预定时间后,立即加入200μl浓度为1.0m的naoh溶液,摇匀终止反应。
进一步,将底物反应管置于磁力架上,待上清液澄清后,取出上清到比色杯中测定405nm吸收。
实施例2.比较链亲和素磁珠对bio-ap饱和结合活性
参照实施例1,洗涤并稀释分离链亲和素磁珠;制备bio-ap1和浓度1.0mg/l得bio-ap2。
进一步,每管加洗涤后链亲和素磁珠各4.0μg;再加入不同体积的bio-ap1或bio-ap2。
进一步,处理阳性对照,用链亲和素磁珠吸附bio-ap,备测定吸附bio-ap活性。
进一步,洗涤吸附bio-ap;制备显色底物稀释液;加稀释底物液测定吸附酶活性。
进一步,结果如图2;据此响应曲线,在测定饱和结合容量时,选择每管用洗涤后链亲和素磁珠各4.0μg,加bio-ap合计100ng混匀,水浴恒温进行吸附。
各种常用链亲和素磁珠饱和结合活性比较,详见表1.
实施例3.比较链亲和素磁珠对生物素化小分子探针结合活性
按图1所述,制备小分子生物素化显色探针,缩写为bio-scp。
进一步,扫描吸收光谱发现,bio-scp相对于其游离显色团,可见光区吸收峰都在445nm附近,其消光系数对ph敏感,但在ph从7.8上升到9.0时吸收增加不足4%;以下都测定bio-scp在445nm吸收,吸附ph选择7.8,在此ph下探针在445nm消光系数约8.2(mm)-1·cm。
进一步,溶解并稀释bio-scp到ph7.80.10mtris-hcl缓冲液中,终浓度15.0μm,其初始吸收0.150;每批次稀释制备15ml显色探针溶液备用;
进一步,用吸附缓冲液洗涤链亲和素磁珠3次,并用此缓冲液将链亲和素磁珠稀释到20g/l;
进一步,试管编号0到5号;分别加入洗涤后稀释链亲和素磁珠为0到16.0mg,间隔4.0mg;
进一步,磁力架保留磁珠在ep管壁,尽量去上清液;迅速加入0.80ml显色探针溶液;温和混匀;
进一步,室温吸附10min;磁力保留磁珠到ep试管壁,小心取上清液0.70ml测定445nm吸收。
以0号管吸收减去上清液吸收为吸附探针前后吸收之差△a;
据设定消光吸收,换算被吸附显色探针量及固定化链亲和素活性蛋白量;比较见表1。
实施例4.比较链亲和素磁珠分离设定量bio-ap的响应曲线
参照实施例1,洗涤链亲和素磁珠并稀释到0.40mg/l作为稀释磁珠1。
进一步,稀释商品bio-ap溶液到2.0mg/l,作为bio-ap3。
进一步,向1-8号ep试管分别加10.0、15.0、20.0、25.0、30.0、35.0、40.0、50.0μl稀释磁珠1;磁力保留磁珠在ep试管壁,尽量去上清液。
进一步,迅速在每管中加入40μl的bio-ap3,立即温和混匀,27℃水浴恒温吸附反应10分钟并计时;期间每隔2-3分钟温和混匀一次。
进一步,吸附反应结束后,用tris-hcl(ph7.41.0m)洗涤3次,1-8号管分别去掉上清液后;各自加入800μltris-hcl(ph7.41.0m),再从中取出10.0μl加入到对应编号的新1-8号ep管中,记作底物反应ep管1-8。
进一步,准备阳性和阴性对照,将bio-ap3取10.0μl,加入190μl的tris-hcl(ph7.41.0m)摇匀备用,记作bio-ap4,其浓度为0.10mg/l;向9和10号管中加入10.0μlbio-ap4,加入链亲和素磁珠4.0μg全吸附bio-ap;洗涤磁珠,转移到底物反应管9和10管中,去上清液后重悬到10.0μl的tris-hcl(ph7.41.0m)中。
进一步,参照实施例1,制备稀释显色底物液,5.0mm;分别向1-10号ep管中加入790μl的稀释显色底物液,温和涡旋混匀后,27℃水浴恒温反应30分钟并计时,并每隔2-3分钟混匀一次。
进一步,酶催化反应结束后,立即加入200μl浓度为1m的naoh摇匀终止反应。
进一步,将试管置于磁力架上,保留磁珠到试管壁,转移上清液0.70ml测定405nm吸收。
用excel中的曲线拟合功能,选择三阶线性多项式拟合,计算对设定量的大分子显色探针达到所要求的分离量所需链亲和素磁珠的最小需要量。
链亲和素磁珠分离性能比较见表1;可见不同产品分离性能差异很大。
注:链亲和素亚基分子量按16kd计算;即1μmole对应为16mg
括号内数字为独立取样稀释后重复测定次数;每个独立稀释样品仅测定一次。
*表示以msp-sav-f1为参考品,t-检验差异显著(p<0.05)。
实施例5不同生产批次链亲和素磁珠的分离性能比较
测定分离性能相关指标的细节见实施例1到4所述。
测定试生产期间得五批次msp-sav-f1,测定其分离性能的指标见表2。
所测试的5批磁珠候选产品中,第5批比活性合格但其余两个分离性能指标都不合格;该批次产品调整加入保存液量即稀释比例,再重新取样三次,测定上述四个指标;结果表明该批次产品第一次加入保存液过多造成有效成分浓度不足,但调整稀释度后成为合格产品。
括号内数字为独立取样稀释后重复测定次数;每个独立稀释样品仅测定一次。
*表示以第1批msp-sav-f1为参考品,t-检验差异显著(p<0.05)。
最后说明的是,以上实施例仅用以说明本发明的技术方案和其应用而非限制;本领域普通技术人员应当理解,对本发明的技术方案进行修改或者等同替换,如用其它生物素化水解酶为大分子探针测定对大分子饱和结合活性及其全分离的最小需要量、用其它生物素化小分子显色探针测定固定化活性蛋白量,而不脱离本发明的技术原理,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!