样本承接件的制作方法
本实用新型有关一种样本承接件,特别是一种用以含住并且带着液态样本移动的样本承接件。
背景技术:
单基因遗传疾病有很多种,例如脊髓性肌肉萎缩症(Spinal Muscular Atrophy,SMA)、杜显氏肌肉萎缩症(Duchenne Muscular Dystrophy,DMD)、多发性内分泌腺瘤病、鱼鳞病、血友病以及部分多囊肾患者(Polycystic Kidney Disease,PKD)等。以下将以各种检测脊髓性肌肉萎缩症的方法作为范例,说明各种检测单基因遗传疾病的方法问题所在。
脊髓性肌肉萎缩症(Spinal Muscular Atrophy,SMA)发生率位居所有的染色体隐性遗传疾病当中的第二位,而致死率居第一位。在临床上,脊髓性肌肉萎缩症依据发病时间又可分为三种类型:第一型(又称Werdnig-Hoffmann disease),发病时间在出生6个月内,病情发展迅速,寿命不超过2岁,半数以上的脊髓性肌肉萎缩症患者属于此类;第二型(又称Dubowitz disease)为慢性婴儿型(中间型),发病时间在出生6~18个月,经照护多数能活至成年;第三型(又称Wohlfart-Kugelberg-Welander disease)为青少年型(轻型),发病时间在出生18个月后,病情发展缓慢,长期存活率较高。
脊髓性肌肉萎缩症的症状为身体躯干和四肢近端骨骼肌进行性肌无力、肌萎缩,一般认为是相关基因的缺失或者突变所造成的,而其中又以脊髓运动神经元(Survival Motor Neurons,SMN)基因扮演最主要的角色。进一步地说,SMN蛋白的功能是维护脊髓前角细胞功能;当SMN基因缺失或者突变时,SMN蛋白表现下降甚至消失,导致脊髓前角细胞变性,从而使个体身体躯干和四肢近端骨骼肌进行性肌无力、肌萎缩。因此,已知的检测脊髓性肌肉萎缩症的方法主要是检测SMN基因缺失或者突变状况。
SMN基因座落在5号染色体长臂1区3带2亚带(5q13.2)上,全长20kb,包括9个外显子(exon)和8个内含子(intron)。SMN基因有两个非常相似基因拷贝,分别为SMN1基因和SMN2基因。SMN1(或称SMNt)基因位在端粒端,SMN2(或称SMNc)基因位于着丝粒端。SMN1基因和SMN2基因为两个高度同源的倒位重复DNA序列,差别在于:3'端有5个碱基是不同的。此一差异使得SMN2基因的第7外显子与SMN1基因的单个碱基差异(c.840C>T),导致此两个基因拷贝所编码的蛋白产物略有不同。换句话说,SMN1基因可编码出完整而且稳定的SMN功能蛋白,SMN2基因主要可编码出功能缺陷的截短SMN蛋白和少部分(10~50%)编码出完整而且稳定的SMN功能蛋白。当SMN1基因功能完全丧失时,SMN2基因的表现对SMN蛋白的功能具有一定的补充作用,因而被定义为SMA的修饰基因。SMN2基因表现具有生物活性的SMN蛋白量虽然较少,但随着拷贝数增加,也会有表现量的累积效应,从而使患者的临床症状有一定程度的减轻。
随着以降低脊髓性肌肉萎缩症患儿出生率为目标的预防计划与措施的相继实施,以及脊髓性肌肉萎缩症发病分子机制和分子流行病学的深入研究,研发准确可靠、简单实用、能够实现自动化和标准化、适合大规模人群筛查和常规分子诊断、高通量同时快速检测精准定量SMN1和SMN2基因拷贝数的状态,从而检测出脊髓性肌肉萎缩症带因或患者的相关方法及装置为当前迫切之需。
目前检测脊髓性肌肉萎缩症的方法包括单链构象多态性分析(Single-Strand Conformation Polymorphism,SSCP)、聚合酶连锁反应-限制酶片段长度多型性(Polymerase Chain Reaction-Restriction Fragment Length Polymorphism,PCR-RFLP)、实时定量聚合酶链锁反应(Quantitative Real-time PCR,qPCR)、变性高效能液相色谱分技术(Denaturing High Performance Liquid Chromatography,DHPLC)和多重连接探针扩增(Multiplex Ligation-dependent Probe Amplification,MLPA)等。通过分析SMN1基因目的片段是否有缺失及缺失的数目而进行常规和产前基因诊断。其中PCR-单链构象多态性分析法、单碱基突变PCR技术和变性高校液相色谱技术分析SMN基因7、8号外显子突变的情况。
然而,现有检测脊髓性肌肉萎缩症的方法普遍存在准确率低、操作复杂而且耗时、检测试剂成本高、只能侦测到基因出现大片段缺失的异常和需要昂贵的仪器设备等问题。PCR-RFLP则有无法判断带因者的问题。
上述技术方法都是基于SMN1基因目的序列缺失状况的检测,没有将SMN2基因目的序列缺失或多拷贝分析纳入检测范畴,也没有基于SMN1/2基因的全面检测与分析。此种情况主要是由以下三个方面造成的:其一,没有意识到SMN2基因在脊髓性肌肉萎缩症临床分型中的重要作用;其二,由于SMN2基因与SMN1基因序列高度同源,只有5个碱基的差异,同时检测SMN1基因和SMN2基因,对技术提出了更高的要求;其三,当在同一体系中增加TaqMan探针数量时,会增加体优化和检测难度。而且,如果只针对SMN1基因序列进行检测,由于SMN1基因和SMN2基因序列高度相似,往往出现假阳性检测结果。此外,由于荧光定量检测中参比序列选择的不合适,导致检测结果受DNA提取方法影响大,检测结果重复率和准确率较差。因此,选择合适的参比序列并采用对SMN1基因序列和SMN2基因序列进行检测,无论从临床实际应用上还是检测技术要求上都是十分必要的。
而近年最新发展出的MLPA基因诊断技术定量SMN1及SMN2基因套数,检测受检者是否带有最常见的SMN1基因缺失突变。此方法具有准确性高和再现性高等优点,并改善目前SMA基因筛检时,定量SMN1及SMN2基因套数易产生误差的问题,准确度高达98%以上。
但是,MLPA检测方法检测单一样本所需的试剂成本要价约新台币500元,而且还需要使用特殊的分析仪器,检测时间长达24小时,成本昂贵,加重患者经济负担,难以在临床上进行大规模人群筛检和技术推广。上述方法都是基于荧光相对定量来分析基因拷贝数,容易有误差造成判读风险。
再者,现有的单基因遗传疾病的液态样本注液方法之一是将检测芯片设在微量试管(eppendorf tube)中,然后操作微量吸管(pipetman),通过微量吸管前端的吸量管尖(pipette tip)吸取约15μl的基因样本,然后伸入微量试管的腔室,将液态样本滴在检测芯片(chip)上,使样本区分在一或数万个微小孔中,达到数字化侦测的效果,以检测出是否有遗传疾病。
然而,微量试管的底部呈倒锥状,检测芯片延伸至微量试管的最内侧,即使是最小量的微量吸管(亦即,10μl的微量吸管)所使用的吸量管尖也无法完全伸入微量试管最内侧,所以液态样本只能分布在检测芯片靠近微量试管的开口的一端的区域的表面,无法分布在检测芯片靠近微量试管最内侧的一端的区域的表面,导致液态样本无法均匀地分布在检测芯片的整个表面,降低检测单基因遗传疾病的准确性。
技术实现要素:
本实用新型的主要目的在于提供一种样本承接件,可顺畅地进入微量试管的腔室,并且可顺利地将液态样本均匀地涂布在检测芯片的整个表面,使液态样本能够通过毛细现象均匀地渗透入检测芯片的每个小孔,不仅实现了单基因遗传疾病(例如脊髓性肌肉萎缩症)的样本自动注液分区,而且检测芯片的每个小孔中具有等量的液态样本,达到数字化绝对定量基因拷贝数判读结果,判读容易且准确度高,提升检测单基因遗传疾病的效率、检测准确性、稳定性及再现性,实现数字化且准确的分析单基因遗传疾病。
为了达成前述的目的,本实用新型将提供一种样本承接件,包括一固定部、一条状体以及一承载部。
条状体设于固定部的一端并且具有弹性。
承载部从条状体远离固定部的一端先水平延伸,然后经过一个弯折之后,再往远离条状体的方向朝下延伸并且其宽度渐缩,其中,承载部于其宽度渐缩处开设一液体注入孔,承载部的弯折处具有一夹角,承载部具有弹性。
较佳地,承载部包括一连结端部及一注入端部,连结端部从条状体远离固定部的一端先水平延伸,然后经过一个弯折之后,再往远离条状体的方向朝下延伸,注入端部从连结端部远离条状体的一端往远离条状体的方向朝下延伸并且其宽度渐缩,液体注入孔开设于注入端部并且其宽度往远离条状体的方向渐缩。
较佳地,注入端部的形状从连结端部往注入端部的方向观看为梯形、三角形或者是远离连结端部的一端的顶点修饰成圆弧的近似三角形,液体注入孔的形状对应承载部的注入端部的形状而呈梯形、三角形或者是远离连结端部的一端的顶点修饰成圆弧的近似三角形。
较佳地,注入端部的长度大于注入端部的最宽处的宽度,液体注入孔的长度大于液体注入孔的最宽处的宽度,注入端部的二侧边等长,液体注入孔的二侧边等长。
较佳地,注入端部的二侧边的夹角和液体注入孔的二侧边的夹角的角度均为10~30度。
较佳地,注入端部的二侧边的夹角和液体注入孔的二侧边的夹角的角度均为20度。
较佳地,连结端部的弯折处的夹角为一钝角。
较佳地,连结端部的弯折处的夹角的角度为170~180度。
较佳地,连结端部呈矩形并且开设一矩形孔。
较佳地,固定部呈板状,样本承接件包括多个条状体以及多个承载部,多个条状体间隔地设于固定部的一端,多个承载部分别设于多个条状体远离固定部的一端。
本实用新型的功效在于,承载部的形状能够对应微量试管的圆锥状管底以及检测芯片的形状;条状体和承载部的弹性搭配承载部呈弯折状的特点,使得承载部能够顺应微量试管的内壁面和导引件的表面之间的高度差以及微量试管的内壁面和检测芯片的表面之间的高度差而弹性变形;液体注入孔的二侧边接触液态样本,所以能够轻易地含住液态样本。透过上述功效之组合,使得本实用新型能够顺畅地进入微量试管的腔室,并且可顺利地将液态样本均匀地涂布于检测芯片的整个表面,使液态样本能够通过毛细现象均匀地渗透入检测芯片的每个小孔,不仅实现了单基因遗传疾病(例如脊髓性肌肉萎缩症)的样本自动注液分区,而且检测芯片的每个小孔中具有等量的液态样本,达到数字化绝对定量基因拷贝数判读结果,判读容易且准确度高,提升检测单基因遗传疾病的效率、检测准确性、稳定性及再现性,实现数字化且准确的分析单基因遗传疾病。
附图说明
图1为本实用新型的样本承接件的第一实施例的立体图;
图2为本实用新型的样本承接件的第一实施例的俯视图;
图3为本实用新型的样本承接件的第一实施例的前视图;
图4为本实用新型的样本承接件的第一实施例的侧视图;
图5为本实用新型的样本承接件的第二实施例的立体图;
图6为本实用新型的样本承接件的第三实施例的立体图;
图7为本实用新型的样本承接件设置在自动注液装置的立体图;
图8为自动注液装置的移动装置的夹持结构的夹板夹住本实用新型的样本承接件的固定部的立体图;
图9为本实用新型的样本承接件的承载部的注入端部的一端抵靠于导引件的表面的侧视图;
图10A为液态样本注入本实用新型的样本承接件的承载部的注入端部的液体注入孔的立体图;
图10B为图10A的侧视图;
图11A为本实用新型的样本承接件的承载部的注入端部带着液态样本沿着导引件的条状体的表面进入微量试管的腔室的立体图;
图11B为图11A的侧视图;
图12为本实用新型的样本承接件的承载部的注入端部接触到检测芯片的示意图;
图13为本实用新型的样本承接件的承载部的注入端部开始移动于检测芯片的表面的示意图;
图14为本实用新型的样本承接件的承载部的注入端部移动于检测芯片的两端之间的表面的示意图;
图15为液态样本渗透入检测芯片的小孔的立体图。
附图标记说明:
10-样本承接件;11-固定部;111-定位凹部;12-条状体;13、13'、13"-承载部;131、131'、131"-液体注入孔;132-弯折处;133、133'、133"-连结端部;1331-矩形孔;134、134'、134"-注入端部;1341-最低点;20-微量试管;21-腔室;30-检测芯片;31-小孔;40-液态样本;50-导引件;100-检测单基因遗传疾病的自动注液装置;101-机台;1011-滑槽;102-架体;103-固定装置;104-移动装置;1041-滑块;1042-夹持结构;10421-座体;10422-夹板;10423-定位凸部;10424-容槽;Θ-夹角。
具体实施方式
以下配合图式及组件符号对本实用新型的实施方式做更详细的说明,俾使熟习该项技艺者在研读本说明书后能据以实施。
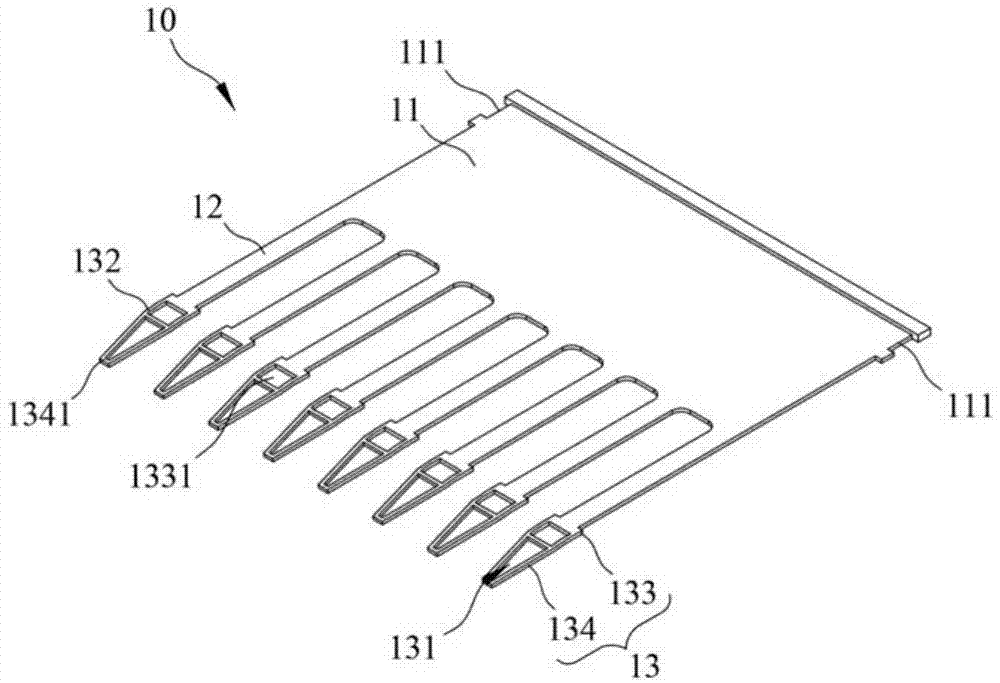
请参阅图1至图4,图1为本实用新型的样本承接件的第一实施例的立体图,图2为本实用新型的样本承接件的第一实施例的俯视图,图3为本实用新型的样本承接件的第一实施例的前视图,图4为本实用新型的样本承接件的第一实施例的侧视图。本实用新型系提供一种样本承接件10,包括一固定部11、一条状体12以及一承载部13。
条状体12设于固定部11的一端并且具有弹性。
承载部13从条状体12远离固定部11的一端先水平延伸,然后经过一个弯折之后,再往远离条状体12的方向朝下延伸并且其宽度渐缩。藉此,承载部13的形状能够对应一微量试管20的圆锥状管底以及微量试管20的一腔室21内的一呈梯形的检测芯片30的形状,有助于承载部13的前端顺畅地进入微量试管20的腔室21,并且顺利地将液态样本40均匀地涂布于检测芯片30的表面,如图9至图15所示。
其中,承载部13于其宽度渐缩处开设一液体注入孔131,液体注入孔131可供一液态样本40注入于其中,如图10A及图10B所示。藉此,液体注入孔131的二侧边接触液态样本40,所以能够轻易地含住液态样本40。
其中,承载部13的弯折处132具有一夹角Θ,条状体12和承载部13均具有弹性。藉此,条状体12和承载部13可通过其弹性而具有一定的变形能力,使本实用新型的样本承接件10的承载部13能够顺应环境变形。换句话说,承载部13能够顺应微量试管20的内壁面和一导引件50的表面之间的高度差以及微量试管20的内壁面和检测芯片30的表面之间的高度差而弹性变形,使本实用新型的样本承接件10的承载部13能够顺畅地进入微量试管20的腔室21中,如图11A及图11B所示。
重要的是,本实用新型的样本承接件10的承载部13在弹性变形的过程中,液体注入孔131的二侧边接触液态样本40的面积并没有任何改变,所以液态样本40仍旧完整地被液体注入孔131含住。
是以,透过上述功效之组合,使得本实用新型能够顺畅地进入微量试管20的腔室21,并且可顺利地将液态样本40均匀地涂布在检测芯片30的整个表面,使液态样本40能够通过毛细现象均匀地进入检测芯片30的多个小孔31,不仅实现了单基因遗传疾病(例如脊髓性肌肉萎缩症)的样本自动注液分区,而且检测芯片30的每个小孔31中具有等量的液态样本40,达到数字化绝对定量基因拷贝数判读结果,判读容易且准确度高,提升检测单基因遗传疾病的效率、检测准确性、稳定性及再现性,实现数字化且准确的分析单基因遗传疾病。
其中,所述单基因遗传疾病,包括但不限于,脊髓性肌肉萎缩症(Spinal Muscular Atrophy,SMA)、杜显氏肌肉萎缩症(Duchenne Muscular Dystrophy,DMD)、多发性内分泌腺瘤病、鱼鳞病、血友病以及部分多囊肾患者(Polycystic Kidney Disease,PKD)等。
进一步地说,承载部13包括一连结端部133及一注入端部134。连结端部133从条状体12远离固定部11的一端先水平延伸,然后经过一个弯折之后,再往远离条状体12的方向朝向延伸。注入端部134从连结端部133远离条状体12的一端往远离条状体12的方向朝下延伸并且其宽度渐缩。换句话说,注入端部134的形状能够对应微量试管20的圆锥状管底以及微量试管20的腔室21内的梯形检测芯片30的形状,有助于注入端部134顺畅地进入微量试管20的腔室21,并且顺利地将液态样本40均匀地涂布于检测芯片30的表面,如图9至图15所示。
再者,液体注入孔131开设于注入端部134并且其宽度往远离条状体12的方向渐缩。是以,液体注入孔131的二侧边能够提供较大的接触面积接触液态样本40,使得液态样本40能够轻易地被液体注入孔131的前端含住,如图10A及图10B所示。
此外,注入端部134相对链接端部133呈倾斜状而具有弹性变形的能力,而且能够顺应环境变形,因此注入端部134能够顺应微量试管20的内壁面和导引件50的表面之间的高度差以及微量试管20的内壁面和检测芯片30的表面之间的高度差而弹性变形,使注入端部134能够顺畅地进入微量试管20的腔室21中,如图11A及图11B所示。
重要的是,注入端部134在弹性变形的过程中,液体注入孔131的二侧边接触液态样本40的面积并没有任何改变,所以液态样本40仍旧完整地被液体注入孔131的前端含住。
在第一实施例中,注入端部134的形状从连结端部133往注入端部134的方向观看为梯形,液体注入孔131的形状对应承载部13的注入端部134的形状而呈梯形,如图1至图3所示。
在第二实施例中,注入端部134'的形状从连结端部133'往注入端部134'的方向观看为三角形,液体注入孔131'的形状对应承载部13'的注入端部134'的形状而呈三角形,如图5所示。
在第三实施例中,注入端部134"的形状从连结端部133"往注入端部134"的方向观看为远离连结端部133"的一端的顶点修饰呈圆弧的近似三角形,液体注入孔131"的形状对应承载部13"的注入端部134"的形状而呈远离连结端部133"的一端的顶点修饰呈圆弧的近似三角形,如图6所示。
由上可知,注入端部134、134'、134"的形状和液体注入孔131、131'、131"的形状可以有至少以上三种变化,然不以此为限,其他符合定义的形状亦被本实用新型的范围所涵盖,合先叙明。
值得一提的是,上述三种实施例的注入端部134、134'、134"的形状比其他形状的注入端部134、134'、134"更能够对应微量试管20的圆锥状管底以及微量试管20的腔室21内的梯形检测芯片30的形状,有助于注入端部134、134'、134"更顺畅地进入微量试管20的腔室21,并且顺利地将液态样本40均匀地涂布于检测芯片30的表面。
再者,上述三种实施例的液体注入孔131、131'、131"的二侧边接触液态样本40的面积比其他形状的液体注入孔的二侧边接触液态样本40的面积大,所以上述三种实施例的液体注入孔131、131'、131"的前端含住液态样本40的效果远比其他形状的液体注入孔含住液态样本40的效果优异。
较佳地,注入端部134的长度大于注入端部134的最宽处的宽度,液体注入孔131的长度大于液体注入孔131的最宽处的宽度,注入端部134的二侧边等长,液体注入孔131的二侧边等长。换句话说,注入端部134和液体注入孔131皆呈现瘦长的样貌,注入端部134和液体注入孔131均为等腰,注入端部134的二侧边的夹角和液体注入孔131的二侧边的夹角皆为锐角。藉此,注入端部134的形状更加符顺微量试管20的圆锥状管底以及微量试管20的腔室21内的梯形检测芯片30的形状,有助于注入端部134更顺畅地进入微量试管20的腔室21,并且顺利地将液态样本40均匀地涂布于检测芯片30的表面。再者,因为表面张力的关系,液体注入孔131的形状能够让液态样本40呈现匀称的水滴状,所以液体注入孔131的前端含住液态样本40的效果相当优异。
较佳地,注入端部134的二侧边的夹角和液体注入孔131的二侧边的夹角的角度均为10~30度。藉此,此角度能够让注入端部134的形状更加符顺微量试管20的圆锥状管底以及微量试管20的腔室21内的梯形检测芯片30的形状,有助于注入端部134更顺畅地进入微量试管20的腔室21,并且以顺利地将液态样本40均匀地涂布于检测芯片30的表面。再者,此角度能够直接提升液体注入孔131的二侧边接触液态样本40的面积,从而提高液体注入孔131的前端含住液态样本40的效果。其中上述功效又以注入端部134的二侧边的夹角和液体注入孔131的二侧边的夹角的角度均为20度时为最佳。
在较佳实施例中,连结端部133呈矩形并且开设一矩形孔1331。藉此,连结端部133的形状对应微量试管20的腔室21靠近开口一侧的圆管形状,从而能够顺利地进出微量试管20的腔室21,如图15所示。
在较佳实施例中,连结端部133的弯折处132的夹角Θ为钝角时,注入端部134的最低点1341和连结端部133的弯折处132的高度差较为接近微量试管20的内壁面和导引件50的表面之间的高度差以及微量试管20的内壁面和检测芯片30的表面之间的高度差,所以注入端部134在进入微量试管20的腔室21的过程中,只要稍微变形就能够顺利进入。其中,连结端部133的弯折处132的夹角Θ的角度为170~180度时,注入端部134的最低点1341和连结端部133的弯折处132的高度差更为接近微量试管20的内壁面和导引件50的表面之间的高度差以及微量试管20的内壁面和检测芯片30的表面之间的高度差。
在较佳实施例中,固定部11呈板状;本实用新型的样本承接件10包括多个条状体12以及多个承载部13;多个条状体12间隔地设于固定部11的一端;多个承载部13分别设于多个条状体12远离固定部11的一端。在本实施例中,条状体12和承载部13的数量皆为八个,以对应八个微量试管20连成一排的八连排PCR反应管。
以下将配合图7至图15等图式说明本实用新型的样本承接件10的实际运用及其所能达成的功效。
请参考图7、图8及图9,图7为本实用新型的样本承接件设置在自动注液装置的立体图,图8为自动注液装置的移动装置的夹持结构的夹板夹住本实用新型的样本承接件的固定部的立体图,图9为本实用新型的样本承接件的承载部的注入端部的一端抵靠于导引件的表面的侧视图。一自动注液装置100包含一机台101、一架体102、一固定装置103以及一移动装置104;机台101的顶面开设一滑槽1011;移动装置104包括一滑块1041及一夹持结构1042;滑块1041滑设于滑槽1011;夹持结构1042包含一座体10421及一夹板10422;座体10421链接滑块1041,位于固定装置103的上方,并且用以供本实用新型的样本承接件10的固定部11设置于其上;夹板10422枢设于座体10421并且用以供选择性地夹住本实用新型的样本承接件10的固定部11。
在较佳实施例中,座体10421的顶面设有二定位凸部10423,夹板10422开设二容槽10424,本实用新型的样本承接件10的两侧分别设有二定位凹部111,如图7所示。请参阅图7,先将夹板10422掀开;接着,将本实用新型的样本承接件10的固定部11的二定位凹部111固定在座体10421的二定位凸部10423;最后,请参阅图8,将夹板10422向下枢摆,使得夹板10422夹住本实用新型的样本承接件10的固定部11,同时座体10421的二定位凸部10423进入夹板10422的二容槽10424中,本实用新型的样本承接件10的承载部13的注入端部134的一端自然会抵靠于导引件50的表面。在本实施例中,因为本实用新型的样本承接件10包含八个承载部13,所以八个承载部13的注入端部134的一端分别抵靠于导引件50的八个条状体的表面。
请参阅图10A及图10B,图10A为液态样本注入本实用新型的样本承接件的承载部的注入端部的液体注入孔的立体图,图10B为图10A的侧视图。液态样本40注入本实用新型的样本承接件10的承载部13的注入端部134的液体注入孔131并且接触导引件50的表面。从图10A及图10B可看出,液体注入孔131的二侧边能够提供较大的接触面积接触液态样本40,使得液态样本40能够轻易地被液体注入孔131的前端含住。
请参阅图11A及图11B,图11A为本实用新型的样本承接件的承载部的注入端部带着液态样本沿着导引件的条状体的表面进入微量试管的腔室的立体图,图11B为图11A的侧视图。移动装置104驱动样本承接件10带着液态样本40沿着导引件50的表面往靠近架体102的方向移动并且进入微量试管20的腔室21。从图11A及图11B可看出,注入端部134能够顺应微量试管20的内壁面和导引件50的表面之间的高度差以及微量试管20的内壁面和检测芯片30的表面之间的高度差而弹性变形,使注入端部134能够顺畅地进入微量试管20的腔室21中。注入端部134在弹性变形的过程中,液体注入孔131的二侧边能够接触液态样本40的面积并没有任何改变,所以液态样本40仍旧完整地被液体注入孔131的前端含住。
请参阅图12至图15,图12为本实用新型的样本承接件的承载部的注入端部接触到检测芯片的示意图,图13为本实用新型的样本承接件的承载部的注入端部开始移动于检测芯片的表面的示意图,图14为本实用新型的样本承接件的承载部的注入端部移动于检测芯片的两端之间的表面的示意图,图15为液态样本渗透入检测芯片的小孔的立体图。移动装置104驱动本实用新型的样本承接件10带着液态样本40沿着检测芯片30的表面移动至检测芯片30的最内侧,使得液态样本40均匀分布于检测芯片30的表面并且通过毛细现象渗透入检测芯片30的多个小孔31中。从图12至图15可看出,注入端部134的形状能够对应微量试管20的圆锥状管底以及微量试管20的腔室21内的梯形检测芯片30的形状,有助于注入端部134顺畅地进入微量试管20的腔室21,并且顺利地将液态样本40均匀地涂布于检测芯片30的表面。
综上所述,本实用新型能够顺畅地进入微量试管20的腔室21,并且可顺利地将液态样本40均匀地涂布在检测芯片30的整个表面,使液态样本40能够通过毛细现象均匀地进入检测芯片30的多个小孔31,不仅实现了单基因遗传疾病(例如脊髓性肌肉萎缩症)的样本自动注液分区,而且检测芯片30的每个小孔31中具有等量的液态样本40,达到数字化绝对定量基因拷贝数判读结果,判读容易且准确度高,提升检测单基因遗传疾病的效率、检测准确性、稳定性及再现性,实现数字化且准确的分析单基因遗传疾病。
以上所述者仅为用以解释本实用新型的较佳实施例,并非企图据以对本实用新型做任何形式上的限制,是以,凡有在相同的实用新型精神下所作有关本实用新型的任何修饰或变更,皆仍应包括在本实用新型意图保护的范畴。
- 还没有人留言评论。精彩留言会获得点赞!