采用His@ZIF-8/Tb3+复合材料测定炭疽孢子生物标志物DPA含量的方法与流程
本发明属于沸石咪唑酯框架复合材料技术领域,具体涉及一种采用his@zif-8/tb3+复合材料测定炭疽孢子生物标志物dpa含量的方法。
背景技术:
沸石咪唑酯骨架结构材料(zeoliticimidazolateframeworks),简称zifs,是将咪唑环上的n原子络合到二价过渡金属离子上而形成的一种具有沸石拓扑结构的多孔晶体材料,通过调变配体或配体间的相互作用可以形成不同结构的zifs。zifs的合成方法包括溶剂热法、水热法、液相扩散法、胶体化学法、微波合成法和超声法等,且其广泛应用于选择性气体吸附/分离、催化反应、光学和磁学等方面。zifs在现代材料学方面呈现出巨大的发展潜力和诱人的发展前景。然而,zifs材料在分析化学传感领域的应用远远落后于其他领域。
目前,国内外还未发现采用his@zif-8/tb3+复合材料测定2,6-吡啶二甲酸(2,6-dipicolinicacid,dpa)的含量方法的报道。
技术实现要素:
本发明的目的是提供一种快速响应、高选择性、高灵敏性的采用his@zif-8/tb3+复合材料测定炭疽孢子生物标志物dpa含量的方法。
本发明所述的采用his@zif-8/tb3+复合材料测定炭疽孢子生物标志物dpa含量的方法,包括以下步骤:
1)制备his@zif-8复合材料
a、将组氨酸溶于去离子水中,加入三乙胺并搅拌,得组氨酸溶液;
b、将六水合硝酸锌溶解在甲醇中,得六水合硝酸锌溶液;将2-甲基咪唑溶解在甲醇中,得2-甲基咪唑溶液;
c、将2-甲基咪唑溶液与组氨酸溶液混合并搅拌,然后加入六水合硝酸锌溶液,室温下搅拌24h,离心收集产物,用甲醇洗涤,干燥,得his@zif-8复合材料;
2)制备his@zif-8/tb3+复合材料
将his@zif-8复合材料分散到硝酸铽乙醇溶液中,室温下搅拌3h,离心收集产物,用乙醇洗涤,干燥,得his@zif-8/tb3+复合材料;
3)绘制工作曲线
将his@zif-8/tb3+复合材料分散到水溶液中,配制成浓度为50mg/l的分散液,移取100μlhis@zif-8/tb3+分散液,加入到含有800μlhepes缓冲溶液的离心管中,并加入从0到10μmol/l的浓度的dpa标准溶液,振荡使其混合均匀,10s后用荧光光谱仪在275nm的激发下测试其荧光发射光谱,根据荧光强度与dpa浓度之间的关系,绘制工作曲线;
4)检测
将待测样品代替dpa标准溶液,通过标准加入法加入,振荡使其混合均匀,10s后用荧光光谱仪在275nm的激发下测试其荧光发射光谱,将荧光强度代入工作曲线,即得待测样品中的dpa浓度;
其中,所述的待测样品为10%人尿液或1%牛血清。
其中:
所述的his@zif-8/tb3+复合材料测定dpa含量的线性范围为0.1~10μmol/l,相关系数r2达0.9988。
所述的his@zif-8/tb3+复合材料测定dpa含量的检测下限达20nmol/l。
优选地,所述的离心转速为7000rpm。
优选地,所述的干燥温度为60℃。
优选地,所述的hepes的ph=7.4,浓度为20mmol/l。
优选地,本发明所述的采用his@zif-8/tb3+复合材料测定炭疽孢子生物标志物dpa含量的方法,步骤如下:
1)制备his@zif-8复合材料
a、将3.0mmol组氨酸溶于40ml去离子水中,然后将250μl的三乙胺加入组氨酸溶液中并搅拌5min,得组氨酸溶液;
b、将6.0mmol六水合硝酸锌溶解在100ml甲醇中,得六水合硝酸锌溶液;将21.0mmol2-甲基咪唑溶解在60ml甲醇中,得2-甲基咪唑溶液;
c、为了制备zifs前体溶液,首先将2-甲基咪唑溶液与组氨酸溶液混合并搅拌15min,然后,加入六水合硝酸锌溶液,将上述混合溶液在室温下搅拌24h,通过在7000rpm下离心5min收集产物,并用甲醇反复洗涤3次,将得到的白色粉末在60℃烘箱中干燥;
2)制备his@zif-8/tb3+复合材料
将30.0mghis@zif-8分散到60.0ml硝酸铽乙醇溶液(10mmol/l)中,然后,将上述溶液在室温下搅拌3h,通过在7000rpm下离心5min收集产物,并用乙醇反复洗涤3次,将得到的白色粉末在烘箱中在60℃烘箱中干燥;
3)绘制工作曲线
将步骤(2)制备的his@zif-8/tb3+复合材料分散到水溶液中,配制成浓度为50mg/l的分散液,移取100μlhis@zif-8/tb3+复合材料分散液加入到含有800μlhepes(ph=7.4,20mmol/l)缓冲溶液的离心管中,并加入从0mol/l到10μmol/l的浓度的dpa标准溶液,振荡使其充分混合均匀,10s后用荧光光谱仪在275nm的激发下测试其荧光发射光谱,根据荧光强度与dpa浓度之间的关系,绘制工作曲线;
4)检测
将待测样品代替dpa标准溶液,通过标准加入法加入,振荡使其混合均匀,10s后用荧光光谱仪在275nm的激发下测试其荧光发射光谱,将荧光强度代入工作曲线,即得待测样品中的dpa浓度;
其中,所述的待测样品为10%人尿液或1%牛血清。
本发明采用his@zif-8/tb3+复合材料测定炭疽孢子生物标志物dpa含量的原理为:当“天线”分子dpa与tb3+相连接时存在能量转移,进而触发tb3+的固有荧光,通过对其荧光光谱变化进行测定。
与现有技术相比,本发明的有益效果如下:
1)所使用的复合材料制备过程简单,并且在室温下进行,而不使用高毒性试剂。
2)zif-8的高度均匀的纳米级空腔和大的比表面积不仅在目标物的特异性识别中起重要作用,而且还促进目标物在孔中的富集,以此获得较低的检测限和较高的灵敏度。
3)his@zif-8拥有比其他mofs更高的水稳定性。
4)响应迅速,10s后即可进行检测。
5)本发明提供了一种高选择性、高灵敏性的采用his@zif-8/tb3+复合材料测定炭疽孢子生物标志物dpa含量的方法。
附图说明
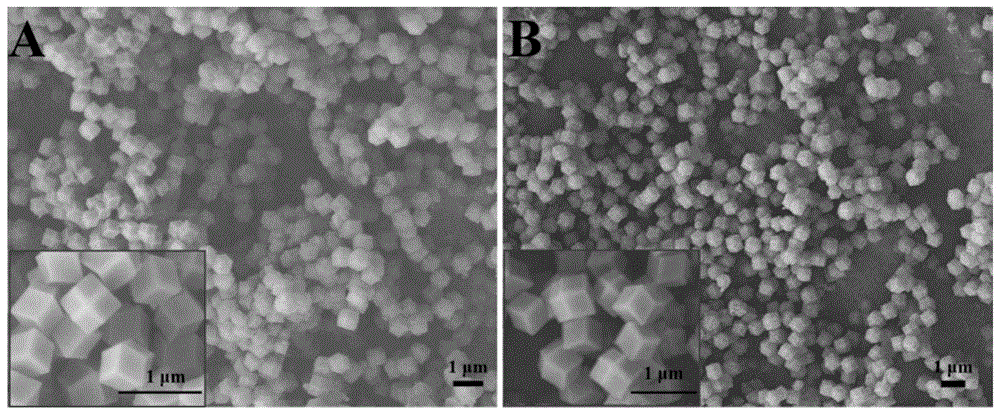
图1是本发明his@zif-8和his@zif-8/tb3+复合材料的扫描电镜图;
a为his@zif-8复合材料的扫描电镜图;
b为his@zif-8/tb3+复合材料的扫描电镜图;
图2是本发明his@zif-8和his@zif-8/tb3+复合材料的xrd衍射图;
图3是本发明his@zif-8和his@zif-8/tb3+复合材料的xps图;
图4是本发明his@zif-8和his@zif-8/tb3+复合材料的n2吸附-解吸曲线图;
图5是本发明实施例1中1μmol/ldpa所对应的his@zif-8/tb3+复合材料随ph(a)和时间(b)变化的荧光强度图;
图6是本发明实施例1的不同浓度的dpa引起的his@zif-8/tb3+复合材料荧光光谱变化图(a)及在0.1~10μmol/l的线性关系图(b);
图7是本发明实施例制备的复合材料的选择性对照。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
实施例1
本发明his@zif-8复合材料的制备过程如下:
a、将3.0mmol组氨酸溶于40ml去离子水中,然后,将250μl的三乙胺加入组氨酸溶液中并搅拌5min。
b、将6.0mmol六水合硝酸锌和21.0mmol2-甲基咪唑分别溶解在100ml和60ml甲醇中,得六水合硝酸锌溶液和2-甲基咪唑溶液;
c、为了制备zifs前体溶液,首先将2-甲基咪唑溶液与组氨酸溶液混合,并搅拌15min,然后加入六水合硝酸锌溶液,将上述混合溶液在室温下搅拌24h,通过在7000rpm下离心5min收集产物,并用甲醇反复洗涤3次,将得到的白色粉末在60℃烘箱中干燥。
本发明his@zif-8/tb3+复合材料的制备过程如下:
将30.0mghis@zif-8分散到60.0ml硝酸铽乙醇溶液(10mmol/l)中,然后将上述溶液在室温下搅拌3h,通过在7000rpm下离心5min收集产物,并用乙醇反复洗涤3次,将得到的白色粉末在烘箱中在60℃烘箱中干燥。
本发明将his@zif-8/tb3+复合材料成功应用于dpa标准溶液的灵敏检测。
具体步骤如下:
1)将本发明制备的his@zif-8/tb3+复合材料分散到水溶液中,配制成浓度为50mg/l的分散液。
2)在100μlhis@zif-8/tb3+水溶液中加入800μlhepes(ph=7.4,20mmol/l)缓冲溶液及从0mol/l到10μmol/l的不同浓度的dpa,振荡使其充分混合均匀,10s后用荧光光谱仪在275nm的激发下测试其荧光发射光谱,根据荧光强度与dpa浓度之间的关系,绘制工作曲线;
图5a是本发明实施例1中his@zif-8/tb3+和1μmol/ldpa所对应的his@zif-8/tb3+复合材料随ph变化的荧光强度图。当ph值高于7.0时,his@zif-8/tb3+溶液和his@zif-8/tb3++dpa溶液的荧光强度均略有增加。此外,荧光响应值在7.4-9.0的ph范围内大致相同,且7.4为生理ph值。因此,我们选择ph=7.4作为检测dpa的最佳ph值。
图5b为1μmol/ldpa所对应的his@zif-8/tb3+复合材料随时间变化的荧光强度图。随着反应时间的增加,his@zif-8/tb3+复合材料的荧光强度逐渐增加,当时间增加到10s时,his@zif-8/tb3+复合材料的荧光强度趋于平稳。因此,在本实施例中,选择10s的反应时间作为最优条件对dpa进行检测。
图6a是本发明实施例1的在最优反应条件下的不同浓度的dpa引起的his@zif-8/tb3+复合材料的荧光强度变化曲线图,自下而上分别是自0至10μmol/ldpa对应的荧光曲线,随着dpa浓度的增大,his@zif-8/tb3+复合材料的荧光强度随之增强。
图6b是dpa浓度在0.1至10μmol/l范围内,该发明实施例展现的检测dpa有良好的线性范围。线性结果f=529.2896c+235.8932,r2=0.9988,最低检测下限为20nmol/l。
图7是本发明实施例的选择性对照,为了证明本发明复合材料对dpa的选择性,设计了2种对照组,空白对照及干扰物质存在的情况下测定复合材料的荧光强度变化。结果表明,复合材料的荧光强度只有在待测物存在下才会变化,其他各种干扰物质基本不影响荧光强度的变化。
实施例2
本发明采用实施例1制备的his@zif-8/tb3+复合材料,成功应用于10%人尿液中dpa的标准加入法检测。
具体步骤如下:
1)用0.45μm滤膜过滤人尿液样品,以除去任何潜在的微粒悬浮液。通过加入三种不同浓度(0.5、1.0和5.0μmol/l)的dpa进行回收试验。在测试溶液中,人尿液最终被稀释10倍。
2)其余如实施例1。
从表格1可以看出,回收率在98.7-103.2%范围内,相对标准偏差(n=3)小于3%,表明该复合材料在10%人尿液生物样品中检测dpa的准确度和精密度较高。
实施例3
本发明采用实施例1制备的his@zif-8/tb3+复合材料,成功应用于1%牛血清中dpa的标准加入法检测。
具体步骤如下:
1)采用三氟乙酸将牛血清样品水解,除去蛋白质后,离心得到牛血清处理液,并用hepes缓冲溶液(ph=7.4,20mmol/l)稀释10倍,通过加入三种不同浓度(0.5、1.0和5.0μmol/l)的dpa进行回收试验。在测试溶液中,牛血清最终被稀释100倍。
2)其余如实施例1。
从表格1可以看出,回收率在97.2-102.7%范围内,相对标准偏差(n=3)小于5%,表明该复合材料在1%牛血清样品中检测dpa的准确度和精密度较高。
表1回收试验结果
/:未检出。
- 还没有人留言评论。精彩留言会获得点赞!