一种新型无标记的铽(III)-核酸适体传感器及其制备方法与应用与流程
本发明属于生物医药
技术领域:
,具体涉及一种新型无标记的铽(iii)-核酸适体传感器及其制备方法与应用,特别涉及一种新型无标记的铽(iii)-核酸适体传感器在制备诊断急性淋巴细胞白血病的产品中的应用。
背景技术:
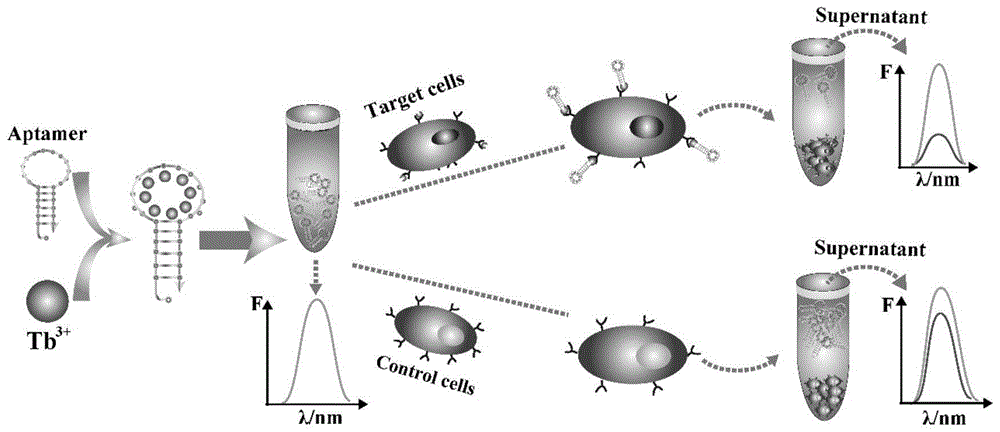
:急性淋巴细胞白血病是一种常见且致命的癌症,通常始于骨髓,其特征是儿童和青少年中存在大量未成熟的白细胞。这种疾病不仅需要大量的医疗卫生资源,而且还会对人民的生活水平和社会福利产生负面影响。急性淋巴细胞白血病可导致骨髓中原代细胞的异常增殖和积聚,并抑制造血发育,导致贫血,血小板减少和中性粒细胞减少。此外,原代细胞还可以渗入肝脏,脾脏和其他外部组织,引起相应的病变。目前,临床检测白血病的方法主要有荧光标记分析、流式细胞分析、免疫组织化学分析等。然而,由于这些方法不仅昂贵,耗时,复杂且劳动密集,而且还需要复杂的仪器,具有低灵敏度并且需要多步骤处理等缺点,因此不适合于简单和快速的医学分析。核酸适体(aptamer)是一类能与靶标物质特异性相互作用的单链dna、rna、肽核酸或化学修饰的核酸序列,通常由15-80个核苷酸组成。核酸适体不仅可以作用于无机离子,小分子,生物大分子,还可以结合超分子物质,如细胞,病毒和病理组织切片,具有亲和力高,特异性好,无免疫原性,易合成、改造与修饰,生物化学稳定性好,能可逆变性与复性等特性,被称之为“化学抗体”。稀土铽离子(tb3+)是一种很有前景的非标记荧光探针,由于其具有独特的光学性质,如长荧光寿命,大的斯托克斯位移和窄发射带而备受关注。技术实现要素:本发明的目的是提供一种新型无标记的铽(iii)-核酸适体传感器及其在制备诊断急性淋巴细胞白血病的产品中的应用。为了实现上述目的,本发明首先提供了一种探针。本发明提供的探针名称为tb3+-apt探针或铽(iii)-核酸适体传感器,其包括核酸适体和tb3+;所述核酸适体富含碱基g,且具有发夹结构,且靶向肿瘤细胞或癌细胞。上述tb3+-apt探针中,所述富含碱基g为碱基g含量至少为20%。上述tb3+-apt探针中,所述核酸适体与所述tb3+的摩尔量比可为1:(2000-4000)。在本发明的一个具体实施例中,所述核酸适体与所述tb3+的摩尔量比为5×10-3:20(1:4000)。进一步的,所述探针还可包括mg2+;所述mg2+用于稳定寡核苷酸(核酸适体)构象并降低其他金属离子与寡核苷酸(核酸适体)之间的非特异性结合。所述核酸适体、所述tb3+和所述mg2+的摩尔量比可为1:(2000-4000):(100-200)。在本发明的一个具体实施例中,所述核酸适体、所述tb3+和所述mg2+的摩尔量比为5×10-3:20:1(1:4000:200)。更进一步的,所述探针还可包括缓冲液;所述缓冲液具体可为pbs缓冲液和hepes缓冲液。上述tb3+-apt探针中,所述核酸适体可为靶向急性淋巴细胞白血病细胞的核酸适体,如靶向人急性淋巴细胞白血病t淋巴细胞ccrf-cem的sgc8核酸适体。所述sgc8适体是特异性识别ccrf-cem细胞的核酸适体。sgc8适体的碱基g含量为26.8%且具有发夹结构(sgc8适体第2-7位所示的dna分子与第35-41位所示的dna分子互补配对,可形成发夹结构)。在本发明的一个具体实施例中,所述探针由sgc8核酸适体、硝酸铽、硝酸镁、pbs缓冲液和hepes缓冲液组成。其中,sgc8核酸适体在所述探针中的终浓度为25μm,tb3+在所述探针中的终浓度为100mm,mg2+在所述探针中的终浓度为5mm。本发明的探针可用于检测或辅助检测肿瘤细胞或癌细胞(如急性淋巴细胞白血病细胞),进而实现肿瘤或癌症(如急性淋巴细胞白血病)的诊断。在实际应用中,可将待测样本溶液(如血液样本或肿瘤细胞悬液或癌细胞悬液)与上述tb3+-apt探针按照体积比为4:1的比例混匀,得到tb3+-apt工作液。核酸适体(如sgc8核酸适体)在tb3+-apt工作液中的终浓度为5μm,tb3+在tb3+-apt工作液中的终浓度为20mm,mg2+在tb3+-apt工作液中的终浓度为1mm。为了实现上述目的,本发明还提供了上述tb3+-apt探针的制备方法。本发明提供的tb3+-apt探针的制备方法包括如下步骤:将核酸适体溶液和tb3+溶液混匀,得到所述探针;所述核酸适体溶液是将核酸适体与缓冲液混匀得到的;所述tb3+溶液是将tb3+与缓冲液混匀得到的。进一步的,所述核酸适体溶液中的缓冲液为pbs缓冲液。所述tb3+溶液是将硝酸铽与含有mg2+的缓冲液混匀得到的。所述含有mg2+的缓冲液是将硝酸镁与hepes缓冲液混匀得到的。更进一步的,所述核酸适体溶液中,所述核酸适体的浓度可为50μm。所述tb3+溶液中,所述tb3+浓度可为200mm,所述mg2+浓度可为10mm。所述核酸适体溶液和所述tb3+溶液等体积混匀。上述方法中,所述核酸适体为靶向人急性淋巴细胞白血病t淋巴细胞ccrf-cem的sgc8核酸适体。所述sgc8核酸适体在所述探针中的终浓度为25μm,所述tb3+在所述探针中的终浓度为100mm,所述mg2+在所述探针中的终浓度为5mm。为了实现上述目的,本发明又提供了一种产品。本发明提供的产品包括上述tb3+-apt探针或按照上述tb3+-apt探针的制备方法制备得到的探针;所述产品的功能为a1)-a8)中任一种:a1)检测或辅助检测肿瘤细胞或癌细胞;a2)制备检测或辅助检测肿瘤细胞或癌细胞的产品;a3)诊断肿瘤或癌症;a4)制备诊断肿瘤或癌症的产品;a5)检测或辅助检测急性淋巴细胞白血病细胞;a6)制备检测或辅助检测急性淋巴细胞白血病细胞的产品;a7)诊断急性淋巴细胞白血病;a8)制备诊断急性淋巴细胞白血病的产品。进一步的,所述产品还可包括用于培养肿瘤细胞或癌细胞的培养基、用于洗涤肿瘤细胞或癌细胞的缓冲液和荧光分光光度计。更进一步的,所述培养基为含10%胎牛血清和100u/ml青霉素-链霉素的培养基1640;所述缓冲液为pbs缓冲液;所述荧光分光光度计为f-7000荧光分光光度计。为了实现上述目的,本发明还提供了上述tb3+-apt探针或按照上述tb3+-apt探针的制备方法制备得到的探针或上述产品的新用途。本发明提供了上述tb3+-apt探针或按照上述tb3+-apt探针的制备方法制备得到的探针或上述产品在如下a1)-a8)中任一种中的应用:a1)检测或辅助检测肿瘤细胞或癌细胞;a2)制备检测或辅助检测肿瘤细胞或癌细胞的产品;a3)诊断肿瘤或癌症;a4)制备诊断肿瘤或癌症的产品;a5)检测或辅助检测急性淋巴细胞白血病细胞;a6)制备检测或辅助检测急性淋巴细胞白血病细胞的产品;a7)诊断急性淋巴细胞白血病;a8)制备诊断急性淋巴细胞白血病的产品。为了实现上述目的,本发明最后提供了一种检测或辅助检测肿瘤细胞或癌细胞的方法。本发明提供的检测或辅助检测肿瘤细胞或癌细胞的方法包括如下步骤:(b1)绘制标准曲线配制系列浓度的肿瘤细胞或癌细胞细胞溶液,将所得的若干份肿瘤细胞或癌细胞溶液分别与上述tb3+-apt探针或按照上述tb3+-apt探针的制备方法制备得到的探针混合,分别得到检测溶液;在黑暗中温育所述检测溶液,离心,收集上清液;用荧光分光光度计检测所述上清液的荧光强度;以肿瘤细胞或癌细胞溶液浓度或其对数值为横坐标,以荧光强度为纵坐标,绘制标准曲线图,得到标准曲线方程;(b2)待测样本检测将待测样本与上述tb3+-apt探针或按照上述tb3+-apt探针的制备方法制备得到的探针混合,得到检测溶液;在黑暗中温育所述检测溶液,离心,收集上清液;用荧光分光光度计检测所述上清液的荧光强度;将所述荧光强度代入步骤b1)所得标准曲线方程,计算得到所述待测样本中的肿瘤细胞或癌细胞浓度值。上述方法中,所述肿瘤细胞或癌细胞溶液或待测样本溶液与上述tb3+-apt探针或按照上述tb3+-apt探针的制备方法制备得到的探针的体积比可为4:1。所述核酸适体在所述检测溶液中的终浓度为5μm,所述tb3+在所述检测溶液中的终浓度为20mm,所述mg2+在所述检测溶液中的终浓度为1mm。上述方法中,所述温育的条件为4℃、黑暗温育10min。用荧光分光光度计在290nm激发波长下检测所述上清液的荧光强度。检测所述上清液的荧光强度前还包括将所述上清液ph值调节至9.6的步骤。上述方法中,所述待测样本可为待测患者的血液样本或肿瘤细胞悬液或癌细胞悬液。在本发明的一个具体实施例中,所述待测样本为ccrf-cem细胞悬液。上述方法中,所述肿瘤细胞或癌细胞可为急性淋巴细胞白血病细胞,具体可为人急性淋巴细胞白血病t淋巴细胞ccrf-cem。上述方法中,所述标准线性方程具体可为f=-751.67logc+5435.7,其中,f为荧光强度,c为ccrf-cem细胞浓度(细胞个数/每毫升)。本发明的基于铽(iii)-核酸适体(tb3+-apt)的无标记信号荧光适体传感器检测白血病细胞的原理如下:tb3+-apt探针中,核酸适体可使tb3+的荧光敏感并形成强荧光,作为靶细胞的人急性淋巴细胞白血病t淋巴细胞ccrf-cem可与tb3+-apt探针组合形成tb3+-apt-cem复合物,其在离心时形成上清液,其荧光信号可用荧光分光光度计检测。浓度范围为5-5×106细胞/ml的ccrf-cem细胞浓度的对数值和荧光信号之间呈现良好的线性关系(r2=0.9881),因此,可通过该方法实现待测样本中ccrf-cem细胞的检测,进而实现急性淋巴细胞白血病的诊断。本发明利用核酸适体致敏稀土tb3+荧光的特征,设计了一种用于ccrf-cem细胞的无标记信号敏感荧光检测法。本发明检测方法的检测限高达5个细胞/毫升。该无标记信号敏感荧光检测法具有选择性高,操作简便,快速的优点,有望为急性淋巴细胞白血病的超灵敏诊断提供一种稳健,简便,廉价的新方法。附图说明图1为用于检测ccrf-cem细胞的tb3+-apt荧光适体传感器的示意图。图2为不同检测体系的荧光强度检测结果。图2a为在不同条件下tb3+、apt和细胞ccrf-cem的荧光发射光谱:a、tb3+;b、apt;c、tb3++apt;d、tb3++apt+cem;e、tb3++apt+romas;f、cem;g、romos。图2b为在不同条件下tb3+、apt和ccrf-cem的荧光发射光谱的定量分析。ns,无统计学意义,*p<0.05,具有统计学意义。图2c为具有不同金属离子的适体的荧光发射光谱。图2d为具有不同金属离子的适体的荧光发射光谱的统计分析,显示tb3+和其他离子之间的显着差异。图3为tb3+浓度和检测条件的优化。图3a为不同浓度的tb3+(20mm)的荧光强度检测结果。图3b为不同ph的检测体系的荧光强度检测结果。图3c为温育不同时间的检测体系的荧光强度检测结果。图3d为不同温度温育的检测体系的荧光强度检测结果。图4为用于检测ccrf-cem细胞的tb3+-apt荧光适体传感器的灵敏度和特异性的测定结果。图4a为在不同浓度的ccrf-cem细胞存在下tb3+-apt荧光适体传感器的荧光发射光谱,a、101细胞/200μl,d、102细胞/200μl,e、103细胞/200μl,f、104细胞/200μl,g、105细胞/200μl,h、106细胞/200μl。图4b为荧光强度与ccrf-cem细胞浓度之间的线性关系。图4c为用于检测ccrf-cem细胞的tb3+-apt荧光适体传感器的特异性。图4d为与tb3+-apt混合后六种不同细胞的荧光显微照片。细胞核用dapi染色。比例尺表示50μm。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中的具有5'-atctaactgctgcgccgccgggaaaatactgtacggttaga-3'序列的无标记sgc8适体(apt)是shanghaisangonbiologicalengineeringtechnology&services(中国上海)的产品。sgc8适体是特异性识别ccrf-cem细胞的核酸适体。sgc8适体的碱基g含量为26.8%且具有发夹结构(sgc8适体第2-7位所示的dna分子与第35-41位所示的dna分子互补配对,可形成发夹结构)。下述实施例中的4-(2-羟基-乙基)哌嗪-1-乙磺酸(hepes,ph=7.2~7.4,>99.5%),金属盐的硝酸盐(>99%),包括钾(k+)、钠(na+)、银(ag+)、镁(mg2+)、钙(ca2+)、铜(cu2+)、铁(fe3+)和铽(tb3+)均是sigma-aldrich,inc的产品。下述实施例中的pbs缓冲液(10mm,ph7.2)是北京索莱宝科技有限公司的产品。下述实施例中的所有溶液均用从milli-q纯化系统(milli-pore,bedford,ma)纯化的18.2mω的超纯水制备。下述实施例中的人急性淋巴细胞白血病t淋巴细胞系ccrf-cem,人burkitt淋巴瘤细胞系ramos,慢性粒细胞白血病细胞系k562,人早幼粒细胞白血病细胞系hl-60,人外周血淋巴细胞pbl,人巨噬细胞系thp-1和人组织细胞淋巴瘤细胞系u937均是中国科学院细胞库(中国上海)的产品。下述实施例中ccrf-cem、ramos、k562、hl-60、thp-1和u937细胞系的培养方法:在37℃、5%二氧化碳(95%氧气)条件下培养,培养基为含10%胎牛血清(fbs,gibco)和100u/ml青霉素-链霉素(gibco,grandisland,ny,usa)的培养基1640。下述实施例中所有荧光测量均在350μl石英比色皿中进行,激发波长为290nm,用f-7000荧光分光光度计(hitachicompany,tokyo,japan)以5nm的激发和发射狭缝记录发射光谱。峰值强度在545nm处获得,采样范围记录在460nm至560nm。下述实施例中所有原子力显微镜成像均通过荧光显微镜(nikonds-ri1;nikon,tokyo,japan)进行。下述实施例中的细胞计数采用细胞计数试剂盒-8,细胞计数试剂盒-8是日本dojindo的产品。下述实施例中的统计分析方法:每个实验一式三份进行。数据表示为平均值±sd或中值(范围)。使用graphpadprism6.02(graphpadsoftware,sandiego,ca,usa)进行所有统计学分析。p<0.05被认为具有统计学意义。实施例1、tb3+-apt荧光适体传感器的制备及其在检测ccrf-cem细胞中的应用一、tb3+-apt荧光适体传感器的制备1、tb3+-apt荧光适体传感器储存液的制备将252μl的浓度为50μmsgc8适体溶液(sgc8适体溶液是将sgc8适体与pbs缓冲液(10mm,ph7.2)混匀得到的)和252μl的tb3+浓度为200mmtb3+溶液(tb3+溶液是将硝酸铽溶液和含有硝酸镁的hepes缓冲液(200mm,10mm硝酸镁,ph7.2)混匀得到的)混匀,得到tb3+-apt荧光适体传感器储存液(ph7.2),并将该储存液在4℃黑暗下储存。sgc8适体在储存液中的终浓度为25μm,tb3+在储存液中的终浓度为100mm,mg2+在储存液中的终浓度为5mm。2、tb3+-apt荧光适体传感器工作液的制备在实际应用中,将160μl的待测样本溶液(如细胞悬液或血液样本)与40μl的tb3+-apt荧光适体传感器储存液混匀,得到tb3+-apt荧光适体传感器工作液(ph7.2)。sgc8适体在工作液中的终浓度为5μm,tb3+在工作液中的终浓度为20mm,mg2+在工作液中的终浓度为1mm。二、利用tb3+-apt荧光适体传感器检测ccrf-cem的方法1、将ccrf-cem细胞或ramos细胞在37℃、5%二氧化碳(95%氧气)条件下培养,培养基为。2、培养3天后离心(1000rpm,3min),收集1ml的ccrf-cem细胞沉淀或ramos细胞沉淀,用pbs洗涤细胞三次,然后排出上清液并重悬于160μl的pbs中,得到ccrf-cem细胞悬液或ramos细胞悬液。3、利用tb3+-apt荧光适体传感器检测ccrf-cem,按照检测体系中的组分不同,分为如下各组:tb3+:将硝酸铽溶液和含有硝酸镁的hepes缓冲液混匀,得到检测体系(ph7.2),tb3+在检测体系中的终浓度为20mm,mg2+在检测体系中的终浓度为1mm。apt:将sgc8适体溶液与hepes缓冲液混匀,得到检测体系(ph7.2),sgc8适体在检测体系中的终浓度为5μm。tb3++apt:将sgc8适体溶液和含有硝酸镁的hepes缓冲液混匀,得到检测体系(ph7.2),sgc8适体在检测体系中的终浓度为5μm,tb3+在检测体系中的终浓度为20mm,mg2+在检测体系中的终浓度为1mm。tb3++apt(sgc8适体)+cem:向160μl的ccrf-cem细胞悬液中加入40μl的tb3+-apt荧光适体传感器储存液并充分混合,得到检测体系(ph9.6)。ccrf-cem细胞在检测体系中的浓度为1×106细胞/200μl,sgc8适体在检测体系中的终浓度为5μm,tb3+在检测体系中的终浓度为20mm,mg2+在混合体系中的终浓度为1mm。tb3++apt(随机序列适体)+cem:向160μl的ccrf-cem细胞悬液中加入40μl的tb3+-apt(随机序列适体)荧光适体传感器储存液并充分混合,得到检测体系(ph9.6)。ccrf-cem细胞在检测体系中的浓度为1×106细胞/200μl,apt(随机序列适体)在检测体系中的终浓度为5μm,tb3+在检测体系中的终浓度为20mm,mg2+在混合体系中的终浓度为1mm。tb3++apt(sgc8适体)+romos:向160μl的ramos细胞悬液中加入40μl的tb3+-apt荧光适体传感器储存液并充分混合,得到检测体系(ph9.6)。ramos细胞在检测体系中的浓度为1×106细胞/μl,sgc8适体在检测体系中的终浓度为5μm,tb3+在检测体系中的终浓度为20mm,mg2+在混合体系中的终浓度为1mm。4、将步骤3中的各组检测体系在4℃下在黑暗中温育10min。然后将样品1000rpm离心3min,收集160μl上清液并将ph值调节至9.6,再通过荧光光谱在460nm-560nm的波长范围内进行荧光检测。检测原理如下:sgc8适体使tb3+的荧光敏感,并形成强荧光tb3+-apt探针。将tb3+-apt探针加入靶细胞ccrf-cem中,可形成tb3+-apt-cem复合物,其在离心时形成上清液,上清液荧光可用荧光分光光度计检测(图1)。结果如图2a和图2b所示。结果表明:上述各组检测体系中,tb3+-apt组和tb3++apt(sgc8适体)+romos组检测体系的荧光强度最强。当将非靶标romas细胞加入到tb3+-apt探针溶液中时(tb3++apt(sgc8适体)+romos组检测体系),荧光强度几乎没有变化。当非靶向的富含碱基g的随机序列适体与cem细胞一起温育时(tb3++apt(随机序列适体)+cem组检测体系),荧光强度也几乎不会衰减。而当靶标cem细胞加入到tb3+-apt探针溶液中时(tb3++apt(sgc8适体)+cem组检测体系),cem细胞膜表面上的ptk7蛋白特异性结合sgc8适体,靶细胞离心除去探针后,在上清液中几乎不存在tb3+-apt探针,荧光强度显著降低。统计图也显示了类似的结果。三、利用荧光适体传感器检测ccrf-cem的方法优化1、不同检测离子的优化将步骤二的3中的tb3++apt检测体系中的tb3+替换为钾(k+)、钠(na+)、银(ag+)、镁(mg2+)、钙(ca2+)、铜(cu2+)和铁(fe3+),得到不同离子的检测体系,并检测不同离子检测体系的荧光强度。同时以不加检测离子作为对照(ctrl)。结果如图2c和图2d所示。结果表明:只有tb3+与sgc8适体结合会产生较强的发射光,而当sgc8适体与其他离子混合时,其他金属离子几乎不显示任何荧光。tb3+与具有适体的其他不同离子之间的反应的统计图也显示出类似的趋势。2、tb3+离子浓度的优化将步骤二的3中的tb3++apt检测体系中的tb3+离子浓度替换为0mm、5mm、15mm、20mm、25mm、30mm、35mm,得到不同tb3+离子浓度的检测体系,并检测不同tb3+离子浓度的检测体系的荧光强度。结果如图3a所示。结果表明:tb3+离子浓度为20mm时荧光最强。3、不同ph的优化将步骤二的3中的tb3++apt检测体系中的ph值分别替换为ph4.8、ph6.0、ph7.2、ph8.4、ph9.6、ph11.0、ph12.0和ph13.0,得到不同ph的检测体系,并检测不同ph的检测体系的荧光强度。结果如图3b所示。结果表明:ph9.6时荧光最强。4、温育时间的优化将步骤二的3中的tb3++apt(sgc8适体)+cem检测体系在4℃温育0min、5min、10min、20min、30min、40min、60min,得到温育不同时间的检测体系,并检测温育不同时间的检测体系的荧光强度。结果如图3c所示。结果表明:温育时间为10min时荧光最强。5、温育温度的优化将步骤二的3中的tb3++apt(sgc8适体)+cem检测体系分别在4℃、25℃、37℃条件下温育10min,得到不同温度温育的检测体系,并检测温育不同时间的检测体系的荧光强度。结果如图3d所示。结果表明:温育温度为4℃时荧光最强。实施例2、tb3+-apt荧光适体传感器的灵敏度测定一、本发明的tb3+-apt荧光适体传感器的灵敏度测定1、检测体系的制备向160μl的不同浓度的ccrf-cem细胞悬液中加入40μl的tb3+-apt荧光适体传感器储存液并充分混合,得到不同细胞浓度的检测体系(ph9.6)。ccrf-cem细胞在检测体系中的浓度分别为1×101细胞/200μl、1至1×102细胞/200μl、1×103细胞/200μl、1×104细胞/200μl、1×105细胞/200μl、1×106细胞/200μl,sgc8适体在检测体系中的终浓度为5μm,tb3+在检测体系中的终浓度为20mm,mg2+在检测体系中的终浓度为1mm。2、荧光强度检测将步骤1中的各组检测体系在4℃下在黑暗中温育10min。然后将样品1000rpm离心3min,收集160μl上清液并将ph值调节至9.6,按照实施例1步骤二的4中的方法检测不同细胞浓度的检测体系的荧光强度。并以细胞浓度的对数值为横坐标,荧光强度为纵坐标绘制标准曲线。结果如图4a和图4b所示。结果表明:随着细胞浓度增高,荧光强度逐渐减弱。在1至106个细胞/200μl的范围内,cem细胞浓度的对数显示出与荧光信号强度的良好线性关系。线性方程为f=-751.67logc+5435.7(f为荧光强度,c为cem细胞浓度),r2=0.9997,检测限为5个细胞/ml。二、灵敏度比较将本发明的利用tb3+-apt荧光适体传感器检测ccrf-cem的方法与现有技术中的其他检测方法的线性范围和检出限进行比较。其中“比色”检测方法参照文献h.shi,d.li,f.xu,etal.theanalyst,2014,139,4181-4184.中的方法进行;“石英晶体微量天平”检测方法参照文献y.pan,m.guo,z.nie,etal.biosensors&bioelectronics,2010,25,1609-1614.中的方法进行;“适体缀合的磁珠”检测方法参照文献j.zhu,t.nguyen,r.pei,etal.labonachip,2012,12,3504-3513.中的方法进行;“流式细胞术”检测方法参照文献j.yin,x.he,k.wang,etal.analyticalchemistry,2013,85,12011-12019.中的方法进行。结果如表1所示。结果表明:与现有技术中的方法相比,本发明的利用tb3+-apt荧光适体传感器检测ccrf-cem的方法的灵敏度更高。表1、本发明方法与现有技术方法的分析性质比较检测方法线性范围检出限cells/ml比色3.30×103-2.69×103214石英晶体微量天平8.00×103-1.00×1058000适体缀合的磁珠1.00×104-1.50×1058000流式细胞术7.50×103-6.25×105750tb3+-apt荧光适体传感器5.00-5.00×1065实施例3、tb3+-apt荧光适体传感器的特异性测定为了研究tb3+-apt荧光适体传感器的特异性,使用f-7000荧光分光光度计和共聚焦荧光显微镜测试不同的血液相关癌细胞,包括ccrf-cem细胞、hl-60细胞、ramos细胞、k562细胞、pbl细胞、thp-1细胞和u937细胞。具体步骤如下1、向160μl的ccrf-cem细胞悬液中加入40μl的tb3+-apt荧光适体传感器储存液并充分混合,得到ccrf-cem检测体系(ph9.6)。ccrf-cem细胞在ccrf-cem检测体系中的浓度为1×106细胞/200μl,sgc8核酸适体在检测体系中的终浓度为5μm,tb3+在检测体系中的终浓度为20mm,mg2+在检测体系中的终浓度为1mm。2、将上述ccrf-cem细胞分别替换为hl-60细胞、ramos细胞、k562细胞、pbl细胞、thp-1细胞和u937细胞,分别得到hl-60细胞检测体系、ramos细胞检测体系、k562细胞检测体系、pbl细胞检测体系、thp-1细胞检测体系和u937细胞检测体系。将各个检测体系在4℃下在黑暗中温育10min。然后1000rpm离心3min,收集160μl(去除可能含有40μl底部细胞的流体)上清液并将ph调节至9.6,用f-7000荧光分光光度计检测上清液的荧光强度,并计算荧光强度率(f-f0)/f。其中f代表材料(tb3+-apt荧光适体传感器)荧光强度,f0代表检测的细胞荧光强度。结果如图4c所示,结果表明:靶细胞ccrf-cem细胞的荧光强度率(f-f0)/f显著高于其他对照细胞,说明靶细胞ccrf-cem细胞的荧光强度最弱,tb3+-apt荧光适体传感器与靶细胞ccrf-cem细胞特异性结合。3、将步骤2中的各个检测体系在4℃下在黑暗中温育10min。然后用pbs洗涤,并将洗涤后的细胞用4%多聚甲醛(sigma-aldrich,st.louis,mo,usa)固定10min,再用pbs洗涤,并用4',6-二脒基-2-苯基吲哚二盐酸盐(dapi;lifetechnologies,foster)染色。在黑暗中放置5min。最后用pbs洗涤细胞并通过共聚焦荧光显微镜观察。结果如图4d所示,结果表明:tb3+-apt荧光适体传感器与共聚焦显微镜检测到的靶细胞ccrf-cem细胞结合良好,发出绿色荧光,而tb3+-apt荧光适体传感器不与其他细胞结合,因为只能看到蓝色细胞核。说明本发明方法对cem细胞具有较强的抗干扰能力和较高的特异性。以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1