一种快速检测活动性结核的试剂盒的制作方法
本发明属于检测领域,具体涉及一种快速检测活动性结核的试剂盒。
背景技术:
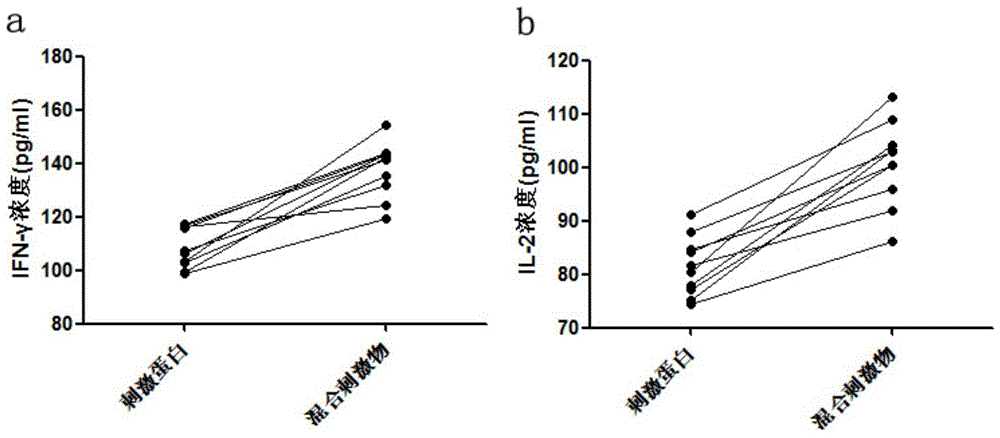
:结核病是一种常见的由结核分枝杆菌引起的慢性传染病,可侵及许多脏器,以肺部结核感染最为常见。目前全球有近1/3的人感染结核杆菌,统计数据表明在2013年有150万人死于结核病,900万新发病例,结核病已成为全世界成人因传染病而死亡的主要疾病之一。中国是全球22个结核病高负担国家之一,活动性肺结核病人数居世界第二位。结核病的传染主要是发生在病人未被发现并进行治疗之前,1名结核病患者一年中通过密切接触可传染多达10-15人。结核病的传播方式为经呼吸道传播,在肺结核病人的肺中有大量的结核杆菌,如果他对着健康人群咳嗽或打喷嚏的话就很有可能将病菌传播给健康人。而在未发现病患前,病人未采取任何预防手段,在与家庭成员、同事、同学等密切接触的过程中,接触者就容易被结核菌感染。现阶段结核病的主要治疗方法主为药物治疗,但是这样的治疗不能够完全阻止结核病的传播。接种卡介苗(bcg)是目前国际公认的最有效预防结核病的免疫方法,中国的计划免疫接种程序中规定新生儿须接种卡介苗,但是其保护效率也并未达到100%,因此,预防结核病的首要措施是尽早发现隐藏在人群中的新发病人。活动性结核是指患有结核病,证明有结核分枝杆菌排出,病灶属于活动期,胸片上常有斑片状阴影或是结核空洞,或者播散病灶,说明结核分枝杆菌繁殖活跃,毒力强。活动性结核患者是结核病的主要传染源,如不能及时诊断治疗,会造成结核病的大范围传播,快速准确的检出活动性结核患者是降低结核病发病率及病死率的关键。目前临床常用于活动性结核诊断的方法中,影像学方法特异性差,诊断过程与医生的经验紧密相关,诊断结果带有较强的主观性;痰培养方法是结核诊断金标准,但敏感性低,且耗时长(2-8周),不利于结核的早期诊断;抗酸染色法敏感性仅有20-30%;分子诊断方法(如pcr)重复性差,且操作繁琐,对实验室环境有一定的要求;结核菌素试验(tst)易受卡介苗(bcg)接种的影响,造成检测结果的假阳性。近年来出现了以t细胞为基础的γ-干扰素释放试验,但是该方法仅能判断患者是否感染了(过)结核分支杆菌,无法判断是否为活动性结核。结核分枝杆菌是一种典型的胞内感染菌,人体对其免疫机制主要是以t细胞为主的细胞免疫。结核分枝杆菌侵入人体后,在机体免疫力低下的时候,巨噬细胞不能防止所吞噬的结核分枝杆菌生长,但可将吞噬的结核分枝杆菌带到他处,提呈抗原,此时结核分枝杆菌大量繁殖,使周围t淋巴细胞致敏,致敏的t淋巴细胞可产生多种细胞因子(如inf-γ、il-2与tnf-α等),这些细胞因子共同作用,杀死病灶中的结核分枝杆菌。γ-干扰素释放试验正是基于利用这一特性,利用结核分枝杆菌表达的抗原刺激外周血单核细胞产生γ干扰素。现有γ-干扰素释放试验检测试剂盒使用的刺激抗原为cfp-10与esat-6,cfp-10与esat-6为结核分枝杆菌rd区表达的蛋白,因此具有结核特异性。但现有γ-干扰素释放试验的试剂盒特异性不高,仅为70%-85%左右,仍有进一步提升的可能与需求。技术实现要素:为了克服上述现有技术的不足,本发明提出了一种快速检测活动性结核的试剂盒,通过该试剂盒可以使检测结果的特异性大幅提升,更准确的判断是否为活动性结核。为了实现上述目的,本发明所采用的技术方案是:本发明提出一种快速检测活动性结核的试剂盒,该试剂盒包括:a)刺激蛋白:cfp-10、esat-6和rv1985c,cfp-10、esat-6与rv1985c为不致病的结核分枝杆菌的特异性表面抗原;b)刺激剂;佛波醇酯类多克隆刺激剂和离子霉素,佛波醇酯类多克隆刺激剂(pma)和离子霉素(ionomysin)具有刺激活化的淋巴细胞加强合成和分泌细胞因子的能力。优选的,所述cfp-10、esat-6和rv1985c通过连接多肽按任意顺序连接成重组融合蛋白。更优选的,所述连接多肽具有seqidno:1所示的氨基酸序列。优选的,上述试剂盒的检测方法包括酶联免疫吸附法、酶联免疫斑点法、细胞内细胞因子染色法、luminex、pcr/rt-pcr法、免疫荧光法、免疫色谱法、免疫杂交法、免疫印记法和细胞增殖法。优选的,上述试剂盒的检测样本为外周血或从外周血中分离得到的淋巴细胞。优选的,上述试剂盒的检测指标为细胞因子ifn-γ和il-2的分泌量。判断是否为活动性结核的标准为:以ifn-γ的分泌量>20pg/ml、il-2的分泌量>15pg/ml为依据,当ifn-γ和il-2的检测结果均呈阳性时,即可判断为活动性结核。与γ-干扰素释放试验的试剂盒相比,增加对白介素2的检测,可以使检测结果的特异性大幅提升,即更准确的判断是否为活动性结核。上述试剂盒的其中一种使用方法为:s1、从外周血样品中分离淋巴细胞,并稀释至浓度为2.5×106个/ml的细胞溶液;使用市售的淋巴细胞分离液分离外周血样品中的淋巴细胞,取4ml生理盐水与4ml外周血混匀,并缓慢加入到淋巴细胞分离液中,于室温下以1800r/min的转速离心20min,吸取云雾层细胞并用1640培养基(rpmi-1640培养基)补足至12ml,于室温下以600r/min的转速离心10min,弃上清,用1640培养基补足沉淀至5ml并轻轻混匀,于室温下以350r/min的转速离心10min,用1640培养基或pbs磷酸缓冲盐溶液重悬细胞,即分离提纯得到淋巴细胞,将提纯得到的存活淋巴细胞进行计数,并使用aim培养基(gibco的aimv培养基)稀释至浓度为2.5×106个/ml的细胞溶液。s2、以该试剂盒作为特异刺激抗原,加入到上述细胞溶液中,混匀后置于5%co2培养箱中于37℃下恒温培养16h,收集培养物;取50μl事先配置好的混合刺激物溶液(用生理盐水将试剂盒中的刺激蛋白和刺激剂配制成混合刺激物溶液)和100μl上述细胞溶液,混匀后加入同一细胞培养孔中,设置10个复孔,然后置于5%co2培养箱中于37℃下恒温培养16h,收集培养物。s3、对上述培养物进行离心处理,收集上清,检测上清中ifn-γ和il-2的浓度,根据ifn-γ和il-2的浓度判断是否为活动性结核。上述试剂盒的另一种使用方法为:s1、以该试剂盒作为特异刺激抗原,加入到外周血中,混匀后置于5%co2培养箱中于37℃下恒温培养16h,收集血浆;取50μl事先配置好的混合刺激物溶液(用生理盐水将试剂盒中的刺激蛋白和刺激剂配制成混合刺激物溶液)和1ml外周血,混匀后置于5%co2培养箱中于37℃下恒温培养16h,收集血浆。s2、检测上述血浆中ifn-γ和il-2的浓度,根据ifn-γ和il-2的浓度判断是否为活动性结核。优选的,在上述两种使用方法中,所述刺激蛋白的终浓度为1.5-2.5μg/ml、所述佛波醇酯类多克隆刺激剂的终浓度为250-350pg/ml、所述离子霉素的终浓度为0.5-1.5μg/ml。更优选的,在上述两种使用方法中,所述刺激蛋白的终浓度为2μg/ml、所述佛波醇酯类多克隆刺激剂的终浓度为300pg/ml、所述离子霉素的终浓度为1μg/ml。两种方法相比,全血样本相较于分离淋巴细胞样本优点为更加方便快捷,缺点为对免疫系统异常的病人更易出现误诊。上述试剂盒可以应用在制备辅助诊断活动性结核或结核潜伏感染的试剂盒中。上述试剂盒还可以应用在制备评价临床抗结核治疗效果的试剂盒中。与现有技术相比,本发明的有益效果是:本发明提出一种快速检测活动性结核的试剂盒,包括刺激蛋白和刺激剂,以刺激蛋白和刺激剂组成的混合刺激物为特异刺激抗原刺激外周血淋巴细胞产生细胞因子ifn-γ和il-2,通过检测ifn-γ和il-2的分泌浓度,从而达到判断是否为活动性结核的目的。本发明的试剂盒是一种更高效的结核分枝杆菌特异性刺激物,是结核分枝杆菌特异性刺激蛋白和刺激剂的混合物,其中,刺激蛋白为不致病的结核分枝杆菌特异性表面抗原cfp-10、esat-6与rv1985c,可以刺激淋巴细胞中结核特异性的效应t细胞分泌细胞因子,与γ-干扰素释放试验的试剂盒的抗原相比新增rv1985c蛋白可提高检测系统的特异性;刺激剂为佛波醇酯类多克隆刺激剂(pma)和离子霉素(ionomysin),可以刺激活化的淋巴细胞加强合成和分泌细胞因子的能力,从而提高刺激物的能力。佛波醇酯类多克隆刺激剂(pma)和离子霉素(ionomysin)一般用于流式细胞技术th1/th2细胞的检测,佛波醇酯类多克隆刺激剂的使用浓度一般为0.5-150ng/ml,离子霉素的使用浓度一般为1-2μg/ml,而本发明发现在配合本发明所述刺激蛋白作为抗原使用的情况下,当该刺激剂浓度较低时,可刺激被抗原活化的淋巴细胞加强相关细胞因子的分泌量而不影响其他淋巴细胞的分泌。佛波醇酯类多克隆刺激剂在本发明中使用的浓度为250-300pg/ml、离子霉素为0.5-1.5μg/ml,在其刺激下活化的淋巴细胞分泌细胞因子的能力得到增强,进一步提高了检测系统的特异性。与此同时,本发明通过大量的筛选实验,发现经过特异性刺激抗原(本发明的试剂盒)诱导的外周血单个核细胞所分泌的细胞因子中ifn-γ和il-2与病人的疾病状态有密切的联系,因此,通过检测这两个因子的分泌量可对患者是否为活动性结核进行准确判断,更有利于临床医生对结核病病人的疾病状态及时做出诊断。本发明的试剂盒的检测范围包括所有活动性结核病,包括肺结核及肺外结核(如淋巴结核、肠结核、骨结核、肾结核等),覆盖面和实用性更广。附图说明图1为两种不同刺激物刺激下活动性结核患者的上清中ifn-γ和il-2的浓度检测结果(a为ifn-γ分泌值;b为il-2分泌值);图2为两种不同刺激物刺激下健康人的上清中ifn-γ和il-2的浓度检测结果(a为ifn-γ分泌值;b为il-2分泌值);图3为采用酶联免疫法检测两种不同刺激物刺激下活动性结核患者、结核感染者和健康人的上清中ifn-γ与il-2的浓度检测结果(a为ifn-γ分泌值;b为il-2分泌值);图4为采用酶联免疫斑点法检测两种不同刺激物刺激下活动性结核患者、结核感染者和健康人的上清中ifn-γ与il-2的浓度检测结果(a为ifn-γ分泌值;b为il-2分泌值);图5为采用酶联免疫法检测两种不同刺激物刺激下活动性结核患者、结核感染者和健康人的血浆(外周血)中ifn-γ与il-2的浓度检测结果(a为ifn-γ分泌值;b为il-2分泌值)。具体实施方式下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。实施例1(1)样本收集:本实施例以1例活动性结核患者为实验对象,使用肝素钠采血管采集不少于15ml的外周血,颠倒混匀,备用;(2)淋巴细胞分离:使用市售的淋巴细胞分离液分离外周血样品中的淋巴细胞,取4ml生理盐水与4ml外周血混匀,并缓慢加入到淋巴细胞分离液中,于室温下以1800r/min的转速离心20min,吸取云雾层细胞并用1640培养基(rpmi-1640培养基)补足至12ml,于室温下以600r/min的转速离心10min,弃上清,用1640培养基补足沉淀至5ml并轻轻混匀,于室温下以350r/min的转速离心10min,用1640培养基或pbs磷酸缓冲盐溶液重悬细胞,即分离提纯得到淋巴细胞,将提纯得到的存活淋巴细胞进行计数,并使用aim培养基(gibco的aimv培养基)稀释至浓度为2.5×106个/ml的细胞溶液;(3)取50μl事先配置好的混合刺激物溶液(刺激蛋白的浓度为6μg/ml、佛波醇酯类多克隆刺激剂的浓度为900pg/ml、离子霉素的终浓度为3μg/ml)和100μl上述细胞溶液,混匀后加入同一细胞培养孔中,设置10个复孔,然后置于5%co2培养箱中于37℃下恒温培养16h,收集培养物;以只添加刺激蛋白的刺激物为对照,即先用生理盐水将刺激蛋白配制成刺激蛋白溶液(刺激蛋白的浓度为6μg/ml),取50μl刺激蛋白溶液和100μl上述细胞溶液,混匀后加入同一细胞培养孔中,设置10个复孔,然后置于5%co2培养箱中于37℃下恒温培养16h,收集培养物;(4)对上述培养物进行离心处理,收集上清,使用酶联免疫法检测上清中的ifn-γ和il-2的浓度,并使用统计学分析软件研究两种不同刺激物刺激下的上清中ifn-γ和il-2浓度的统计学差异。数据显示(表1),使用混合刺激物的上清中ifn-γ和il-2的浓度均显著高于使用刺激蛋白的上清,该样本在混合刺激物刺激下分泌的ifn-γ的平均浓度为137.9±20.6pg/ml(95%置信区间,下同)、il-2为100.7±15.7pg/ml;在刺激蛋白刺激下分泌的ifn-γ的平均浓度为108.5±15.1pg/ml、il-2为81.5±11.0pg/ml。说明混合刺激物可有效提高被活化的淋巴细胞的相关细胞因子的分泌量。在本实施例中,评价了混合刺激物与单刺激蛋白刺激多份来自同一结核患者样本的等量淋巴细胞16h。使用的刺激蛋白相同,终浓度均为2μg/ml;混合刺激物中佛波醇酯类多克隆刺激剂(pma)的终浓度为300pg/ml、离子霉素(ionomysin)终浓度为1μg/ml。混合刺激物刺激分泌的ifn-γ平均浓度为137.9±20.6pg/ml,而刺激蛋白刺激下的浓度仅为108.5±15.1pg/ml;il-2在混合刺激物刺激下平均浓度为100.7±15.7pg/ml,而刺激蛋白刺激下的浓度仅为81.5±11.0pg/ml,说明使用不同的刺激物刺激被活化的淋巴细胞分泌产生的ifn-γ与il-2存在显著差异。此方案证实使用本发明的试剂盒(即混合刺激物)可有效提高被活化的淋巴细胞的相关细胞因子的分泌量。表1两种不同刺激物刺激下的上清中ifn-γ和il-2浓度的统计结果实施例2(1)样本收集:本实施例以1例经ppd检测结果为阴性的健康人为实验对象,使用肝素钠采血管采集不少于15ml的外周血,颠倒混匀,备用;(2)淋巴细胞分离:使用市售的淋巴细胞分离液分离外周血样品中的淋巴细胞,取4ml生理盐水与4ml外周血混匀,并缓慢加入到淋巴细胞分离液中,于室温下以1800r/min的转速离心20min,吸取云雾层细胞并用1640培养基(rpmi-1640培养基)补足至12ml,于室温下以600r/min的转速离心10min,弃上清,用1640培养基补足沉淀至5ml并轻轻混匀,于室温下以350r/min的转速离心10min,用1640培养基或pbs磷酸缓冲盐溶液重悬细胞,即分离提纯得到淋巴细胞,将提纯得到的存活淋巴细胞进行计数,并使用aim培养基(gibco的aimv培养基)稀释至浓度为2.5×106个/ml的细胞溶液;(3)取50μl事先配置好的混合刺激物溶液(刺激蛋白的浓度为6μg/ml、佛波醇酯类多克隆刺激剂的浓度为900pg/ml、离子霉素的终浓度为3μg/ml)和100μl上述细胞溶液,混匀后加入同一细胞培养孔中,设置10个复孔,然后置于5%co2培养箱中于37℃下恒温培养16h,收集培养物;以只添加刺激蛋白的刺激物为对照,即先用生理盐水将刺激蛋白配制成刺激蛋白溶液(刺激蛋白的浓度为6μg/ml),取50μl刺激蛋白溶液和100μl上述细胞溶液,混匀后加入同一细胞培养孔中,设置10个复孔,然后置于5%co2培养箱中于37℃下恒温培养16h,收集培养物;以不添加刺激物的细胞培养基为空白对照,即取50μlaim培养基和100μl上述细胞溶液加入同一细胞培养孔中,设置10个复孔,然后置于5%co2培养箱中于37℃下恒温培养16h,收集培养物;(4)对上述培养物进行离心处理,收集上清,使用酶联免疫法检测上清中的ifn-γ和il-2的浓度,并使用统计学分析软件研究两种不同刺激物刺激下的上清中ifn-γ和il-2浓度的统计学差异。数据显示(表2),使用刺激蛋白的上清中ifn-γ与il-2的浓度与使用混合刺激物的上清不存在显著性差异,该样本在混合刺激物刺激下分泌的ifn-γ的平均浓度为18.2±3.2pg/ml、il-2为8.0±2.2pg/ml;在刺激蛋白刺激下分泌的ifn-γ的平均浓度为17.2±2.5pg/ml、il-2为7.5±3.0pg/ml。说明混合刺激物中添加的刺激剂不会刺激未被活化的淋巴细胞分泌相关细胞因子。在本实施例中,评价了细胞培养基培养、混合刺激物与单刺激蛋白刺激多份来自同一健康人样本(ppd检测结果为阴性)的等量淋巴细胞16h。使用的刺激蛋白相同,终浓度均为2μg/ml;混合刺激物中佛波醇酯类多克隆刺激剂(pma)的终浓度为300pg/ml、离子霉素(ionomysin)终浓度为1μg/ml。混合刺激物刺激分泌的ifn-γ的平均浓度为18.2±3.2pg/ml,而刺激蛋白刺激下ifn-γ的浓度为17.2±2.5pg/ml;il-2在混合刺激物刺激下的平均浓度为8.0±2.2pg/ml,刺激蛋白下仅为7.5±3.0pg/ml,说明使用两种不同的刺激物刺激未被活化的淋巴细胞分泌产生的ifn-γ和il-2不存在显著差异。此方案证明使用本发明的试剂盒(即混合刺激物)不会刺激未被活化的淋巴细胞分泌相关细胞因子。表2两种不同刺激物刺激下的上清中ifn-γ和il-2浓度的统计结果实施例3(1)样本收集:本实施例以10例活动性结核患者、10例结核感染者(ppd检测结果为阳性)以及10例健康人(ppd检测结果为阴性)共计30例样本为实验对象,使用肝素钠采血管采集不少于12ml的外周血,颠倒混匀,备用;(2)淋巴细胞分离:使用市售的淋巴细胞分离液分离外周血样品中的淋巴细胞,取4ml生理盐水与4ml外周血混匀,并缓慢加入到淋巴细胞分离液中,于室温下以1800r/min的转速离心20min,吸取云雾层细胞并用1640培养基(rpmi-1640培养基)补足至12ml,于室温下以600r/min的转速离心10min,弃上清,用1640培养基补足沉淀至5ml并轻轻混匀,于室温下以350r/min的转速离心10min,用1640培养基或pbs磷酸缓冲盐溶液重悬细胞,即分离提纯得到淋巴细胞,将提纯得到的存活淋巴细胞进行计数,并使用aim培养基(gibco的aimv培养基)稀释至浓度为2.5×106个/ml的细胞溶液;(3)取50μl事先配置好的混合刺激物溶液(刺激蛋白的浓度为6μg/ml、佛波醇酯类多克隆刺激剂的浓度为900pg/ml、离子霉素的终浓度为3μg/ml)和100μl上述细胞溶液,混匀后加入细胞培养孔和elispot预包被检测板孔中,均设置2个复孔,然后置于5%co2培养箱中于37℃下恒温培养16h,收集培养物;以只添加刺激蛋白的刺激物为对照,即先用生理盐水将刺激蛋白配制成刺激蛋白溶液(刺激蛋白的浓度为6μg/ml),取50μl刺激蛋白溶液和100μl上述细胞溶液,混匀后加入细胞培养孔和elispot预包被检测板孔中,均设置2个复孔,然后置于5%co2培养箱中于37℃下恒温培养16h,收集培养物;以不添加刺激物的细胞培养基为空白对照,即取50μlaim培养基和100μl上述细胞溶液,混匀后加入细胞培养孔和elispot预包被检测板孔中,均设置2个复孔,然后置于5%co2培养箱中于37℃下恒温培养16h,收集培养物;(4)对上述培养物进行离心处理,收集上清,使用酶联免疫法检测培养上清中的ifn-γ与il-2浓度,结果见表3;同时,使用酶联免疫斑点法检测elispot预包被检测板,检测培养上清中的ifn-γ与il-2浓度,结果见表3;针对各检测结果进行roc分析并计算其曲线下面积,各组曲线下面积如表4所示。如表3和表4所示,使用两种检测手段的检测结果均显示,使用混合刺激物的检测结果优于使用单刺激蛋白的检测结果。在本实施例中,评价了混合刺激物与刺激蛋白刺激多份结核患者、结核感染者(ppd检测结果为阳性)、健康人样本(ppd检测结果为阴性)的等量淋巴细胞16h。使用的刺激蛋白浓度为2μg/ml、佛波醇酯类多克隆刺激剂(pma)的浓度为300pg/ml、离子霉素(ionomysin)浓度为1μg/ml。使用酶联免疫法与酶联免疫斑点法检测分泌产生的ifn-γ与il-2,使用roc曲线分析发现两种刺激物刺激分泌的ifn-γ与il-2均与样本是否患有结核病有关,且混合刺激物刺激产生的两种细胞因子的roc曲线下面积均高于刺激蛋白本身,说明本发明的试剂盒(即混合刺激物)与是否患有结核病的相关性更高,更具有诊断价值。表3酶联免疫法和酶联免疫斑点法检测培养上清中的ifn-γ与il-2浓度结果表4pbmc(人外周血单核细胞)细胞培养法各检测结果曲线下面积表注:下面积表越高说明诊断试剂越有价值。实施例4(1)样本收集:本实施例以10例活动性结核患者、10例结核感染者(ppd检测结果为阳性)以及10例健康人(ppd检测结果为阴性)共计30例样本为实验对象,使用肝素钠采血管采集不少于5ml的外周血,颠倒混匀,备用;(2)取50μl事先配置好的混合刺激物溶液(刺激蛋白的浓度为40μg/ml、佛波醇酯类多克隆刺激剂的浓度为6ng/ml、离子霉素的终浓度为20μg/ml)和1ml外周血,混匀后加入细胞培养孔中,均设置2个复孔,然后置于5%co2培养箱中于37℃下恒温培养16h,收集血浆;以只添加刺激蛋白的刺激物为对照,即先用生理盐水将刺激蛋白配制成刺激蛋白溶液(刺激蛋白的浓度为40μg/ml),取50μl刺激蛋白溶液和1ml外周血,混匀后加入细胞培养孔中,均设置2个复孔,然后置于5%co2培养箱中于37℃下恒温培养16h,收集血浆;以不添加刺激物的细胞培养基为空白对照,即取50μlaim培养基和1ml外周血,混匀后加入细胞培养孔中,均设置2个复孔,然后置于5%co2培养箱中于37℃下恒温培养16h,收集血浆;(3)使用酶联免疫法检测上述血浆中ifn-γ和il-2的浓度,结果见表5;针对各检测结果进行roc分析并计算其曲线下面积,各组曲线下面积如表6所示。如表5和表6所示的检测结果显示,使用混合刺激物的检测结果优于使用单刺激蛋白的检测结果。在本实施例中,评价了混合刺激物与刺激蛋白刺激多份结核患者、结核感染者(ppd检测结果为阳性)、健康人样本(ppd检测结果为阴性)的等量外周血16h。使用的刺激蛋白浓度为2μg/ml、佛波醇酯类多克隆刺激剂(pma)的浓度为300pg/ml、离子霉素(ionomysin)浓度为1μg/ml。使用酶联免疫法检测分泌产生的ifn-γ和il-2,使用roc曲线分析发现两种刺激物刺激分泌的ifn-γ和il-2均与样本是否患有结核病有关,且混合刺激物刺激产生的两种细胞因子的roc曲线下面积均高于刺激蛋白本身,说明本发明的试剂盒(即混合刺激物)与是否患有结核病的相关性更高,更具有诊断价值。表5酶联免疫法检测血浆中ifn-γ和il-2的浓度结果表6外周血细胞因子检测结果曲线下面积表注:曲线下面积越高说明诊断试剂越有价值。实施例5为验证本发明的试剂盒的检测性能,以刺激蛋白为对照,对混合刺激物(包括刺激蛋白、佛波醇酯类多克隆刺激剂和离子霉素)的检测性能进行检测,选择100例活动性结核患者、50例结核感染者(ppd检测结果为阳性)以及50例健康人(ppd检测结果为阴性)共计200例样本为实验对象,其中100例活动性结核作为临床阳性组、50例结核感染者与50例健康人作为临床阴性组,采用实施例3中的检测方法进行检测,使用roc曲线分析两种细胞因子最佳cut-off值,以最佳cut-off值为阈值,γ-干扰素和/或白介素-2阳性为阳性,统计诊断的灵敏度与特异度,检测结果见表7-9。如表9所示的结果显示,混合刺激物检测特异性92%高于常规刺激蛋白特异性,说明本发明的试剂盒特异性好,检测精度高。表7混合刺激物与临床诊断结果的四格表临床阳性临床阴性合计混合刺激物阳性82890混合刺激物阴性1892110合计100100200表8刺激蛋白与临床诊断结果的四格表临床阳性临床阴性合计刺激蛋白阳性8319102刺激蛋白阴性178198合计100100200表9本发明试剂盒与普通刺激蛋白试剂盒的性能比较本发明试剂盒刺激蛋白试剂盒灵敏度82%83%特异度92%81%以上对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1