一种λ-DNA中和后剩余电量的测量装置的制作方法
本实用新型涉及一种λ-dna中和后剩余电量的测量装置。
背景技术:
目前已经有各种技术方法应用于dna与核酸结合分子之间相互作用的研究。传统方法有光谱法、x-射线晶体衍射、凝胶电泳法、dna足迹分析、流体力学技术和电化学方法等。这些集群测量的方法,在灵敏度、定量检测等方面都有一定的局限性。用单分子技术研究多价离子与dna作用,能够测量传统集群测量所无法实现的生物分子的个性行为,对生物分子行为(包括构象变化、相互作用、相互识别等)进行实时,动态监测以及在此基础上的操纵、调控等。
现有技术中,测量λ-dna的带电量是通过电泳法进行测量,将λ-dna放入溶液中,在溶液两端加电压,让λ-dna在溶液中移动,观察测量λ-dna在溶液中移动的速度,以此来计算分析出λ-dna上的带电量,但此种方法存在测量上的不便与测量结果精度不高的问题。
技术实现要素:
本实用新型的目的是为了解决现有技术中存在的问题,提供一种λ-dna中和后剩余电量的测量装置。
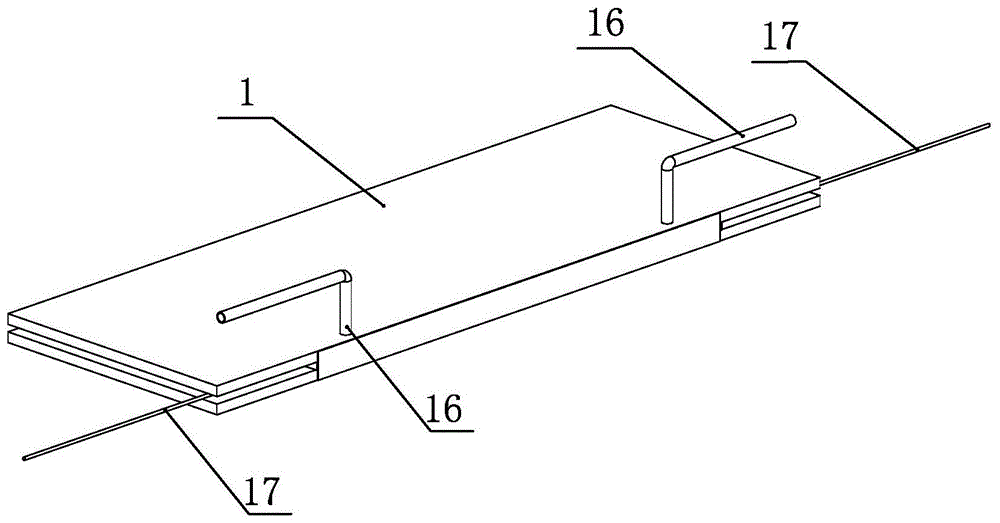
为实现上述目的,本实用新型提供了如下技术方案:一种λ-dna中和后剩余电量的测量装置,包括玻璃基座,所述玻璃基座的一侧设置有用于存储样品溶液的开槽,所述玻璃基座对应开槽的一侧设置有前挡片,所述玻璃基座包括第一盖玻片、第二盖玻片及载玻片,所述载玻片设置于第一盖玻片与第二盖玻片之间并与第一盖玻片及第二盖玻片连接,所述开槽由所述第一盖玻片的下底面、第二盖玻片的上顶面、载玻片对应开槽一侧的侧壁及前挡片对应开槽一侧的侧壁围绕而成,所述载玻片对应开槽一侧的侧壁上附着有抗地高辛,所述第一盖玻片对应开槽处对称设置有与开槽贯通的玻璃微管,所述开槽的两端对称设置有自开槽内向外延伸的铂丝导线,所述开槽的两端由玻璃胶进行密封。
通过采用上述技术方案,玻璃基座上设置有用于储存样品溶液的开槽,开槽由第一盖玻片的下底面、第二盖玻片的上顶面、载玻片对应开槽的一侧侧壁及前挡片对应开槽的一侧侧壁围绕而成,开槽的两端由具有密封性的玻璃胶密封,使得开槽密封,第一盖玻片对应开槽处对称设置有与开槽连接的玻璃微管,玻璃微管与开槽贯通连接,含有λ-dna的溶液或药品可通过玻璃微管注射进开槽内并与开槽对应载玻片一侧的侧壁上的抗地高辛进行反应,通过外置电压装置对伸入开槽内的铂丝导线导电,对开槽内的样品溶液施加电压,磁力装置设置于前挡片一侧对样品溶液进行操作,使得样品溶液内的λ-dna受电场力及磁场力作用发生变化,从而测得λ-dna中和后携带的剩余电荷量。
本实用新型进一步设置:所述载玻片与第一盖玻片及第二盖玻片通过玻璃胶相互粘合连接,所述前挡片对应开槽一侧的侧壁与所述第一盖玻片及第二盖玻片对应前挡片一侧的侧壁通过玻璃胶相互粘合连接。
通过采用上述技术方案,载玻片设置于第一盖玻片与第二盖玻片之间,通过玻璃胶进行粘合连接,前挡片与第一盖玻片及第二盖玻片通过玻璃胶进行粘合连接,玻璃胶具有良好的黏性、密封性及防漏性,能紧固连接载玻片、第一盖玻片与第二盖玻片、前挡片,避免注射入开槽内的溶液或药品从载玻片、第一盖玻片与第二盖玻片、前挡片之间的间隙渗漏出,影响测量结果。
本实用新型进一步设置:所述第一盖玻片与第二盖玻片的大小形状相同,所述第一盖玻片及第二盖玻片的长度大于所述载玻片的长度。
通过采用上述技术方案,第一盖玻片与第二盖玻片的大小形状相同,第一盖玻片及第二盖玻片的长度大于载玻片的长度,使得载玻片与第一盖玻片及第二盖玻片能更好地通过玻璃胶进行粘合连接,保证开槽的密封性。
本实用新型进一步设置:所述载玻片的厚度小于所述第一盖玻片及第二盖玻片的厚度。
通过采用上述技术方案,载玻片的厚度小于第一盖玻片及第二盖玻片的厚度,将测量装置整体放置于显微镜下观察时,能更好地观察到λ-dna与载玻片侧壁上的抗地高辛的连接反应情况。
本实用新型进一步设置:所述第一盖玻片及第二盖玻片的厚度为1mm,所述载玻片的厚度为0.17mm。
通过采用上述技术方案,第一盖玻片及第二盖玻片的厚度为1mm,载玻片的厚度为0.17mm,载玻片的厚度小于第一盖玻片及第二盖玻片的厚度,将测量装置整体放置于显微镜下观察时,能更好地观察到λ-dna与载玻片侧壁上的抗地高辛的连接反应情况。
利用本实用新型的测量装置对λ-dna中和后剩余电量的测量方法,包括:
步骤(1),在λ-dna两端分别修饰地高辛与亲和素;
步骤(2),通过测量装置的玻璃微管将一定浓度的抗地高辛冲入封闭好的开槽内,将测量装置竖直放置静置5-6个小时,使抗地高辛附着到开槽对应载玻片一侧的侧壁上;
步骤(3),将修饰好的λ-dna与带有链霉亲和素的磁球混合冲入开槽中,静置30分钟,形成磁球-dna-侧壁结构;
步骤(4),将测量装置放置在一个倒置显微镜的样品台上,通过磁镊装置对测量装置内的磁球进行操作,同时通过两端的铂丝导线对样品溶液施加电压,并通过录像记录磁球的偏转;
步骤(5),通过分析录像结果,分析计算λ-dna的拉伸长度及水平偏移距离,从而得出磁球受到的力的大小、根据磁力和dna的偏转角度计算λ-dna所受的电场力,从而计算出λ-dna中和后携带的剩余电量。
本发明进一步设置:所述步骤(1)包括以下分步骤:
分步(1),在λ-dna一端修饰亲和素:在离心管中将一定量的λ-dna、te缓冲液以及含有亲和素的单链寡核苷酸片段混合,密封后进行水浴加热,加热完毕使将离心管内混合溶液降至室温;再向混合溶液内加入一定量的ligationbuffer及ligase,使其混合后进行冰浴,冰浴后使离心管内混合溶液降至室温;继续向混合溶液内加入一定量的bufferq*i、bufferq*ii以及超纯水,用手震荡使其完全混合均匀;将装有混合溶液的离心管在超速离心机下离心并移去上层清液;分两次在剩余溶液内加入一定量的含有无水乙醇的bufferpe进行清洗,并用离心机离心后分别移出上层清液;将离心管内经两次清洗后的溶液风干,再加入一定量的te缓冲液混合进行水浴加热,水浴后利用离心机离心,将离心出的上层清液移出至干净的离心管中,得到一端修饰有亲和素的λ-dna;
分步(2),在λ-dna另一端修饰地高辛:在移出的上层清液中加入te缓冲液及含有地高辛的单链寡核苷酸片段,轻敲使其混合均匀后,放入水浴加热,取出加热后的离心管使其温度降至室温;降温后向离心管内加入一定量的ligationbuffer以及ligase,使其混合后进行冰浴;冰浴后往离心管内加入一定量的bufferq*i、bufferq*ii以及去离子水,用手震荡使其完全混合均匀;将装有混合溶液的离心管在超速离心机下离心并移去上层清液;分两次在剩余溶液内加入一定量的含有无水乙醇的bufferpe进行清洗,并用离心机离心后分别移出上层清液;将离心管内经两次清洗后的溶液风干,再加入一定量的te缓冲液混合进行水浴加热,水浴后利用离心机离心,将离心出的上层清液移出至干净的离心管中,得到两端分别修饰有亲和素和地高辛的λ-dna,将修饰好的λ-dna放置于-20℃冷冻层保存。
步骤一中,te缓冲液是由tris和edta配制而成,主要用于溶解核酸,能稳定储存dna和rna。
te缓冲液是一种能在加入少量酸或碱时抵抗ph改变的溶液。
ligationbuffer是由tris-hcl、mgcl2、dtt、atp混合的连接酶缓冲液。
ligase是连接酶。
bufferq*i是一种提供硅颗粒的悬浮液,在存在鏊合盐的条件下可结合dna片段。
bufferq*ii是一种添加到溶液或溶解的琼脂糖凝胶中结合dna。通过简单的离心操作收集硅胶颗粒,洗涤后用tris缓冲液或纯水洗脱得到40bp到50000bp的dna。
bufferpe为洗涤液,适用于dna回收实验。
本发明进一步设置:所述步骤(5)通过录像分析测量出λ-dna受磁场力拉伸的长度l、磁球受电场力影响带动λ-dna在水平方向的偏转距离δx、电流i、开槽的横截面d、开槽内通入的溶液的导电率σ、λ-dna所受到磁镊装置的磁力f磁力,则计算出λ-dna携带的电量所受到的电场力f电场力、λ-dna中和后携带的剩余电荷q,λ-dna受电场力影响偏转的角度为θ,应用公式:
因sinθ已知,则计算出tanθ;
因f电=f磁·tanθ,
则
下面结合附图及具体实施方式对本实用新型做进一步说明。
附图说明
图1为本实用新型实施例的测量装置整体结构图;
图2为本实用新型实施例的测量装置局部剖视图;
图中标号含义:玻璃基座1,开槽11,前挡片12,第一盖玻片13,第二盖玻片14,载玻片15,玻璃微管16,铂丝导线17。
具体实施方式
本具体实施例仅仅是对本实施例的解释,其并不是对本实施例的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本实施例的权利要求范围内都受到专利法的保护。
参见附图1-2,本实施例公开了一种λ-dna中和后剩余电量的测量装置,包括玻璃基座1,所述玻璃基座1的一侧设置有用于存储样品溶液的开槽11,所述玻璃基座1对应开槽11的一侧设置有前挡片12,所述玻璃基座1包括第一盖玻片13、第二盖玻片14及载玻片15,所述载玻片15设置于第一盖玻片13与第二盖玻片14之间并与第一盖玻片13及第二盖玻片14连接,所述开槽11由所述第一盖玻片13的下底面、第二盖玻片14的上顶面、载玻片15对应开槽11一侧的侧壁及前挡片12对应开槽11一侧的侧壁围绕而成,所述载玻片15对应开槽11一侧的侧壁上附着有抗地高辛,所述第一盖玻片13对应开槽11处对称设置有与开槽11贯通的玻璃微管16,所述开槽11的两端对称设置有自开槽11内向外延伸的铂丝导线17,所述开槽11的两端由玻璃胶进行密封。通过采用上述技术方案,玻璃基座1上设置有用于储存样品溶液的开槽11,开槽11由第一盖玻片13的下底面、第二盖玻片14的上顶面、载玻片15对应开槽11的一侧侧壁及前挡片12对应开槽11的一侧侧壁围绕而成,开槽11的两端由具有密封性的玻璃胶密封,使得开槽11密封,第一盖玻片13对应开槽11处对称设置有与开槽11连接的玻璃微管16,玻璃微管16与开槽11贯通连接,含有λ-dna的溶液或药品可通过玻璃微管16注射进开槽11内并与开槽11对应载玻片15一侧的侧壁上的抗地高辛进行反应,通过外置电压装置对伸入开槽11内的铂丝导线17导电,对开槽11内的样品溶液施加电压,磁力装置设置于前挡片12一侧对样品溶液进行操作,使得样品溶液内的λ-dna受电场力及磁场力作用发生变化,从而测得λ-dna中和后携带的剩余电荷量。
本实施例进一步设置:所述载玻片15与第一盖玻片13及第二盖玻片14通过玻璃胶相互粘合连接,所述前挡片12对应开槽11一侧的侧壁与所述第一盖玻片13及第二盖玻片14对应前挡片12一侧的侧壁通过玻璃胶相互粘合连接。通过采用上述技术方案,载玻片15设置于第一盖玻片13与第二盖玻片14之间,通过玻璃胶进行粘合连接,前挡片12与第一盖玻片13及第二盖玻片14通过玻璃胶进行粘合连接,玻璃胶具有良好的黏性、密封性及防漏性,能紧固连接载玻片15、第一盖玻片13与第二盖玻片14、前挡片12,避免注射入开槽11内的溶液或药品从载玻片15、第一盖玻片13与第二盖玻片14、前挡片12之间的间隙渗漏出,影响测量结果。
本实施例进一步设置:所述第一盖玻片13与第二盖玻片14的大小形状相同,所述第一盖玻片13及第二盖玻片14的长度大于所述载玻片15的长度。通过采用上述技术方案,第一盖玻片13与第二盖玻片14的大小形状相同,第一盖玻片13及第二盖玻片14的长度大于载玻片15的长度,使得载玻片15与第一盖玻片13及第二盖玻片14能更好地通过玻璃胶进行粘合连接,保证开槽11的密封性。
本实施例进一步设置:所述载玻片15的厚度小于所述第一盖玻片13及第二盖玻片14的厚度。通过采用上述技术方案,载玻片15的厚度小于第一盖玻片13及第二盖玻片14的厚度,将测量装置整体放置于显微镜下观察时,能更好地观察到λ-dna与载玻片15侧壁上的抗地高辛的连接反应情况。
本实施例进一步设置:所述第一盖玻片13及第二盖玻片14的厚度为1mm,所述载玻片15的厚度为0.17mm。通过采用上述技术方案,第一盖玻片13及第二盖玻片14的厚度为1mm,载玻片15的厚度为0.17mm,载玻片15的厚度小于第一盖玻片13及第二盖玻片14的厚度,将测量装置整体放置于显微镜下观察时,能更好地观察到λ-dna与载玻片15侧壁上的抗地高辛的连接反应情况。
利用本实用新型的测量装置对λ-dna中和后剩余电量的测量方法,包括步骤(1),在λ-dna两端分别修饰地高辛与亲和素,具体操作方法如下:
分步(1):
(1)分别用量程为5-50μl、0.2-2μl的移液器取44μlλ-dna、24μl1×te缓冲液以及4μl的12碱基对的单链寡核苷酸(3’生物素-cccgccgctgga)片段放入干净的离心管内,轻轻震荡使其完全混合后,将此离心管密封好放置于温度为65℃的水浴锅中,加热约10分钟。
(2)把水浴加热后的离心管放到干净的烧杯中,在室温下放置约5分钟使离心管内液体温度降至室温,再向离心管中加入8μlligationbuffer和4μlligase,轻轻震荡使其完全混合。然后再把装有溶液的离心管放置于放有冰袋的泡沫保温箱中冰浴8~12小时。
(3)将冰浴好的离心管取出放置在烧杯中,在室温下放置约10分钟使其恢复至室温。继续向冰浴好的溶液中加入240μlbufferq*i、44μlbufferq*ii以及160μl超纯水,轻轻震荡使其溶液完全混合均匀,放于室温下培育2分钟后,用手再次将因静止分层的溶液轻轻震荡使其完全混合均匀(共5次,总计10分钟)。
(4)然后将装有混合液的离心管在12000r/min的超速离心机下离心2min,并移去上层清液。
(5)接着向离心管中加入250μl的bufferpe(含无水乙醇)来清洗(2)剩余的白色胶体粒子,用离心机(12000r/min)离心2分钟,移去上清液。
(6)继续加入250μl的bufferpe(含无水乙醇)再次清洗,离心2min,然后移去上层清液。
(7)将离心管盖打开,置于通风处中风干,约15-30min,直到风干为止。
(8)风干之后继续加入40μl1×te缓冲液,轻敲使其混匀,然后放在65℃的水浴锅中水浴10min。
(9)水浴后,继续离心2min(12000r/min),用移液器将上清液移入干净的离心管中,此时,dna的biotin(生物素)修饰完成。
分步(2):
(1)在上述biotin修饰完成的上清液中继续加入2μl1×te缓冲液、3~4μl3’地高辛-tccagcggcggg片段后轻敲混匀,65℃水浴培育10min。
(2)取出离心管放置在室温5min。
(3)继续加入4μlt4ligationbuffer和2μlt4ligase,混匀后将离心管冰浴10~12小时。
(4)将上述冰浴后的离心管取出,向离心管中加入120μlbufferq*i、22μlbufferq*ii以及80μl去离子水,这时离心管中出现了白色絮状沉淀,然后每隔2min用手指轻轻弹至混匀,培育10min。
(5)离心2min(12000r/min),移去上层清液。
(6)分两次加入250μl的bufferpe清洗白色胶体粒子,每次都离心2min(12000r/min),分别移去上清液。
(7)打开离心管盖,风干15-30min,直到风干为止。
(8)加入100μl1×te缓冲液,轻敲混合均匀,65℃水浴培育10min。
(9)最后离心2min(12000r/min),将上清液移至干净的离心管中,该上清液即为修饰好的λ-dna,放置于-20℃冷冻层保存。
步骤(2),通过测量装置的玻璃微管16浓度为1%的抗地高辛冲入封闭好的开槽11内,将测量装置竖直放置静置5-6个小时,使抗地高辛附着到开槽11对应载玻片15一侧的侧壁上;
步骤(3),将修饰好的λ-dna与带有链霉亲和素的磁球混合冲入开槽11中,静置30分钟,形成磁球-dna-侧壁结构;
步骤(4),将测量装置放置在一个倒置显微镜的样品台上,通过磁镊装置对测量装置内的磁球进行操作,同时通过两端的铂丝导线17对样品溶液施加电压,并通过录像记录磁球的偏转;
步骤(5),通过分析录像结果,分析计算λ-dna的拉伸长度及水平偏移距离,从而得出磁球受到的力的大小、根据磁力和dna的偏转角度计算λ-dna所受的电场力,从而计算出λ-dna中和后携带的剩余电量。
实施例1
当λ-dna在浓度为0.5mm的spermine(精胺)溶液中凝聚时,
已知电流i=488μa,spermine(精胺)溶液电阻率σ=647μs/cm,开槽的横截面d=8×10-6m2,
通过实时分析软件可测量出λ-dna拉伸长度l=11.44μm,偏转距离δx=0.42μm,对应的f磁=0.95pn,得:
∴tanθ=0.036
∴f电=f磁·tanθ=0.95×0.036=0.034pn
已知元电荷带电量为1.6×10-19c,
实施例2
当λ-dna在浓度为10mm的nacl溶液中凝聚时,
已知电流i=980μa,nacl溶液电阻率σ=1665μs/cm,开槽的横截面d=8×10-6m2,
通过实时分析软件可测量出λ-dna拉伸长度l=14.85μm,偏转距离δx=0.3μm,对应的f磁=1.34pn,得:
∴tanθ=0.02
∴f电=f磁·tanθ=1.34×0.02=0.0268pn
已知元电荷带电量为1.6×10-19c,
- 还没有人留言评论。精彩留言会获得点赞!