基于GMR的生物标志物检测中检测分析的系统和方法与流程
相关申请的交叉引用
本申请基于并要求2018年7月27日提交的美国临时专利申请no.62/711,396的优先权,在此引入其全部内容作为参考。
本公开涉及用于检测水和生物试样中的分析物的系统和方法。特别地,本公开涉及使用基于巨磁阻(gmr)传感器的检测方法的分析物检测。
gmr传感器能够在紧凑型系统中开发高灵敏度和低成本的多重测定,因此具有提供适用于多种应用的平台的潜力。可靠的分析物检测仍然是一个挑战。本公开提供示例性解决方案。
技术实现要素:
在一些方面,本文的实施方式涉及检测测试试样中分析物存在的方法,其包括提供传感器,该传感器包括设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的生物分子,该生物分子包括共价结合至生物分子的可裂解部分,裂解被测试试样中分析物的存在和与生物分子可裂解部分相关的受体催化,该受体能够结合磁性纳米颗粒,使测试试样通过传感器,从而允许当分析物存在时从生物分子中分离和去除带有相关受体的可裂解部分,测试试样通过传感器后将磁性颗粒通过传感器,并
根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来检测试样中是否存在分析物。
在其他方面,本文的实施例涉及检测测试试样中分析物的存在的方法,其包括提供传感器,该传感器包含设置在巨磁阻(gmr)传感器的聚合物涂层表面上的生物分子,该生物分子包括在抗原结合位点结合抗体的抗原部分,该抗体进一步包括与抗原结合位点分开的部分,该部分被配置为结合磁性纳米颗粒,使测试试样和抗体的混合物通过传感器,其中抗原结合位点如果存在于测试试样中,则抗体会与分析物结合,从而防止抗体与生物分子的抗原部分结合,在混合物通过传感器后使磁性颗粒通过传感器,并根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来检测试样中是否存在分析物。
在其他方面,本文的实施例涉及检测测试试样中分析物的存在的方法,其包括提供传感器,该传感器包含设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的生物分子,该生物分子包括一个结合区域,被配置为结合检测蛋白,检测蛋白也能够结合分析物,当检测蛋白结合分析物时,它防止检测蛋白与生物分子的结合区域结合,使检测蛋白通过传感器,再使测试试样通过传感器,在测试试样通过传感器之后使报告蛋白通过传感器,报告蛋白可以与检测蛋白结合,报告蛋白被配置为与磁性纳米颗粒结合,在使报告蛋白通过传感器后让磁性颗粒通过传感器,并根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来检测金属离子的存在。
在其他方面,本文的实施例涉及检测测试试样中分析物的存在的方法,其包括提供传感器,该传感器包含设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的生物分子,该生物分子包括相关的磁性颗粒,使测试试样通过传感器,从而在存在分析物的情况下从生物分子中除去相关的磁性颗粒,并根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来检测测试试样中分析物的存在,其中确定gmr传感器的电阻变化包括使用至少一个基准电阻器来执行gmr传感器的电阻变化的相位敏感解决方案。
在其他方面,本文的实施例涉及检测测试试样中分析物的存在的方法,其包括提供传感器,该传感器包含设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的第一生物分子,该第一生物分子包括第二生物分子的条件结合位点,其包括磁性颗粒的结合位点,将测试试样通过传感器,并将第二生物分子通过传感器,在将测试试样通过传感器后将磁性颗粒通过传感器,并根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来检测测试试样中分析物的存在,其中确定gmr传感器的电阻变化包括使用至少一个基准电阻器来执行gmr传感器的电阻变化的相位敏感解决方案。
在其他方面,本文的实施例涉及检测测试试样中分析物的存在的方法,其包括提供传感器,该传感器包含设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的第一生物分子,该生物分子包括存在分析物时磁性颗粒的结合位点,将测试试样通过传感器,在将测试试样通过传感器后将磁性颗粒通过传感器,并根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来检测测试试样中分析物的存在,其中确定gmr传感器的电阻变化包括使用至少一个基准电阻器来执行gmr传感器的电阻变化的相位敏感解决方案。
在其他方面,实施例涉及为执行上述方法而配置的系统。
本公开的其他实施形态、特征和优点将由下面的详细说明、附图以及所附权利要求明了。
附图说明
下面将参照附图介绍本公开的多种实施例,在附图中:
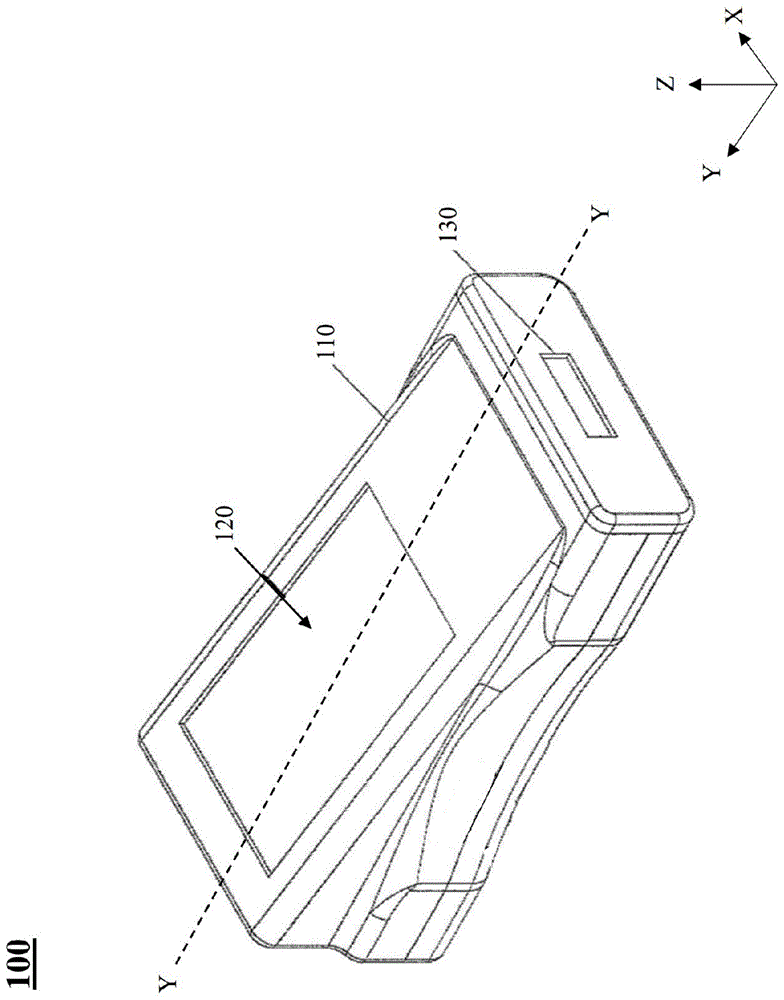
图1为在根据本公开一实施例的系统中使用的示例性卡盒(cartridge)读取器单元的透视图。
图2a为用在根据本公开一实施例的系统中的示例性卡盒组件的透视图。
图2b为根据这里的一实施例的图2a中的卡盒组件的分解图。
图2c为根据这里的一实施例的图2a中的卡盒组件的原理图。
图2d示出了图2a的卡盒组件的截面图,其描绘了在试样处理卡与其传感和通信衬底之间的连接接口。
图3为根据本公开一实施例的系统的原理图。
图4示出了根据一实施例,当使用图3中所公开系统的特征时,用于执行试样中的分析物检测的方法的步骤。
图5a示出了根据一实施例的包括多个gmr传感器的蛇形通道。
图5b示出了根据一实施例,用于gmr感测的衬底上的多个通道的布置。
图6a示出了根据一实施例,在其中布置有gmr传感器的通道的线性长度的横截面。
图6b示出了根据一实施例的,具有圆形通道扩大段的通道的线性长度的横截面,其中gmr传感器驻留在该圆形通道扩大段。
图6c示出了根据一实施例的,具有方形通道扩大段的通道的线性长度的横截面,其中gmr传感器驻留在该方形通道扩大段。
图6d示出了根据一实施例的,具有三角通道扩大段的通道的线性长度的横截面,其中gmr传感器驻留在该三角形通道扩大段。
图6e示出了根据一实施例的,在其中设置有gmr传感器的蛇形通道的一部分。
图6f示出了根据一实施例的,具有gmr传感器的蛇形通道的截面,所述gmr传感器设置在圆形通道扩大段。
图6g示出了根据一实施例的,具有分叉并且其中布置有gmr传感器的通道的截面。
图7示出了根据一实施例的,具有圆形通道扩大段的线性长度的通道的横截面,不同的gmr传感器驻留在该圆形通道扩大段。
图图8a示出了根据一实施例的,具有多个通道的gmr传感器芯片,其中,gmr传感器在圆形扩大段并入,并经电线与接触垫连接。
图8b示出了根据一实施例的,圆形通道扩大段中的gmr传感器周围区域,其示出了布线网络。
图8c示出了根据一实施例的开关的结构。
图9示出了根据一实施例的圆形通道扩大段和驻留在其中的gmr以及经由电线附接到接触垫的截面图。
图10a示出了根据一实施例的不具有扩大段的通道的横截面图,gmr传感器与布置在gmr传感器上的生物表层一起位于其中。
图10b示出了根据一实施例的gmr传感器的基本结构和工作原理。
图11a示出了根据一实施例的gmr减法感测过程的结构状态图。
图11b示出了图11a中的gmr感测过程的流程图
图12a示出了根据一实施例的gmr添加感测过程的结构状态图。
图12b示出了图12a中的gmr感测过程的流程图。
图13a示出了根据一实施例的gmr添加感测过程的另一结构状态图。
图13b示出了图13a中的gmr感测过程的流程图。
图13c展示图13a中的gmr感测过程的替代流程图
图14a示出了根据一实施例的gmr添加感测过程的结构状态图,其中分析物修改了与生物表面结合的一个分子。
图14b示出了图14a中的gmr感测过程的流程图。
图15a示出了根据一实施例的,gmr添加感测过程的替代结构状态图,其中分析物修改了与生物表面结合的一个分子。
图15b展示图15a中的gmr感测过程的流程图。
图16a示出了采用示例性“三明治”抗体过程的gmr添加感测过程的结构状态图。
图16b展示图16a中的gmr感测过程的流程图。
图17a示出了用于检测d-二聚体心脏生物标志物的gmr传感器产生的数据图:实线是阳性对照;虚线是试样运行;用“+”表示的线是阴性对照。
图17b示出了用于检测d-二聚体心脏生物标记物的gmr传感器的d-二聚体的校准曲线。
图17c示出了用于检测肌钙蛋白心脏生物标志物的gmr传感器产生的数据图。
图18示出了根据一实施例的用于基于gmr的铅离子检测的反应方案。
图19示出了根据一实施例的用于基于gmr的汞离子检测的反应方案。
图20示出了根据一实施例的用于基于gmr的镉或砷离子检测的反应方案。
具体实施方式
由附图以及下面的说明可见,本公开涉及一种试样处理系统(或贯穿本公开所称的“系统”),该系统可用于检测试样中分析物(或多于一种分析物)的存在。在一实施例中,这种系统,在图3中示为系统300,可包含:(1)试样处理系统或“卡盒组件”,其包含试样制备微流体通道和用于检测测试试样中的生物标志物的至少一个传感装置(或传感器),以及(2)数据处理和显示装置或“卡盒读取器单元”,其包含用于对卡盒组件的传感装置的任何检测数据进行处理的处理器或控制器以及用于显示检测事件的显示器。这两个部件共同组成系统。在一实施例中,这些部件可包含多种部件,包括但不限于一个以上的试剂卡盒、废料卡盒以及流动控制系统,该系统可以是例如气动流动控制器。
一般而言,通过该组件对分析物、生物标志物等的检测并经由卡盒读取器单元输出,用于在卡盒组件中制备试样的过程如下:患者的原始试样被载入卡,视情况可选地经由过滤膜过滤,然后,由卡外气动装置生成的负压将试样过滤为分离的测试试样(例如血浆)。这种分离的测试试样通过通道的几何形态(channelgeometry)在卡上进行定量。通过在流过传感器/传感装置之前与来自混合材料源(例如泡罩包装、储存腔、卡盒、井等等)的混合材料(例如试剂(其可以是湿的或干的)、缓冲剂和/或清洗缓冲剂,珠和/或珠溶液等)的相互作用,试样在卡上被制备。试样制备通道可以被设计为任何数量的通道都可以在卡上竖直地堆叠,以允许同时使用多个患者试样。检测微流体装置也是如此,其也可竖直堆叠。试样制备卡,其为卡盒组件的一部分,包含:一个以上提供选自下列的功能性的结构:过滤、加热、制冷、混合、稀释、添加试剂、色谱分离及其组合;以及在整个试样制备卡中移动试样的装置。关于这些特征的进一步介绍将稍后在下面提供。
图1示出了根据一实施例用在系统300(见图3)中的卡盒读取器单元100的实例。卡盒读取器单元100可被配置为足够紧凑和/或小,以便作为例如手持式便携设备。卡盒读取器单元100包含主体或外壳110,其具有显示器120和用于容纳卡盒组件的卡盒容纳器130。外壳110可具有人体工学设计,以便读取器单元100被握在操作者手中时更舒适。然而,外壳110的形状和设计并非旨在限制。
卡盒读取器单元100可包含接口140和显示器120,用于例如促进用户输入和/或将卡盒组件200与单元和/或试样连接。根据一实施例,结合所公开的卡盒组件200,作为一过程的一部分,系统300可处理、检测、分析和生成结果的报告,并进一步显示生物标志物结果,例如,使用传感器(磁阻性)技术,关于试样中检测出来的多种生物标志物(例如五种心脏生物标志物)的结果。
例如,显示器120可被配置为向操作者或用户显示信息。显示器120可以以集成的显示屏或触摸屏的形式提供(例如具有触觉或触摸反馈),例如设置在外壳110上的lcd屏或led屏或任何其他平坦面板显示器,并且(视情况可选地)提供输入表面,其可被设计为终端用户接口(ui)140,操作者可用其向单元100输入命令和/或设置,例如经由用手指触碰显示器120自身。显示器120的尺寸可变。具体而言,在一实施例中,显示器120可以被配置为,作为终端用户接口的一部分,显示具有键、按钮、菜单和/或键盘功能的控制面板,输入用于系统300的命令和/或设置。在一实施例中,控制面板包含功能键、开始与停止按钮、返回或输入按钮以及设置按钮。作为附加和/或作为替代地,尽管图1未示出,在一实施例中,卡盒读取器100可包含任何数量的实体输入装置,包括但不限于按钮和键盘。在另一实施例中,卡盒读取器100可被配置为经由另一装置接收输入,例如经由直接或有线连接(例如使用插头和线缆连接到计算机(pc或cpu)或处理器)或经由无线连接。在又一实施例中,显示器120可以是集成的屏幕,或者,可以是外在的显示系统,或者可以是它们二者。经由显示控制单元120,测试结果(例如来自参照图3介绍的卡盒读取器310)可以显示在集成的或外在的显示器上。在再一实施例中,用户接口140可以与显示器120分开地提供。例如,如果触摸屏ui不用于显示器120,其他的输入装置可用作用户接口140(例如遥控器、键盘、鼠标、按钮、操纵杆等),并可以与卡盒读取器100和/或系统300关联。相应地,应当明了,用于到卡盒读取器100的输入的装置和/或方法并非旨在限制。在一实施例中,卡盒读取器100和/或系统300的所有功能可以经由显示器120和/或输入装置受到管理,包括但不限于:开始处理的方法(例如通过开始按钮),选择和/或改变检定和/或卡盒组件200的设置,选择和/或改变与气动装置有关的设置,确认输入的提醒,查看处理测试试样的方法中的步骤,和/或查看(例如经由显示器120和/或用户接口140)测试结果以及gmr传感器和控制单元/卡盒读取器计算的结果。显示器120可以通过视觉显示与试样中的分析物检测有关的信息。显示器120可以被配置为显示控制单元/卡盒读取器所生成的测试结果。在一实施例中,关于由卡盒读取器单元/控制器(通过接收来自传感装置的测量,该测量被确定为被检测分析物或生物标志物的结果)确定/处理的测试结果的实时反馈被显示在显示器120上。
视情况可选地,扬声器(未示出)也可被提供为卡盒读取器100的一部分,用于提供音频输出。任何数量的声音都可被输出,包括但不限于语音和/或警报。卡盒读取器单元100也可包括,或者视情况可选地包括任何数量的连接器,例如,lan连接器和usb连接器,和/或与之相关联的其他的输入/输出装置。lan连接器和/或usb连接器可用于将输入装置和/或输出装置连接到卡盒读取器单元100,包括可移除的存储器或驱动器或其它系统。
根据一实施例,卡盒容纳器130可以是外壳110内的开口(例如图1所示),其中可插入卡盒组件(例如图2的卡盒组件200)。在另一实施例中,卡盒容纳器130可包含托盘,其被配置为可在其中容纳卡盒组件。这样的托盘(见例如图6、10中的托盘610)可以相对于外壳100移动,例如移出和移入其中的开口,从而容纳卡盒组件200,并将卡盒组件移入(以及移出)外壳110。在一实施例中,托盘可以是弹簧承载的托盘,其被配置为可释放地相对于外壳110锁定。关于卡盒读取器100的另外的细节将在下面参照图3介绍。
如前所述,卡盒组件200可被设计为插入卡盒读取器单元100,使得试样(例如血、尿)可以被制备、处理和分析。图2a-2c示出了根据此实施例的卡盒组件200的示例性实施例。某些与所公开的卡盒组件200相关联的一般性的特征通过参照这些附图介绍。然而,如后面更为详细地介绍的,几种不同类型的卡盒卡以及卡盒组件可与卡盒读取器单元100一起使用,并因此设置为系统300的一部分。在某些实施例中,试样处理系统或卡盒组件200可采用进行个体测试的用后可弃组件的形式。也就是说,通过这里的介绍进一步明了的,取决于试样和/或将要测试的分析物的类型,可使用不同的卡盒卡配置和/或卡盒组件。图2a示出了根据这里的一实施例的卡盒组件200的倾斜的顶视图。卡盒组件200包含试样处理卡210以及传感和通信衬底202(也参照图2b)。一般来说,试样处理卡210被配置为接收试样(例如经由试样端口,例如注入端口,其也在后面介绍),并且,一旦插入卡盒读取器单元100,处理试样并引导试样流动,以生成制备的试样。卡210也可在内部的废料腔(图2a未示出,但在下面进一步介绍)中存储来自来自用于制备测试试样的流体和/或试样的废料。存储器芯片275可被读取和/或写入,并用于存储与例如卡盒应用、传感器校准、所需试样处理有关的信息。在一实施例中,存储器芯片275被配置为存储气动系统规约,其包含用于有选择地向卡盒组件200的卡210施加压力,并因此实现制备试样的方法的步骤和设置,该试样用于传送到磁阻性或磁阻传感器(例如gmr传感器芯片280)。传感器芯片可用于对插入单元100的各个卡盒组件200进行防误措施,因为其包括于各种化验测定的自动操作配方(automationrecipe)。存储器芯片275也包含制造各个卡210和/或卡盒组件200的可追溯性。传感和通信衬底202可被配置为建立和维护与卡盒读取器单元100的通信,以及接收、处理和检测所制备试样的特征。衬底202建立与卡盒读取器单元100中的控制器的通信,使得分析物可在所制备的试样中被检测。试样处理卡210与传感和通信衬底202(见例如图2b)组装或组合在一起,以形成卡盒组件200。在一实施例中,粘合材料(见例如图2d)可以视情况可选地用于使卡210与衬底202彼此粘合。在一实施例中,衬底202可以为施加到试样处理卡210的层叠层。在一实施例中,衬底202可以设计为层叠到试样处理卡210的柔性电路。在另一实施例中,试样处理卡210可以用陶瓷材料制造,并在其上集成有电路、传感器(传感器芯片280)以及流体通道。作为替代的是,卡210和衬底202可以机械对准并连接在一起。在一实施例中,衬底202的一部分可以从卡的一个边缘或一端延伸,例如图2a所示。在另一实施例中,如图2b所示,衬底2-2可被对准和/或将尺寸设计为使其具有与卡210类似的边缘或较小的边缘。
图2c原理性地示出了根据一实施例的卡盒组件200的特征。如图所示,某些特征可设置在试样处理卡210上,而其他特征可以与衬底202相关联。一般而言,为了(在卡的主体内)容纳测试试样(例如血、尿),卡盒组件200包含试样注入端口215,其可设置在卡210的顶部。另外,视情况可选地,过滤器220(这里也称为过滤膜)、排气端口225、阀阵列230(或阀阵列带230)以及气动控制端口235可被设置为卡210的一部分。连通通道233设置在卡210内,以流体连接卡210的这些特征。气动控制端口235是卡盒组件200上的气动接口的一部分,用于有选择地将加压流体(空气)施加到卡的连通通道233(以便指引其中的流体(空气、液体、测试试样等等)流动)和/或阀阵列230。视情况可选地,卡210可包含连接到指定的连通通道233的不同的阀控制端口535,用于对阀阵列230中的阀进行控制。卡210也可具有经由连通通道233流体连接的一个以上的计量腔240、气体渗透膜245以及混合通道250。计量腔被设计为经由连通通道233在其中接收至少测试试样(直接地,或是经过过滤地)。一般而言,试样可经由端口215注入卡盒组件200,并借助使用过滤器(例如过滤器220)的过滤、计量腔240中的计量、混合通道250中的混合、加热和/或制冷(视情况可选的)以及经由连通通道233、气动控制端口235和阀阵列230被引导和改变流速来进行处理。例如,流体的流动可使用内部微流体通道(贯穿本公开,一般也称为连通通道233)和阀,经由气动系统(例如卡盒读取器单元100中的系统330,如图3所示)与气动接口(例如在具有气动控制端口235的卡210上)的连接或类似的连接部分而受到控制。根据一实施例,经由加热器259,可实现对卡210内的测试试样和/或混合材料/流体的视情况可选的加热,该加热器可以采用具有热敏电阻器的设置在pcb/衬底202上侧的布线轨迹的形式。根据一实施例,经由集成在卡盒组件200中(例如在衬底202上)的tec模块,或在另一实施例中,经由集成在卡盒读取器单元100内部的模块,可实现对卡210内的测试试样和/或混合材料/流体的视情况可选的制冷。例如,如果制冷模块设置在单元100中,如果需要制冷的话,其可以被按压为紧贴卡盒组件200。处理也可视情况可选地包含经由卡210上的视情况可选的试剂部分260(和/或泡罩包装),和/或经由卡盒读取器单元100的外壳110内的试剂卡盒来引入试剂。试剂可以按照对于该试样的处理以及被分析的卡盒组件200的需要释放或混合。另外,视情况可选的泡罩包装265可设置在卡210上,以便在处理中经由连通通道233向试样引入例如试剂、洗脱剂、清洗缓冲剂、磁纳米颗粒、珠溶液或其他缓冲剂的材料。一个以上的内部废料腔(这里也称为废料池或废料贮器)270也可视情况可选地设置在卡210上,以便贮存来自试样和试剂的废料。如下面讨论的那样,输出端口255——也称为传感器传送端口或到传感器的输入端口——被设置为将制备好的试样从卡210输出到gmr传感器芯片280,用于检测测试试样中的分析物。输出端口255可以流体连接至计量腔,以便将测试试样和一种以上的混合材料传送到传感器。因此,传感器可被配置为,经由所述至少一个输出端口255,接收测试试样以及所述一种以上的混合材料。在实施例中,输入端口257——也称为废料传送端口或来自传感器的输出端口——被设置为将来自gmr传感器芯片280的任何流体或试样输出到废料腔270。废料腔270可以经由连通通道233流体连接到卡210的其他功能部件(包括例如计量腔240、输入端口257或二者)。
卡盒组件200具有在存储器芯片275上存储、读取和/或写入数据的能力,存储器芯片275可与卡210或衬底202相关联。如前所述,存储器芯片275可用于存储与卡盒应用、传感器校准以及所需试样处理(在试样处理卡内)有关和/或相关联的信息,并基于所制备和处理的试样接收附加的信息。存储器芯片275可位于试样处理卡210上或衬底200上。
如前所述,根据此实施例,可以使用磁阻性传感器,以使用这里公开的系统确定测试试样内的分析物(例如生物标志物)。尽管说明书和附图提及使用特定类型的磁阻传感器,即巨磁阻(gmr)传感器,应当明了,本公开并不局限于gmr传感器平台。根据某些实施例,传感器可以是例如各向异性磁阻性(amr)传感器和/或磁性隧道结(mtj)传感器。在实施例中,可以使用其他类型的磁阻性传感器技术。但是,仅仅出于阐释目的,说明书和附图提到使用作为磁阻性传感器的gmr传感器。
卡盒组件200的衬底202可以是或者包含电子接口和/或电路接口,例如pcb(印刷电路板),其可具有巨磁阻(gmr)传感器芯片280和与之相关联的电气接触垫290(或电气接触部分)。其他的部件也可设置在衬底202上。根据一实施例,gmr传感器芯片280至少附着在衬底202上。gmr传感器芯片280可以被布置在衬底202上并使用粘合剂粘在衬底202上。在一实施例中,可在gmr传感器280和pcb衬底202之间使用液体粘合剂或带粘合剂。这样的设计可能需要在底部到pcb的结合以及在顶部到处理卡的结合。作为替代的是,将gmr传感器芯片280附着到衬底202的其他方法包括但不限于:将gmr传感器摩擦装配(frictionfitting)到pcb,以及将gmr传感器芯片280的顶部直接连接到试样处理卡210(例如,特别是在以层叠到试样处理卡210(的背部)的柔性电路的形式提供衬底202时)。gmr传感器芯片280可被设计为接收来自试样处理卡210的输出端口255的制备好的试样。因此,gmr传感器芯片280在衬底上的放置可以基于输出端口255在卡210上的位置而改变或更改(因此,图2b所作图示并非旨在限制),反之亦可。在一实施例中,例如,gmr传感器芯片280被放置在衬底202的第一侧(例如,朝向卡210的下侧的顶侧,如图2b所示),以便从卡210的下侧的输出端口接收所制备的试样,接触垫290被设置在衬底的相反的第二侧(例如,在衬底202的底侧或下侧,使得当组装完成时,接触垫290在卡盒组件200的底侧露出,从而插入卡盒读取器单元100)。gmr传感器芯片280可包括其自己的相关联的接触垫(例如金属条或销),其经由pcb/衬底202上的电子连接而电气地连接到设置在其下侧的电气接触垫290。因此,当卡盒组件200插入卡盒读取器100时,电气接触垫290被配置为电子接口并建立电气连接,因此与卡盒读取器单元100中的电子装置(例如卡盒读取器310)电气连接。因此,传感器芯片280中的所有传感器都通过电气接触垫290和gmr传感器芯片280的接触垫连接到卡盒读取器单元100中的电子装置。
图2d示出了卡210和衬底202的配合或连接接口的示例性截面图。具体而言,图2d示出了根据一实施例在卡210上的输出端口255和衬底202的gmr传感器芯片280之间的接口。例如,图中示出了根据这里公开的任一实施例,位于卡210下方并邻接卡210的pcb衬底202。衬底202可附着到卡210的底面。卡210在其至少一个层中具有通道特征,这里标记为微流体通道433(它是卡210内的许多连通通道中的一个),其被设计为将在卡210中处理的测试试样引导到指向gmr传感器280的输出端口255。视情况可选地,粘合材料可设置在卡210的层之间,例如,粘合剂434a可设置在卡中具有试剂端口434b的层和具有通道433的层之间。衬底202包含gmr传感器芯片280,该芯片被设置为邻近通道433以及卡210的输出端口255。
磁场(来自与下面参照图3所介绍的磁场发生器360不同的磁场发生器365)可用于激励位于传感器附近的纳米磁颗粒。
gmr传感器具有超出各向异性磁阻(amr)或霍尔传感器的灵敏度。这种特性使得检测来自纳米等级磁性材料的杂散场成为可能。例如,来自黏附在传感器表面上的磁纳米颗粒的杂散场将改变磁性层的磁化,并因此改变gmr传感器的电阻。因此,每单位面积黏附到gmr传感器的磁纳米颗粒的数量的变化可以反映在gmr传感器电阻值的变化当中。
出于这些原因,根据这里介绍的实施例,卡盒组件200中使用的传感器是gmr传感器芯片280。
现在参照图3,示出了系统中设置的特征的一种概览。特别地,原理性地示出了卡盒读取器单元100的某些其他的特征,以进一步介绍卡盒读取器单元100和卡盒组件200如何被配置在一起工作,组成用于检测试样中分析物的系统300。如所介绍的,卡盒组件200可插入卡盒读取器单元100的外壳110。一般而言,卡盒读取器单元100的外壳110可进一步包括或包含:处理器或控制单元310,贯穿本公开,也称为“控制器”和/或“卡盒读取器”310;电源320;气动系统330;通信单元340;(视情况可选的)诊断单元350;磁场发生器360;存储器370(或数据存储器);以及,用户接口140和/或显示器120。视情况可选地,用于打开插入的卡盒组件上的试剂源或用于将试剂引入卡盒组件中(如果试剂不是在组件内特定的装试剂的地方)的试剂开启器(例如图6中的刺穿系统553)也可被设置为卡盒读取器单元100的一部分。一旦卡盒组件200被插入卡盒读取器单元100的外壳110,且电气及气动系统被连接,卡盒存储器芯片275可通过卡盒组件200被读取(例如由单元100中的卡盒读取器310/控制单元或pcb组件读取),以确定气动系统规约,该规约包含有选择地将压力施加到卡盒组件200的卡210的步骤和设置,从而实现制备用于传送到传感器(例如gmr传感器芯片280)的试样的方法,因此,放在组件200中的试样可被制备、处理和分析。控制单元或卡盒读取器310可控制用于在试样中检测分析物的过程的自动化所需要的输入和输出。例如,卡盒读取器310可以是实时控制器,其被配置为,除其他的以外,控制与卡盒组件200相关联的巨磁阻(gmr)传感器芯片280和/或存储器芯片275以及外壳110内的气动系统330以及来自用户接口的控制,例如,驱动磁场发生器360,向与卡盒组件200相关联的传感器芯片和/或存储器发送和/或从之接收信号。在一实施例中,卡盒读取器310以pcb(印刷电路板)的形式被提供,其中可包含另外的芯片、存储器、装置。卡盒读取器310可被配置为与例如内部存储器单元、系统运行初始化器、信号准备单元、信号准备单元、信号处理单元和/或数据存储器(图中均未示出)进行通信和/或对之进行控制。卡盒读取器310也可被配置为通过通信单元340发送和接收信号,使得网络连接和遥测(telemetry)(例如与云服务器)可被建立,非易失性的配方可被实施。一般而言,通信单元340允许卡盒读取器单元100使用无线或有线技术发送和接收数据。电力可经由电源320(通过内部的电池的形式,或经由连接(例如经由线缆和插头)的外部电源接收电力的形式)供给卡盒读取器单元100。气动系统330用于,在试样处理卡210内部和沿着试样处理卡210移动和指引流体(例如经由气动连接235,通过其通道以及到直接弹性阀的连接),处理和制备放入卡盒组件200的试样(例如,血、尿)。气动系统330可以是用于移动流体的系统和/或装置,其可使用与流体接触的柱塞和/或活塞(稍后在下面进一步介绍)。磁场发生器360可以是外部的磁性线圈或其他的磁场发生装置,其安装在单元100中,或以某种方式与设置在卡盒读取器单元100的电路板上或设置在卡盒组件200上的一个以上的芯片(例如传感器芯片280)集成在一起。磁场发生器360用于在读取信号的同时激励gmr传感器芯片280附近的磁纳米颗粒。根据实施例,第二磁场发生器365——其可以是线圈或其他的磁场发生装置——可以设置为卡盒读取器单元100的一部分并在外壳100内。例如,根据一实施例,第二磁场发生器365可以是与磁场发生器360分开且不同的。此第二磁场发生器365可被配置为用来生成非均匀的磁场,使得其能够在试样制备和处理过程中将这样的磁场施加到试样处理卡210的部分(例如上面、下面、侧面),例如当在卡中移动来自混合材料源的混合材料(例如,缓冲剂和/或磁珠)以及测试试样的时候。在一实施例中,第二磁场发生器365设置在卡盒读取器单元的相反端或相反侧(例如,位于单元100的外壳110的顶部),即远离用于gmr检测的磁场发生器360。在一实施例中,第二磁场发生器365设置在卡盒读取器单元相较于磁场发生器360的相反端(例如第二磁场发生器位于单元100的外壳110的顶部,磁场发生器360设置在单元100的底端(在卡盒容纳器130附近))。在一实施例中,用于检测生物标志物/分析物的总磁场包含来自磁场发生器360(在传感器芯片外或与传感器芯片集成在一起)的磁场以及来自gmr传感器芯片280附近的磁纳米颗粒的任何扰动。试剂开启器视情况可选地用在gmr传感器芯片280的读取和试样处理期间引入试剂(如果试剂不在卡内特定的装试剂的地方)。如前面所介绍的,用户接口140/显示器120允许操作者输入信息、控制过程、提供系统反馈以及显示测试结果(经由输入显示屏,其可以是触摸屏)。
图4示出了使用这里公开的系统300进行试样中分析物检测的方法400的步骤。在步骤410中,系统被初始化。系统的初始化可包含:向系统300(包括卡盒读取器单元100)加电,确定系统的配置信息,读取计算,确定特征(例如磁场发生器和载波信号)在线且准备就绪,等等。在步骤415中,完整的测试试样被加入或载入卡盒组件200(例如,试样被注射到如图2c所示的注入端口215中)。步骤410和415的顺序可以改变,即,可以在系统初始化之前或之后将完整的测试试样加入组件200。在步骤420中,卡盒组件200被插入卡盒读取器单元100。视情况可选地,作为方法400的一部分,用户指令可经由用户接口/显示器120输入到卡盒读取器单元100和/或系统300。于是,在步骤425中,试样的处理经由控制单元310启动。例如,这种启动可包含通过用户接口/显示器120和/或连接到读取器单元100的系统从操作者或用户接收输入。在另一实施例中,可以通过将卡盒组件200插入卡盒读取器单元100以及检测到其中卡盒组件200的存在(例如,经由组件200上的电气接触垫290与控制单元310之间的电气连接,以及自动读取来自存储器芯片275的指令),自动地启动处理。使用气动控制指令(例如从存储器芯片275获得),试样在步骤425中受到处理,从而生成制备的试样。如上面介绍(以及下面进一步介绍)的,试样的处理可以取决于试样的类型和/或插入读取器单元100的卡盒组件200的类型。在某些情况下,处理可包含制备试样之前的若干步骤,包括混合、引入缓冲剂或试剂等等。一旦试样制备好,所制备的试样被发送(例如,通过卡210中的通道,经由气动系统330和控制单元310的气动控制,到输出端口255)到gmr传感器芯片280。在步骤440中,所制备试样中的分析物在gmr传感器芯片280中被检测。接着,在步骤445中,来自gmr传感器芯片280的信号被接收和处理,例如,经由卡盒读取器310(控制单元,其可包含例如一个以上的处理器)。一旦信号被处理完,测试结果可在450处经由例如显示器120/用户接口被显示。在455处,测试结果被保存。测试结果可保存在云服务器中和/或卡盒组件200上的板载存储器芯片275中。在实施例中,任何流体或试样可从gmr传感器芯片280通过输入端口257被引导到废料腔270。此后,一旦所有测试被传感装置/gmr传感器芯片280执行和读取,卡盒组件200可从卡盒读取器单元100退出。根据一实施例,这可以自动执行,例如,卡盒读取器单元的外壳110中的机械装置可将组件200推出外壳110,或者,这也可以由操作者手动执行(借助按钮或力)。
在一实施例中,这里介绍的系统300可使用如题目为“systemandmethodforgmr-baseddetectionofbiomarkers”且于同日提交的国际专利申请no.pct/us2019/______(代理人案卷号no.026462-0504846)所公开的气动控制系统,该申请全文并入此处作为参考。
在一实施例中,这里介绍的系统300可使用如题目为“systemandmethodforsamplepeparationingmr-baseddetectionofbiomarkers”且于同日提交的国际专利申请no.pct/us2019/______(代理人案卷号no.026462-0504847)所公开的卡盒组件,该申请全文并入此处作为参考。
在一实施例中,这里介绍的系统300可如题目为“systemandmethodforprocessinganalytesignalsingmr-baseddetectionofbiomarkers”且于同日提交的国际专利申请no.pct/us2019/______(代理人案卷号no.026462-0504850)所公开的那样处理gmr传感器的信号,该申请全文并入此处作为参考。例如,如上所述,在步骤445中,经由卡盒读取器310,来自gmr传感器芯片280的信号被接收和处理。在一实施例中,卡盒读取器310被配置为使用试样制备控制部分和信号处理部分来执行对来自gmr传感器芯片280的结果进行处理的功能,试样准备控制部分具有存储器读取单元和试样准备控制单元(用于接收表示卡盒组件200已经插入卡盒读取器单元100的信号,读取存储在存储器芯片275中的信息,生成气动控制信号,并将它们发送到气动系统330),信号处理部分适用于控制电气元件,准备和收集信号,处理、显示和/或将测试结果中继到外部系统,包括处理测量信号以获得分析物检测的测试结果,如-0504850申请中详细介绍的那样。与卡盒读取器310和单元100的信号处理器有关的附加特征稍后在本公开中更为详细地提供。
应当明了,关于图1和图2a-2f,所示的特征是作为这里公开的用于在试样中检测分析物的系统300的部分的卡盒读取器单元100和卡盒组件200的示例性原理图。因此,图示仅仅是阐释性的,并非旨在限制。
回到前面关于图2c讨论的试样处理卡210和卡盒组件200的部件,卡盒组件200中的试样处理卡210上提供的部件的布置、放置、包含在内以及数量可以基于所分析测试试样和/或所执行测试(例如生物标志物检测、金属检测等)而定。另外,在某些实施例中,卡210可以布置为使得卡上存在分区,和/或使得特征设置在不同的层中(然而,这些层不需要为具有其主体的不同的层);相反,是在深度或高度上(z轴方向上)相对于彼此分层。根据这里的实施例,试样处理卡210可以使用激光切割以形成入口、通道、阀区域等并且夹和连接/封装在一起的部分形成。在其他的实施例中,试样处理卡的一个和多个的层可以激光切割、层叠、模塑等等或由多种工艺的组合形成。形成试样处理卡210的方法并非旨在限制。这里出于说明性目的,某些图包含层的图示,以显示试样处理卡210的部分相对于彼此的定位(例如相对于位于上和/或下面的其他特征在卡中的定位)。提供这些图示,以显示特征(通道、阀等)在试样处理卡210的主体内的示例性深度或放置,并非作为限制。
一般而言,每个卡210都有主体214,当从顶上或从上侧观看时,其沿着纵向中心线a—a(设置在y轴方向上)纵向延伸。在一实施例中,各个卡210可具有这样定义的维度:以纵向方向延伸的长度(即相对于或沿着中心线a—a)、以长度方向的横向延伸的宽度(例如在x轴方向上)以及在z轴方向或竖直方向上的高度(或者深度或厚度)。在一非限制性实施例中,卡210的主体214可以大致为矩形构造。在一实施例中,卡盒读取器单元100中的卡盒容纳器130(和/或任何相关的托盘)的尺寸设计为容纳试样处理卡210的维度,使得卡210可插入单元100的外壳。
在本公开的附图中示出的结构特征并非旨在限制。例如,装置,阀,计量室,膜,混合通道和/或端口的数量不限于所示出的那些。在一些实施例中,可以提供更多的通道。在一些实施例中,可以提供更少的通道。阀的数量也不是限制性的。
尽管卡盒组件200和试样处理卡210在本文中可以描述为与试剂和患者或医学血液试样一起使用,但是应当注意,本文公开的卡盒组件200不限于仅在医疗实践中与血液或血液试样一起使用。在本文公开的卡盒中可以使其他的液体分离并与试剂或反应性材料结合而进行分析。其他试样可能来自唾液,尿液,粪便试样,上皮拭子,眼液,活检试样(固体和液体)(例如来自口腔),水试样(例如来自市政饮用水,自来水,污水,海水,湖水之类。
感测微流体装置包括一个以上微流体通道以及设置在一个以上微流体通道内的多个传感器垫。现在参考图5a,示出了根据一些实施例的示例性通道500。通道500在结构上显示为蛇形,但不必局限于几何形状。通道500包括设置在通道主体520内的多个gmr传感器510。gmr传感器510可以全部相同地配置为检测单个分析物,其冗余度允许增强检测。gmr传感器510也可以全部被不同地配置以检测多个分析物或具有一些冗余的不同配置的传感器的组合。通道500还包括通道入口530,任何试样,试剂,珠悬浮液等在此处进入通道主体520。流体可以在通道入口530处的正压下或在通道出口540处施加的真空下介导通过通道主体520。
图5b显示了设置在基座550内的多个通道500。每个通道500具有通道扩大段560,该通道扩大段是围绕每个gmr传感器510的扩大区域(图5a;为清楚起见未在图5b中示出)。不受理论的束缚,假定通道扩大段560提供了一种在材料经过gmr传感器时更好地混合材料的手段。在基座550的外围布置有一对接触垫570,其用作位于通道扩大段560中的gmr传感器与电路的其余部分之间的电导管。gmr传感器510经由电线(未示出)电连接到接触垫570。
图6a示出了在具有直线构造的通道主体620中包括多个gmr传感器610的通道600的横截面。在这样的实施例中,材料的流动方向可以来自任一方向。在其他实施例中,如图6b所示,通道600可包括在形状大致为圆形或椭圆形的通道扩大段630处并入通道主体620内的多个相似的gmr传感器610。在另外的实施例中,如图6c所示,通道600可以具有设置在大致正方形或矩形的通道扩大段630中的gmr传感器610。尽管未示出,但是也可以设置这种正方形或矩形的通道扩大段,使得侧面而不是正方形或矩形的点是通道扩大段630而不是顶点的一部分。通道扩大段1030的其他配置也是可能的,包括图6d所示的配置,其中通道600具有设置成三角形(或梯形)形状的gmr传感器610。通道扩大段630可以具有任何几何形状,并且可以针对期望的流动和混合特性以及在gmr传感器610上的停留时间进行选择。
如图6d所示,通道600可具有蛇形形状的通道主体620,并且沿着蛇形路径的长度设置有gmr传感器610。在一些实施例中,与线性通道600相比,这样的蛇形结构可以允许更多的传感器被安装到较小的区域中。如图6f所示,通道600可以结合具有蛇形结构的主体620以及具有包含gmr传感器610的通道扩大段630。通道1000进一步可选的结构特征在图6g中示出,其示出了具有设置在其中的gmr传感器的通道600,及具有分支的通道主体620。在一些这样的实施例中,取决于确切的应用,可以在任一方向上调节流动方向。例如,当流向图的左侧时,材料可以分为两个不同的路径。这可以表示沿着两个分叉使用不同的gmr传感器610。通道主体620的宽度可以在分叉之前和之后变化,并且可以针对特定的流动特性进行选择。
现在参考图7,其示出了通道700,其在通道主体720内并入了通道扩大段730,其中布置了不同的gmr传感器710a和710b。尽管图7交替显示了不同的gmr传感器710a和710b,但它不必遵循这种模式。例如,所有的同种类型的gmr传感器710a可以彼此相邻地聚类在一起,并且同样地,所有其他类型的gmr传感器710b可以聚类在一起。再次参考图6g,不同的传感器也可能沿着分叉的线出现。
图8a,图8b和图8c示意性地示出了根据本公开的实施例中可以安装在卡盒组件200上的gmr传感器芯片280的结构。如图8a所示,gmr传感器芯片280包括:至少一个布置在芯片中心的通道810、820和830;多个gmr传感器880设置在通道内;电接触垫840a,840b布置在gmr传感器芯片的两个相对端上;金属线850、860、870a,870b,870c,890a,890b,890c耦合到电接触垫840a,840b。
通道810、820和830每个都可以具有蛇形形状,以允许更多的传感器被安装在其中。可以沿着通道布置多个通道扩大段885,以容纳多个gmr传感器。要测试的流体分别通过通道入口815a,825a,835a和通道出口815b,825b,835b流入和流出通道810、820、830。尽管图8a显示gmr传感器880以8×6传感器阵列排列,三个通道810、820、830的每个通道中都装有16个传感器,但也可以使用其他组合来满足待分析物的特定需求。
电接触垫840a,840b包括多个电接触销。金属线850、860、870a,870b,870c将gmr传感器连接到相应的电接触针845a,845b,875。电接触垫840a,840b依次连接到卡盒组件200上提供的电接触垫290。当将卡盒组件200插入盒读取器310时,在gmr传感器芯片280和盒读取器310之间形成电连接,以使得能够将测量信号从gmr传感器发送到盒读取器310。
图8b示出了gmr传感器的更多细节。例如,每个gmr传感器可以由五个并联的gmr条组成。在一端,每个gmr传感器通过两条主要金属线之一(即导线850或860)连接到两个公共引脚(即引脚845a或845b)之一。gmr传感器的另一端通过分开的金属线870a,870b,870c连接到电接触垫840a或840b上的不同的引脚875。
图8a还示出了流体检测金属线890a,890b,890c,它们布置在通道入口和/或出口的附近,每个通道入口和/或出口对应于一个通道。流体检测功能由布置在各个流体检测金属线中的开关895a,895b,895c执行。图8c详细示出了开关895a的结构。响应于识别出导电流体(例如,等离子体)在其上流动,开关895a可以将一侧的导线896a耦合到另一侧的导线896b,从而产生流体检测信号。
图8a-c所示的gmr传感器芯片的结构和布线本质上仅是示例性的,对于本领域技术人员显而易见的是,其他结构和布线对于实现相同或相似的功能也是可行的。现在参考图9,其示出了在通道扩大段930处的通道900的剖视图。在通道扩大段930内布置有gmr传感器910,其上固定有一个以上生物分子925。通过常规的表面化学方法(在图14中更详细地显示)将生物分子925固定至gmr传感器910。生物分子925可以是肽或蛋白质,dna,rna,寡糖,激素,抗体,糖蛋白等,这取决于进行的测定的性质。每个gmr传感器910通过导线995连接到位于通道900外部的接触垫970。在一些实施例中,导线995在传感器底部连接到gmr传感器910。
现在参考图10a,其示出了通道1000的更详细的横截面图,该通道1000具有在gmr传感器1010的位置处缺少通道扩大段的通道主体1030。生物分子1025通过附接到传感器的生物表面1045而被固定。生物表面固定化学是本领域已知的。参见例如cha等的论文“immobilizationoforientedproteinmoleculesonpoly(ethyleneglycol)-coatedsi(111)”,proteomics4:1965-1976,(2004);以及zellander等的论文“characterizationofporestructureinbiologicallyfunctionalpoly(2-hydroxyethylmethacrylate)-poly(ethyleneglycol)diacrylate(phema-pegda),”plosone9(5):e96709,(2014)。在一些实施例中,生物表面1045包含与phema交联的peg聚合物。在一些实施例中,交联基团由式(i)表示:
pa-lg-pa(i)
其中每个pa是光或金属活化或活化的基团,lg是连接基团。在一些实施例中,每个pa是相同的,而在其他一些实施例中,每个pa是不同的。在一些实施例中,pa被光活化或金属活化以形成能够c-h和/或o-h插入的腈中间体。例如,在第二版《laboratorytechniquesinbiochemistryandmolecularbiology》,elsevierpress,12:8-24(1983)中的论文“photogeneratedreactiveintermediatesandtheirproperties”。在一些实施例中,pa被金属活化以形成能够c-h和/或o-h插入的卡宾或类胡萝卜素中间体。例如,在chem.rev.2:704-724(2010)中doyle等的论文“catalyticcarbeneinsertionintoc-hbonds”。
在一些实施例中,每个pa是叠氮化物(-n3)部分,并且光活化产生能够c-h和/或o-h插入的腈中间体,从而介导peg和phema聚合物的交联。在一些实施例中,每个pa是重氮(-n2),并且金属催化的分解反应形成能够c-h和/或o-h插入的卡宾或类胡萝卜素中间体,从而介导peg和phema聚合物的交联。叠氮化物和重氮制剂都在本领域中是众所周知的,并且在叠氮化物的情况下,可以通过叠氮化物阴离子n3-具有合适的具有离去基团的有机部分的sn2置换反应来容易地制备。
公式(i)中的lg可以是将支持每个pa部分的存在的任何有机片段。它可以是直链或支链的简单c2-c20烃链。这样的烃可以包括具有任何程度的氟取代的氟化变体。在一些实施例中,lg可包括芳族烃,其包括但不限于苯,萘,联苯,联萘基或具有c2-c20烃链的芳族结构的组合。因此,在一些实施例中,lg在结构上可以是烷基,芳基或芳烷基。在一些实施例中,烷基连接基团在其链中可具有一个以上碳原子,所述碳原子被氧(o)或胺(nr)取代,其中r为h或c1-c6烷基。
根据前述实施例,交联的peg-phema结构可以由式(ii)给出:
peg-a-lg-a-phema
其中peg是聚乙二醇部分,每个a是来自叠氮化物或重氮的催化反应的连接原子,即ch2或nh,而lg是如上所述的连接基团。
在图10a中,磁珠结合实体1015被配置为与生物分子1025或目标分析物相互作用,例如在抗体-分析物-磁珠结合抗体的三明治复合物中。在生物表面1045下方是另一绝缘层1055。绝缘层1055可以与gmr传感器1010直接接触,并且可以包括例如金属氧化物层。生物表面层1045与绝缘层1045直接接触。基底1065用作其上方的每个组件,gmr传感器1010,绝缘层1055和生物表面层1045,的支架。在一些实施例中,基底1065由硅晶片制成。
图10b示意性地示出了gmr传感器的基本结构和原理。典型的gmr传感器由金属多层结构组成,该金属多层结构具有夹在两个磁性层1080a和1080b之间的非磁性导电中间层1090。非磁性导电中间层1490通常是薄铜膜。磁性层1080a和1080b可以由铁磁合金材料制成。
金属多层结构的电阻根据磁性层1080a和1080b的相对磁化方向而变化。平行磁化(如图10b的右半部分所示)导致较低的电阻,而反平行磁化(如图10b的左半部分所示)导致较高的电阻。磁化方向可以通过外部施加的磁场来控制。作为结果,金属多层结构显示出其电阻随外部磁场的变化。
gmr传感器的灵敏度超过各向异性磁阻(amr)或霍尔传感器的灵敏度。此特性使得能够检测纳米级磁性材料的杂散场。例如,结合在传感器表面的磁性纳米颗粒的杂散场将改变磁性层中的磁化强度,从而改变gmr传感器的电阻。因此,可以在gmr传感器的电阻值的变化中反映出每单位面积结合到gmr传感器的磁性纳米颗粒的数量的变化。
现在参考图11a和12a,其示出了两种示例性基本模式,gmr传感器通过应用其操作本文所述的各种测定。在图11a中示例的第一模式中,在测定开始时,磁珠1115经由生物表面1165被加载到接近gmr传感器(参见图11a,1010)。在测定期间,测试分析物的存在导致磁珠1115从生物表面1165移位(并因此从gmr传感器移位);这种模式是所谓的减法模式,因为磁珠被从传感器表面附近带走。图12a中代表的第二种主要模式操作是添加模式。在这样的测定中,当存在测试分析物时,在gmr传感器附近净增加了磁珠1215(见图10a,1010)。减法或加法中的任何一种模式都依赖于传感器表面附近的磁珠数量(1115、1215)的变化状态,从而改变了gmr传感器系统中的电阻。测量电阻的变化可以定量分析物的浓度。
返回参考图11a,示出了传感器结构图,其示出了整个示例性减法过程中的传感器结构。在过程开始时,系统处于状态1100a,其中gmr传感器已在其生物表面1165上放置了多个分子(通常是生物分子)1125,并带有相关的磁珠1115。生物表面1165上方的体积可能开始干燥或存在溶剂。当干燥时,检测过程可以包括用例如缓冲溶液的溶剂灌注步骤。在引入分析物之后,系统采取状态1100b的形式,其中一些磁珠1115已经与分析物的浓度成比例地从分子1125中去除。状态1100a和1100b的变化提供了可测量的电阻变化,从而允许对目标分析物进行定量。在一些实施例中,分析物可以简单地直接从分子1125置换珠子。在其他实施例中,分析物可以与分子1125化学反应以裂解附着于珠子1115的一部分分子,从而与分子1125的裂解部分一起释放珠子1115。
在实施例中,生物表面1165包含聚合物。可以选择特定的聚合物以促进分子1125共价附接到生物表面1165。在其他实施例中,分子1125可以经由静电相互作用与生物表面1165缔合。例如,可以选择聚合物涂层或对其进行改性以使用常规的连接化学来共价锚定生物分子。连接化学包括任何包含有机功能团的化学部分,包括但不限于胺,醇,羧酸和硫醇基。共价连接化学包括但不限于酯,酰胺,硫代酯和亚胺的形成(可随后对其进行还原,即还原胺化)。生物表面1165可包括表面改性剂,例如表面活性剂,包括但不限于阴离子表面活性剂,阳离子表面活性剂和两性离子表面活性剂。
分子1125可以包括可连接至生物表面1165的任何数量的受体/配体实体。在一些实施例中,分子1125包括多种生物分子中的任何一种。生物分子包括dna,rna和含有游离胺基的蛋白质,可以将其与具有功能性nhs基团的gmr传感器表面共价固定。对于免疫测定,对分析物具有特定性的原发抗体(小鼠单克隆igg)附着在gmr表面。所有原发抗体均具有多个游离胺基,大多数蛋白质具有赖氨酸和/或α-氨基。只要存在无赖氨酸的伯胺,抗体就会被共价固定在gmr传感器上。为了将抗体固定在传感器表面,使用打印机系统(sciflexarrayer,scienion,德国)将1.2nl原发抗体(pbs缓冲液中1mg/ml)注入传感器表面。将所有印刷表面在4℃和相对湿度~85%的条件下孵育过夜。将表面用封闭缓冲液(tris缓冲液中的50mm乙醇胺)洗涤3次,再用相同的缓冲液封闭30分钟。
在实施例中,磁珠1115可以是纳米颗粒,包括球形纳米颗粒。这样的纳米颗粒可具有在约2至约50纳米(nm),或约5至约20nm,或约5至约10nm范围内的有效直径。在实施例中,可以涂覆磁珠1115以促进共价附于分子1125。在其他实施例中,可以涂覆磁珠1115以促进与分子1125的静电缔合。可以对磁珠1115进行差异标记和/或涂覆以促进多重检测方案。在这样的实施例中,差异标记和/或涂层被配置成使得不同的珠子与设置在不同的gmr传感器上或在单个传感器上的不同分子相互作用,在该传感器中分别不同的分子以创建可寻址信号。
图11b示出了与图11a的传感器结构方案相关的处理流程1101。该过程开始于1120,通过将试样注射到卡盒组件中。然后,试样可以在步骤1130通过任何必要的步骤进行处理,例如过滤,稀释和/或化学修饰。这些预处理步骤的顺序取决于试样的性质及将要检测的分析物。其通过系统的运动可以通过气动控制。步骤1140以规定的流速将处理后的试样发送至gmr传感器。这样的流速可被选择来反映gmr传感器表面上的化学动力学。步骤1150提供从gmr传感器获得的读数,该读数反映了gmr传感器表面上的磁珠浓度的变化。这些读数允许在步骤1160处检测电阻的变化。最后,步骤1170提供基于电阻变化来计算检测结果的步骤。
现在参考图12a,示出了传感器结构图,其示出了整个示例性添加过程中的传感器结构。在过程开始时,系统处于状态1200a,其中gmr传感器已在其生物表面1265上放置了多个分子(通常为生物分子)1225。选择多个分子1225来绑定测试分析物1290,如第二状态1200b。测试分析物1295被配置为与磁珠1215结合。在一些实施例中,测试分析物1295在经过生物表面1265之前与磁珠相关联。例如,这可以在被测试试样的预处理期间发生。(在其他实施例中,测试分析物1295可以首先经过生物表面,然后在分析物结合到生物表面1265之后,可以用磁珠1215修改测试分析物1295,如下面参考图13a所描述的)。在一些实施例中,给定的测试分析物1295在结合磁性颗粒1215之前可能需要化学修饰。在一些实施例中,磁珠1215可以被修饰以与测试分析物1295相互作用。通过分析测得的电阻的变化来定量分析物。状态1200a(其中不存在磁珠1215)到状态1200b,其中磁珠1215与生物表面1265相关联。
图12b示出了与图12a的传感器结构方案相关联的示例性流程1201。该过程开始于1220,通过将试样注入卡盒组件中。然后可以在步骤1230通过任何必要的步骤,例如过滤,稀释和/或化学修饰,对试样进行处理。这些预处理步骤的顺序取决于试样的性质及将要检测的分析物。其通过系统的运动可以通过气动控制。步骤1240将处理后的试样发送至反应腔,然后在步骤1250中将珠粒引入反应腔以修饰测试分析物。如上所述,可以直接在传感器表面而不是在反应腔中进行这种修改。在步骤1260中,将修改后的试样以目标流速发送到gmr传感器。这样的流速可被选择来反映gmr传感器表面上的化学动力学。步骤1270提供从gmr传感器获得的读数,该读数反映了gmr传感器表面上的磁珠浓度的变化。这些读数允许在步骤1280处检测电阻的变化。最后,步骤1290提供基于电阻的变化来计算检测结果。
现在参考图13a,示出了传感器结构图,该传感器结构图示出了整个示例性添加过程中的传感器结构状态1300a-c。在过程开始时,系统处于状态1300a,其中gmr传感器已在其生物表面1365上放置了多个分子(通常是生物分子)1325。选择多个分子1325来绑定测试分析物1395,如第二状态1300b。测试分析物1395被配置为与磁珠1315结合,如状态1300c所示。在一些实施例中,给定的测试分析物1395在结合磁性颗粒1315之前可能需要化学修饰。在其他实施例中,测试分析物1395可以在没有化学修饰的情况下结合磁性纳米颗粒1315。在一些实施例中,磁珠1315被涂覆或以其他方式被修饰以与测试分析物1395相互作用。通过从状态1300a(不存在磁珠1315存在)到状态1300c的测量电阻变化来量化测试分析物1395。磁珠1315与生物表面1365相关联。
图13b示出了与图13a的传感器结构方案相关联的示例性处理流程1301a。该过程开始于1310,通过将试样注入盒组件中。然后,试样可以在步骤1320通过任何必要的步骤进行处理,例如过滤,稀释等。这些预处理步骤的顺序取决于试样的性质及将要检测的分析物。在1330将处理试样发送到反应腔。其通过系统的运动可以气动控制。步骤1340用试剂修饰存在于试样腔中的分析物,以使其与磁性颗粒相互作用。在步骤1350,将修改后的试样以目标流速发送到gmr传感器。这样的流速可被选择来反映gmr传感器表面上的化学动力学。接下来,步骤1360将珠子引入gmr传感器,该gmr传感器可与修饰的分析物相互作用。在一些实施例中,珠子也可以被修饰,例如用能够与修饰的分析物相互作用的涂层或一些其他连接分子。步骤1370提供从gmr传感器获得的读数,该读数反映了gmr传感器表面上的磁珠浓度的变化。这些读数允许在步骤1380处检测电阻的变化。最后,步骤1390提供基于电阻的变化来计算检测结果。
图13c示出了与图13a的传感器结构方案相关联的替代示例性流程1301b。该过程开始于1302,通过将试样注射到卡盒组件中。然后,试样可以在步骤1304通过诸如过滤,稀释等的任何必要步骤进行处理。这些预处理步骤的顺序取决于试样的性质及将要检测的分析物。其通过系统的运动可以通过气动控制。在步骤1306,将修改后的试样以目标流速发送到gmr传感器。这样的流速可被选择来反映gmr传感器表面上的化学动力学。步骤1308涉及用试剂修饰试样中存在的分析物,以使其与磁性颗粒相互作用。接下来,步骤1312将珠子引入到gmr传感器中,该gmr传感器现在可以与修饰的分析物相互作用。在一些实施例中,珠子也可以被修饰,例如用能够与修饰的分析物相互作用的涂层或一些其他连接分子。步骤1314提供了从gmr传感器获得的读数,该读数反映了gmr传感器表面上的磁珠浓度的变化。这些读数允许在步骤1316处检测电阻的变化。最后,步骤1318提供基于电阻的变化来计算检测结果。
现在参考图14a,其示出了传感器结构图,该传感器结构图示出了整个示例性添加过程中的传感器结构状态1400a-c。在过程开始时,系统处于状态1400a,其中gmr传感器已在其生物表面1465上放置了多个分子(通常是生物分子)1425。选择了多个分子1425与测试分析物进行交互(化学反应)。如第二状态1400b所示,这种相互作用修饰分子1425(与分析物浓度成比例)以提供修饰的分子1411。如状态1300c所示,修饰分子1411被配置为与磁珠1415结合。在一些实施例中,修饰的分子1411在结合磁性颗粒1415之前可能需要进一步的化学修饰。在其他实施例中,修饰的分子1411可以在不进行化学修饰的情况下结合磁性纳米颗粒1415。在一些实施例中,磁珠1415被涂覆或以其他方式被修饰以与修饰的分子1411相互作用。通过从从不存在磁珠1415的状态1400a到状态1400c的测量电阻的变化来定量测试分析物。珠子1415经由修饰的分子1411与生物表面1465相关联。注意,在整个过程中,测试分析物仅用作化学修饰多个分子1425的试剂,并且一旦执行此功能,就不会保留该过程的一部分。
图14b示出了与图14a的传感器结构方案相关的示例性流程1401。该过程开始于1420,通过将试样注射到卡盒组件中。然后可以在步骤1430通过诸如过滤,稀释等的任何必要步骤对试样进行处理。这些预处理步骤的顺序取决于试样的性质及将要检测的分析物。其通过系统的运动可以通过气动控制。在1440,将试样以指定的流量发送到gmr传感器。这样的流速可被选择来反映gmr传感器表面上的化学动力学。接下来,步骤1450将珠子引入到gmr传感器中,该gmr传感器可与生物表面上的修饰分子相互作用。在一些实施例中,珠子也可以被修饰,例如用能够与生物表面上的修饰分子相互作用的涂层或一些其他连接分子。步骤1460提供了从gmr传感器获得的读数,该读数反映了gmr传感器表面上的磁珠浓度的变化。这些读数允许在步骤1470处检测电阻的变化。最后,步骤1480提供基于电阻的变化来计算检测结果的步骤。
现在参考图15a,其示出了传感器结构图,该传感器结构图示出了整个示例性添加过程中的传感器结构状态1500a-c。在过程开始时,系统处于状态1500a,其中gmr传感器已在其生物表面1565上放置了多个分子(通常是生物分子)1525。选择了多个分子1525与测试分析物进行交互(化学反应)。如第二状态1500b所示,这种相互作用修饰分子1525(与分析物浓度成比例)以提供修饰的分子1511。如状态1500c中所示,修饰的分子1511被配置为防止磁珠1515的结合,在状态1500c中,磁珠仅结合未被分析物修饰的分子1525。在一些实施例中,磁珠1515被涂覆或以其他方式被修改以与分子1525相互作用。通过从不存在磁珠1515的状态1500a到状态1500c的测量电阻的变化来定量测试分析物。1515通过分子1525与生物表面1565关联。注意,在整个过程中,测试分析物仅充当化学修饰多个分子1525的试剂,并且一旦执行了此功能,就不会保留为过程的一部分。
图15b示出了与图15a的传感器结构方案相关的示例性流程1501。该过程开始于1510,通过将试样注入卡盒组件中。然后,试样可以在步骤1520通过任何必要的步骤进行处理,例如过滤,稀释等。这些预处理步骤的顺序取决于试样的性质及将要检测的分析物。其通过系统的运动可以通过气动控制。在步骤1530,将处理后的试样以指定的流量发送到gmr传感器。这样的流速可被选择来反映gmr传感器表面上的化学动力学。接下来,步骤1540将珠子引入到gmr传感器中,该gmr传感器现在可以与生物表面上的未修饰分子相互作用。在一些实施例中,珠子可以被修饰,例如用能够与未修饰的分子相互作用的涂层或一些其他连接分子。步骤1550提供了从gmr传感器获得的读数,该读数反映了gmr传感器表面上的磁珠浓度的变化。这些读数允许在步骤1560处检测电阻的变化。最后,步骤1570提供基于电阻的变化来计算检测结果。
现在参考图16a,其示出了传感器结构图,该传感器结构图示出了整个示例性添加过程中的传感器结构状态1600a-d,该过程采用“三明治”抗体策略来检测分析物1695(状态1600b)。在过程开始时,系统处于状态1600a,其中gmr传感器已在其生物表面1665上放置了多种抗体1625。然后,将分析物1695通过生物表面1665,从而使分析物1695与抗体1625结合,如状态1600b。然后,如状态1600c所示,通过与提供共价连接的生物素部分(b)的第二抗体1635结合来修饰分析物1695。然后加入用抗生蛋白链菌素(s)修饰的磁珠1615,从而使强的生物素-抗生蛋白链菌素缔合提供状态1600d。在一些实施例中,抗生蛋白链菌素被提供作为磁珠1615上的涂层。
图16b示出了与图16a的传感器结构方案相关的示例性流程1601。该过程开始于1610,将试样注入到卡盒组件中。然后,试样可以在步骤1620通过任何必要的步骤进行处理,例如过滤,稀释等。这些预处理步骤的顺序取决于试样的性质及将要检测的分析物。其通过系统的运动可以通过气动控制。在步骤1630,将处理后的试样以指定的流量发送到gmr传感器。可以选择这样的流速以反映在生物表面结合的抗体和分析物之间的gmr传感器表面上的化学动力学。接下来,步骤1640将生物素化的抗体(ab)引入gmr传感器。这在两个抗体之间创建了分析物的“三明治”结构。在步骤1650,将链菌素涂覆的珠子引入gmr传感器,该传感器现在可以与结合生物素的抗体相互作用。步骤1660提供从gmr传感器获得的读数,该读数反映了gmr传感器表面上的磁珠浓度的变化。这些读数允许在步骤1670处检测电阻的变化。最后,步骤1680提供基于电阻的变化来计算检测结果。
图16a和图16b的方案通过心脏生物标志物被实施,并且概念结果的证明在图17a-c中示出。图17a显示了在设计用于检测心脏生物标记物d-二聚体的测试运行中,gmr信号(以ppm为单位)随时间(以秒为单位)的曲线图。为了产生该数据,通过在含有0.05%叠氮化钠的pbs缓冲液中使用2nl1mg/mld-二聚体抗体来印刷d-二聚体捕获抗体来制备生物表面。为了测试潜在的交叉反应性,还可以通过使用2nl含0.05%叠氮化钠的pbs缓冲液中1mg/ml肌钙蛋白i抗体的溶液印刷两种组合的捕获抗体,用肌钙蛋白i捕获抗体对生物表面进行功能化。另外,在生物表面上印刷了另外两个对照。第一个是阴性对照,是通过将2nl0.5%bsa的pbs缓冲液与0.05%叠氮化钠一起印刷制备的,第二个是阳性对照,是通过将2nl1mg/ml的生物素与含0.05%叠氮化钠的pbs缓冲液中的小鼠igg偶联而制备的。印刷的传感器被结合到心脏测试盒中,并且被配置为使用以上在图16a和16b中描述的“三明治”测定法。
在试样测试中,将120微升血浆或全血加载到试剂卡盒中的试样孔中。过滤膜用于将试样从试样井中拉入流道中,以去除血细胞。将40微升血浆(或全血的血浆部分)流入计量通道,并将沉积的粉末(包括抗体/生物素偶联物,阻滞剂和通道中的小鼠igg)溶解到试样溶液中。当流过传感器区域时,分析物,抗体/生物素结合物和固定在传感器表面的抗体形成了抗体-分析物-生物素化抗体的三明治。根据测试调节流速。对于肌钙蛋白i,试样以1微升/分钟的流速流过传感器20分钟。对于d-二聚体,试样以4微升/分钟的流速流动5分钟。在试样流动之后,引入链霉抗生物素蛋白涂覆的磁珠,该磁珠允许在结合有生物素化抗体的任何地方与传感器表面结合。gmr传感器测量结合的磁珠,磁珠与试样中分析物的浓度成比例。珠溶液以4至10微升/分钟的流速流过传感器5分钟。在珠子开始结合后的300秒内,从峰值读取信号。
如图17a所示,仅印有bsa的阴性对照不结合d-二聚体,因此,信号如预期的那样保持在基线附近。如所预期的,用生物素化的小鼠igg的阳性对照显示出有效的磁珠结合。出现666.6ng/ml人d-二聚体的实际试样图,峰值检测信号约为750ppm,表明已成功检测到实际试样中的d-二聚体。与两种结合的肌钙蛋白i捕获抗体几乎没有交叉反应性(为清楚起见未显示,因为这些线与阴性对照的线非常接近)。
图17b示出了通过以变化的,固定的浓度的d-二聚体运行试样而获得的d-二聚体的校准曲线(以ppm为单位的gmr信号对d-二聚体浓度)。校准曲线可以计算出将来含有d-二聚体作为测试分析物的未知试样的浓度。为心脏生物标志物肌钙蛋白i提供了图17c中的类似图。这些结果一起确定了检测受试者血液或血浆试样中d-二聚体和肌钙蛋白i的可行性。
金属检测应用
图18示出了根据以上实施例的使用gmr传感器平台的铅检测方案的应用。双链dna印在传感器的生物表面上,一条链被生物素化(b)。如果不存在铅,则链霉亲和素标记的(或涂覆的)磁性纳米颗粒(mnp)可以与生物素(b)结合,后者是dna底物链的一部分。当存在铅时,pb激活的dnazyme会裂解含生物素的底物链。裂解后,带有抗生蛋白链菌素标记的mnp不能通过dna链与cdna结合,因为该链的生物素化部分不再存在。因此,如果试样中不存在铅,则mnp仅与gmr表面结合。存在的铅越多,与生物表面上的dna结合的mnp越少。这样的方案可以用于检测水,血液或其他目标流体中的铅。
图19示出了根据以上实施例的使用gmr传感器平台的汞检测方案的应用。hg-bsa底物固定在生物表面上。在不存在汞(hg)离子(i或ii或两者)的情况下,生物素化(b)的hg抗体可以与生物表面结合的hg-bsa结合。在存在hg离子的情况下,离子会阻断生物素化的hg抗体与hg-bsa的结合位点,从而阻止hg抗体与hg-bsa结合。如上所述,抗生蛋白链菌素标记的(或涂覆的)磁性纳米颗粒可以结合生物素。因此,由于汞与生物素化的hg抗体的干扰性结合,溶液中存在的汞离子越多,最终在生物表面上与传感器结合的磁珠就越少。
图20示出了根据以上实施例的,使用gmr传感器平台的镉或砷检测方案的应用。双链dna印在传感器的生物表面上,可以结合检测蛋白。在可能包含金属测试分析物的试样存在的情况下,添加检测蛋白arsr(用于砷酸iii检测)或pcad(用于镉检测)。在存在各自的重金属离子的情况下,检测蛋白无法与dna双链结合,因此dna-蛋白的结合与试样中不存在重金属离子的比例成正比。这是类似的竞争性结合事件,非常类似于上述的汞测定法。然后添加生物素化的(b)报告蛋白。该蛋白质可以与检测蛋白质结合。如果检测蛋白与dna双链结合,则将生物素化的报道分子固定在dna-蛋白复合物中。再次,抗生蛋白链菌素标记的磁性纳米颗粒将与结合到生物表面的生物素化的报道蛋白结合。因此,镉或砷的浓度越小,更多的珠子将结合到生物表面。
以下是根据本文详述的原理可以实现的分析物感测的应用的非限制性列表。
(1)血液试样可以包括分析物,例如蛋白质或其他物质,例如dna,其可以通过使用gmr装置的免疫测定法来测量。下表1总结了与可检测到的分析物相关的示例性疾病状态。
表格i
(2)本文所述的gmr系统可用于尿液分析物检测。尿液中的任何蛋白质,dna,金属或其他物质均可通过本文所述的gmr设备进行测量和/或检测。与尿相关蛋白生物标志物包括但不限于先兆子痫,人绒毛膜促性腺激素(hcg),肾损伤分子1(kim-1),中性粒细胞明胶酶相关脂质运载蛋白(ngal),白介素(il)-18和脂肪酸结合蛋白(fabp),核基质蛋白22(nmp22),blca-4和表皮生长因子受体(egfr)等。药物和/或其主要尿代谢产物包括对乙酰氨基酚/对乙酰氨基酚(apap),苯丙胺(amp),甲基苯丙胺(mamp),巴比妥酸盐(bar),苯二氮卓类(bzo),可卡因(coc),美沙酮(mtd),阿片酸盐(opi),苯环利定(pcp),thc和三环抗抑郁药(tca)等。
(3)本文所述的gmr系统可用于唾液分析物检测。唾液或口腔上皮中的任何蛋白质,dna,金属或其他物质均可通过本文所述的gmr设备进行测量和/或检测。示例性生物标志物包括但不限于基质金属蛋白酶(即mmp1,mmp3,mmp9),细胞因子(即白介素6,白介素8,血管内皮生长因子a(vegf-a),肿瘤坏死因子(tnf),转铁蛋白,成纤维细胞生长因子,髓样相关蛋白14(mrp14),脯氨酸蛋白,分化簇59(cd59),过氧化氢酶和mac-2-结合蛋白(m2bp)等。药物包括苯丙胺(amp),巴比妥酸盐(bar)),苯二氮卓类(bzo),丁丙诺啡(bup),可卡因(coc),可替宁(cot),芬太尼(fyl),k2/香料(k2),氯胺酮(ket),甲基苯丙胺(met),美沙酮(mtd),阿片类药物(opi),羟考酮(oxy),苯环利定(pcp),大麻(thc)和曲马多(tml)
(4)本文所述的gmr系统可用于眼液分析物检测。眼液中的任何蛋白质,dna,金属或其他物质均可通过本文所述的gmr设备进行测量和/或检测。眼液蛋白生物标志物包括但不限于α-烯醇酶,α-1酸性糖蛋白1,s100a8/calgranulina,s100a9/calgranulinb,s100a4和s100a11(calgizzarin),催乳素诱导蛋白(pip),脂蛋白-1(lcn-1),乳铁蛋白和溶菌酶,β-淀粉样蛋白1–40,中性粒细胞防御素np-1和np-2等可以通过系统中的“三明治”测定进行测量。
(5)本文公开的实施方式可以采用液体活检作为试样来测试诸如生物标志物之类的分析物。在一些这样的实施例中,可以提供用于识别患者血液中的癌症的方法。下述方法可用于检测血液中dna的“罕见”突变。来自癌细胞的dna经常进入血流,但是大多数血液传播的dna(>99%)将来自健康细胞。本文公开的方法提供了用于检测这些“罕见”突变并验证结果的方法。本文公开的方法提供了使用gmr检测平台在单个测定中捕获的多步骤过程。
本文公开的方法包括从血液提取dna,根据本文的实施例,其在卡盒中是自动化的,其可以从血液中进行必需的dna提取和纯化。在一些实施例中,将二氧化硅膜用作提取过程的一部分,但是本文的方法不限于此。在提取和纯化之后,该方法提供了选择性扩增目标测试生物标记的方法。在一些实施例中,仅扩增癌症dna的方法包括使用锁核酸来充当阻断剂以防止正常dna被扩增。其他选择性扩增方法是本领域已知的。该方法的下一步是检测患者试样中是否存在目标癌症dna生物标志物。在一些实施例中,使用核酸外切酶将双链dna(dsdna)转化为单链dna(ssdna)来实现。将dsdna转化为ssdna的其他方法是本领域已知的。该方法继续通过使用印刷在生物表面上的互补dna片段捕获ssdna。在一些实施例中,ssdna具有附着至末端的生物素,且该生物素捕获链霉亲和素标记的磁珠。在一些实施例中,方法包括验证(来自患者的)ssdna是否与印刷探针(dna的合成片段)完全互补。可以通过加热使两片dna之间的结合变性来完成验证。与完美结合相比,不完美的结合会在更低的温度下变性(或分离)。这允许验证信号,确定信号是由真阳性还是假阳性引起的。通过使用此验证步骤,可以在诊断患者时达到更高的准确性。除了加热使dna变性之外,还有其他本领域已知的方法。
本文提供了用于分析核酸的方法和组合物。在一些实施例中,分析核酸片段混合物中的核酸片段。可以从任何类型的合适的生物试样(例如测试试样)中分离核酸。在一些实施例中,试样包含核酸。测试试样可以是从受试者(例如,哺乳动物,人)分离或获得的任何试样。试样的非限制性实例包括来自受试者的液体或组织,包括但不限于血液,羊水,脑脊髓液,脊髓液,灌洗液(例如,支气管肺泡,胃,腹膜,导管,耳朵,关节镜),活检试样,尿液,粪便,痰,唾液,鼻粘液,前列腺液,灌洗液,精液,淋巴液,胆汁,眼泪,汗液,母乳等或其组合。在一些实施例中,生物试样是血液或血液制品(例如血浆或血清)。核酸可以衍生自一种以上的试样或来源。
在一些实施例中,试样与一种以上的合适的细胞裂解试剂接触。裂解试剂通常被配置为裂解整个细胞,和/或将核酸与污染物(例如蛋白质,碳水化合物和脂肪酸)分开。细胞溶解试剂的非限制性实例包括去污剂,低渗溶液,高盐溶液,碱性溶液,有机溶剂(例如苯酚,氯仿),离液盐,酶等或其组合。任何合适的裂解程序均可用于本文所述的方法。
术语“核酸”是指脱氧核糖核酸(dna,例如互补dna(cdna),基因组dna(gdna)等)和/或核糖核酸(rna,例如mrna,短抑制rna(sirna)dna,rna或dna类似物(例如,包含碱基类似物,糖类似物和/或非天然骨架等),rna/dna杂化物和聚酰胺核酸(pna)等及其组合。核酸可以是单链或双链的。在一些实施例中,核酸是引物。在一些实施例中,核酸是靶核酸。靶核酸通常是目的核酸。
在某些实施例中,可以提供核酸用于进行本文所述的方法,而不处理含有核酸的试样。在一些实施例中,提供核酸用于在处理含有核酸的试样之后进行本文所述的方法。例如,可以在本文所述的方法之前,期间或之后,从试样中提取,分离,纯化,部分纯化或扩增核酸。
在一些实施例中,通过包括核酸扩增的方法来扩增核酸,其中核酸的一条或两条链被酶促复制,从而产生核酸链的拷贝或互补拷贝。通过扩增过程产生的核酸的拷贝通常被称为扩增子。核酸扩增过程可以线性或指数地产生具有与模板或靶核酸或其片段相同或基本相同的核苷酸序列的扩增子。可以通过合适的核酸扩增方法扩增核酸,其非限制性实例包括聚合酶链反应(pcr),巢式(n)pcr,定量(q)pcr,实时pcr,逆转录(rt)pcr,等温扩增(例如,环介导的等温扩增(lamp)),基于定量核酸序列的扩增(qt-nasba)等,其变体及其组合。在一些实施例中,扩增过程包括聚合酶链反应。在一些实施例中,扩增过程包括等温扩增过程。
在一些实施例中,核酸扩增过程包括使用一种以上的引物(例如,可以与核酸模板或靶特异性杂交的短寡核苷酸)。杂交的引物通常可以在核酸扩增过程中通过聚合酶进行延伸。在一些实施例中,包含核酸的试样与一种以上的引物接触。在一些实施例中,核酸与一种以上的引物接触。引物可以附着在固体基质上,也可以在溶液中游离。
在一些实施例中,核酸或引物包含一个以上可区分的标识符。任何合适的可区分标识符和/或可检测标识符可以用于本文描述的组合物或方法。在某些实施例中,可区分的标识符可以与核酸直接或间接相关(例如结合)。可区分的标识符可以与核酸共价或非共价结合。在一些实施例中,可区分的标识符附着于与核酸共价或非共价结合的结合对中的一个成员。在一些实施例中,可区分的标识符与核酸可逆地相关。在某些实施例中,可以使用合适的方法(例如,通过增加盐浓度,变性,洗涤,添加合适的溶剂和/或通过加热)从核酸中去除与核酸可逆结合的可区分的标识符。
在一些实施例中,可区分的标识符是标签。在一些实施例中,核酸包含可检测标签,其非限制性实例包括放射性标签(例如同位素),金属标签,荧光标签,发色团,化学发光标签,电化学发光标签(例如origentm),磷光标签,猝灭剂(例如荧光团猝灭剂),荧光共振能量转移(fret)对(例如供体和受体),染料,蛋白质(例如酶(例如碱性磷酸酶和辣根)过氧化物酶),酶底物,小分子,质量标签,量子点等或其组合。任何合适的荧光团都可以用作标签。可以通过各种合适的方法检测和/或定量发光标签方法,例如通过光电管,数码相机,流式细胞仪,凝胶电泳,胶片曝光,质谱,细胞荧光分析,荧光显微镜,共聚焦激光扫描显微镜,激光扫描细胞仪等及其组合。
在一些实施例中,可区分的标识符是条形码。在一些实施例中,核酸包含核酸条形码(例如,索引核苷酸,序列标签或“条形码”核苷酸)。在某些实施例中,核酸条形码包含可用作标识符的核苷酸的可区分序列,以允许在试样,方法或测定中明确识别一个以上核酸(例如,核酸的子集)。在某些实施例中,例如,试样,试样来源,特定核酸属或核酸种类,染色体或基因是特异性和/或独特的。
在一些实施例中,核酸或引物包含一个以上结合对。在一些实施例中,核酸或引物包含结合对的一个以上成员。在一些实施例中,结合对包含至少两个非共价且特定地彼此结合的成员(例如分子)。结合对的成员经常彼此可逆地结合,例如其中结合对的两个成员的缔合可以通过合适的方法解离。任何合适的结合对或其成员可以用于本文所述的组合物或方法。结合对的非限制性实例包括抗体/抗原,抗体/抗体受体,抗体/蛋白a或蛋白g,半抗原/抗半抗原,巯基/马来酰亚胺,巯基/卤代乙酰基衍生物,胺/异三氰酸酯,胺/琥珀酰亚胺酯,胺/磺酰卤,生物素/抗生物素蛋白,生物素/抗生蛋白链菌素,叶酸/叶酸结合蛋白,受体/配体,维生素b12/内在因子,其类似物,其衍生物,其结合部分,类似物或组合。结合对的成员的非限制性实例包括抗体或抗体片段,抗体受体,抗原,半抗原,肽,蛋白质,脂肪酸,甘油基部分(例如脂质),磷酸基部分,糖基部分,泛素部分,凝集素,适体,受体,配体,金属离子,抗生物素蛋白,中性亲和素,生物素,b12,内在因子,其类似物,其衍生物,其结合部分,类似物或组合。在一些实施例中,核酸或引物包含生物素。在一些实施例中,核酸或引物共价附于生物素。
在一些实施例中,核酸或引物非共价或共价附于合适的固体衬底。在一些实施例中,捕获寡核苷酸和/或结合对的成员连接至固体衬底。捕获寡核苷酸通常是被配置为与靶核酸特定杂交的核酸。在一些实施例中,捕获核酸是附着于固体衬底的引物。固体衬底的非限制性实例包括由微阵列和颗粒例如珠(例如,顺磁性珠,磁性珠,微珠,纳米珠),微粒和纳米颗粒提供的表面。固体衬底还可以包括,例如,芯片,圆柱,光纤,抹布,过滤器(例如,平面过滤器),一个以上毛细管,玻璃和改性或功能化玻璃(例如,受控孔玻璃(cpg)),石英,云母,重氮化膜(纸或尼龙),聚甲醛,纤维素,醋酸纤维素,纸,陶瓷,金属,准金属,半导电材料,量子点,涂层珠或颗粒,其他色谱材料,磁性颗粒;塑料(包括丙烯酸,聚苯乙烯,苯乙烯或其他材料的共聚物,聚丁烯,聚氨酯,teflontm,聚乙烯,聚丙烯,聚酰胺,聚酯,聚偏二氟乙烯(pvdf)等),多糖,尼龙或硝酸纤维素,树脂,二氧化硅或二氧化硅衬底料,包括硅,硅胶和改性硅,
在一些实施例中,核酸是捕获寡核苷酸。在一些实施例中,捕获寡核苷酸是共价或非共价附于固体衬底的核酸。捕获寡核苷酸通常包含能够与目的核酸(例如靶核酸)或其一部分特定杂交或退火的核苷酸序列。在一些实施例中,捕获核酸包含与靶核酸或其部分基本互补的核酸序列。在一些实施例中,捕获寡核苷酸是连接至固体衬底的引物。捕获寡核苷酸可以是天然存在的或合成的,并且可以是基于dna或rna的。捕获寡核苷酸可以允许靶核酸与试样中的其他核酸或污染物的特定分离。
在一些实施例中,本文描述的方法包括使多个核酸(例如,试样中的核酸)与至少一个包含结合对成员的引物接触。在一些实施例中,结合对的成员包含生物素。在一些实施例中,多个核酸与第一引物和第二引物接触,其中第一或第二引物之一包含生物素。在一些实施例中,多个核酸包含靶核酸(例如靶rna或dna分子)。靶核酸通常是目标核酸(例如,基因,转录本或其部分)。在一些实施例中,靶核酸包含rna。在一些实施例中,靶核酸通过核酸扩增过程扩增。在一些实施例中,核酸扩增过程包括使试样,试样的核酸和/或靶核酸与第一引物,被生物素化的第二引物和聚合酶在促进核酸扩增的合适条件下接触(例如,有利于pcr或等温扩增的条件)。在一些实施例中,核酸扩增过程导致扩增子的产生。在一些实施例中,扩增子包括dna扩增子,rna扩增子或其组合。在一些实施例中,扩增子包括生物素化的dna扩增子,rna扩增子或其组合。在一些实施例中,使包含rna和生物素化的dna的扩增子(例如rna/dna双链体)与核酸酶(例如rna核酸外切酶)接触。在一些实施例中,dna扩增子非共价附于包含捕获寡核苷酸的固体衬底,其中dna扩增子或其一部分与捕获寡核苷酸特定杂交。在一些实施例中,生物素化的扩增子与包含抗生蛋白链菌素或其变体的磁珠接触和/或附着于磁珠。
因此,在一些实施例中,提供了检测测试试样中分析物的存在的方法,其包括提供传感器,其传感器包括设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的生物分子,该生物分子包括共价结合至生物分子的可裂解部分,裂解被测试试样中分析物的存在和与生物分子可裂解部分相关的受体催化,该受体能够结合磁性纳米颗粒,使测试试样通过传感器,从而在存在分析物的情况下允许从生物分子中裂解和去除带有相关受体的可裂解部分,在将测试试样通过传感器后将磁性颗粒通过传感器,并根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来检测试样中是否存在分析物。
在一些实施例中,该方法还包括基于gmr传感器的电阻变化来计算测试试样中分析物的浓度。
在一个以上前述实施例中,方法包括在使测试试样通过传感器之前在传感器上执行缓冲液清洗。
在一个以上前述实施例中,方法包括在使测试试样通过传感器之后但在使磁性颗粒通过传感器之前对传感器执行缓冲液清洗。
在一个以上前述实施例中,方法包括在使磁性颗粒通过传感器之后在传感器上执行缓冲液洗涤。
在一个以上前述实施方式中,分析物是金属离子。在一个以上前述实施例中,测试试样是水。
在一个以上前述实施例中,测试试样来自受试者的血液。
在一个以上前述实施例中,生物分子是双链dna(dsdna)。
在一个以上前述实施例中,受体共价结合至dsdna的两条链中之一。
在一个以上前述实施例中,dsdna包含dna酶,该dna酶被金属离子激活。
在一个以上前述实施例中,方法包括确定gmr传感器的电阻变化,包括使用至少一个基准电阻器来执行gmr传感器的电阻变化的相位敏感解决方案。
在一个以上前述实施例中,多个生物分子以每平方毫米约1x109至约5x1010个生物分子的密度附着在传感器的表面上。
在一个以上前述实施例中,分析物中检测的灵敏度极限在约1纳摩尔至约10纳摩尔的范围内。
在一个以上前述实施例中,使测试试样通过检测器包括以大约1微升/分钟至大约20微升/分钟的速率使测试试样流经传感器。
在一些实施例中,提供了检测测试试样中分析物的存在的方法,包括提供传感器,该传感器包括设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的生物分子,该生物分子包括抗原性在抗原结合位点结合抗体的部分,该抗体进一步包括与抗原结合位点分开的部分,该部分被配置为结合磁性纳米颗粒,使测试试样和抗体的混合物通过传感器,其中抗体会结合分析物(如果存在于测试试样中),从而防止抗体与生物分子的抗原部分结合,在混合物经过传感器后将磁性颗粒通过传感器,并根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来检测金属离子的存在。
在一些实施例中,该方法还包括基于gmr传感器的电阻变化来计算测试试样中分析物的浓度。
在一个以上前述实施例中,方法可进一步包括在使混合物通过传感器之前在传感器上执行缓冲液洗涤。
在一个以上前述实施例中,方法可进一步包括在将混合物通过传感器之后但在使磁性颗粒通过传感器之前在传感器上执行缓冲液洗涤。
在一个以上前述实施例中,方法可进一步包括在使磁性颗粒通过传感器之后在传感器上执行缓冲液洗涤。
在一个以上前述实施例中,分析物是金属离子。
在一个以上前述实施例中,测试试样是水。
在一个以上前述实施例中,测试试样源自受试者的血液。
在一个以上前述实施例中,生物分子是蛋白质。
在一个以上前述实施例中,该蛋白质是牛血清白蛋白。
在前述实施例中的一个以上中,确定gmr传感器的电阻变化包括使用至少一个基准电阻器来执行gmr传感器的电阻变化的相位敏感解决方案。
在一个以上前述实施例中,多个生物分子以每平方毫米约1x109到约5x1010个生物分子的密度附着在传感器的表面上。
在一个以上前述实施例中,金属离子中检测的灵敏度极限在约1纳摩尔至约10纳摩尔的范围内。
在一个以上前述实施例中,使混合物通过检测器包括混合物以约1ul/min至约20ul/min的速率流过传感器。
在一些实施例中,提供了用于检测测试试样中分析物的存在的方法,包括提供传感器,该传感器包括设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的生物分子,该生物分子包括结合物被配置为结合检测蛋白的区域,该检测蛋白还能够结合分析物,其中当检测蛋白结合分析物时,它防止检测蛋白与生物分子的结合区域结合,从而使检测蛋白通过传感器,将测试试样传递到传感器上,在将测试试样传递到传感器上之后,将报告蛋白传递到传感器上,能够结合检测蛋白的报告蛋白和配置成与磁性纳米颗粒结合的报告蛋白,将报告蛋白通过传感器上后将磁性微粒通过传感器后,并根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来检测金属离子的存在。
在一些实施例中,方法可以进一步包括基于电阻变化来计算测试试样中分析物的浓度。
在一个以上前述实施例中,方法可以进一步包括执行一个以上缓冲器清洗。
在一个以上前述实施例中,在将检测蛋白和测试试样通过传感器之前将它们混合。
在一个以上前述实施例中,在检测蛋白通过传感器之后,测试试样通过传感器。
在一个以上前述实施例中,分析物是金属离子。
在一个以上前述实施例中,测试试样是水。
在一个以上前述实施例中,测试试样源自受试者的血液。
在一个以上前述实施例中,生物分子是双链dna(dsdna)。
在一个以上前述实施例中,检测蛋白是包含标签的砷结合调节蛋白。
在一个以上前述实施例中,检测蛋白是包含标签的镉结合调节蛋白。
在一个以上前述实施例中,标签是谷胱甘肽s-转移酶。
在一个以上前述实施例中,标签是聚组氨酸。
在一个以上前述实施例中,报道蛋白是生物素化抗体。
在一个以上前述实施例中,磁性颗粒包含链霉亲和素连接的纳米颗粒。
在一个以上前述实施例中,确定gmr传感器的电阻变化包括使用至少一个基准电阻器来执行gmr传感器的电阻变化的相位敏感解决方案。
在一个以上前述实施例中,多个生物分子以每平方毫米1x109到大约5x1010个生物分子的密度附着在传感器的表面上。
在一个以上前述实施例中,金属离子中检测的灵敏度极限在约1纳摩尔至约10纳摩尔的范围内。
在一个以上前述实施例中,使测试试样通过检测器包括以大约1ul/min至大约20ul/min的速率使测试试样在传感器上的流速。
在一些实施例中,提供了用于检测测试试样中分析物的存在的方法,包括提供传感器,该传感器包括设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的生物分子,该生物分子包括相关的磁性粒子,将测试试样传递到传感器上方,从而在存在分析物的情况下从生物分子中除去相关的磁性粒子,并根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来确定测试试样中检测分析物的存在,其中确定gmr传感器的电阻变化包括使用至少一个基准电阻器来执行gmr传感器的电阻变化的相位敏感解决方案。
在一些实施例中,提供了用于检测测试试样中分析物的存在的方法,包括提供传感器,该传感器包括设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的第一生物分子,该第一生物分子包括第二生物分子的条件结合位点,其包括磁性颗粒的结合位点,将测试试样通过传感器,将第二生物分子通过传感器,在将测试试样通过传感器后将磁性颗粒通过传感器,并根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来确定测试试样中检测分析物的存在,其中确定gmr传感器的电阻变化包括使用至少一个基准电阻器来执行gmr传感器的电阻变化的相位敏感解决方案。
在一个以上前述实施例中,分析物的存在阻止了第二生物分子的结合。
在一个以上前述实施例中,分析物的存在使得第二分子与第一生物分子结合。
在一些实施例中,提供了用于检测测试试样中分析物的存在的方法,包括提供传感器,该传感器包括设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的第一生物分子,该生物分子包括存在分析物时磁性颗粒的结合位点,将测试试样通过传感器,在将测试试样通过传感器后将磁性颗粒通过传感器,并根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来确定测试试样中检测分析物的存在,其中确定gmr传感器的电阻变化包括使用至少一个基准电阻器来执行gmr传感器的电阻变化的相位敏感解决方案。
在一个以上前述实施例中,方法可以进一步包括基于gmr传感器的电阻变化来计算测试试样中分析物的浓度。
在一个以上前述实施例中,生物分子包含dna。
在一个以上前述实施例中,生物分子包含蛋白质。
在一些实施例中,提供了被配置为执行本文公开的方法的系统,该系统包括:包括试样处理子系统;包括具有微流体网络的传感器子系统,该微流体网络包括gmr传感器,该gmr传感器上设置有聚合物涂层表面;连接到多个接触垫的将信号传送到处理器的多条电线;处理器;及气动控制子系统,该气动控制子系统在整个试样处理子系统和传感器子系统中移动试样,试剂和溶剂。
在一些实施例中,提供了用于检测测试试样中金属离子的存在的方法,包括提供传感器,该传感器包括设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的生物分子,该生物分子包括共价结合至生物分子的可裂解部分,通过测试试样中金属离子的存在催化裂解,以及与生物分子的可裂解部分相关的受体,该受体能够结合磁性纳米颗粒,从而使测试试样通过如果存在金属离子,则可以从生物分子中裂解并去除带有相关受体的可裂解部分,如果将金属试样通过传感器后将磁性颗粒通过传感器,并根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来确定测试试样中金属离子的存在。
在一些实施例中,这样的方法可以进一步包括基于gmr传感器的电阻变化来计算测试试样中金属离子的浓度。
在一个以上前述实施例中,方法可以进一步包括在使测试试样通过传感器之前,对传感器执行缓冲液清洗。
在一个以上前述实施例中,方法可以进一步包括在使测试试样通过传感器之后但在使磁性颗粒通过传感器之前在传感器上执行缓冲液洗涤。
在一个以上前述实施例中,方法可进一步包括在使磁性颗粒通过传感器之后在传感器上执行缓冲液洗涤。
在一个以上前述实施例中,金属离子是铅。
在一个以上前述实施例中,测试试样是水。
在一个以上前述实施例中,测试试样源自受试者的血液。
在一个以上前述实施例中,生物分子是双链dna(dsdna)。
在一个以上前述实施例中,受体与dsdna的两条链之一共价结合。
在一个以上前述实施例中,dsdna包含dna酶,该dna酶被金属离子激活。
在一个以上前述实施例中,确定gmr传感器的电阻变化包括使用至少一个基准电阻器来执行gmr传感器的电阻变化的相位敏感解决方案。
在一个以上前述实施例中,多个生物分子以每平方毫米约1x109到约5x1010个生物分子的密度附着在传感器的表面上。
在一个以上前述实施方式中,金属离子中检测的灵敏度极限在约10纳摩尔至约1微摩尔的范围内。
在一个以上前述实施例中,使测试试样通过检测器包括以约0.5ul/min至约5ul/min的速率使测试试样在传感器上的流速。试样以恒定的新鲜试样流过传感器。这样可确保dsdna最大限度地暴露于试样溶液中存在的金属离子。例如,对于铅离子,试样在传感器上流动30分钟。
在一些实施例中,提供了用于检测测试试样中铅离子的存在的方法,该方法包括提供传感器,该传感器包括置于巨磁致电阻(gmr)传感器的聚合物涂覆表面上的双链dna(dsdna),dsdna,其包含dsdna的一条链的可裂解部分,该裂解被测试试样中铅离子的存在催化,以及与该可裂解部分相关的受体,该受体能够结合磁性纳米颗粒,从而使测试试样通过传感器,从而允许在存在铅离子的情况下从dsdna裂解和去除带有相关受体的可裂解部分,在将测试试样通过传感器后将磁性颗粒通过传感器,并根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来确定测试试样中铅离子的存在。
在一些这样的实施例中,方法可以进一步包括基于gmr传感器的电阻变化来计算测试试样中铅离子的浓度。
在一个以上前述实施例中,方法可以进一步包括:在使测试试样通过传感器之前,对传感器执行缓冲液清洗。
在一个以上前述实施例中,方法可以进一步包括在使测试试样通过传感器之后但在使磁性颗粒通过传感器之前在传感器上执行缓冲液洗涤。
在一个以上前述实施例中,可进一步包括在使磁性颗粒通过传感器之后在传感器上执行缓冲液洗涤。
在一个以上前述实施例中,测试试样是水。
在一个以上前述实施例中,测试试样源自受试者的血液。
在一个以上前述实施例中,受体是共价结合的。
在一个以上前述实施例中,dsdna包含dnazyme,该dnazyme被铅离子激活。
在一个以上前述实施例中,确定gmr传感器的电阻变化包括使用至少一个基准电阻器来执行gmr传感器的电阻变化的相位敏感解决方案。
在一个以上前述实施例中,多个dsdna以每平方毫米约1x109至约5x1010个生物分子的密度附着在传感器的表面上。
在一个以上前述实施例中,检测的灵敏度极限在铅离子中为约1纳摩尔至约10纳摩尔。
在一个以上前述实施例中,使测试试样通过检测器包括以约0.5ul/min至约5ul/min的速率使测试试样在传感器上的流速。
在一些实施例中,提供了传感器,该传感器包括设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的生物分子,该生物分子包括与该生物分子共价结合的可裂解部分,该裂解通过存在下的催化剂来催化。金属离子和与可裂解部分相关的受体,该受体能够结合磁性纳米颗粒。其中当可裂解部分被裂解时,具有受体的可裂解部分不再与生物分子共价结合。
在一些这样的实施例中,生物分子是双链dna(dsdna)。
在一个以上前述实施例中,受体共价结合至dsdna的两条链之一。
在一个以上前述实施例中,dsdna包含dna酶,该dna酶被金属离子激活。
在一个以上前述实施例中,多个生物分子以每平方毫米约1x109到约5x1010个生物分子的密度附着在传感器的表面上。
在一个以上前述实施例中,gmr传感器的表面包括交联的peg-phema聚合物。
在一个以上前述实施例中,聚合物用表面活性剂涂覆。
在一个以上前述实施例中,表面活性剂是十六烷基三甲基溴化铵。
在一个以上前述实施例中,传感器可以进一步包括连接至多个接触垫的多条线,该多个接触垫被配置为将电信号从传感器传送至处理器。
在一些实施例中,提供了包括双链dna(dsdna)的传感器,其布置在巨磁阻(gmr)传感器的聚合物涂覆的表面上,该dsdna包括可裂解的部分,通过铅的存在催化裂解离子和与可裂解部分相关的受体,该受体能够结合磁性纳米颗粒,其中当可裂解部分被裂解时,具有受体的可裂解部分不再与dsdna共价结合。
在一些此类实施例中,受体与dsdna的两条链之一共价结合。
在一个以上前述实施例中,dsdna包含dnazyme,该dnazyme被铅离子激活。
在一个以上前述实施例中,多个dsdna以每平方毫米约1×109至约5×1010生物分子的密度附着在传感器的表面上。
在一个以上前述实施例中,gmr传感器的表面包括交联的peg-phema聚合物。
在一个以上前述实施方式中,聚合物用表面活性剂涂覆。
在一个以上前述实施方式中,表面活性剂是十六烷基三甲基溴化铵。
在一个以上前述实施例中,传感器可以进一步包括连接到多个接触垫的多条电线,该多个接触垫被配置为将电信号从传感器传送到处理器。
在一些实施例中,提供了用于检测测试试样中的金属离子的卡盒,该卡盒包括:(a)包括设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的生物分子,该生物分子包括与该生物分子共价结合的可裂解部分,该裂解通过测试试样中金属离子的存在和与该可裂解部分缔合的受体而被催化;该受体能够结合磁性纳米颗粒;其中当可裂解部分被裂解时,具有受体的可裂解部分不再与生物分子共价结合;(b)一个以上端口,用于将测试试样,磁性纳米颗粒和可选的洗涤缓冲液引入盒中;(c)一种微流体系统,用于将测试试样,磁性纳米颗粒和可选的洗涤缓冲液从一个以上端口移至传感器。
在一些这样的实施例中,这样的卡盒可以进一步包括废物收集区域。
在一个以上前述实施例中,生物分子是双链dna(dsdna)。
在一个以上前述实施例中,受体共价结合至dsdna的两条链之一。
在一个以上前述实施例中,dsdna包含dna酶,该dna酶被金属离子激活。
在一个以上前述实施例中,多个生物分子以每平方毫米约1x109到约5x1010个生物分子的密度附着在传感器的表面上。
在一个以上前述实施例中,gmr传感器的表面包括交联的peg-phema聚合物。
在一个以上前述实施例中,聚合物用表面活性剂涂覆。
在一个以上前述实施例中,表面活性剂是十六烷基三甲基溴化铵。
在一个以上前述实施例中,卡盒可进一步包括连接到多个接触垫的多条电线,该多个接触垫被配置为将电信号从传感器传送到处理器。
在一个以上前述实施例中,卡盒可以进一步包括一个以上过滤器以过滤测试试样。
在一个以上前述实施例中,金属离子是铅离子。
在一个以上前述实施例中,微流体系统是气动控制的。
在一个以上前述实施例中,卡盒还包括一个以上硬件芯片,以控制整个微流体系统的流速。
在一些实施例中,提供了用于检测测试试样中的铅离子的卡盒,该卡盒包括(a)包括聚合物涂层表面上具有双链dna(dsdna)的巨磁阻(gmr)传感器,该dsdna在dsdna的一条链上包含可裂解部分,该裂解通过测试试样中铅离子的存在和与该可裂解部分相关的受体而被催化;该受体能够结合磁性纳米颗粒;其中当切割可切割部分时,与受体的可切割部分不再与dsdna共价结合;(b)一个以上端口,用于将测试试样,磁性纳米颗粒和可选的洗涤缓冲液引入卡盒中;(c)一种微流体系统,用于将测试试样,磁性纳米颗粒和可选的洗涤缓冲液从一个以上端口移至传感器。
在一些这样的实施例中,卡盒可进一步包括废物收集区域。
在一个以上前述实施例中,dsdna包含dna核酶,该dna核酶被金属离子激活。
在一个以上前述实施例中,多个dsdna以每平方毫米约1x109至约5x1010生物分子的密度附着在传感器的表面上。
在一个以上前述实施例中,gmr传感器的表面包括交联的peg-phema聚合物。
在一个以上前述实施例中,聚合物用表面活性剂涂覆。
在一个以上前述实施例中,表面活性剂是十六烷基三甲基溴化铵。
在一个以上前述实施例中,卡盒可进一步包括连接到多个接触垫的多条电线,该多个接触垫被配置成将电信号从传感器传送到处理器。
在一个以上前述实施例中,卡盒可进一步包括一个以上过滤器以过滤测试试样。
在一个以上前述实施例中,微流体系统是气动控制的。
在一个以上前述实施例中,卡盒还包括一个以上硬件芯片,以控制整个微流体系统中的流量。
在一些实施例中,提供了制造用于检测测试试样中的铅离子的传感器的方法,该方法包括(a)在巨磁阻(gmr)传感器的表面上印刷双链dna(dsdna);在dsdna的一条链上包含可裂解的部分,该可裂解部分被测试试样中存在的铅离子催化;与该可裂解部分相关的受体,该受体能够结合磁性纳米颗粒。当裂解可裂解部分时,与受体的可裂解部分不再与dsdna共价结合;该gmr传感器包括聚合物涂层,该聚合物涂层上印有dsdna。(b)在印刷步骤之后,通过向聚合物涂层中加入一种以上的封闭剂来修饰聚合物涂层的表面;在添加一种以上的封闭剂之后,向聚合物涂层中添加表面活性剂。
在一些此类实施例中,dsdna包含dna核酶。
在一个以上前述实施例中,聚合物涂层包含交联的peg-phema聚合物。
在一个以上前述实施例中,方法可进一步包括一个以上用缓冲液洗涤的洗涤步骤。
在一个以上前述实施例中,缓冲液洗涤是hepes缓冲液。
在一个以上前述实施例中,hepes缓冲液具有25mm的浓度。
在一个以上前述实施例中,表面活性剂是乙酰基三甲基溴化铵(ctab)。
在一个以上前述实施例中,ctab在25mmhepes中的重量浓度为1%。
在一些实施例中,提供了用于检测测试试样中金属离子的存在的方法,包括提供传感器,该传感器包括设置在巨磁阻(gmr)传感器的聚合物涂覆表面上的生物分子,该生物分子包括在抗原结合位点结合抗体的抗原性部分,该抗体还包括与抗原结合位点分开的被配置为结合磁性纳米粒子的部分;使测试试样和抗体的混合物通过传感器,其中如果存在于测试试样中,则抗体的抗原结合位点结合金属离子,从而防止抗体与生物分子的抗原部分结合;使混合物通过传感器后,使磁性颗粒通过传感器;并根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来确定测试试样中金属离子的存在。
在一些这样的实施例中,方法可以进一步包括基于gmr传感器的电阻变化来计算测试试样中的金属离子浓度。
在一个以上前述实施例中,方法可进一步包括在使混合物通过传感器之前在传感器上执行缓冲液洗涤。
在一个以上前述实施例中,方法可进一步包括在将混合物通过传感器之后但在使磁性颗粒通过传感器之前在传感器上执行缓冲液洗涤。
在一个以上前述实施例中,方法可进一步包括在使磁性颗粒通过传感器之后在传感器上执行缓冲液洗涤。
在一个以上前述实施例中,金属离子是汞。
在一个以上前述实施例中,测试试样是水。
在一个以上前述实施例中,测试试样源自受试者的血液。
在一个以上前述实施例中,生物分子是蛋白质。
在一个以上前述实施例中,该蛋白质是修饰的牛血清白蛋白。在实施方案中,修饰的牛血清白蛋白是hgbsa,并具有产品名称:hg2+[bsa](货号:daga-007b),产自位于美国纽约州ramseyroad,shirley,ny11967,usa的creativediagnostics公司。在实施方案中,与hgbsa配对的抗体是hgab,并具有产品名称:rhaanti-hg2+monoclonalanti-body,clonehg2(目录号:hmabpy007)也可得自creativediagnostics公司。
在一个以上前述实施例中,确定gmr传感器的电阻变化包括使用至少一个基准电阻器来执行gmr传感器的电阻变化的相位敏归感解决方案。
在一个以上前述实施例中,金属离子中检测的灵敏度极限在约1纳摩尔至约10纳摩尔的范围内。
在一个以上前述实施例中,试样以循环的方式流过传感器。在一个以上前述实施例中,试样流过传感器,从而提供恒定的新鲜试样。在一个以上前述实施例中,以约0.1ug/ml的工作浓度将b-hgab(检测抗体)添加至含汞离子的测试试样中。溶液中的汞离子(ii)与hgbsa衬底竞争hgab的结合位点。在高汞浓度的溶液中,几乎没有hgab可以与hgbsa结合。当gmr传感器以1ul/min至5ul/min的流速流动时,就会发生这种孵育。可以在传感器上连续引入新鲜的试样,以确保任何未结合hg的hgab具有足够的结合时间。在一个以上前述实施例中,测试试样可以被反应大约30分钟。
在一些实施例中,提供了用于检测测试试样中汞离子的存在的方法,包括提供一种传感器,该传感器包括置于巨磁阻(gmr)传感器的聚合物涂层表面上的蛋白质,该蛋白质包括抗原性能够在抗原结合位点结合抗体的部分,该抗体进一步包括与抗原结合位点分开的被配置为结合磁性纳米颗粒的部分;使测试试样和抗体的混合物通过传感器,其中如果测试试样中存在抗体的抗原结合位点,则结合汞离子,从而防止抗体与蛋白质的抗原部分结合;使混合物通过传感器后,使磁性颗粒通过传感器;并根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来确定测试试样中汞离子的存在。在一些这样的实施方案中,使用这样的方法来检测hg2+离子。
在一些这样的实施例中,方法可以进一步包括基于gmr传感器的电阻变化来计算测试试样中的汞离子浓度。
在一个以上前述实施例中,所述方法可包括在使混合物通过传感器之前在传感器上进行缓冲液洗涤。
在一个以上前述实施例中,所述方法可进一步包括在将混合物通过传感器之后但在使磁性颗粒通过传感器之前在传感器上执行缓冲液洗涤。
在一个以上前述实施例中,该方法可以进一步包括在使磁性颗粒经过传感器之后在传感器上执行缓冲液洗涤。
在一个以上前述实施例中,测试试样是水。
在一个以上前述实施例中,测试试样源自受试者的血液。
在一个以上前述实施例中,该蛋白质是修饰的牛血清白蛋白。在实施方案中,修饰的牛血清白蛋白是hgbsa,并具有产品名称:hg2+[bsa](货号:daga-007b),产自位于美国纽约州ramseyroad,shirley,ny11967,usa的creativediagnostics公司。在实施方案中,与hgbsa配对的抗体是hgab,并具有产品名称:rhaanti-hg2+monoclonalanti-body,clonehg2(目录号:hmabpy007)也可得自creativediagnostics公司。
在一个以上前述实施例中,确定gmr传感器的电阻变化包括使用至少一个基准电阻器来执行gmr传感器的电阻变化的相位敏感解决方案。
在一个以上前述实施例中,试样以循环的方式流过传感器。在一个以上前述实施例中,试样流过传感器,从而提供恒定的新鲜试样。在一个以上前述实施例中,以约0.1ug/ml的工作浓度将b-hgab(检测抗体)添加至含汞离子的测试试样中。溶液中的汞离子(ii)与hgbsa底物竞争hgab的结合位点。在高汞浓度的溶液中,几乎没有hgab可以与hgbsa结合。当gmr传感器以1ul/min至5ul/min的流速流动时,就会发生这种孵育。可以在传感器上连续引入新鲜的试样,以确保任何未结合hg的hgab具有足够的结合时间。在一个以上前述实施例中,测试试样可以被反应大约30分钟。
在一个以上前述实施方式中,汞离子中的检测灵敏度极限在约1纳摩尔至约10纳摩尔的范围内。
在一些实施方式中,提供了包含蛋白质的传感器,该蛋白质被置于巨磁阻(gmr)传感器的聚合物涂覆的表面上,该蛋白质包含抗原部分。在一些这样的实施例中,该蛋白质是修饰的牛血清白蛋白。在实施方案中,修饰的牛血清白蛋白是hgbsa,并具有产品名称:hg2+[bsa](货号:daga-007b),产自位于美国纽约州ramseyroad,shirley,ny11967,usa的creativediagnostics公司。在实施方案中,与hgbsa配对的抗体是hgab,并具有产品名称:rhaanti-hg2+monoclonalanti-body,clonehg2(目录号:hmabpy007)也可得自creativediagnostics公司。
在一个以上前述实施例中,表面活性剂可以设置在gmr传感器的聚合物涂层表面上。在一些这样的实施例中,表面活性剂是阳离子的。在一些这样的实施方案中,表面活性剂是十六烷基三甲基溴化铵。
在一个以上前述实施例中,蛋白质通过印刷有组织的布置在gmr传感器上。
在一些实施例中,提供了包含修饰的牛血清白蛋白(bsa)的传感器,其布置在巨磁阻(gmr)传感器的聚合物涂层表面上,该修饰的牛血清白蛋白包含与抗体结合的抗原部分。抗原结合位点。在实施方案中,修饰的牛血清白蛋白是hgbsa,并具有产品名称:hg2+[bsa](货号:daga-007b),产自位于美国纽约州ramseyroad,shirley,ny11967,usa的creativediagnostics公司。在实施方案中,与hgbsa配对的抗体是hgab,并具有产品名称:rhaanti-hg2+monoclonalanti-body,clonehg2(目录号:hmabpy007)也可得自creativediagnostics公司。
在一个以上前述实施例中,传感器可以进一步包括布置在gmr传感器的聚合物涂覆的表面上的表面活性剂。在一些这样的实施例中,表面活性剂是阳离子的。在一些这样的实施例中,表面活性剂是十六烷基三甲基溴化铵。
在一个以上前述实施例中,修改后的bsa通过印刷有组织的布置在gmr传感器上。
在一些实施例中,提供了用于检测测试试样中的金属离子的卡盒,该卡盒包括:(a)包含蛋白质的传感器,该蛋白质设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上,包含抗原部分的蛋白质;(b)引入测试试样的接口;(c)磁性纳米粒子的储存源;(d)抗体的储存源,该抗体包含能够结合抗原部分的抗原结合位点和与抗原结合位点分开的被配置为结合磁性纳米颗粒的部分;(e)气动微流控系统,用于移动测试试样,磁性纳米粒子和抗体。
在一些这样的实施例中,卡盒还包括废物收集区域。
在一个以上前述实施例中,该蛋白质是修饰的牛血清白蛋白。在实施方案中,修饰的牛血清白蛋白是hgbsa,并具有产品名称:hg2+[bsa](货号:daga-007b),产自位于美国纽约州ramseyroad,shirley,ny11967,usa的creativediagnostics公司。在实施方案中,与hgbsa配对的抗体是hgab,并具有产品名称:rhaanti-hg2+monoclonalanti-body,clonehg2(目录号:hmabpy007)也可得自creativediagnostics公司。
在一个以上前述实施例中,表面活性剂被布置在聚合物涂覆的gmr传感器上。在一些这样的实施方案中,表面活性剂是十六烷基三甲基溴化铵。
在一个以上前述实施例中,传感器被配置为与多个引脚电连通,以将电信号从传感器传送到处理器。
在一个以上前述实施例中,卡盒可以包括一个以上过滤器以过滤测试试样。
在一个以上前述实施例中,卡盒可以进一步包括一个以上硬件芯片,以控制气动微流体系统。
在一些实施例中,提供了用于检测测试试样中的汞离子的卡盒,该卡盒包括(a)包含修饰的牛血清白蛋白(bsa)的传感器,该传感器布置在巨磁阻的聚合物涂覆的表面上(gmr)传感器,该修饰的bsa包含抗原部分;(b)引入测试试样的接口;(c)磁性纳米粒子的储存源;(d)抗体的储存源,该抗体包含能够结合抗原部分的抗原结合位点和与抗原结合位点分开的被配置为结合磁性纳米颗粒的部分;(e)气动微流控系统,用于移动测试试样,磁性纳米粒子和抗体。在实施方案中,修饰的牛血清白蛋白是hgbsa,并具有产品名称:hg2+[bsa](货号:daga-007b),产自位于美国纽约州ramseyroad,shirley,ny11967,usa的creativediagnostics公司。在实施方案中,与hgbsa配对的抗体是hgab,并具有产品名称:rhaanti-hg2+monoclonalanti-body,clonehg2(目录号:hmabpy007)也可得自creativediagnostics公司。
在一些这样的实施例中,卡盒可以进一步包括废物收集区域。
在一个以上前述实施例中,表面活性剂可置于聚合物涂覆的gmr传感器上。在一些这样的实施方案中,表面活性剂可以是十六烷基三甲基溴化铵。
在一个以上前述实施例中,传感器被配置为与多个引脚电连通,以将电信号从传感器传送到处理器。
在一个以上前述实施例中,卡盒可以包括一个以上过滤器以过滤测试试样。
在一个以上前述实施例中,卡盒还包括一个以上硬件芯片,以控制气动微流控系统。
在一些实施例中,提供了制造用于检测测试试样中的汞离子的传感器的方法,该方法包括在聚合物涂覆的gmr传感器上印刷包含抗原部分的蛋白质。在实施方案中,该蛋白质是修饰的牛血清白蛋白。在实施方案中,修饰的牛血清白蛋白是hgbsa,并具有产品名称:hg2+[bsa](货号:daga-007b),产自位于美国纽约州ramseyroad,shirley,ny11967,usa的creativediagnostics公司。在实施方案中,与hgbsa配对的抗体是hgab,并具有产品名称:rhaanti-hg2+monoclonalanti-body,clonehg2(目录号:hmabpy007)也可得自creativediagnostics公司。
在一个以上前述实施例中,聚合物涂层是交联的peg-phema聚合物。
在一些实施例中,提供了检测测试试样中金属离子的存在的方法,包括提供传感器,其传感器包括设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的生物分子,该生物分子包括结合区域,其配置为结合检测蛋白,该检测蛋白还能够结合金属离子。其中当检测蛋白结合金属离子时,它防止检测蛋白与生物分子的结合区域结合;使检测蛋白通过传感器;将测试试样传递到传感器上;使测试试样通过传感器后,使报告蛋白通过传感器,该报告蛋白能够结合检测蛋白,并且该报告蛋白被配置为结合磁性纳米颗粒。使报告蛋白通过传感器后,使磁性颗粒通过传感器。根据磁性颗粒通过gmr传感器前后gmr传感器的电阻变化来确定测试试样中金属离子的存在。
在一些这样的实施例中,该方法可以进一步包括基于gmr传感器的电阻变化来计算测试试样中的金属离子浓度。
在一个以上前述实施例中,该方法可以进一步包括执行一个以上缓冲器清洗。
在一个以上前述实施例中,在将检测蛋白和测试试样通过传感器之前对其进行混合。
在一个以上前述实施例中,在检测蛋白通过传感器之后,测试试样通过传感器。
在一个以上前述实施例中,金属离子是砷。
在一个以上前述实施例中,金属离子是镉。
在一个以上前述实施例中,测试试样是水。
在一个以上前述实施例中,测试试样源自受试者的血液。
在一个以上前述实施例中,检测蛋白是包含标签的砷结合调节蛋白。
在一个以上前述实施例中,检测蛋白是包含标签的镉结合调节蛋白。
在一个以上前述实施例中,其中所述标签是谷胱甘肽s-转移酶。
在一个以上前述实施例中,标签是聚组氨酸。
在一个以上前述实施例中,生物分子是双链dna(dsdna)。
在一个以上前述实施例中,dsdna的正链具有序列5'-cttacacattcgttaagtcatatatgttttatgacttatccgcttcgaaga/3ammc6t/-3'序列标号1。
在一个以上前述实施例中,dsdna的反向链具有序列5'-tcttcgaagcggataagtcaaaaacatatatgacttaacgaatgtgtaag-3'序列标号2。
在一个以上前述实施例中,dsdna的正链具有序列5'-tgagtcgaaaatggttataatacactcaaataaatatttgaatgaagatg/3ammc6t/-3'序列标号3。
在一个以上前述实施例中,dsdna的反向链具有序列5'-catcttcattcaaatatttatttgagtgtattataaccattttcgactca-3'序列标号4。
在一个以上前述实施例中,报道蛋白是生物素化的抗体。
在一个以上前述实施例中,磁性颗粒包含链霉亲和素连接的纳米颗粒。
在一个以上前述实施例中,确定gmr传感器的电阻变化包括使用至少一个基准电阻器来执行gmr传感器的电阻变化的相位敏感解决方案。
在一个以上前述实施例中,多个生物分子以每传感器每平方毫米约1x109到约5x1010个生物分子的密度附着在传感器的表面上。
在一个以上前述实施例中,pcad-ocad-f-胺链可以以10um与25um之间的浓度印刷在表面上。
在一个以上前述实施例中,金属离子中检测的灵敏度极限在约1纳摩尔至约10纳摩尔的范围内。
在一个以上前述实施例中,使测试试样通过检测器包括以大约1ul/min和5ul/min的速率使测试试样在传感器上的流速。在一些这样的实施例中,反应持续时间可以是约30分钟。在一些实施例中,通过测试生物素化的pcad-ocad-r在印刷的pcad-ocad-f上的流动来确定该反应时间足够。引入链霉亲和素标记的磁性纳米颗粒时获得了信号,这证实了两条pcad-ocad链发生了杂交。在一些实施例中,r链杂交总是以至少等于最高可用的f链浓度的浓度进行。
在一些实施例中,提供了用于检测金属离子的传感器,该金属离子包括设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的生物分子,该生物分子包括被配置为结合检测蛋白的结合区,该检测蛋白质还能够结合金属离子;其中当检测蛋白结合金属离子时,它防止检测蛋白与生物分子的结合区域结合。
在一些这样的实施例中,生物分子是双链dna(dsdna)。
在一个以上前述实施例中,dsdna的正链具有序列5'-cttacacattcgttaagtcatatatgttttatgacttatccgcttcgaaga/3ammc6t/-3'序列标号1。
在一个以上前述实施例中,dsdna的反向链具有序列5'-tcttcgaagcggataagtcaaaaacatatatgacttaacgaatgtgtaag-3'序列标号2。
在一个以上前述实施例中,dsdna的正链具有序列5'-tgagtcgaaaatggttataatacactcaaataaatatttgaatgaagatg/3ammc6t/-3'序列标号3。
在一个以上前述实施例中,dsdna的反向链具有序列5'-catcttcattcaaatatttatttgagtgtattataaccattttcgactca-3'序列标号4。
在一个以上前述实施例中,多个生物分子以每传感器每平方毫米约1x109到约5x1010个生物分子的密度附着在传感器的表面上。
在一个以上前述实施例中,gmr传感器的表面包括包含交联的peg-phema的聚合物。
在一个以上前述实施例中,聚合物涂覆的表面的聚合物用表面活性剂覆盖。表面活性剂是十六烷基三甲基溴化铵。
在一个以上实施例中,传感器可以进一步包括连接至多个接触垫的多条线,该多个接触垫被配置为将电信号从传感器传送至处理器。
在一个以上前述实施例中,金属离子包括砷或镉。
在一些实施例中,提供了用于检测测试试样中的金属离子的卡盒,该卡盒包括:(a)包括设置在巨磁阻(gmr)传感器的聚合物涂覆的表面上的生物分子,该生物分子包括被配置为结合检测蛋白的结合区,该检测蛋白还能够结合金属离子。其中当检测蛋白结合金属离子时,它防止检测蛋白与生物分子的结合区域结合;(b)一个以上端口,用于将测试试样,磁性纳米颗粒和可选的洗涤缓冲液引入卡盒中;(c)一种微流体系统,用于将测试试样,磁性纳米颗粒和可选的洗涤缓冲液从一个以上端口移至传感器。
在一些这样的实施例中,卡盒可以进一步包括废物收集区域。
在一个以上前述实施例中,生物分子是双链dna(dsdna)。
在一个以上前述实施例中,dsdna的正链具有序列5'-cttacacattcgttaagtcatatatgttttatgacttatccgcttcgaaga/3ammc6t/-3'序列标号1。
在一个以上前述实施例中,dsdna的反向链具有序列5'-tcttcgaagcggataagtcaaaaacatatatgacttaacgaatgtgtaag-3'序列标号2。
在一个以上前述实施例中,dsdna的正链具有序列5'-tgagtcgaaaatggttataatacactcaaataaatatttgaatgaagatg/3ammc6t/-3'序列标号3。
在一个以上前述实施例中,dsdna的反向链具有序列5'-catcttcattcaaatatttatttgagtgtattataaccattttcgactca-3'序列标号4。
在一个以上前述实施例中,多个生物分子以每传感器每平方毫米约1x109到约5x1010个生物分子的密度附着在传感器的表面上。
在一个以上前述实施例中,gmr传感器的表面包括交联的peg-phema聚合物。
在一个以上前述实施例中,聚合物用表面活性剂涂覆。在一些这样的实施方案中,表面活性剂可以是十六烷基三甲基溴化铵。
在一个以上前述实施例中,卡盒中的传感器可以进一步包括连接至多个接触垫的多条电线,所述多个接触垫被配置为将电子信号从传感器传送至处理器。
在一个以上前述实施例中,卡盒可包括一个以上过滤器以过滤测试试样。
在一个以上前述实施例中,金属离子包括砷或镉。
在一个以上前述实施例中,微流体系统是气动控制的。
在一个以上前述实施例中,卡盒还包括一个以上硬件芯片,以控制整个微流体系统的流速。
在一些实施例中,提供了一种制造用于检测测试试样中的砷或镉离子的传感器的方法,该方法包括(a)在巨磁阻(gmr)传感器的表面上印刷双链dna(dsdna);所述dsdna包含被配置为结合检测蛋白的结合区,所述检测蛋白还能够结合砷或镉离子。其中当检测蛋白结合金属离子时,它防止检测蛋白与生物分子的结合区域结合;该gmr传感器包括聚合物涂层,该聚合物涂层上印有dsdna。(b)通过以下步骤来修饰聚合物涂层的表面:在印刷步骤之后将一种以上的封闭剂添加到聚合物涂层中;以及在添加一种以上的封闭剂之后任选地将表面活性剂添加到聚合物涂层中。
在一个以上前述实施例中,dsdna的正链具有序列5'-cttacacattcgttaagtcatatatgttttatgacttatccgcttcgaaga/3ammc6t/-3'序列标号1。
在一个以上前述实施例中,dsdna的反向链具有序列5'-tcttcgaagcggataagtcaaaaacatatatgacttaacgaatgtgtaag-3'序列标号2。
在一个以上前述实施例中,dsdna的正链具有序列5'-tgagtcgaaaatggttataatacactcaaataaatatttgaatgaagatg/3ammc6t/-3'序列标号3。
在一个以上前述实施例中,dsdna的反向链具有序列5'-catcttcattcaaatatttatttgagtgtattataaccattttcgactca-3'序列标号4。
在一个以上前述实施例中,多个生物分子以每传感器每平方毫米约1x109到约5x1010个生物分子的密度附着在传感器的表面上。
在一个以上前述实施例中,pcad-ocad-f-胺链以10um至25um之间的浓度印刷在表面上。
在一个以上前述实施例中,聚合物涂层包含交联的peg-phema聚合物。
需要明了的是,可以以任何方式组合本文公开的所有实施例来进行检测分析物的方法,并且可以使用本文描述的各种系统组件的任何组合来实施这些方法。
尽管在上述示例性实施例中已经讲明了本公开的原理,但是对于本领域技术人员来说,显而易见的是,可以对在本公开的实践中使用的组件,结构,布置,比例,元件,材料和结构进行各种修改。
因此,可以看到,本公开的特征已经被完全和有效地实现。然而,需要认识到,出于示出本公开的功能和结构原理的目的以及示出和描述了前述的具体实施方式,并且在不违背这些原理的情况下可以对其进行改变。因此,本公开包括在所附权利要求的精神和范围之内的所有修改。
- 还没有人留言评论。精彩留言会获得点赞!