病毒性肝癌的检测方法与流程
本发明涉及一种病毒性肝癌的检测方法。本发明还涉及用于检测病毒性肝癌的诊断试剂盒。
背景技术:
肝癌是指在肝脏中发生的恶性肿瘤。肝癌是一种预后较差的疾病,在全世界恶性肿瘤中是第二大的死亡原因。肝癌的主要原因是持续性肝炎病毒感染、酒精性肝病和非酒精性脂肪肝病(nash)等。据认为,在日本的70-80%的肝癌患者中,肝癌是由肝炎病毒的持续性感染引起的,因此需要用于诊断由肝炎病毒引起的肝癌的生物标志物。
aim(巨噬细胞的凋亡抑制剂)是由组织巨噬细胞产生的分子量约为50kda的分泌性血液蛋白。aim具有这样的结构,其中三个清道夫受体富半胱氨酸(scavengerrecipientcysteine-rich,srcr)结构域(即包含许多半胱氨酸残基的特定序列)串联连接,并且半胱氨酸残基被认为在每个结构域中彼此通过二硫键键合,以形成紧凑的球形三维结构。
已知aim具有与各种分子(如脂多糖、igm、补体调节因子和脂肪酸合成酶)结合的特征。特别地,已知aim在血液中以与igm的复合物的形式存在。由于igm是一个超过500kda的巨型蛋白质复合物,因此只要aim与igm结合,aim就不会穿过肾小球并转移到尿液中,并保持着高血液浓度。与igm分离后,aim迅速排入尿液。因此,大多数aim在血液中与igm形成复合物,并且很少以游离状态而不是缀合物形式存在于血液中。
近年来,已经明确aim参与各种疾病如胰岛素抵抗或动脉硬化的病理状况的进展。专利文献1公开了一种检测肝癌的方法,该方法包括检测或定量源自受试者的生物样品中的游离aim的步骤。然而,专利文献1中所测试的所有肝癌都是由非酒精性脂肪肝病(nash)引起的肝癌,迄今为止,尚无游离aim与由肝炎病毒引起的肝癌之间的关联的报道。
引文列表
专利文献
专利文献1:wo2017/043617
非专利文献
非专利文献1:pierangelofasanietal.,hepatologyvol.29,no.6,1999
非专利文献2:takeshiokanoueetal.,rinshobyori.2016may;64(4):472-479
技术实现要素:
技术问题
本发明的目的是提供具有优异的灵敏度和特异性的病毒性肝癌的检测方法以及具有优异的灵敏度和特异性的病毒性肝癌的诊断试剂盒。
解决问题的方法
为了解决问题而深入研究的结果,本发明人发现,通过测量生物样品中未与其他物质结合的游离aim的量并将其与参考值进行比较,可以以优异的灵敏度和特异性检测病毒性肝癌,从而完成了本发明。已知在特定生物标志物与肝癌之间的关联取决于肝癌的原因,如酒精、非酒精性脂肪(nash)或病毒等而不同(非专利文献1)。还据报道,对作为丙型和乙型病毒性肝癌使用的生物标志物的afp而言,在由nash引起的肝癌的诊断中没有发现具有高价值(非专利文献2)。令人惊讶的是,发现生物样品中的游离aim量与由肝炎病毒引起的肝癌之间存在关联。
具体地,本发明如下。
<1>病毒性肝癌的检测方法,包括:
测量来自受试者的生物样品中的游离aim的量;和
将测得的游离aim的量与参考值进行比较。
<2>根据<1>的病毒性肝癌的检测方法,其中所述病毒性肝癌是由乙型肝炎病毒和/或丙型肝炎病毒引起的病毒性肝癌。
<3>根据<1>或<2>的病毒性肝癌的检测方法,其中将病毒性肝炎或病毒性肝硬化区别于病毒性肝癌。
<4>根据<1>至<3>中任一项的病毒性肝癌的检测方法,其中所述生物样品是体液样品。
<5>根据<4>的病毒性肝癌的检测方法,其中所述生物样品是血液、血清、血浆或尿液。
<6>根据<1>至<5>中任一项的病毒性肝癌的检测方法,其中通过使所述生物样品与特异性结合游离aim的抗体接触,来测量来自受试者的生物样品中的游离aim的量。
<7>用于检测病毒性肝癌的诊断试剂盒,其包含用于测量游离aim的量的试剂。
<8>根据<7>的诊断试剂盒,其中所述病毒性肝癌是由hbv和/或hcv引起的病毒性肝癌。
<9>根据<7>或<8>的诊断试剂盒,其中将病毒性肝炎或病毒性肝硬化区别于病毒性肝癌。
<10>根据<7>至<9>中任一项的诊断试剂盒,其中所述诊断试剂盒用于测量体液样品中的游离aim的量。
<11>根据<10>的诊断试剂盒,其中所述体液样品是血液、血清、血浆或尿液。
<12>根据<7>至<11>中任一项的诊断试剂盒,其包含特异性结合游离aim的抗体。
<13>根据<7>至<12>中任一项的诊断试剂盒,其包含固相,及用标记物质标记的抗aim抗体,在所述固相上固定有特异性结合游离aim的抗体的。
发明的有益效果
根据本发明,可以以优异的灵敏度和特异性检测病毒性肝癌。根据本发明,可以提供具有优异的灵敏度和特异性的用于病毒性肝癌的诊断试剂盒。
附图说明
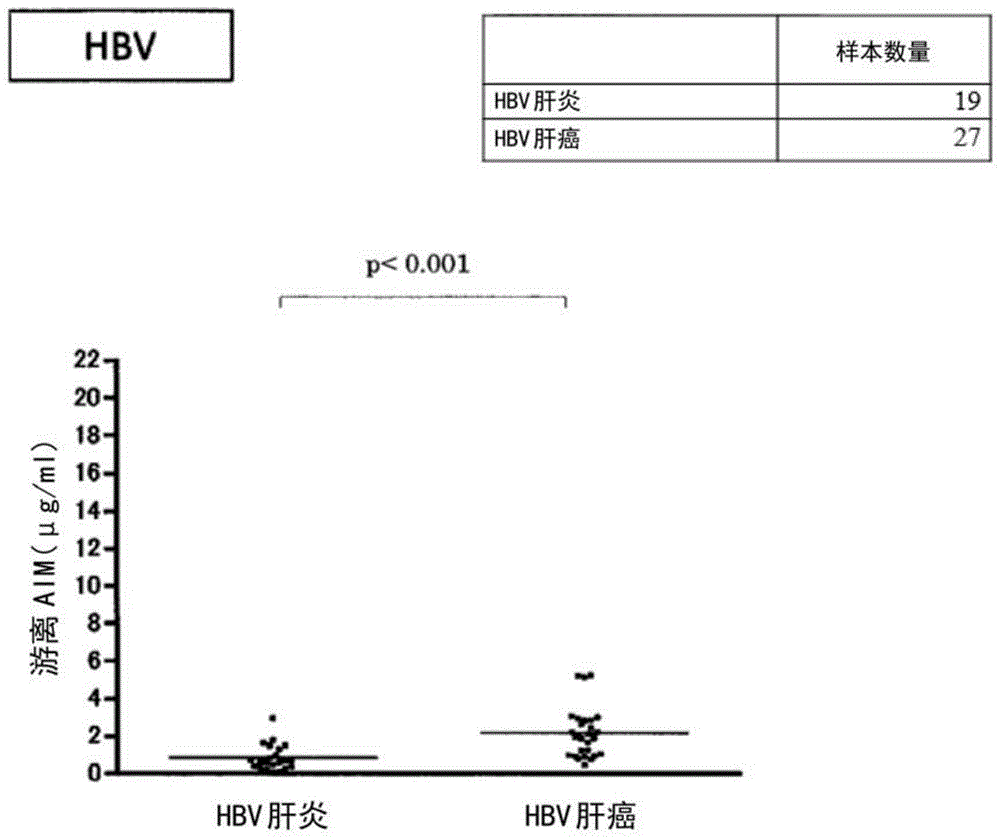
[图1]图1是显示乙型病毒性肝炎患者和乙型病毒性肝癌患者中血清中游离aim的量的比较的图。
[图2]图2是显示丙型病毒性肝炎患者和丙型病毒性肝癌患者中血清中游离aim的量的比较的图。
[图3]图3是显示afp、pivka-ii和游离aim作为乙型肝炎病毒性肝癌的生物标志物的能力的比较的图。
[图4]图4是显示afp、pivka-ii和游离aim作为丙型肝炎病毒性肝癌的生物标志物的能力的比较的图。
具体实施方式
[1]病毒性肝癌的检测方法
(来自受试者的生物样品)
在本发明中可分析的生物样品的实例包括源自活体(生物体)的固体组织和体液,并且优选使用体液。本发明中的生物样品更优选为血液、血清、血浆、尿液、唾液、痰、泪液、耳漏(otorrhea)或前列腺液,更优选为血液、血清、血浆或尿液,进一步优选为可能患有病毒性肝癌的受试者的血液、血清、血浆、或尿液。活体或受试者的实例包括人或动物(例如,小鼠、豚鼠、大鼠、猴、狗、猫、仓鼠、马、牛和猪),并且优选为人。来自受试者的生物样品可以在实施本发明时收集或制备,或者可以预先收集或制备并储存。制备样品的人和测量样品中游离aim的量的人可以不同。生物样品可以是体内或体外样品。生物样品可以是可能患有病毒性肝癌的受试者的生物样品。
(aim)
aim(巨噬细胞的凋亡抑制剂)是由组织巨噬细胞产生的分子量约为50kda的分泌性血液蛋白。aim具有这样的结构,其中三个清道夫受体富半胱氨酸(srcr)结构域(即包含许多半胱氨酸残基的特定序列)串联连接,并且半胱氨酸残基被认为在每个结构域中彼此通过二硫键键合,以形成紧凑的球形三维结构。
(游离aim)
在本说明书中,“游离aim”是指以游离状态存在而未与脂多糖或igm等其他物质结合的aim。另一方面,在本说明书中,与脂多糖或igm等其他物质结合并以复合物状态存在的aim可以称为复合物aim。游离aim可以是人游离aim。
(游离aim的测量方法)
对于游离aim的测定或定量方法没有特别限定,只要可以分别检测游离aim和复合物aim即可,可以应用通常使用的蛋白质检测方法。这种方法的实例包括但不限于使用抗aim抗体的免疫学分析方法,分子筛层析,离子交换层析,质谱法等。术语“抗aim抗体”是指能够与游离aim和复合物aim均反应的抗体。
使用抗aim抗体的免疫测定方法的实例包括但不限于电化学发光免疫测定(ecl法)、elisa、酶免疫测定、免疫组织学染色、表面等离子体共振、乳胶凝集免疫测定、化学发光免疫测定、荧光抗体法、放射免疫测定、免疫沉淀法、蛋白质印迹法、免疫层析法、高效液相色谱(hplc)等。
可以根据已知方法将抗aim抗体制备为单克隆抗体或多克隆抗体。单克隆抗体可通过以下方法获得,例如,从用游离aim或游离aim片段免疫的非人类哺乳动物中分离出作为抗体产生细胞的脾细胞或淋巴结细胞,将该细胞与具有高增殖能力的骨髓瘤来源的细胞系融合,以产生杂交瘤,并纯化由该杂交瘤产生的抗体。多克隆抗体可以从用游离aim或游离aim片段免疫的动物的血清中获得。游离aim片段是游离aim的部分肽,且与游离aim片段结合的抗体识别游离aim。免疫原的实例包括但不限于灵长类动物(例如人和猴)、啮齿动物(例如大鼠和小鼠)、狗、猫、马、绵羊和猪的游离aim或游离aim片段。
抗aim抗体可以是完整的抗体分子,也可以是具有抗原抗体反应活性的抗体片段,可以是通过如上所述的动物免疫步骤获得的抗体,也可以是通过基因重组技术获得的抗体,或嵌合抗体。抗体片段优选是功能片段;其实例包括f(ab')2、fab'、scfv等;并且可以通过用蛋白水解酶(例如,胃蛋白酶或木瓜蛋白酶)处理如上所述获得的抗体,或通过将抗体的dna进行克隆并在使用大肠杆菌或酵母的培养系统中表达来产生这些片段。
抗aim抗体是指与aim反应的抗体。对于抗aim抗体,优选使用与游离aim特异性反应的抗体。“与游离aim特异性反应”是指抗体与游离aim反应,并且实质上不与其他物质特别是复合物aim反应。稍后将描述“实质上不反应”的含义。本发明中使用的抗aim抗体或与游离aim特异性反应的抗体优选为单克隆抗体。
尽管在本说明书中同义地使用了与游离aim“反应”、“识别”游离aim和“结合”游离aim,但是它们必须在最广义上解释而不限于这些示例。可以通过抗原固相elisa法、竞争性elisa法、夹心elisa法等以及通过使用表面等离子体共振原理的方法(spr法)等来确认抗体是否与游离aim等抗原(化合物)“反应”。spr方法可以通过使用以biacore(注册商标)名称商业销售的设备、传感器和试剂来执行。
声称所使用的抗体“不与某种化合物反应”是指本发明中使用的抗体实质上不与某种化合物反应,而声称“实质上不反应”是指例如,当将biacore(注册商标)t100或t200用于固定本发明的抗体以基于spr方法进行测量时,未识别到本发明中使用的抗体的反应性增强。具体而言,这意味着抗体与化合物之间的反应性与对照(未添加化合物)的反应性没有显著差异。显然,可以通过除了spr方法以外的本领域技术人员熟知的方法或手段确认抗体“实质上不与该化合物反应”。
在本说明书中,“不溶性载体”可以表示为“固相”,并且用不溶性载体物理或化学地支持抗原或抗体,或者支持状态可以表示为“固定”,“固定化”或“固相化的”。术语“分析”、“检测”或“测量”必须从最广义上进行解释,包括对游离aim的存在的证明和/或定量,并且在任何意义上均不得以受限的方式进行解释。
通过使用可以与所使用的抗体结合的标记抗体(第二抗体),可以测量与游离aim结合的抗体的量,从而可以检测生物样品中的游离aim。用于制备标记抗体的标记物质的实例包括酶、荧光物质、化学发光物质、生物素、抗生物素蛋白、放射性同位素、胶体金颗粒或有色乳胶。尽管本领域技术人员可以根据所使用的抗体和标记物质适当地选择免疫分析方法,但是优选使用电化学发光免疫测定法(ecl法),因为可以容易地构建实验系统。
电化学发光免疫测定法(ecl法)是指通过利用电化学刺激使标记物质发光并检测发光量来计算分析物的量的方法。在电化学发光免疫测定法(ecl法)中,钌络合物可用作标记物质。钌络合物的发光量可通过将电极置于固相(微孔板或珠子等)上并在电极上引起电化学刺激来检测。
可以使用抗aim抗体作为固相抗体,使用与游离aim结合的另一种抗体作为检测抗体(标记抗体)进行电化学发光免疫分析(ecl法)。优选将与游离aim特异性结合的抗体用作固相抗体和/或标记抗体,更优选将与游离aim特异性结合的抗体用作固相抗体。当使用固相抗体和标记抗体并且将珠子和钌络合物分别用作固相和标记物时,测量原理如下。以下描述描述了本发明实施例中的测量原理,并且完全不限制本发明的范围。
1.当结合有抗aim抗体的珠子与样品反应时,样品中的游离aim与结合于珠子的抗体进行结合。
2.洗涤珠子后,钌标记的抗体(具有与项1.不同的识别表位的抗体)与结合于珠子的游离aim进行反应,并以夹心状结合。
3.洗涤珠子后,当在电极上施加电能时,钌络合物取决于通过游离aim结合到珠子的钌标记抗体的量而发光。通过测量该发光量,可以准确地测量在样品中的游离aim。
在免疫分析方法中,使用酶标记的elisa方法也是优选的,因为可以容易且快速地测量靶标。在夹心elisa的情况下,可以使用其上固定有抗aim抗体的不溶性载体,以及用标记物质标记并且具有与所述固定的抗体不同的表位的抗aim抗体。在这种情况下,不溶性载体优选为板(免疫板),并且可以适当地选择和使用标记物质。与不溶性载体结合的抗体和/或用标记物质标记的抗体优选为与游离aim特异性结合的抗体,更优选将与游离aim特异性结合的抗体用作固相抗体。
固定在不溶性载体上的抗体捕获样品中的游离aim,并在不溶性载体上形成抗体-游离aim复合物。用标记物质标记的抗体与被捕获的游离aim结合,从而与上述抗体-游离aim复合物形成夹心。样品中的游离aim可以通过用与标记物质相对应的方法测量标记物质的量来测量。对于特定的方法,例如将抗体固定在不溶膜上的方法以及将抗体与标记物质结合的方法,可以不受限制地使用本领域技术人员众所周知的方法。
通过使用高效液相色谱法(hplc法)或eata法:电驱动转运分析法(electrokineticanalytetransportassay),本发明的病毒性肝癌的检测方法可以在不使用与游离aim特异性结合的抗体的情况下进行。在这种情况下,使荧光标记的抗aim抗体与生物样品接触,以使抗aim抗体与游离aim和复合物aim结合。随后,通过利用hplc仅分离与游离aim结合的抗aim抗体,可以进行本发明的病毒性肝癌的检测方法。
乳胶免疫凝集法(以下也称为ltia法)是典型的颗粒凝集免疫测定法,并且作为免疫分析方法也是优选的。在ltia方法中,使用了携带针对靶标成分的抗体的乳胶颗粒,并且通过光学手段(例如,用于测量透射光的比浊法,用于测量散射光的浊度法)检测由在作为靶标成分的抗原与抗体支持乳胶颗粒之间的,形成抗原-抗体复合物的结合所导致的乳胶颗粒的聚集度(浊度),从而可以分析靶标成分。在本发明的免疫分析方法中,使用了携带抗aim抗体的乳胶颗粒,并且可以通过光学手段,对由在作为靶标成分的游离aim与抗体支持乳胶颗粒之间的,形成抗原-抗体复合物的结合所导致的乳胶颗粒的聚集度进行检测。当将ltia用作免疫分析方法时,优选使用至少一种与游离aim特异性结合的抗体。
在本发明中,游离aim的量可以使用能够特异性检测游离aim的市售试剂盒来测量。能够特异性检测游离aim的市售试剂盒的实例包括但不限于人aimelisa试剂盒(cy-8080;circulex)。
在本发明中,游离aim的量还可以通过从aim的总量(游离aim和复合物aim的量的总和)中减去复合物aim来测量。aim的总量和复合物aim可以通过使用本领域技术人员已知的技术来测量。
(病毒性肝癌)
在本说明书中,病毒性肝癌是指由于持续感染肝炎病毒而由慢性肝炎和肝硬化引起的原发性肝细胞癌。肝炎病毒的实例包括甲型肝炎病毒(hav)、乙型肝炎病毒(hbv)、丙型肝炎病毒(hcv)、丁型肝炎病毒(hdv)和戊型肝炎病毒(hev)。通过本发明检测的病毒性肝癌优选是由hbv(乙型肝炎病毒)和/或hcv(丙型肝炎病毒)引起的病毒性肝癌。
(参考值)
本发明的病毒性肝癌的检测方法包括将测得的游离aim量与参考值进行比较。在本发明的病毒性肝癌的检测方法中,可以通过将受试者中游离aim的量高于健康受试者组中游离aim的量这一事实作为指标来检测病毒性肝癌。具体地,例如,当受试者的游离aim的量等于或大于用于测定针对健康受试者组的阈值(参考值)时,能够检测出病毒性肝癌。
可以使用一系列数值用作参考值。当诊断人是否患有病毒性肝癌时,预先在已诊断出患有病毒性肝癌的受试者和已诊断出没有病毒性肝癌的受试者的生物样品中测量游离aim的量的范围,如果受试者的生物样品中的游离aim量在健康受试者的生物样品中的游离aim量的范围内,则该受试者高可能性不患有病毒性肝癌,而如果游离aim的量落在患有病毒性肝癌的受试者的生物样品中的游离aim量的范围内,则该受试者高可能性患有病毒性肝癌。
对用于测定的阈值(参考值)而言,尽管期望根据诸如潜在疾病、性别和年龄的各种条件而改变,但是本领域技术人员可以适当地选择与受试者相对应的适当群体,并且统计处理从该群体获得的数据,以确定正常值范围或用于测定的阈值。例如,作为人血清中的值,参考值可以是0.1μg/ml,0.2μg/ml,0.3μg/ml,0.4μg/ml,0.5μg/ml,0.6μg/ml和0.7μg/ml,0.8μg/ml,0.9μg/ml,1.0μg/ml,1.1μg/ml,1.2μg/ml,1.3μg/ml,1.4μg/ml,1.5μg/ml,1.6μg/ml,1.7μg/ml,1.8μg/ml,19μg/ml,2.0μg/ml,2.1μg/ml,2.2μg/ml,2.3μg/ml,2.4μg/ml,2.5μg/ml,2.6μg/ml,2.7μg/ml,2.8μg/ml,2.9μg/ml,3.0μg/ml,3.1μg/ml,3.2μg/ml,3.3μg/ml,3.4μg/ml或3.5μg/ml。例如,如后述的实施例所示,作为人血清中的值,参考值可以是2.2μg/ml。
本发明的病毒性肝癌的检测方法可以是辅助诊断病毒性肝癌的方法,其包括测量来自受试者的生物样品中的游离aim的量,并将所测得的游离aim的量与参考值进行比较。根据需要,基于结果,本发明的检测方法可以进一步包括实施用于检测患者中的病毒性肝癌的其他方法和/或治疗病毒性肝癌。
本发明的病毒性肝癌的检测方法还可以确定受试者中的病毒性肝炎或肝硬化是否已经发展为病毒性肝癌。在这种情况下,可以将受试者在特定时间点的游离aim量用作用于测定的阈值(参考值)。经过一定时间后(例如1、3、6或12个月后),再次测量该受试者的游离aim量,如果游离aim量显著高于先前的测量值,则可以确定病毒性肝炎或肝硬化已发展为病毒性肝癌。相反,如果游离aim量与先前的测量值相比没有变化,则可以确定病毒性肝炎或肝硬化尚未发展为病毒性肝癌。
[2]用于检测病毒性肝癌的诊断试剂盒
本发明的用于检测病毒性肝癌的诊断试剂盒包含用于测量游离aim量的试剂。该试剂可以是用于仅测量游离aim的量的试剂,或者可以是用于测量aim的总量和复合物aim的量以测量游离aim的量的试剂。本发明的诊断试剂盒还可以包含其他的测试试剂、样本稀释剂和/或使用说明书。
本发明的用于检测病毒性肝癌的诊断试剂盒优选包括固相,其上固定有第一抗aim抗体和用标记物质标记的第二抗aim抗体。第一抗aim抗体和第二抗aim抗体识别不同的表位。当使用ecl法时,本发明的诊断试剂盒可包含在其上固定有抗aim抗体的固相,及用电化学发光物质例如钌络合物标记的抗aim抗体。固定在固相上的抗体和/或用标记物质标记的抗体优选是与游离aim特异性结合的抗体,更优选将与游离aim特异性结合的抗体用作固定在固相上的抗体。例如,在使用微珠作为固相的试剂盒中,将生物样品添加到固定有抗aim抗体的微珠上并与之反应,然后去除样品并洗涤。随后,添加识别另一个表位并被电化学发光物质标记的抗aim抗体并使之反应。在洗涤微珠之后,施加电能以进行发光,并且可以测量标记物质的发光量以获得游离aim的浓度。
当使用夹心elisa法时,诊断试剂盒至少包括在其上固定有第一抗aim抗体(固相抗体)的不溶性载体,和被标记物质标记并与游离aim结合的第二抗aim抗体(标记抗体)。第一抗aim抗体和第二抗aim抗体识别不同的表位。在这种试剂盒中,首先,将生物样品添加到固定有第一抗aim抗体的不溶性载体中,然后进行温育,然后去除样品并洗涤。添加标记抗体,然后温育,并添加底物进行显色。游离aim浓度可以通过用酶标仪等测定显色来确定。固定在不溶性载体上的抗体和/或用标记物质标记的抗体优选为与游离aim特异性结合的抗体,更优选将与游离aim特异性结合的抗体用作固定在不溶性载体上的抗体。
通过使用高效液相色谱法(hplc法)或eata法:电驱动转运分析法,可以通过使用本发明的诊断试剂盒来诊断病毒性肝癌,而无需使用与游离aim特异性结合的抗体。在这种情况下,使荧光标记的抗aim抗体与生物样品接触,以使抗aim抗体与游离aim和复合物aim进行结合。随后,通过hplc仅分离与游离aim结合的抗aim抗体,可以通过使用本发明的诊断试剂盒来诊断病毒性肝癌。
使用ltia方法时,诊断试剂盒至少包括以下(1)和(2):
(1)在其上固定有第一抗aim抗体的乳胶颗粒;和
(2)在其上固定有识别与第一抗aim抗体不同的表位的第二抗aim抗体的乳胶颗粒。
在这种试剂盒中,第一抗aim抗体和第二抗aim抗体通过游离aim聚集。生物样品中的游离aim浓度可以通过使用光学手段检测聚集度来获得。优选第一抗aim抗体和第二抗aim抗体中的至少一个是与游离aim特异性结合的抗体。
在下文中将通过实施例具体描述本发明;然而,这些实施例并不限制本发明的范围。
实施例
1.小鼠抗人aim单克隆抗体的制备
11号抗体和12号抗体是小鼠抗人aim单克隆抗体,并通过以下步骤获得。
通过将全长人raim(2mg/ml)作为抗原与等量的titermaxgold(g-1funakoshi)混合来制作乳液。将两只8周大的雌性balb/c小鼠(charlesriverlaboratories)用作免疫动物,并将50μl的抗原溶液施用于后脚掌。2周后进行相同的施用,再过2周或更长时间后,将50μg的抗原溶液施用于后脚掌,以准备3天后进行的细胞融合。
关于骨髓瘤细胞使用了小鼠p3u1,通过向rpmi1640(11875-119gibco)中添加谷氨酰胺和丙酮酸并以10%添加fbs(s1560bwt)来获得用于增殖培养的培养基。作为抗生素以适当的量加入青霉素和链霉素。
在麻醉下收集心脏血液后,从小鼠中无菌摘出腘淋巴结,并将其置于具有#200网的烧杯中,并用硅棒按压而制备细胞悬液。将细胞在rpmi1640中离心洗涤两次,然后计数细胞数。通过离心收集处于对数生长期的骨髓瘤细胞,洗涤,然后进行制备使得淋巴细胞与骨髓瘤细胞的比例为5∶1,并进行混合离心。通过使用peg1500(783641roche)进行细胞融合。具体地,将细胞沉淀与1mlpeg溶液反应3分钟,然后进行阶梯稀释,并通过离心洗涤后,添加了培养基,并在15个96孔板中分别放置200μl进行1周的培养。对于培养基,将hat补充剂(21060-017gibco)添加至骨髓瘤细胞的培养基以将fbs浓度调节至15%。
将冷冻保存的细胞解冻并进行增殖培养后,向裸鼠(balb/cajcl-nu/nunipponclaire)的腹腔中施用1×107个细胞,其中所述裸鼠在1周或更早之前向腹膜内施用了0.5ml的姥鲛烷(42-002cosmobio),大约2周后,获得4至12ml的腹水。通过离心除去固体物质后,将腹水冷冻保存。随后,从冷冻保存的腹水中纯化抗体,获得了11号抗体和12号抗体。
2.抗体结合的磁珠的制备
1)测量用150mm磷酸钾缓冲液(ph7.8)进行了透析的12号抗体的吸光度,并使用相同的缓冲液将其调节至abs0.5。
2)用该缓冲溶液将1ml(30mg/ml)由dynamicbiotech制造的dynabeadsm-450epoxy洗涤3次,并添加1ml的1)的抗体溶液。在25℃下进行旋转搅拌18小时或以上。
3)用珠封闭缓冲液[50mmtris,150mmnacl,0.1%bsa(不含脂肪酸),0.1%nan3,ph7.8)将珠洗涤两次。通过洗涤除去缓冲液,从而除去残留在溶液中而未与珠子结合的抗体。随后,添加1ml的珠封闭缓冲液并搅拌,并且在25℃下进行旋转搅拌18小时或以上。
4)用珠封闭缓冲液洗涤珠两次后,加入1ml的珠封闭缓冲液并搅拌。
将它们用作抗aim抗体结合的磁珠,并在4℃下保存至使用。
3.钌标记抗体的制备
1)向用150mm磷酸钾缓冲液(ph7.8)进行了透析的11号抗体溶液312.5μl中加入14.1μl10mg/ml钌络合物(igen生产的origintag-nhsester),将溶液搅拌30分钟。随后,添加50μl的2m甘氨酸,并将溶液搅拌20分钟。
2)将钌络合物标记的抗体应用于装在直径为1cm,高度为30cm的玻璃管中的凝胶过滤柱色谱(gehealthcarebioscience生产的sephadexg-25),以分离和纯化非标记的钌络合物和钌络合物标记的抗体。用10mm磷酸钾缓冲液(ph6.0)进行洗脱。
4.血清中游离aim的定量
1)将每个患者的血清样本(19例乙型病毒性肝炎样本,27例乙型病毒性肝癌样本,55例丙型病毒性肝炎样本,45例丙型病毒性肝癌样本)在反应溶液[50mmheeps,50mmnacl,0.05%tween20,1mmedt-4na,0.5%bsa,0.1%nan3,100μg/ml小鼠igg,ph7.8]中稀释至1/10,以制备样本稀释溶液。随后,将100μl的反应溶液置于反应管中,并添加2μl的样本稀释溶液。
2)向溶液中加入用珠稀释剂[50mmhepes,100mmnacl,0.1%tween20,1mmedt-4na,0.5%bsa(不含脂肪酸),0.1%nan3,ph7.8]稀释至浓度为0.5mg/ml的结合了12号抗体的磁珠25μl,并在30℃下反应9分钟(第一反应)。
随后,用磁铁捕获磁珠,提取反应管中的液体,并用350μl清洁液[50mmol/ltrishcl,0.01%(w/v)吐温20,0.15mol/lnacl,ph7.5]洗涤磁珠两次,以除去抗原-抗体反应以外的非特异性结合物质(bf分离)。
3)随后,加入用钌的稀释溶液[50mmhepes,50mmnacl,0.05%tween20,1mmedt-4na,0.5%bsa,0.1%nan3,100μg/ml小鼠igg,ph7.8]稀释至浓度为0.6μg/ml的钌标记11号抗体200μl,并在30℃下反应9分钟(第二反应)。
用磁铁捕获反应后的磁珠,提取反应管中的液体,并用350μl清洗液洗涤磁珠两次,以除去抗原-抗体反应以外的非特异性结合物质(bf分离)。
4)随后,将300μl三丙胺放入反应管中,并与磁珠混合。
通过在该状态下施加电能,钌络合物发光,并且通过检测器检测发光强度。
将磁珠添加到反应管中之后,在自动钌络合物发光测量仪picolumiiii上进行检测。
5.病毒性肝炎患者和肝癌患者中游离aim值的分布和roc分析
1)在19例乙型病毒性肝炎样本和27例乙型病毒性肝癌样本中确认了游离aim值的分布,并且在55例丙型病毒性肝炎样本和45例丙型病毒性肝癌样本中也确认了游离aim值的分布。结果示于图1和2中。
2)如图1所示,观察到hbv肝炎患者和hbv肝癌患者之间游离aim量存在显著差异。因此,发现通过测量游离aim的量,可以将乙型病毒性肝炎患者与乙型病毒性肝癌患者区分开。如图2所示,观察到hcv肝炎患者和hcv肝癌患者之间游离aim量的显著差异。因此,发现通过测量游离aim的量,可以将丙型病毒性肝炎患者与丙型病毒性肝癌患者区分开。
3)对于上述肝炎和肝癌样本的游离aim值,使用ibmspssstatisticsver.24进行了roc分析来计算auc。还对现有的肿瘤标志物(afp、pivka-ii)进行了roc分析,并与游离aim进行了比较。结果示于图3和4中。
4)在检测hbv时,游离aim在auc、灵敏度和正确诊断率上均优于afp和pivka-ii。在特异性方面,游离aim与pivka-ii具有相同的值,并且优于afp。
在检测hcv时,游离aim在auc、灵敏度和正确诊断率上均优于afp和pivka-ii。在特异性方面,游离aim低于pivka-ii和afp。
工业实用性
根据本发明,能够以优异的灵敏度和特异性检测病毒性肝癌。根据本发明,可以提供具有优异的灵敏度和特异性的用于病毒性肝癌的诊断试剂盒。
- 还没有人留言评论。精彩留言会获得点赞!