基于N’-(1,3二甲基亚丁基)-3-羟基-萘酰腙荧光探针的Ni2+的测定方法与流程
本发明涉及仪器分析技术领域,具体涉及基于n’-(1,3二甲基亚丁基)-3-羟基-萘酰腙荧光探针的ni2+的测定方法。
背景技术:
酰腙类化合物作为一类特殊的schiff碱,具有生物活性好、配位能力强、分子有良好的共轭效果等优点,故其在医药、催化反应、功能材料、检测分析等方面都得到了广泛的应用。
酰腙类荧光探针是一类含有—c(o)—nh—n=ch—结构的新型荧光探针。酰腙类荧光探针中含有c=o、n=c等生色团,这些含有双键的不饱和基团的存在使分子内电子的流动性显著增加而降低分子的激发能。当荧光探针识别金属离子时,由于金属离子的极化作用,使探针中的π键与π键相互作用(π一π*共轭),助色团孤对电子与生色团π键的作用(π-p共轭)进一步加强,激发能进一步降低,从而使配合物的光谱性质发生较大的变化。因此,可将酰腙类化合物作为荧光探针用于测定金属离子的含量,还可以推测一些金属离子与酰腙类化合物的结合点位置和配位方式。此外,酰腙类化合物存在烯醇式和酮式两种互变异构体,使其金属配合物的配位形式更加繁多。未与金属离子配位时,由于烯醇式的结构相对于酮式稳定性较差,酰腙类化合物大部分呈酮式结构。而在与金属离子配位形成配合物后,受两个原因影响(一是去质子的烯醇式酰腙化合物呈负离子形态,能与过渡金属阳离子以共价键形式结合,二是金属离子有空d轨道时,氮原子能提供孤对电子进入空d轨道形成配位键),故而去质子的烯醇式配位结构更稳定。
n’-(1,3二甲基亚丁基)-3-羟基-萘酰腙(简写为bmh)为一类酰腙类化合物;最接近的对比文件(徐启杰,王康康,柳准,等.n’-(1,3二甲基亚丁基)-3-羟基-2-萘酰腙的合成与表征[j].化学研究,2017,28(05):580-583)公开了bmh的合成方法;但其并未公开bmh的用途,更未公开bmh可以用于检测金属离子,尤其是用于检测ni2+。因此,对bmh进行进一步研究,将其用于检测金属离子,一方面可以开拓bmh的用途,另一方面可以提供检测金属离子的新的手段,具有重要的应用价值。
技术实现要素:
本发明所要解决的技术问题是,为了克服bmh在具体应用中的研究不足,提供一种基于n’-(1,3二甲基亚丁基)-3-羟基-萘酰腙荧光探针的ni2+的测定方法。该方法在检测过程中具有较低的检出限。
本发明所要解决的上述技术问题,通过以下技术方案予以实现:
一种基于n’-(1,3二甲基亚丁基)-3-羟基-萘酰腙荧光探针的ni2+的测定方法,其以n’-(1,3二甲基亚丁基)-3-羟基-萘酰腙作为荧光探针,采用荧光猝灭法测定ni2+的含量。
在10ml的具塞比色管中,依次加入9.6mldmf,300μlph为10.5的naoh溶液,50μl2×10-3mol/l的bmh溶液,剧烈摇晃后,再加入50μl1×10-3mol/l的金属离子溶液,混匀。以9.65mldmf,300μlph为10.5的naoh溶液,50μl超纯水的混合体系为背景溶液。在200~500nm范围内扫描吸收峰。
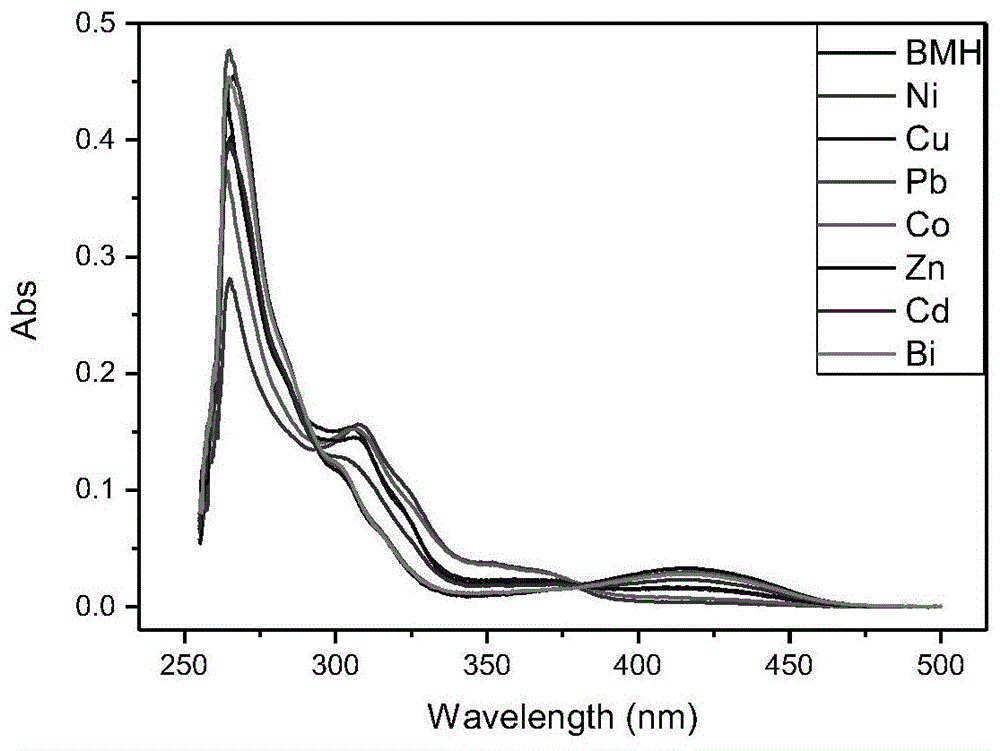
表1bmh及其在各重金属离子溶液中的紫外可见光谱数据
如图1和表1所示,bmh在266nm处出现了最强吸收峰,将其置于各重金属离子溶液体系时,也在266nm附近出现最强吸收峰,这可能是萘环的b带跃迁。在413nm处,bmh出现一个弱吸收峰,而除了ni2+、co2+体系外,将bmh至于其它体系时,均在416nm处出现弱吸收,较bmh的吸收峰微有红移。另外,将bmh置于ni2+、co2+、cu2+、zn2+、cd2+体系时,在307nm处附近均出现了新的吸收峰,其中,在ni2+体系中时吸收峰最为明显,这可能是因为bmh与这些金属离子在溶液中发生了螯合作用。
在10ml的具塞比色管中,依次加入9.85mldmf,50μl2×10-3mol/l的bmh溶液,剧烈摇晃后,再加入100μl的1×10-3mol/l的金属离子溶液或超纯水,混匀。设置激发和发射狭缝分别为3nm和5nm,在约20~25℃时以ex=300nm扫描发射光谱,以em=503nm扫描激发光谱。
表2bmh的荧光光谱数据
如图2和表2所示,设置激发和发射狭缝分别为3nm和5nm,在250nm~330nm范围内扫描bmh的激发光谱,在275nm出现最大激发峰,这与紫外可见光谱图中出现的最大吸收波长266nm也较为接近。当选择275nm作为激发波长扫描发射光谱时,由于倍频峰与发射峰距离较近,易产生干扰,为避开倍频峰的干扰,故选择300nm作为激发波长进行后续的实验。由发射图谱可以看出,bmh的荧光峰出现在503nm。
表3bmh与重金属离子的发射峰数据
图3是bmh在ni2+、cu2+、pb2+、co2+、zn2+、cd2+、bi3+溶液中的发射峰图谱。由图3和表3可知,bmh在bi3+溶液中时荧光峰微蓝移,但荧光强度基本不变。在pb2+、cu2+、co2+、ni2+溶液中,bmh的荧光出现了不同程度的猝灭,在ni2+溶液中,bmh的荧光几乎完全猝灭。而在zn2+、cd2+溶液中时,发射峰位置分别移到554nm和544nm处,并出现了一定程度的荧光猝灭。
由上述实验可知,与其它离子相比,ni2+能几乎完全猝灭bmh的荧光;因此,基于bmh荧光探针检测ni2+相对于其他金属离子而言具有绝对的优势。其中荧光猝灭法中的条件选为:调节激发和发射狭缝分别为3nm和5nm,以ex=300nm扫描发射光谱,记录em=503处的荧光强度
优选地,采用荧光猝灭法测定ni2+的含量的具体方法为:
(1)在20~25℃下,向9~10ml有机溶剂中加入200~400ulph=10~11的碱溶液,振荡摇匀后再依次加入40~60μl2×10-3mol的bmh和40~60μl超纯水,2~5min后测其荧光强度f0;
(2)在20~25℃下,向9~10ml有机溶剂中加入200~400ulph=10~11的碱溶液,振荡摇匀后再依次加入40~60μl2×10-3mol的bmh和40~60μl含不同ni2+浓度的标准溶液,2~5min后测其荧光强度f;
(3)计算△f=f0-f,得出△f与ni2+浓度的线性方程;
(4)测定待测样品溶液的△f;根据△f与ni2+浓度的线性方程得出待测样品溶液中ni2+浓度。
进一步优选地,步骤(1)和(2)中的有机溶剂为dmf。
进一步优选地,步骤(1)和(2)中的碱溶液为naoh水溶液。
进一步优选地,步骤(1)在20~25℃下,向9.6ml有机溶剂中加入300ulph=10.5的碱溶液,振荡摇匀后再依次加入50μl2×10-3mol的bmh和50μl超纯水,2min后测其荧光强度f0。
进一步优选地,步骤(2)在20~25℃下,向9.6ml有机溶剂中加入300ulph=10.5的碱溶液,振荡摇匀后再依次加入50μl2×10-3mol的bmh和50μl含不同ni2+浓度的标准溶液,2~5min后测其荧光强度f。
进一步优选地,步骤(2)中所述的含不同ni2+浓度的标准溶液,是指0.08μmol/l、0.1μmol/l、0.2μmol/l、0.4μmol/l、0.6μmol/l、0.8μmol/l、1μmol/l或2μmol/l的ni(no3)2溶液。
进一步优选地,步骤(3)中△f与ni2+浓度的线性方程为δf=192.6756c+0.49255;其中,线性方程中c为ni2+的浓度,单位为μmol/l;线性相关系数是r=0.99854,检测限为6×10-8mol/l。
进一步优选地,步骤(4)中参照步骤(1)和(2)的方法测定待测样品溶液的△f。
进一步优选地,荧光猝灭法中调节激发和发射狭缝分别为3nm和5nm,以ex=300nm扫描发射光谱,记录em=503处的荧光强度f0和f值。
发明人进一步研究发现,采用荧光猝灭法测定ni2+的含量,必须保证荧光强度差值△f最大,才能使得荧光猝灭法具有较高的灵敏度;而研究表明荧光强度差值△f与溶剂体系的选择,酸度体系,naoh溶液的用量,反应时间,反应温度等因素密切相关;上述因素只有在本发明上述选择下才能取得最大的荧光强度差值△f,保证荧光猝灭法具有较高的灵敏度和较低的检出限。
配制9.9ml溶剂+50μl2×10-3mol/l的bmh+50μl1×10-3mol/l金属离子溶液(或超纯水),测试其荧光强度数据;具体见图4和表4。
表4bmh和bmh-ni2+在不同溶剂体系中的荧光强度数据
图4a、b、c、d四图分别是在dmf、dmso、乙醇(95%)、水中,bmh和bmh-ni2+溶液的发射图谱,由图4和表4可以看出,在乙醇和水中的δf较小,这可能是因为在质子性溶剂中,bmh不易发生去质子化反应,一定程度上阻碍了bmh与ni2+的螯合。此外,水是常见的猝灭剂,在本实验中,bmh在水中的荧光强度相对于在其它溶剂中时大大降低,故后续实验应注意控制水的加入量。而在dmf中,二者荧光强度之差最大,达到了410.7,故后续实验选用dmf作为溶剂。
配制9.8mldmf+100μlhno3或naoh水溶液+50μl2×10-3mol/l的bmh+50μl1×10-3mol/l金属离子溶液(或超纯水),测试其荧光强度数据;具体见图5和表5。
表5bmh和bmh-ni2+在不同酸度体系中的荧光强度数据
由图5和表5可以看出,在实验中,加0.1mlph=1.5的hno3溶液调ph到约3.5,加0.1mlph=11.5的naoh溶液调ph到约9.5,其余以此类推。如图12所示,荧光强度之差随酸度的减小呈现出先增大后减小的趋势。bmh的荧光强度一直随酸度减小而增加,这可能是因为在碱性溶液中,bmh分子结构的共轭体系增强,从而使荧光强度一直增大。bmh-ni2+溶液的荧光强度随酸度的减小呈现出先减小后增大的趋势,这可能是由于,在酸性环境下,bmh在与ni2+结合时不易失去质子,则不能以更稳定的烯醇式配位;而在ph超过9.5时,ni2+易水解产生氢氧化物,同样不利于bmh与ni2+的结合。因此,选择用氢氧化钠调ph到约8.5进行后续实验。
配制ymldmf+xμlnaoh水溶液+50μl2×10-3mol/l的bmh+50μl1×10-3mol/l金属离子溶液(或超纯水)10ml测试其荧光强度数据;具体见图6和表6。
表6不同naoh溶液用量时,bmh和bmh-ni2+溶液的荧光强度数据
如图6和表6所示,在50~400μl的范围内,当naoh溶液的用量逐增时,bmh和bmh-ni2+溶液荧光强度差值也逐渐增大,在保证荧光强度差值足够大的同时,为避免溶液碱性过高,最终选择300μl作为最佳用量进行后续实验。
配制9.6mldmf+300μlnaoh水溶液+50μl2×10-3mol/l的bmh+50μl1×10-3mol/l金属离子溶液(或超纯水)测试其荧光强度数据;具体见图7和表7。
表7不同反应时间下,bmh和bmh-ni2+溶液的荧光强度数据
由图7和表7可以看出,在溶液配制完成后,随着反应时间的增加,bmh的荧光强度不断减弱。而bmh-ni2+溶液的荧光强度从一开始就维持在50左右,随反应时间变化不大,故bmh与ni2+的反应应是瞬时完成。因此,为保证荧光强度差值最大,选择反应时间为2min。即从最后加入ni2+溶液开始计时,2min时,设置激发和发射狭缝分别为3nm和5nm,以300nm的激发波长扫描发射光谱,记录503nm处的荧光强度。
配制9.6mldmf+300μlnaoh水溶液+50μl2×10-3mol/l的bmh+50μl1×10-3mol/l金属离子溶液(或超纯水)测试其荧光强度数据;具体见图8和表8。
表8不同温度下,bmh和bmh-ni2+溶液的荧光强度数据
由图8和表8可以看出,从最后加入ni2+溶液开始计时,2min时,设置激发狭缝为3nm,发射狭缝为5nm,以300nm的激发波长扫描发射光谱,记录503nm处的荧光强度。由图8可知,随着温度升高,bmh和bmh-ni2+溶液的荧光强度都出现了下降,因此,为保证荧光强度差值最大,选择20~25℃作为最佳反应温度。
在20~25℃下,向9.6mldmf中,加入300μlph=10.5的naoh水溶液,振荡摇匀后,再依次加入50μl2×10-3mol的bmh和50μl不同浓度的ni(no3)2溶液(或超纯水),2min后测其荧光强度。具体见图9和表9。
表9bmh检测不同浓度ni2+的荧光强度数据
由图9和表9可以看出,在8×10-8mol/l到2×10-6mol/l之间,相对荧光强度(δf=f0-f)和ni2+浓度(c)之间存在良好的线性关系,线性方程为δf=192.6756c(μmol/l)+0.49255,线性相关系数是r=0.99854。平行测定16次空白溶液,计算相对标准偏差为0.54%。由公式d=3σ/k(d表示检出限,σ表示空白溶液测量值的相对标准偏差,k表示标准曲线的斜率),计算得到该测定方法的检测限为6×10-8mol/l。
为了探究以bmh为荧光探针所建立的检测ni2+的荧光光谱分析法的可靠性和实用性,采用在湘江水中加入标准ni2+溶液的方法来检验。实验所得数据如表10所示。用荧光探针bmh所测得的实验数据与实验操作中实际加入的ni2+的量几乎完全接近,实验误差在允许的范围内,这说明荧光探针bmh可用于实际水样中ni2+的检测。
表10水样中的ni2+含量测定结果
上述实验表明,溶剂体系的选择,酸度体系,naoh溶液的用量,反应时间,反应温度等因素只有在本发明上述选择下才能取得最大的荧光强度差值△f,进而保证荧光猝灭法具有较高的灵敏度和较低的检出限。
有益效果:本发明提供了n’-(1,3二甲基亚丁基)-3-羟基-萘酰腙(bmh)的全新应用。实验表明,n’-(1,3二甲基亚丁基)-3-羟基-萘酰腙(bmh)可以用于检测水中ni2+含量测定;最佳方法为采用荧光猝灭法测定ni2+的含量,进一步研究表明,在本发明上述条件下进行荧光猝灭法具有较高的灵敏度和较低的检出限,其检出限为6×10-8mol/l。
附图说明
图1为bmh及其与重金属离子的紫外可见吸收光谱图。
图2为bmh的激发光谱和荧光光谱图。
图3为bmh与重金属离子的荧光光谱图。
图4为不同溶剂体系对bmh和bmh-ni2+溶液荧光强度的影响。
图5为不同酸度对bmh和bmh-ni2+溶液荧光强度的影响。
图6为不同naoh水溶液用量对bmh和bmh-ni2+溶液荧光强度的影响。
图7为反应时间对bmh和bmh-ni2+溶液荧光强度的影响。
图8为温度对bmh和bmh-ni2+溶液荧光强度的影响。
图9为bmh检测ni2+的线性关系图。
图10为bmh的合成路线。
图11为bmh的核磁氢谱图。
图12为bmh的核磁碳谱图。
图13为bmh的红外光谱图。
具体实施方式
以下结合具体实施例来解释本发明,但实施例对本发明不做任何形式的限定。
实施例1n’-(1,3二甲基亚丁基)-3-羟基-萘酰腙(bmh)的制备
利用微波“一锅法”合成n′-(1-苯基亚乙基)-3-羟基-2-萘酰腙(bmh):在100ml微波反应罐中加入10mmol3-羟基-2-萘甲酰肼和20ml4-甲基2-戊酮,在100℃下微波反应40min,冷却到室温,过滤至锥形瓶中,用甲醇洗涤,真空干燥,得灰白色粉末状产物。
灰白色粉末状产物表征数据如下:1hnmr(500mhz,meod,δ):8.67(d,1h),7.87(d,1h),7.67(d,1h),7.48(t,1h),7.34(t,1h),7.27(d,1h),4.96(s,2h),3.31(d,2h),2.29(s,1h),2.10(s,1h),2.00(s,1h),1.04-0.95(m,6h).13cnmr(125mhz,dmso,δ):163.09,160.17,152.53,136.49,132.61,128.70,128.20,127.82,125.46,123.84,119.25,110.47,47.55,25.97,21.64,14.91.ir(kbr):3400~2400,1650,1550,1510,1470,1360,1230,1170,1140,1120,1050,950,900,880,770,740,670,600,550,480cm-1。核磁氢谱表征表明,芳香质子出现在8.67~7.27ppm之间,而在4.96~0.95ppm之间观察到的信号被分配给脂肪族质子。核磁碳谱表明,163.09和160.17ppm的峰应归属于c-n和c=n基团。红外光谱在3400~2400之间有一个宽带,这可以归因于o-h和n-h的拉伸振动以及1650cm-1(c=o)、1510cm-1(c=n)、1550cm-1和1230cm-1(n-h)的特征吸收。上述表征数据表明,所得的灰白色粉末状产物即为n’-(1,3二甲基亚丁基)-3-羟基-萘酰腙(bmh)。
实施例2基于n’-(1,3二甲基亚丁基)-3-羟基-萘酰腙(bmh)荧光探针的ni2+的测定方法
本实施例以n’-(1,3二甲基亚丁基)-3-羟基-萘酰腙(bmh)作为荧光探针,采用荧光猝灭法测定ni2+的含量;荧光猝灭法中调节激发和发射狭缝分别为3nm和5nm,以ex=300nm扫描发射光谱,记录em=503处的荧光强度f0和f值;
采用荧光猝灭法测定ni2+的含量的具体方法为:
(1)在20~25℃下,向9.6mldmf中加入300ulph=10.5的naoh水溶液,振荡摇匀后,再依次加入50μl2×10-3mol的bmh和50μl超纯水,2min后测其荧光强度f0;
(2)在20~25℃下,向9.6mldmf中加入300ulph=10.5的naoh水溶液,振荡摇匀后再依次加入50μl2×10-3mol的bmh和50μl含不同ni2+浓度的标准溶液(含不同ni2+浓度的标准溶液是指0.08μmol/l、0.1μmol/l、0.2μmol/l、0.4μmol/l、0.6μmol/l、0.8μmol/l、1μmol/l和2μmol/l的ni(no3)2溶液),2min后测其荧光强度f;
(3)计算△f=f0-f,得出△f与ni2+浓度的线性方程;△f与ni2+浓度的线性方程为δf=192.6756c+0.49255;其中,线性方程中c为ni2+的浓度,单位为μmol/l;线性相关系数是r=0.99854,检测限为6×10-8mol/l;
(4)取待测样品溶液,在步骤(1)条件下测定荧光强度f0,在步骤(2)条件下测定待测样品溶液的荧光强度f,计算待测样品溶液的△f=f0-f;根据△f与ni2+浓度的线性方程得出待测样品溶液中ni2+浓度。
- 还没有人留言评论。精彩留言会获得点赞!