检测血清中幽门螺旋杆菌抗体含量的试剂盒及其使用方法与流程
本发明涉及生物化学相关技术领域,特别涉及检测血清中幽门螺旋杆菌抗体含量的试剂盒及其使用方法。
背景技术:
幽门螺旋杆菌是一种弯曲、螺旋形或s形的革兰染色阴性微需氧杆菌。1979年澳大利亚学者warren及marshall首次从胃黏膜分离培养出幽门螺杆菌,随后发现消化性溃疡和慢性胃炎的首要病因是幽门螺旋杆菌。幽门螺旋杆菌属于临床上常见的革兰氏阴性杆菌,主要分布在机体的胃部、十二指肠等区域中,可能造成胃粘膜慢性炎症,严重者甚至出现胃及十二指肠溃疡或者胃癌,直接威胁患者生命安全,受到医疗界重点关注。幽门螺旋杆菌能够轻易穿透胃粘膜,从而生长于胃上皮细胞,同时促进大量尿素酶产生,将其分解后可在菌体周边形成碱性的“氨云”,以此抵抗胃内酸性环境,从而避免被胃酸杀灭。幽门螺旋杆菌是目前公认的慢性胃炎、消化性溃疡和胃癌的致病因素之一,已被世界卫生组织列为i类致癌源。幽门螺杆菌(hp)感染率极高,在发达国家占成年人的30~50%,发展中国家为40~80%,中国流行学调查结果为40~90%平均为59%。幽门螺旋杆菌中包括cana、urease及vaca三种分型,其中caga并无细胞毒性作用,可能与vaca转录能力存在密切相关性;而vaca能够改变上皮细胞空泡样,并使其受损、坏死甚至发生溃疡。
目前已知的幽门螺旋杆菌抗体测定方法有酶联免疫吸附法(elisa)、胶乳增强比浊法等。酶联免疫吸附法存在检测时间长、操作复杂、重复性差、不适于急诊和临床病人及时诊断的需要。胶乳增强免疫比浊法操作简单、快速,但是灵敏度低、低值重复性差。
技术实现要素:
针对现有技术存在以上的技术问题,本发明提供检测血清中幽门螺旋杆菌抗体含量的试剂盒及其使用方法。
基于以下技术原理:异硫氰酸荧光素(fitc)标记的hp抗原与碱性磷酸酶(ap)标记的hp抗原和样本、校准品或质控品中的hp抗体结合形成“三明治”复合物。随后加入连有抗fitc抗体的磁微粒,通过抗fitc抗体与fitc的特异性结合使抗原抗体免疫复合物结合在磁微粒上。在外加磁场的作用下,将免疫反应形成的复合物与未结合的其他物质分离,清洗复合物后,加入酶促化学发光底物。底物在酶作用下被催化裂解,形成不稳定的激发态中间体,当激发态中间体回到基态时发出光子,形成发光反应,即可使用化学发光仪检测反应的发光强度。在检测范围内,发光强度与样本中的hp抗体的含量成正比,使用改良的四参数logistic方程拟合可计算出样本中hp抗体浓度。
本发明的技术方案为:
检测血清中幽门螺旋杆菌抗体含量的试剂盒,包括相互独立包装的抗试剂a、抗试剂b、磁微粒试剂、校准品、质控品、清洗液和发光底物;
所述抗试剂a为包括异硫氰酸荧光素标记的幽门螺旋杆菌抗体连接物的bsa缓冲溶液;所述抗试剂a通过包括以下步骤的操作制备而成:
sa1:用抗试剂缓冲液将异硫氰酸荧光素配制成浓度为1.0~5.0mg/ml的异硫氰酸荧光素溶液;
sa2:向幽门螺旋杆菌抗体中加入所述幽门螺旋杆菌抗体质量1.1~1.5倍的所述异硫氰酸荧光素溶液并充分混合;
sa3:用ph为8~9的碳酸盐缓冲液调节ph平衡,再用凝胶层析分离纯化制得异硫氰酸荧光素标记的幽门螺旋杆菌抗体包被抗体;
所述抗试剂b为包括碱性磷酸酶标记的幽门螺旋杆菌抗原连接物的bsa的缓冲溶液;所述抗试剂b通过包括以下步骤的操作制备而成:
sb1:用抗试剂缓冲液将碱性磷酸酶配制成浓度为1.0~5.0mg/ml的碱性磷酸酶溶液;
sb2:用幽门螺旋杆菌抗原和碱性磷酸酶分别将反应基团分别活化,然后按照摩尔比为碱性磷酸酶:幽门螺旋杆菌抗原为1:1~1:3的比例,在催化剂的催化下充分混匀进行偶联反应;
sb3:使用ph为8~9的tris缓冲液调节ph平衡,再用凝胶柱分离纯化制得碱性磷酸酶标记的幽门螺旋杆菌抗原连接物;
sb4:筛选出效果最优的分子片段进行测试;
所述磁微粒试剂通过包括抗异硫氰酸荧光素羊抗fitc与羧基磁珠偶联物的bsa缓冲溶液;
所述校准品和所述质控品均通过包括以下步骤的操作制备而成:在1l的含bsa缓冲液中加入0.01~0.05g的四环素和0.1~0.5g的硫酸新霉素,然后加入幽门螺旋杆菌抗体并充分溶解;
所述清洗液通过将150~170gnacl、3~5gkcl、24~24.4g三羟甲基氨基甲烷、0.8~1.2ml吐温20溶于900ml双蒸水中,再用hcl调整至ph7.2~7.6,最后用双蒸水定容至1000ml制备而成;
所述发光底物通过将alps溶解于缓冲液中制备而成。
进一步的,所述抗试剂缓冲液通过包括以下步骤的操作制备而成:准确称取如下组分:10~20gna2po3h·12h2o、1~2gnapo3h2·12h2o、3~10g新生牛血清;将称得的各组分加入1l的纯化水中,充分搅拌至完全溶解;调节ph值为5~6即得。
进一步的,调节ph值的试剂为4m的hcl。
进一步的,sa2在避光条件下操作。
进一步的,所述校准品和所述质控品均经过0.22μm滤膜处理。
进一步的,所述磁微粒试剂通过包括以下步骤的操作制备而成:
sc1:将充分混匀后的羧基磁珠浓缩液在磁场内放置15~20min,待羧基磁珠全部沉降后吸去上清,向所述羧基磁珠中加入所述羧基磁珠体积2~5倍的磁微粒缓冲液,震荡清洗20~30min后在磁场内放置15~20min再吸去上清;重复清洗羧基磁珠1~3遍;最后将羧基磁珠混合液定容到10~50mg/ml,制得羧基磁珠溶液;
sc2:向所述羧基磁珠溶液中加入所述羧基磁珠溶液质量0.8~1.2%的抗异硫氰酸荧光素羊抗fitc,在2~8℃内保持混匀状态反应16~20h;
sc3:将sc2制得的溶液在磁场中放置12~18min,待所述羧基磁珠沉降后用磁微粒缓冲液洗1~3遍,随后定容至8~12mg/ml,2~8℃保存。
进一步的,所述磁微粒缓冲液通过将12.12~15.26mg的tris、5.82~8.58mg的nacl和50~60g的甲基纤维醚加入到1l纯化水中,充分搅拌至完全溶解制备而成。
上述任一项所述的检测血清中幽门螺旋杆菌抗体含量的试剂盒的使用方法,包括以下步骤:
sd1:取三支试管分别加30μl所述校准品、30μl所述质控品、30μl待测样本;
sd2:向每支试管中加入30μl抗试剂a和30μl抗试剂b,用塑料薄膜覆盖试管,轻轻振荡试管30s,置于37℃下水浴5min;
sd3:再向每支试管中加入30μl磁微粒试剂,用塑料薄膜覆盖试管,轻轻振荡试管30s,置37℃下水浴5min;
sd4:将所有试管在磁分离器上沉淀3min,缓慢地倒转所述试管和所述磁分离器,倒出上清液;把倒转的所述试管连同所述磁分离器一起,放在滤纸上,拍击所述磁分离器底部除去粘在管壁上的所有液滴;
sd5:向每支试管中加入300μl所述清洗液,用塑料薄膜覆盖试管,轻轻振荡试管30s,混匀后缓慢的倒转试管和磁分离器,倒出上清液,把倒转的所述试管连同所述磁分离器一起,放在滤纸上,用力拍击分离器底部以除去粘在管壁上的所有液滴;
sd6:向每支试管中加入200μl所述发光底物,振荡混匀3s,用化学发光仪检测发光强度。
进一步的,sd2的操作中还向每支试管中加入对应试管中溶液重量0.01~0.5%表面活性剂;所述表面活性剂为tween20、tritonx-100、bronidox中的一种或多种。
进一步的,sd5的操作后还包括sd5.1:重复sd5的操作1~3次。
本发明具有如下优点:
1.本发明将化学发光技术与免疫磁微粒相结合,提供了一种接近均相的反应体系,并且采用了一步法反应模式,使得包括灵敏度、精密性、检测范围在内的检测性能大大提高,反应时间大大缩短,从开始加样到检测结果,时间少于35min,明显快于同类试剂盒;
2.提供了一种新的fitc抗体与磁微粒偶联方法,该方法偶联效率高,结合牢固,且工艺稳定,在提高产品性能的同时,大大降低了产品成本。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
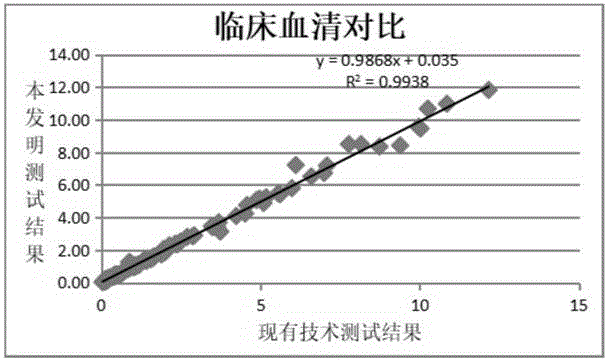
图1为本发明试剂盒与市售幽门螺旋杆菌抗体试剂盒检测结果的相关性。
具体实施方式
下面结合附图对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,在以下说明中,省略了对公知结构、技术及操作的描述,以避免不必要地混淆本发明的概念。另外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
本发明中,未特别注明单位的比例与含量,固体组分为质量比例与含量,液体组分为体积比例与含量。
实施例1
检测血清中幽门螺旋杆菌抗体含量的试剂盒,包括相互独立包装的抗试剂a、抗试剂b、磁微粒试剂、校准品、质控品、清洗液和发光底物;
抗试剂a为包括异硫氰酸荧光素标记的幽门螺旋杆菌抗体连接物的bsa缓冲溶液;抗试剂a通过包括以下步骤的操作制备而成:
sa1:用抗试剂缓冲液将异硫氰酸荧光素配制成浓度为1.0mg/ml的异硫氰酸荧光素溶液;
其中,抗试剂缓冲液通过包括以下步骤的操作制备而成:准确称取如下组分:10gna2po3h·12h2o、1gnapo3h2·12h2o、3g新生牛血清;将称得的各组分加入1l的纯化水中,充分搅拌至完全溶解;用4m的hcl调节ph值为5制得;
sa2:避光条件下,向幽门螺旋杆菌抗体中加入幽门螺旋杆菌抗体质量1.1倍的异硫氰酸荧光素溶液并充分混合;
sa3:用ph为8的碳酸盐缓冲液调节ph平衡,再用凝胶层析分离纯化制得异硫氰酸荧光素标记的幽门螺旋杆菌抗体包被抗体;
抗试剂b为包括碱性磷酸酶标记的幽门螺旋杆菌抗原连接物的bsa的缓冲溶液;抗试剂b通过包括以下步骤的操作制备而成:
sb1:用抗试剂缓冲液将碱性磷酸酶配制成浓度为1.0mg/ml的碱性磷酸酶溶液;
sb2:用幽门螺旋杆菌抗原和碱性磷酸酶分别将反应基团分别活化,然后按照摩尔比为碱性磷酸酶:幽门螺旋杆菌抗原为1:1的比例,在催化剂的催化下充分混匀进行偶联反应;
sb3:使用ph为8的tris缓冲液调节ph平衡,再用凝胶柱分离纯化制得碱性磷酸酶标记的幽门螺旋杆菌抗原连接物;
磁微粒试剂通过包括抗异硫氰酸荧光素羊抗fitc与羧基磁珠偶联物的bsa缓冲溶液;磁微粒试剂通过包括以下步骤的操作制备而成:
sc1:将充分混匀后的羧基磁珠浓缩液在磁场内放置15min,待羧基磁珠全部沉降后吸去上清,向羧基磁珠中加入述羧基磁珠体积2倍的磁微粒缓冲液,震荡清洗20min后在磁场内放置15min再吸去上清;重复清洗羧基磁珠1遍;最后将羧基磁珠混合液定容到10mg/ml,制得羧基磁珠溶液;
sc2:向羧基磁珠溶液中加入羧基磁珠溶液质量0.8%的抗异硫氰酸荧光素羊抗fitc,在2℃内保持混匀状态反应16h;
sc3:将sc2制得的溶液在磁场中放置12min,待羧基磁珠沉降后用磁微粒缓冲液洗1遍,随后定容至8mg/ml,2℃保存;
其中,磁微粒缓冲液通过将12.12mg的tris、5.82mg的nacl和50g的甲基纤维醚加入到1l纯化水中,充分搅拌至完全溶解制备而成;
校准品和质控品均通过包括以下步骤的操作制备而成:在1l的含bsa缓冲液中加入0.01g的四环素和0.1g的硫酸新霉素,然后加入幽门螺旋杆菌抗体并充分溶解,经过0.22μm滤膜处理;
清洗液通过将150gnacl、3gkcl、24g三羟甲基氨基甲烷、0.8ml吐温20溶于900ml双蒸水中,再用hcl调整至ph7.2,最后用双蒸水定容至1000ml制备而成;
发光底物通过将alps溶解于缓冲液中制备而成。
实施例2
检测血清中幽门螺旋杆菌抗体含量的试剂盒,包括相互独立包装的抗试剂a、抗试剂b、磁微粒试剂、校准品、质控品、清洗液和发光底物;
抗试剂a为包括异硫氰酸荧光素标记的幽门螺旋杆菌抗体连接物的bsa缓冲溶液;抗试剂a通过包括以下步骤的操作制备而成:
sa1:用抗试剂缓冲液将异硫氰酸荧光素配制成浓度为3.0mg/ml的异硫氰酸荧光素溶液;
其中,抗试剂缓冲液通过包括以下步骤的操作制备而成:准确称取如下组分:15gna2po3h·12h2o、1.5gnapo3h2·12h2o、6g新生牛血清;将称得的各组分加入1l的纯化水中,充分搅拌至完全溶解;用4m的hcl调节ph值为5.5制得;
sa2:避光条件下,向幽门螺旋杆菌抗体中加入幽门螺旋杆菌抗体质量1.3倍的异硫氰酸荧光素溶液并充分混合;
sa3:用ph为8.5的碳酸盐缓冲液调节ph平衡,再用凝胶层析分离纯化制得异硫氰酸荧光素标记的幽门螺旋杆菌抗体包被抗体;
抗试剂b为包括碱性磷酸酶标记的幽门螺旋杆菌抗原连接物的bsa的缓冲溶液;抗试剂b通过包括以下步骤的操作制备而成:
sb1:用抗试剂缓冲液将碱性磷酸酶配制成浓度为3.0mg/ml的碱性磷酸酶溶液;
sb2:用幽门螺旋杆菌抗原和碱性磷酸酶分别将反应基团分别活化,然后按照摩尔比为碱性磷酸酶:幽门螺旋杆菌抗原为1:2的比例,在催化剂的催化下充分混匀进行偶联反应;
sb3:使用ph为8.5的tris缓冲液调节ph平衡,再用凝胶柱分离纯化制得碱性磷酸酶标记的幽门螺旋杆菌抗原连接物;
磁微粒试剂通过包括抗异硫氰酸荧光素羊抗fitc与羧基磁珠偶联物的bsa缓冲溶液;磁微粒试剂通过包括以下步骤的操作制备而成:
sc1:将充分混匀后的羧基磁珠浓缩液在磁场内放置18min,待羧基磁珠全部沉降后吸去上清,向羧基磁珠中加入述羧基磁珠体积4倍的磁微粒缓冲液,震荡清洗25min后在磁场内放置18min再吸去上清;重复清洗羧基磁珠2遍;最后将羧基磁珠混合液定容到30mg/ml,制得羧基磁珠溶液;
sc2:向羧基磁珠溶液中加入羧基磁珠溶液质量1%的抗异硫氰酸荧光素羊抗fitc,在4℃内保持混匀状态反应18h;
sc3:将sc2制得的溶液在磁场中放置15min,待羧基磁珠沉降后用磁微粒缓冲液洗2遍,随后定容至10mg/ml,4℃保存;
其中,磁微粒缓冲液通过将14.26mg的tris、6.58mg的nacl和55g的甲基纤维醚加入到1l纯化水中,充分搅拌至完全溶解制备而成;
校准品和质控品均通过包括以下步骤的操作制备而成:在1l的含bsa缓冲液中加入0.03g的四环素和0.3g的硫酸新霉素,然后加入幽门螺旋杆菌抗体并充分溶解,经过0.22μm滤膜处理;
清洗液通过将160gnacl、4gkcl、24.2g三羟甲基氨基甲烷、1ml吐温20溶于900ml双蒸水中,再用hcl调整至ph7.4,最后用双蒸水定容至1000ml制备而成;
发光底物通过将alps溶解于缓冲液中制备而成。
实施例3
检测血清中幽门螺旋杆菌抗体含量的试剂盒,包括相互独立包装的抗试剂a、抗试剂b、磁微粒试剂、校准品、质控品、清洗液和发光底物;
抗试剂a为包括异硫氰酸荧光素标记的幽门螺旋杆菌抗体连接物的bsa缓冲溶液;抗试剂a通过包括以下步骤的操作制备而成:
sa1:用抗试剂缓冲液将异硫氰酸荧光素配制成浓度为5.0mg/ml的异硫氰酸荧光素溶液;
其中,抗试剂缓冲液通过包括以下步骤的操作制备而成:准确称取如下组分:20gna2po3h·12h2o、2gnapo3h2·12h2o、10g新生牛血清;将称得的各组分加入1l的纯化水中,充分搅拌至完全溶解;用4m的hcl调节ph值为6制得;
sa2:避光条件下,向幽门螺旋杆菌抗体中加入幽门螺旋杆菌抗体质量1.5倍的异硫氰酸荧光素溶液并充分混合;
sa3:用ph为9的碳酸盐缓冲液调节ph平衡,再用凝胶层析分离纯化制得异硫氰酸荧光素标记的幽门螺旋杆菌抗体包被抗体;
抗试剂b为包括碱性磷酸酶标记的幽门螺旋杆菌抗原连接物的bsa的缓冲溶液;抗试剂b通过包括以下步骤的操作制备而成:
sb1:用抗试剂缓冲液将碱性磷酸酶配制成浓度为5.0mg/ml的碱性磷酸酶溶液;
sb2:用幽门螺旋杆菌抗原和碱性磷酸酶分别将反应基团分别活化,然后按照摩尔比为碱性磷酸酶:幽门螺旋杆菌抗原为1:3的比例,在催化剂的催化下充分混匀进行偶联反应;
sb3:使用ph为9的tris缓冲液调节ph平衡,再用凝胶柱分离纯化制得碱性磷酸酶标记的幽门螺旋杆菌抗原连接物;
磁微粒试剂通过包括抗异硫氰酸荧光素羊抗fitc与羧基磁珠偶联物的bsa缓冲溶液;磁微粒试剂通过包括以下步骤的操作制备而成:
sc1:将充分混匀后的羧基磁珠浓缩液在磁场内放置20min,待羧基磁珠全部沉降后吸去上清,向羧基磁珠中加入述羧基磁珠体积5倍的磁微粒缓冲液,震荡清洗30min后在磁场内放置20min再吸去上清;重复清洗羧基磁珠3遍;最后将羧基磁珠混合液定容到50mg/ml,制得羧基磁珠溶液;
sc2:向羧基磁珠溶液中加入羧基磁珠溶液质量1.2%的抗异硫氰酸荧光素羊抗fitc,在8℃内保持混匀状态反应20h;
sc3:将sc2制得的溶液在磁场中放置18min,待羧基磁珠沉降后用磁微粒缓冲液洗3遍,随后定容至12mg/ml,8℃保存;
其中,磁微粒缓冲液通过将15.26mg的tris、8.58mg的nacl和60g的甲基纤维醚加入到1l纯化水中,充分搅拌至完全溶解制备而成;
校准品和质控品均通过包括以下步骤的操作制备而成:在1l的含bsa缓冲液中加入0.05g的四环素和0.5g的硫酸新霉素,然后加入幽门螺旋杆菌抗体并充分溶解,经过0.22μm滤膜处理;
清洗液通过将170gnacl、5gkcl、24.4g三羟甲基氨基甲烷、1.2ml吐温20溶于900ml双蒸水中,再用hcl调整至ph7.6,最后用双蒸水定容至1000ml制备而成;
发光底物通过将alps溶解于缓冲液中制备而成。
实施例4
实施例1~3中任一项的检测血清中幽门螺旋杆菌抗体含量的试剂盒的使用方法,以实施例2制备的检测血清中幽门螺旋杆菌抗体含量的试剂盒检测来检测血清中幽门螺旋杆菌抗体含量,包括以下步骤:
1、样本采集
采用正确医用技术收集血清(严重溶血或脂血的样本不能用于测定),收集后的样本在室温放置不可超过8小时;如果不在8小时内检测需将样本放置于2~8℃的冰箱中;若需72小时以上保存或运输,则应冻存于-20℃以下,避免反复冻融。使用前回复到室温,轻轻摇动混匀。
2、实验前准备
2.1取一瓶浓缩洗液用蒸馏水进行15倍稀释;
2.2将恒温箱或水浴锅温度调至37℃,待温度稳定后使用;
2.3将磁微粒混悬液充分混匀至无肉眼可见沉淀。
3、检测操作
sd1:取三支试管,编号,分别加30μl校准品、30μl质控品、30μl待测样本;
sd2:向每支试管中加入30μl抗试剂a、30μl抗试剂b和表面活性剂,用塑料薄膜覆盖试管,轻轻振荡试管30s,置于37℃下水浴5min;
其中,表面活性剂为tween20,具体实施时,还可以用tritonx-100或bronidox代替,并且表面活性剂在对应试管中溶液重量中占0.2%,具体实施时可以在0.01~0.5%之间任意选择;
sd3:再向每支试管中加入30μl磁微粒试剂,用塑料薄膜覆盖试管,轻轻振荡试管30s,置37℃下水浴5min;
sd4:将所有试管在磁分离器上沉淀3min,缓慢地倒转试管和磁分离器,倒出上清液;把倒转的试管连同磁分离器一起,放在滤纸上,拍击磁分离器底部除去粘在管壁上的所有液滴;
sd5:向每支试管中加入300μl清洗液,用塑料薄膜覆盖试管,轻轻振荡试管30s,混匀后缓慢的倒转试管和磁分离器,倒出上清液,把倒转的试管连同磁分离器一起,放在滤纸上,用力拍击分离器底部以除去粘在管壁上的所有液滴;具体实施时还可以重复本部操作1~3次;
sd6:向每支试管中加入200μl发光底物,振荡混匀3s,用化学发光仪检测发光强度。
采用四参数拟合方式,以校准品浓度值为x轴,以校准品发光强度值为y轴,建立定标曲线,根据待测样本的发光强度值回算相应的浓度值。
将本发明试剂盒按照方法学鉴定,可达到如下指标:
标准曲线线性:r>0.9900;
最低检测限:≤0.1u/ml;
准确度:添加回收率85~115%;
重复性:变异系数cv≤8%;
批间差:变异系数≤15%;
线性稀释:r大于0.9900。
如图1所示,将100份血清样本测值与市售幽门螺旋杆菌抗体检测试剂盒a对比,比较本发明试剂盒与市售幽门螺旋杆菌抗体试剂盒检测结果的相关性很好。
以上结合附图对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,在没有做出创造性劳动前提下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!