基于近场太赫兹病变生物组织高分辨检测的方法与流程
本发明涉及生物组织光谱成像检测领域,特别涉及基于近场太赫兹病变生物组织高分辨检测的方法。
背景技术:
太赫兹波(teraherz,thz)对水分含量和生物分子类别和结构变化及其敏感,且不易对生物体产生电离危害,因而十分有利于生物医学的诊断研究,尤其是生物组织检测研究。
相对于传统的组织病理切片和免疫组化等基于化学染色检测的技术,基于太赫兹光谱成像技术的组织病变探测不需要对样品进行任何染色处理,且能够从生物分子层面揭示丰富的关于样品的物理及化学信息,给出客观的、准确的检测结果。目前,传统太赫兹光谱成像技术已被开始应用于生物组织,尤其是病变组织的检测研究。然而,由于受“瑞利”准则的光学衍射极限限制,传统太赫兹成像的空间分辨率无法突破半波长限制,其成像空间分辨率通常在毫米或亚毫米量级,无法实现对组织样品的精确检测,从而大大限制了太赫兹技术在生物组织,特别是病变生物组织检测方面的应用。
公开于该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术人员所公知的现有技术。
技术实现要素:
本发明的目的在于提供一种基于近场太赫兹病变生物组织高分辨检测的方法,从而克服病变生物组织成像分辨率低、病变组织检测精确度低的缺点。
为实现上述目的,本发明提供了一种基于近场太赫兹病变生物组织高分辨检测的方法,包括以下步骤:
(1)近场探测器选择:选择能实现优于半波长空间分辨探测的太赫兹探测器;
(2)近场模式选择;
(3)样品处理,将生物组织的细胞切片平整置于带有微纳结构的载玻片上,然后置于抽真空的负压贴合装置内,抽真空一段时间,组织细胞切片与载玻片贴合;
(4)将贴合好的载玻片置于近场太赫兹光谱仪的载物台上,移动载物台至针尖下部,调整z轴位移,确保生物组织的细胞切片与针尖距离保持微米级后,按近场太赫兹光谱成像检测方法进行检测,获取生物组织细胞太赫兹光谱及特征物质的光谱图像。
优选地,上述技术方案中,步骤(1)太赫兹探测器包括光电导微天线探针。
优选地,上述技术方案中,步骤(2)中近场模式选择包括:远场太赫兹源照射-近场探针探测透射模式、近场太赫兹源照射-近场探针探测透射模式、远场太赫兹源探测-近场探针探测反射模式、近场太赫兹源照射-近场探针探测反射模式。
优选地,上述技术方案中,步骤(3)所述载玻片上设有谐振环,该谐振环能够与所述太赫兹探测器的探针之间产生共振。
优选地,上述技术方案中,所述谐振环为金属材质制成,所述谐振环开口环线宽度为150-250μm,高度120-170nm,开口缝隙为4-8μm。
优选地,上述技术方案中,所述负压贴合装置包括密封盒盒体,所述密封盒盒体一端设有吸气接口,另一端设有密封盖,所述密封盒体内设有载物台,用于摆放载玻片。
优选地,上述技术方案中,步骤(3)中生物组织为人体或动物发生病变的组织。
优选地,上述技术方案中,所述病变的组织包括肺癌组织、脑肿瘤组织、皮肤癌组织、胃癌组织、黑色素瘤组织。
优选地,上述技术方案中,步骤(3)中细胞切片包括包埋切片、冷冻切片和直接切片。
优选地,上述技术方案中,所述包埋切片的制备方法包括:先固定组织细胞的固有形态,再用水冲洗已经固定的组织细胞块10-20min,然后用包埋剂对组织细胞进行包埋,包埋5-8h后取出,置于切片机内,切片机温度设置为-30--20℃,放置30-60min,然后进行切片,得到百微米级以下尺寸的切片;
优选地,上述技术方案中,所述冷冻切片的制备方法包括:将生物组织-90--70℃的条件下20-60min,取出置于切片机内,然后进行切片,得到百微米级以下尺寸的切片。
优选地,上述技术方案中,步骤(4)中生物组织的细胞切片与针尖距离保持在10μm及以下。
与现有技术相比,本发明具有如下有益效果:
(1)本发明基于近场太赫兹病变生物组织高分辨检测的方法,选择采用近场检测方法,然后确定选择该方法下的检测模式,根据不同的模式对生物组织进行处理,最后进行近场太赫兹光谱检测,通过不同的扫描方式,可以得到点光谱、二维扫描成像光谱和三维扫描成像光谱。利用本发明的方法可以得到高分辨的生物组织成像及特征光谱,为生物组织的病变和其机理研究提供一种高分辨的全新检测技术。
(2)本发明的方法能够对突破光学衍射极限,使得空间分辨率优于半波长,可以达到几微米,为生物组织的病变检测、边界划分和机理研究提供一种新的检测手段。
附图说明
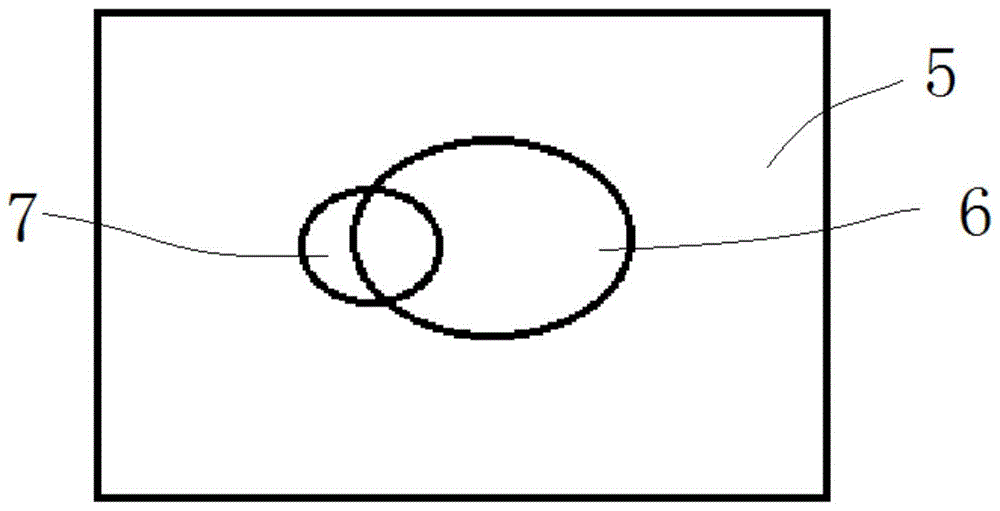
图1-(a)至图1-(b)是普通和近场太赫兹显微镜分辨率示意图;
图1-(a)是传统太赫兹成像技术在病变组织检测中具有不同空间分辨能力的原理示意图;
图1-(b)是本发明近场太赫兹成像技术在病变组织检测中具有不同空间分辨能力的原理示意图;
图2-(a)至图2-(d)是根据本发明近场太赫兹生物检测模式的结构示意图;
图2-(a)是透视式,远场太赫兹源辐射与近场探针探测的结构示意图;
图2-(b)是透视式,近场太赫兹源辐射与近场探针探测的结构示意图;
图2-(c)是反射式,远场太赫兹源辐射与近场探针探测的结构示意图;
图2-(d)是反射式,近场太赫兹源辐射与近场探针探测的结构示意图;
图3是根据本发明带有微纳结构载玻片的结构示意图;
图4是根据本发明负压贴合装置的结构示意图;
图5是根据本发明负压贴合装置的主视图。
具体实施方式
下面结合附图,对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。
除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或组成部分,而并未排除其它元件或其它组成部分。
如图1-(a)至图5所示,根据本发明具体实施方式的一种基于近场太赫兹病变生物组织高分辨检测的方法,包括以下步骤:
(1)近场探测器选择:选择能实现优于半波长空间分辨探测的太赫兹探测器,例如光电导微天线探测针;
(2)近场模式选择;近场模式选择包括:远场太赫兹源照射-近场探针探测透射模式、近场太赫兹源照射-近场探针探测透射模式、远场太赫兹源探测-近场探针探测反射模式、近场太赫兹源照射-近场探针探测反射模式。
其中,太赫兹源包括光电导天线、量子级联激光器、固态源等能够发射太和磁波的任何辐射源。
如图2-(a)所示,远场太赫兹源照射-近场探针探测透射模式:由远场太赫兹源1辐射出太赫兹波透射样品2,样品2放置在载玻片3上,再由近场探针4探测信号,该模式下,需要对样品进行切片处理,样品厚度的厚度与太赫兹源的功率和样品的性质有关,通常在百微米级。
如图2-(b)所示,近场太赫兹源照射-近场探针探测透射模式:由近场太赫兹源辐射出太赫兹波透射样品2,样品2放置在载玻片3上,再由近场探针4探测信号,该模式下,需要对样品进行切片处理,样品厚度的厚度与太赫兹源的功率和样品的性质有关,通常在百微米级。
远场太赫兹源探测-近场探针探测反射(散射式)模式:由远场太赫兹源辐射出太赫兹波从侧面照射样品2,样品2放置在载玻片3上,再由近场探针4探测信号,该模式下,可以直接进行探测。图2-(c)仅是为了说明示意,入射太赫兹波与探针角度并不仅限于如图所示,其位置角度关系能实现太赫兹波与探针耦合即可。
近场太赫兹源照射-近场探针探测反射模式:由近场太赫兹源辐射出太赫兹波从侧面照射样品2,样品2放置在载玻片3上,再由近场探针4探测信号,该模式下,可以直接进行探测。图4-(d)仅是为了说明示意,入射太赫兹波与探针角度并不仅限于如图所示,其位置角度关系能实现太赫兹波与探针耦合即可。
(3)样品处理:选择的样品为生物组织,生物组织为人体或动物发生病变的组织。病变的组织包括肺癌组织、脑肿瘤组织、皮肤癌组织、胃癌组织、黑色素瘤组织等人体或动物发生病变的组织。将生物组织的细胞切片平整置于带有微纳结构的载玻片上,然后将载玻片置于抽真空的负压贴合装置内,抽真空-30kpa,保持10分钟,组织细胞切片与载玻片紧密贴合。切片与载玻片(可以带微纳结构对太赫兹信号进行增强)紧密贴合,更好的实现等离子体共振,增强生物组织太赫兹特征信号提供支撑进行最后近场太赫兹光谱成像检测。
(4)近场探测:将贴合好的载玻片置于近场太赫兹光谱仪的载物台上,移动载物台至针尖下部,设置x、y平面的扫描步骤,自动动态调整针尖与样品间的距离,即调整针尖的z轴位移,生物组织的细胞切片与针尖距离保持在10μm以下。在保证探针安全的情况下,尽可能的接近待测样品,进行太赫兹光谱扫描。扫描完后根据生物组织的特征光谱进行成像,图像不仅带有生物组织物质结构的太赫兹光谱信息,而且图像能够对不同物质进行高精度的区分和边界识别。
进行近场探测时,设置太赫兹光谱仪x、y平面的扫描步距,进行太赫兹扫描光谱成像。进一步,同时设置x、y平面扫描步距和z轴上下进行扫描成像,可以得到太赫兹三维扫描成像。
如图1所示,普通和近场太赫兹显微镜分辨率示意图。图1-(a)中图中方框5代表生物组织,椭圆部分6代表已经病变的组织,圆圈7部分代表不同显微镜的分辨率。左边可以看出,普通太赫兹显微镜不能突破衍射极限,分辨率低,光斑大,对于病变组织和正常组织不能很好的区分,很难准确的找出病变组织的边界,而右边的近场太赫兹显微镜分辨率高,可以达到几微米的分辨,光斑小,进行扫描成像的时候能很好的区分病变组织与正常组织,精确的找出病变的组织边界。
优选地,如图3所示,载玻片3上的微纳结构为谐振环31,该谐振环31能够与所述太赫兹探测器的探针4之间产生共振,增强生物组织太赫兹特征信号,增大了信噪比。
优选地,谐振环31利用刻蚀、溅射等微纳加工手段制备而成。优选地,谐振环为金、银等金属材料制成,谐振环31开口环线宽度为150-250μm,高度120-170nm,开口缝隙为4-8μm。本实施例的谐振环31正方形、圆形等结构,也可以是任何可以引起太赫兹共振的几何结构。
优选地,如图4和图5所示,负压贴合装置8包括密封盒体81,所述密封盒体81一端设有吸气接口82,吸气接口82外接空压机,通过空压机对密封盒体进行抽真空,真空压力为-30kpa。密封盒体另一端设有密封盖83,密封盖83内设有密封橡胶环84,增加了密封盒体81的密封性。密封盒体81内设有载物台85,工作用,将载玻片房子与载物台85上。密封盒体81里面设有多组载物台85,在本实施例中有3组载物台。
优选地,步骤(3)中细胞切片包括包埋切片、冷冻切片和直接切片。
包埋切片的制备方法包括:使用稀释的多聚甲醛溶液固定,也可以用其它方法固定,目的是保持组织细胞的固有形态,避免组织自溶和腐烂等。水洗,用去离子水冲洗已经固定的组织细胞块10-20min。包埋,组织细胞被oct包埋剂包埋,也可以是包括石蜡等物质进行包埋,包埋5-8h后取出,用刀片切除组织四周多余的包埋剂。切片,将包埋体固定在切片机内,切片机温度设置为-30--20℃,放置30-60min,然后进行切片,得到百微米级及以下尺寸的切片。
冷冻切片的制备方法包括:将生物组织-90--70℃的条件下20-60min,取出置于切片机内,然后进行切片,得到百微米级以下尺寸的切片。(切片后5分钟内完成后续操作)。
直接切片的制备方法为:生物组织不经过任何处理,直接进行切片处理。切片尽可能的保证切片厚度均匀,表面平整。
前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
- 还没有人留言评论。精彩留言会获得点赞!