食源性致病菌检测用线基电化学生物传感器及其制备方法及食源性致病菌的检测方法与流程
本发明涉及食品安全领域,具体涉及一种食源性致病菌检测用线基电化学生物传感器及其制备方法及食源性致病菌的检测方法。
背景技术:
食源性疾病指的是通过摄食受污染食物、致病菌、病毒或毒素等所引起的感染性、中毒性疾病。其中,食源性致病菌主要包括肠道沙门氏菌、大肠杆菌、李斯特菌和弯曲杆菌属。人感染食源性致病菌后,轻则腹泻、胃部痉挛或呕吐,重则出现严重后遗症或并发症。
根据中国国家卫生计生办公厅通报的2015年(2016-2017年未统计)全国食物中毒事件情况,全国食物中毒类突发公共卫生事件报告169起,中毒6015人,死亡121人。其中,报告起数和中毒人数最多的就是食源性致病菌食物中毒,分别占39.6%和56.9%。可见,食源性致病菌引起的疾病是影响食品安全的最主要因素之一,给卫生医疗系统造成巨大压力同时阻碍经济、旅游和贸易的发展。因此,食源性致病菌快速检测方法的发展对应对和控制食源性疾病的爆发至关重要。食源性致病菌的快速检测方法在我国生物/医学研究、疾病防治、食品安全等方面具有巨大的潜力,也因而拥有突出的社会、经济价值。但是,目前研究人员在研制低成本的便携式食源性致病菌的快速检测方法上还面临很多的困难。
随着微流控(microfluidics,又称为芯片实验室,lab-on-a-chip)技术和电化学纳米生物传感器的日益成熟,将微流控和电化学纳米生物传感器相结合引入到传统食源性致病菌检测中,从而找出一种基于微流控和电化学生物传感器的便携式食源性致病菌快速检测新方法具有很强的现实意义。但目前绝大多数微流控芯片制作过程较为复杂,对芯片要求高,导致生产成本增加,不利于大规模推广应用。而且,现有的检测传感器一般只能在专门的实验室中检测,必须将样品送检到实验室,十分不便,而且检测过程较为复杂,检测结果的灵敏度也有待进一步提高。
技术实现要素:
为了解决现有技术存在的问题,本发明提供了一种食源性致病菌检测用线基电化学生物传感器及其制备方法及食源性致病菌的检测方法,本发明将线基微流控芯片与电化学纳米生物材料相结合得到线基电化学生物传感器,具有简单、快速、灵敏度高的特点,制备方法简单,同时能够脱离实验室环境,从而弥补了现有检测方法的不足。
本发明解决上述技术问题的技术方案如下:
一种食源性致病菌检测用线基电化学生物传感器的制备方法,包括:
(1.1)制作线基支撑电极并构建线基微流控通道,将线基微流控通道与线基支撑电极连通并置于基底上;
(1.2)将二维片状纳米材料加入至多聚-l-赖氨酸溶液中搅拌,静置,得到修饰后的二维片状纳米材料,然后将修饰后的二维片状纳米材料涂覆到线基支撑电极上以修饰线基支撑电极,再将食源性致病菌的适配子溶液滴加在修饰后的线基支撑电极上,静置,清洗,得到线基电化学生物传感器。
本发明省去了传统微流控芯片和纸基微流控芯片的复杂制作过程以及对芯片高要求的制作条件,在制备时只需对构建微流控通道网格的线基材料做亲水处理(在等离子清洗机中处理2-5min)即可,具有成本低、加工简易、使用和携带方便等优点。本发明的线基纳米电化学生物传感器其生物相容性好,柔性和可塑性强,且非常环保。
本发明用二维片状纳米材料修饰电极,利用二维片状纳米材料极佳的比表面积将作为探针的适配子进行固定,能够增加固定的适配子数量,从而实现电化学信号的增强,进而提高检测灵敏度。在用二维片状纳米材料修饰电极之前,先用多聚-l-赖氨酸(pll)溶液对二维片状纳米材料进行处理,利用电沉积的原理,将二维片状纳米材料与电极很好地结合。用多聚-l-赖氨酸溶液对二维片状纳米材料进行处理后,可利用zeta电势检测和ftir检测验证修饰结果。后续加入的适配子溶液通过静电作用与二维片状纳米材料形成化学键-离子键得以结合固定。由此,实现二维片状纳米材料和适配子在电极上的构建,获得能够快速、灵敏检测的二维片状纳米材料-适配子-食源性致病菌的线基纳米电化学生物传感器。本发明采用的二维片状纳米材料包括但不限于石墨烯、黑磷和二硫化钼纳米片。
需要说明的是,本发明的适配子溶液是根据待检测的食源性致病菌来确定的。也即是,针对不同的食源性致病菌制得不同的线基电化学生物传感器。食源性致病菌包括但不限于:副溶血性弧菌、大肠杆菌、李斯特菌和沙门氏菌,其对应的适配子的筛选通过selex技术(即指数富集的配体系统进化技术,systematicevolutionofligandsbyexponentialenrichment,selex)进行。大致过程是:首先合成一个随机单链寡核苷酸序列(ssdna)文库,通过筛选介质重复进行寡核苷酸库和靶标分子孵育,寡核苷酸复合物和未结合的寡核苷酸分离和结合序列的pcr扩增,从而把与靶物质有强亲和力的dna或rna分子被分离出来,从而获取高特异性的适配子(也称为适配体)。
进一步地,在本发明较佳的实施例中,步骤(1.1)中,制作线基支撑电极包括:制作工作电极和对电极,分别在纺织线上涂覆碳/石墨油墨并于室温下干燥1.5~2.5h,然后再次涂覆碳/石墨油墨并于50~70℃下干燥9~11h;
制作参比电极,在预处理后的纺织线上涂覆银/氯化银油墨并于室温下干燥1.5~2.5h,然后再次涂覆银/氯化银油墨并于50~70℃下干燥9~11h;
构建线基微流控通道的方式是:将另取一根纺织线,并将其一端拆分成多股,作为线基微流控通道。具体拆分成几股,本领域技术人员根据实际所需的检测单元进行确定。
本发明的线基支撑电极和线基微流控通道采用纺织线为线基材料,通过涂覆导电油墨获得。将线基微流控通道连接在线基支撑电极上,形成反应区域。在将线基微流控通道分别与工作电极、对电极和参比电极连接时,对电极与线基微流控通道的接触面积比工作电极和参比电极与线基微流控通道的接触面积更大,以此保证产生足够的电流信号,从而提高检测灵敏度。由于工作电极和对电极上发生氧化还原反应,工作电极和对电极需保持性质稳定,因而本发明采用不易反应的碳/石墨油墨,而参比电极的作用是与工作电极的电信号相比较,从而使获得的电信号更加稳定,因此参比电极电极采用导电性更好的银/氯化银油墨。
本发明所指的纺织线可以是尼龙线、棉线或丝线。由于尼龙线不容易起毛边,且均一性和浸润性比较好,本发明优选尼龙线作为电极材料;同时,由于棉线成本低且具有良好的亲水性和浸润性,本发明优选棉线作为构建线基微流控通道的线基材料。
碳/石墨油墨,是指由碳和石墨构成的混合油墨。银/氯化银油墨,是指由银和氯化银构成的混合油墨。
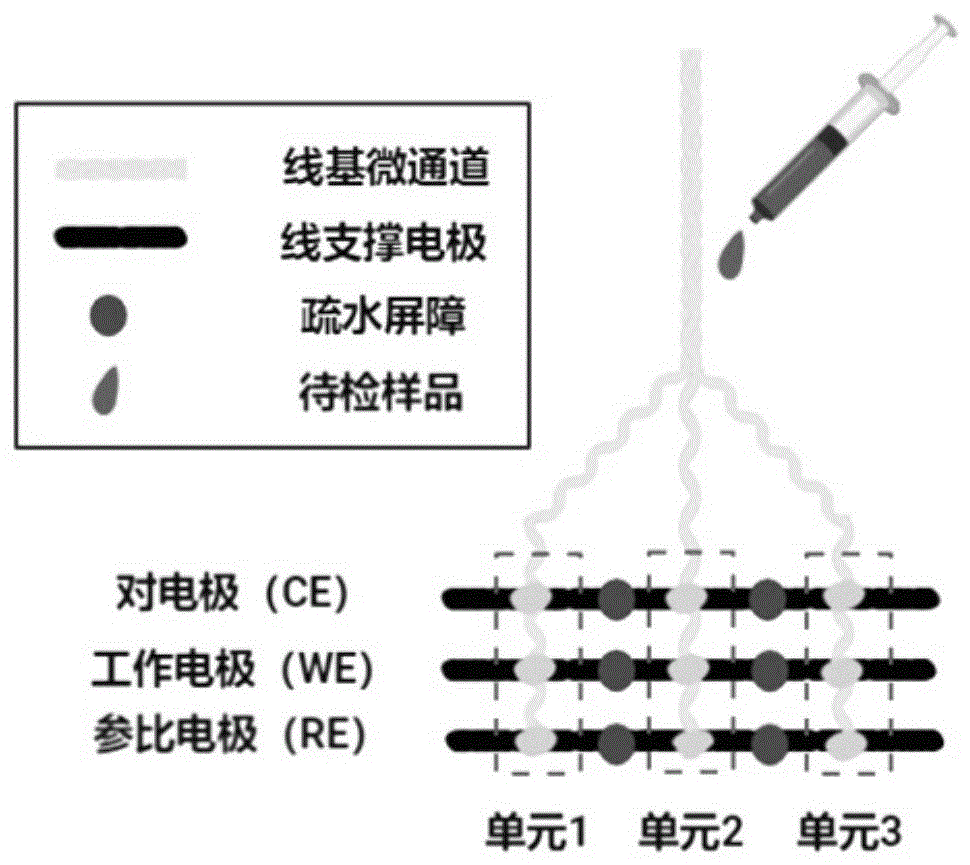
进一步地,在本发明较佳的实施例中,将工作电极、参比电极和对电极平行布置在基底上,将作为线基微流控通道的每股纺织线以垂直于工作电极、参比电极和对电极的方式布置并且分别缠绕在工作电极、参比电极和对电极上。
线基支撑电极与线基微流控通道的连接方式包括但不限于缠绕。在本发明实施例中,缠绕方式操作起来更加快捷、方便。本发明优选棉线作为构建线基微流控通道的线基材料,其成本低且在泵送液体的过程中不需要借助外部泵,只需依靠自身的毛细管力就可以完成。
进一步地,在本发明较佳的实施例中,二维片状纳米材料通过液相剥离法制得。
作为一个优选的实施方式,液相剥离法制备二维片状纳米材料的具体过程为:将二硫化钼粉末与去离子水混合,配制成3mg/ml的二硫化钼水溶液,将二硫化钼水溶液置于超声波冰水浴(37khz)进行“清洗”8小时,最后,将清洗后的混合液进行离心处理以去除未剥离的二硫化钼颗粒,收集上层二硫化钼纳米片备用。
进一步地,在本发明较佳的实施例中,步骤(1.2)中,搅拌时间为50~70min,二维片状纳米材料在多聚-l-赖氨酸溶液中的静置条件为:在3~5℃下静置至少12h;适配子溶液滴加在线基支撑电极上后的静置条件为:室温下静置至少1h。
本发明通过上述特定的搅拌时间和纳米材料的静置条件以及适配子的静置条件,使纳米材料和多聚-l-赖氨酸充分结合并获得的稳定的修饰溶液,同时将适配子充分结合于电极上。
进一步地,在本发明较佳的实施例中,步骤(1.2)中,清洗的具体过程为:用pbs缓冲液清洗线基支撑电极,再用牛血清蛋白封闭液浸泡至少0.5h,再次用pbs缓冲液清洗。
本发明先用pbs缓冲液清洗线基支撑电极其目的是去除未结合的适配子,用牛血清蛋白封闭液浸泡线基支撑电极其目的是减少非特异性吸附,最后再次用pbs缓冲液清洗,以洗净残留的牛血清蛋白封闭液。
上述制备方法制得的食源性致病菌检测用线基电化学生物传感器。
进一步地,在本发明较佳的实施例中,线基电化学生物传感器包括基底、设置在基底上的线基支撑电极以及设置在基底上且垂直于线基支撑电极的线基微流控通道,线基支撑电极包括平行设置的工作电极、参比电极和对电极,线基微流控通道分别缠绕在工作电极、参比电极和对电极上。
一种食源性致病菌的检测方法,采用上述食源性致病菌检测用线基电化学生物传感器进行检测,其包括以下步骤:
(2.1)采用标准浓度的食源性致病菌液制作标准曲线;
(2.2)将待检测食源性致病菌的食物样品进行预处理,得到待检测菌液,将待检测菌液加在线基电化学生物传感器上,孵育,利用电化学工作站检测电流信号值,将得到的信号值与标准曲线对照,得到待检测菌液的浓度。
进一步地,在本发明较佳的实施例中,步骤(2.1)中,制作标准曲线的具体过程为:将标准浓度的食源性致病菌液按浓度梯度稀释成10-107cfu/ml不同浓度的标准菌液,将不同浓度的标准菌液分别加在线基电化学生物传感器上,在37℃下孵育10~15min,利用电化学工作站分别检测传感器的电流信号值,根据得到的电流信号值与菌液浓度的线性关系描绘出标准曲线;步骤(2.2)中,孵育的条件为:37℃下孵育10~15min。
本发明具有以下有益效果:
本发明的传感器通过适配子捕获目标食源菌进行检测,同时通过二维的二维片状纳米材料修饰电极从而增加固定的适配子数量,进而增强电信号、提高检测灵敏度。本发明线基电化学生物传感器采用静电吸附的方法,工艺简单,建立的定性测量方法具有简单快速、特异性强、灵敏度高的特点。该发明适用于食源性致病菌的现场快速检测领域,实用性强,可靠性高,具有很高的实用价值和商业价值。
附图说明
图1为本发明实施例线基电化学生物传感器的结构示意图;
图2为本发明实施例线基电化学生物传感器的构建以及检测原理图;
图3为本发明实施例线基电化学生物传感器的机制验证实验结果图;
图4为本发明实施例液相剥离的二硫化钼纳米材料的扫描电子显微镜照片;
图5为对二维纳米材料(以二硫化钼为例)、二维纳米材料-pll、二维纳米材料-pll-适配子修饰结果的粒径表征结果图;
图6对二维纳米材料(以二硫化钼为例)、二维纳米材料-pll、二维纳米材料-pll-适配子修饰结果的zeta电位图。
具体实施方式
以下结合附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1
一种食源性致病菌检测用线基电化学生物传感器的制备方法,包括:
(1.1)制作线基支撑电极并构建线基微流控通道,将所述线基微流控通道与所述线基支撑电极连通并置于基底上。制作线基支撑电极包括:制作工作电极和对电极,分别在纺织线上多次涂覆碳/石墨油墨,每次涂覆后低温加热后再涂覆;制作参比电极,在预处理后的纺织线上涂覆银/氯化银油墨,高温干燥。构建线基微流控通道是通过在纺织线上涂覆导电油墨得到。将所述工作电极、参比电极和对电极平行布置在基底上,将所述线基微流控通道以垂直于所述工作电极、参比电极和对电极的方式布置并且分别缠绕在所述工作电极、参比电极和对电极上。
(1.2)将液相剥离法制得的二硫化钼纳米材料加入至多聚-l-赖氨酸溶液中搅拌50min,在3℃下静置12h,得到修饰后的二硫化钼纳米材料,然后将修饰后的二硫化钼纳米材料涂覆到所述线基支撑电极上以修饰线基支撑电极,再将食源性致病菌的适配子溶液滴加在修饰后的线基支撑电极上,室温下静置2h,用pbs缓冲液清洗所述线基支撑电极,再用牛血清蛋白封闭液浸泡0.5h,再次用pbs缓冲液清洗,得到线基电化学生物传感器。
实施例2
一种食源性致病菌检测用线基电化学生物传感器的制备方法,包括:
(1.1)制作线基支撑电极并构建线基微流控通道,将所述线基微流控通道与所述线基支撑电极连通并置于基底上。制作线基支撑电极包括:制作工作电极和对电极,分别在纺织线上多次涂覆碳/石墨油墨,每次涂覆后低温加热后再涂覆;制作参比电极,在预处理后的纺织线上涂覆银/氯化银油墨,高温干燥。构建线基微流控通道是通过在纺织线上涂覆导电油墨得到。将所述工作电极、参比电极和对电极平行布置在基底上,将所述线基微流控通道以垂直于所述工作电极、参比电极和对电极的方式布置并且分别缠绕在所述工作电极、参比电极和对电极上。
(1.2)将液相剥离法制得的石墨烯纳米材料加入至多聚-l-赖氨酸溶液中搅拌70min,在5℃下静置15h,得到修饰后的石墨烯纳米材料,然后将修饰后的石墨烯纳米材料涂覆到所述线基支撑电极上以修饰线基支撑电极,再将食源性致病菌的适配子溶液滴加在修饰后的线基支撑电极上,室温下静置4h,用pbs缓冲液清洗所述线基支撑电极,再用牛血清蛋白封闭液浸泡1h,再次用pbs缓冲液清洗,得到线基电化学生物传感器。
实施例3
一种食源性致病菌检测用线基电化学生物传感器的制备方法,包括:
(1.1)制作线基支撑电极并构建线基微流控通道,将所述线基微流控通道与所述线基支撑电极连通并置于基底上。制作线基支撑电极包括:制作工作电极和对电极,分别在纺织线上多次涂覆碳/石墨油墨,每次涂覆后低温加热后再涂覆;制作参比电极,在预处理后的纺织线上涂覆银/氯化银油墨,高温干燥。构建线基微流控通道是通过在纺织线上涂覆导电油墨得到。将所述工作电极、参比电极和对电极平行布置在基底上,将所述线基微流控通道以垂直于所述工作电极、参比电极和对电极的方式布置并且分别缠绕在所述工作电极、参比电极和对电极上。
(1.2)将液相剥离法制得的黑磷纳米材料加入至多聚-l-赖氨酸溶液中搅拌60min,在4℃下静置13h,得到修饰后的黑磷纳米材料,然后将修饰后的黑磷纳米材料涂覆到所述线基支撑电极上以修饰线基支撑电极,再将食源性致病菌的适配子溶液滴加在修饰后的线基支撑电极上,室温下静置3h,用pbs缓冲液清洗所述线基支撑电极,再用牛血清蛋白封闭液浸泡1h,再次用pbs缓冲液清洗,得到线基电化学生物传感器。
实施例4
请参照图1,本发明实施例的食源性致病菌检测用线基电化学生物传感器,其包括基底(图未示)、线基支撑电极和线基微流控通道。基底材质包括但不限于石蜡,本领域技术人员可以根据实际情况进行适应选择。线基支撑电极设置在所述基底上。线基微流控通道设置在所述基底上且垂直于所述线基支撑电极。线基支撑电极和线基微流控通道均采用纺织线涂覆导电油墨制得。具体如上述实施例1~3中所记载。所述线基支撑电极包括平行设置的工作电极、参比电极和对电极。所述线基微流控通道分别缠绕在所述工作电极、参比电极和对电极上。本发明实施例设置三个检测单元(对应纺织线的一端拆分成三股),能够实现对样品的多重检测,实现多种细菌同时检测,同时检测沙门氏菌、副溶血弧菌、大肠杆菌等细菌。
实施例5:利用线基电化学纳米生物传感器检测沙门氏菌
一种食源性致病菌的检测方法,包括以下步骤:
参照图2,首先,利用selex技术筛选得到沙门氏菌的适配子,然后将适配子与事先剥离好的二维片状纳米材料通过静电吸附的作用固定在电化学芯片的工作电极上,同时用pbs缓冲溶液进行冲洗。
其次,配置已知浓度的沙门氏菌标准液,按浓度梯度稀释成10-107cfu/ml不同浓度的菌液。将制备好的不同浓度的菌液,分别滴加到含有纳米生物传感器的电化学芯片上,37℃孵育10min。孵育完成后,利用电化学工作站分别检测电化学芯片的dpv值,并得到电流峰值增量δi(菌液固定前后峰值电流差)与菌液浓度c0的线性关系曲线,从而建立电流峰值增量δi与沙门氏菌浓度的标准曲线,用以定量检测待检样品中的细菌浓度。
最后,取待检测沙门氏菌的食物样品,经过研磨、均质、传递和预增菌培养的预处理过程,加入到电化学芯片上,37℃孵育10min,利用电化学工作站检测电流信号值,将得到的信号值与标准曲线对照,从而精确定量得到待检测菌液的浓度。
实施例6:利用线基电化学纳米生物传感器检测大肠杆菌
一种食源性致病菌的检测方法,包括以下步骤:
首先,利用selex技术筛选得到大肠肝菌的适配子,然后将适配子与事先剥离好的二维片状纳米材料通过静电吸附的作用固定在电化学芯片的工作电极上,同时用pbs缓冲溶液进行冲洗。
其次,配置已知浓度的大肠肝菌标准液,按浓度梯度稀释成10-107cfu/ml不同浓度的菌液。将制备好的不同浓度的菌液,分别滴加到含有纳米生物传感器的电化学芯片上,37℃孵育10min。孵育完成后,利用电化学工作站分别检测电化学芯片的dpv值,并得到电流峰值增量δi(菌液固定前后峰值电流差)与菌液浓度c0的线性关系曲线,从而建立电流峰值增量δi与大肠肝菌浓度的标准曲线,用以定量检测待检样品中的细菌浓度。
最后,取待检测大肠肝菌的食物样品,经过研磨、均质、传递和预增菌培养的预处理过程,加入到电化学芯片上,37℃孵育10min,利用电化学工作站检测电流信号值,将得到的信号值与标准曲线对照,从而精确定量得到待检测菌液的浓度。
实施例7:利用线基电化学纳米生物传感器检测李斯特菌
一种食源性致病菌的检测方法,包括以下步骤:
首先,利用selex技术筛选得到李斯特菌的适配子,然后将适配子与事先剥离好的二维片状纳米材料通过静电吸附的作用固定在电化学芯片的工作电极上,同时用pbs缓冲溶液进行冲洗。
其次,配置已知浓度的李斯特菌标准液,按浓度梯度稀释成10-107cfu/ml不同浓度的菌液。将制备好的不同浓度的菌液,分别滴加到含有纳米生物传感器的电化学芯片上,37℃孵育10min。孵育完成后,利用电化学工作站分别检测电化学芯片的dpv值,并得到电流峰值增量δi(菌液固定前后峰值电流差)与菌液浓度c0的线性关系曲线,从而建立电流峰值增量δi与李斯特菌浓度的标准曲线,用以定量检测待检样品中的细菌浓度。
最后,取待检测李斯特菌的食物样品,经过研磨、均质、传递和预增菌培养的预处理过程,加入到电化学芯片上,37℃孵育10min,利用电化学工作站检测电流信号值,将得到的信号值与标准曲线对照,从而精确定量得到待检测菌液的浓度。
实施例8:利用线基电化学纳米生物传感器检测副溶血弧菌
一种食源性致病菌的检测方法,包括以下步骤:
首先,利用selex技术筛选得到副溶血性弧菌的适配子,然后将适配子与事先剥离好的二维片状纳米材料通过静电吸附的作用固定在电化学芯片的工作电极上,同时用pbs缓冲溶液进行冲洗。
其次,配置已知浓度的副溶血性弧菌标准液,按浓度梯度稀释成10-107cfu/ml不同浓度的菌液。将制备好的不同浓度的菌液,分别滴加到含有纳米生物传感器的电化学芯片上,37℃孵育10min。孵育完成后,利用电化学工作站分别检测电化学芯片的dpv值,并得到电流峰值增量δi(菌液固定前后峰值电流差)与菌液浓度c0的线性关系曲线,从而建立电流峰值增量δi与副溶血性弧菌浓度的标准曲线,用以定量检测待检样品中的细菌浓度。
最后,取待检测副溶血性弧菌的食物样品,经过研磨、均质、传递和预增菌培养的预处理过程,加入到电化学芯片上,37℃孵育10min,利用电化学工作站检测电流信号值,将得到的信号值与标准曲线对照,从而精确定量得到待检测菌液的浓度。
试验例1:线基电化学生物传感器的机制验证实验
本实验通过分别检测修饰了纳米材料、适配子和食源菌的电化学芯片的电信号,验证了电化学生物传感器机制的正确性与可行性。
图3中,曲线a代表原始的电极材料的电流信号、曲线b代表二维纳米材料修饰后的曲线、曲线c为适配子修饰后的曲线、曲线d为适配子与待检测细菌结合后的曲线。从图3可以看出,修饰了二硫化钼纳米材料之后,b曲线的峰值相较于a曲线明显增加且峰值电位差(δep)减小,证明纳米材料显著增强了生物传感器的灵敏度;修饰适配子之后,峰值电流出现下降(c曲线),主要原因为适配子附着于纳米材料表面,阻碍了电信号的传输;适配子对目标食源菌进行捕获之后,在表面生成进一步阻碍电信号传输的蛋白,使电流峰值进一步减小(d曲线)。
试验例2:液相剥离硫化钼结果验证
用扫描电子显微镜观察液相剥离后的二硫化钼的微观形貌,结果如图4所示,从图4可以看出,二硫化钼的尺寸都在纳米级,说明二硫化钼粉末已被剥离成片状二维纳米材料。同理可以确定,通过液相剥离方法也可以同样得到二维黑磷纳米片和石墨烯。通过液相剥离二维纳米材料,从而为适配子附着提供高的表面积。
试验例3:线基电极的修饰结果验证
本试验例通过对二维纳米材料(以二硫化钼为例)、二维纳米材料-pll、二维纳米材料-pll-适配子修饰结果的粒径表征,来验证是否对线基电极成功修饰。从图5可以看出,二维纳米材料的平均粒径约为62.27nm,加pll修饰之后为414.35nm,加适配子修饰之后为1801.41nm,经过不断修饰后,平均粒径逐步增大,由此说明了本发明通过二硫化钼以及pll修饰电极成功。
试验例4:zeta电位表征
本试验例分别对二维纳米材料、二维纳米材料-pll、二维纳米材料-pll-适配子修饰结果的zeta电位表征,结果如图6所示。从图6可以看出,经检测二硫化钼纳米材料的电位为负值,在二硫化钼纳米材料上修饰pll之后电位为正,说明了pll确实沉积在了二硫化钼纳米材料表面,由此结合改变了电位的性质,当二维纳米材料-pll与电位为负的适配子结合之后电位再次变负,说明适配子通过静电作用与二维片状纳米材料形成化学键-离子键得以结合固定,静电吸附可行。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!