ACAT1蛋白作为生物标志物在少弱精子症中的应用的制作方法
本发明属于生物医学技术领域,具体涉及acat1蛋白作为生物标志物在少弱精子症中的应用。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
根据who第五版诊断标准,弱精子症是指精液中前向运动的精子少于32%。弱精子症是男性不育的主要原因之一。弱精子症约占男性不育的19%,而少精弱精或畸形弱精子症占男性不育的63%。其病因和病理复杂多样,许多假说被认为和弱精症相关,如先天性或获得性泌尿生殖道异常,内分泌紊乱,阴囊温度异常(精索静脉曲张),泌尿生殖道感染,睾丸损伤或病变,抗精子抗体等,但是遗传因素也是不可忽视的原因,也因此,近年来许多研究已经开始关注于弱精症发生发展的分子机制。
目前关于精子蛋白质组的研究已有报道。saraswat等利用uplc-ms的方法在人类精子中定量了667个蛋白,并且分析出了20个健康人和弱精症患者精子中的差异蛋白。最新更新的人类精子蛋白质组共6198个蛋白。gaigaiwang等利用高分辨质谱在人类精子中鉴定出4675个蛋白。蛋白质是生命活动的分子基础,将疾病状态下异常的或者数量变化极大的特异蛋白作为疾病的生物标志物进而用于诊断疾病的进程具有重要意义。
技术实现要素:
针对上述现有技术中存在的问题,本发明目的在于提供acat1(乙酰辅酶a乙酰转移酶1)蛋白作为生物标志物在少弱精子症中的应用,本发明首次发现acat1蛋白在少弱精样本中显著下调,且具有较好的诊断效果,因此可以将其作为诊断弱精子症的生物标志物,具有良好的实际应用之价值。
为了实现上述技术目的,本发明的技术方案为:
本发明的第一个方面,提供用于检测acat1蛋白的物质在制备产品中的应用;所述产品的功能为如下a1)至a3)中的至少一种:a1)诊断少弱精子症;a2)诊断待测者是否为少弱精子症患者;a3)防控少弱精子症。
本发明的第二个方面,提供用于检测acat1蛋白的物质和/或装置甲在制备产品中的应用;
所述产品的功能为如下a1)至a3)中的至少一种:a1)诊断少弱精子症;a2)诊断待测者是否为少弱精子症患者;a3)防控少弱精子症;
本发明的第三个方面,提供用于检测acat1基因的物质在制备产品中的应用;所述产品的功能为如下a1)至a3)中的至少一种:a1)诊断少弱精子症;a2)诊断待测者是否为少弱精子症患者;a3)防控少弱精子症。
本发明的第四个方面,提供用于检测acat1基因的物质和/或装置乙在制备产品中的应用;所述产品的功能为如下a1)至a3)中的至少一种:a1)诊断少弱精子症;a2)诊断待测者是否为少弱精子症患者;a3)防控少弱精子症。
本发明的第五个方面,提供一种试剂盒,包括用于检测acat1蛋白的物质和/或用于检测acat1基因的物质;所述试剂盒具有如下a1)至a3)中至少一种功能:a1)诊断少弱精子症;a2)诊断待测者是否为少弱精子症患者;a3)防控少弱精子症。
所述“用于检测acat1蛋白的物质”为用于检测acat1蛋白的表达量的物质;
所述“用于检测acat1基因的物质”为用于检测acat1基因的表达量的物质。
本发明的第六个方面,提供如下y1)-y4)中任意一种应用:
y1)acat1蛋白作为生物标志物在开发诊断少弱精子症的试剂中的应用;
y2)acat1蛋白作为生物标志物在诊断少弱精子症中的应用;
y3)acat1基因作为生物标志物在开发诊断少弱精子症的试剂中的应用;
y4)acat1基因作为生物标志物在诊断少弱精子症中的应用。
上文中,所述低于可为在统计学上的低于。
上述一个或多个技术方案的有益技术效果:
上述技术方案首次发现acat1蛋白在少弱精样本中显著下调,且具有较好的诊断效果,经试验验证,acat1蛋白检测特异肽段数15条,蛋白可信度高,经比较发现这一蛋白在少弱精样本中显著下调3.1倍,p值为1.3e-15<<0.05。在相对检验丰度为0.030时,灵敏度为84.1%,特异度为90.5%。当进行个体检测时,相对检验丰度小于0.030时,被判为少弱精患者(假阳性率为90.5%)。因此可以将其作为诊断弱精子症的生物标志物,同时上述技术方案采用蛋白质作为生物标志物,其表达水平较高,更容易定量,作为生物标志物进行分析时操作工序更为简单,因此具有良好的实际应用之价值。
说明书附图
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
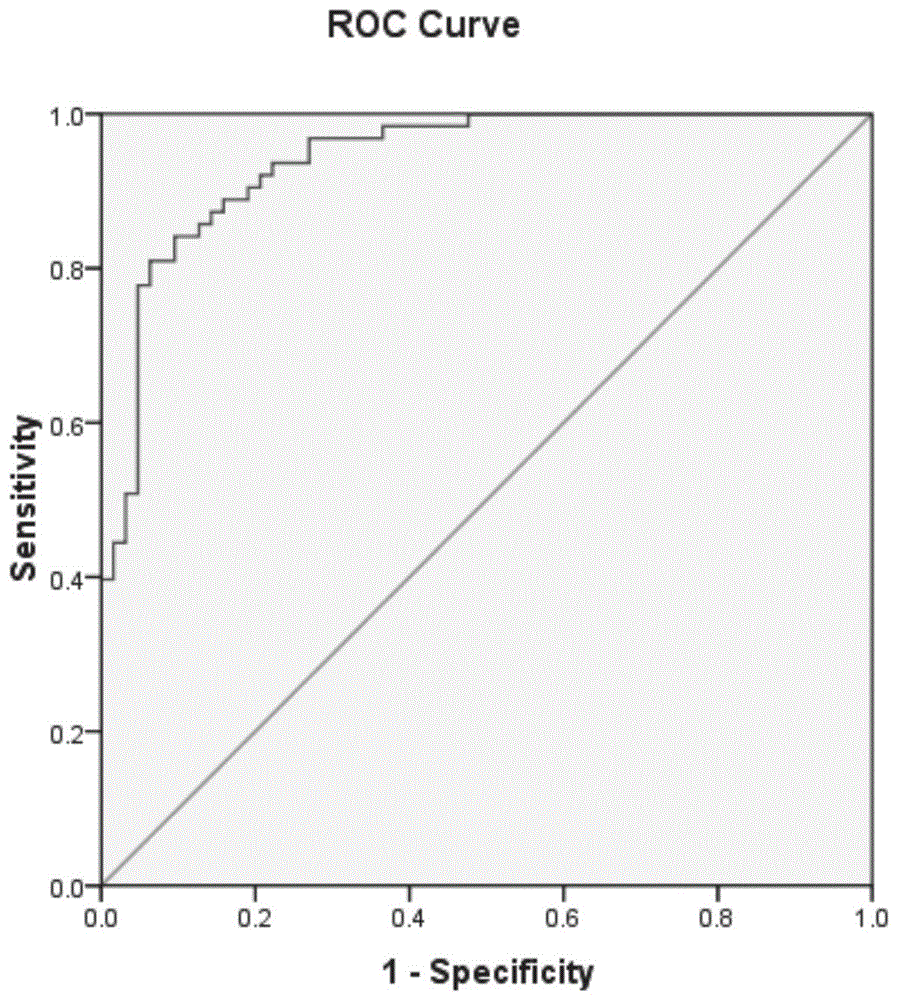
图1为本发明实施例中acat1蛋白检测相对丰度的roc曲线。
图2为本发明实施例中健康和少弱精样本的acat1蛋白检测强度比较图。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
本发明的一个具体实施方式中,提供用于检测acat1蛋白的物质在制备产品中的应用;所述产品的功能为如下a1)至a3)中的至少一种:a1)诊断少弱精子症;a2)诊断待测者是否为少弱精子症患者;a3)防控少弱精子症。
本发明的又一具体实施方式中,提供用于检测acat1蛋白的物质和/或装置甲在制备产品中的应用;
所述产品的功能为如下a1)至a3)中的至少一种:a1)诊断少弱精子症;a2)诊断待测者是否为少弱精子症患者;a3)防控少弱精子症;
所述装置甲包括数据输入设备1、数据记录模块1、数据比较模块1和输出模块1;
数据输入设备1用于输入acat1蛋白的表达量数值;
数据记录模块1用于存储acat1蛋白的表达量数值;
数据比较模块1用于将待测者精子样本中acat1蛋白的表达量和对照精子样本中acat1蛋白的表达量进行比较;
输出模块1用于显示结论,即如果待测者精子样本中acat1蛋白的表达量低于对照精子样本中acat1蛋白的表达量,则输出模块1显示待测者为少弱精子症患者;如果待测者精子样本中acat1蛋白的表达量不低于对照精子样本中acat1蛋白的表达量,则输出模块1显示待测者为非少弱精子症患者;
其中,acat1蛋白的表达量为相对检验丰度;当相对检验丰度小于0.030时,被判为少弱精患者。
所述对照精子样本为非少弱精症患者或健康人的精子样本。
本发明的又一具体实施方式中,提供用于检测acat1基因的物质在制备产品中的应用;所述产品的功能为如下a1)至a3)中的至少一种:a1)诊断少弱精子症;a2)诊断待测者是否为少弱精子症患者;a3)防控少弱精子症。
本发明的又一具体实施方式中,用于检测acat1基因的物质和/或装置乙在制备产品中的应用;所述产品的功能为如下a1)至a3)中的至少一种:a1)诊断少弱精子症;a2)诊断待测者是否为少弱精子症患者;a3)防控少弱精子症;
所述装置乙包括数据输入设备2、数据记录模块2、数据比较模块2和输出模块2;
数据输入设备2用于输入acat1基因的表达量数值;
数据记录模块2用于存储acat1基因的表达量数值;
数据比较模块2用于将待测者精子样本中acat1基因的表达量和对照精子样本中acat1基因的表达量进行比较;
输出模块2用于显示结论,即如果待测者精子样本中acat1基因的表达量低于对照精子样本中acat1基因的表达量,则输出模块2显示待测者为少弱精子症患者;如果待测者精子样本中acat1基因的表达量不低于对照精子样本中acat1基因的表达量,则输出模块2显示待测者为非少弱精子症患者;
所述对照精子样本为结核潜伏感染者或健康人的精子样本。
本发明的又一具体实施方式中,提供一种试剂盒,包括用于检测acat1蛋白的物质和/或用于检测acat1基因的物质;所述试剂盒具有如下a1)至a3)中至少一种功能:a1)诊断少弱精子症;a2)诊断待测者是否为少弱精子症患者;a3)防控少弱精子症。
所述“用于检测acat1蛋白的物质”为用于检测acat1蛋白的表达量的物质;
所述“用于检测acat1基因的物质”为用于检测acat1基因的表达量的物质。
本发明的又一具体实施方式中,提供如下y1)-y4)中任意一种应用:
y1)acat1蛋白作为生物标志物在开发诊断少弱精子症的试剂中的应用;
y2)acat1蛋白作为生物标志物在诊断少弱精子症中的应用;
y3)acat1基因作为生物标志物在开发诊断少弱精子症的试剂中的应用;
y4)acat1基因作为生物标志物在诊断少弱精子症中的应用。
上文中,所述低于可为在统计学上的低于。
为了使得本领域技术人员能够更加清楚地了解本公开的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
实施例
本实施例所用样本全部来源于山东大学附属生殖医院,21例少弱精子症患者样本精子前向运动在7.8%-17.3之间,精子浓度在3.8-14.8百万/ml之间。
acat1蛋白的检测方法,包括如下步骤:
(1)提取精子细胞全蛋白:将精子样本采用dpbs洗涤,加入ripa裂解液超声1~2min,置于冰上孵育30min裂解,14,000g离心20min,取上层蛋白质清液,利用bradford法测定清液中蛋白浓度;
(2)利用基于超滤辅助样品制备(fasp)方法对蛋白进行酶解:在10kd的超滤管中加入300μg蛋白溶液,600rpm震荡1min,14000g,20min离心,加入100μl8murea,600rpm震荡1min,并14000g,20min离心,并重复一次;加入100μl50mmnh4hco3,600rpm震荡1min,并14000g,20min离心,并重复两次;更换超滤管套管,加入1fmol/μgbsa(300μg蛋白应加入19.929ngbsa),并加入50mmnh4hco3溶液,使总溶液体积保持在50-60ul,加入胰蛋白酶3-6μg,37℃过夜消化。
(3)对酶解后的肽段进行ziptip法脱盐,制备得到样品混合肽段;
(4)混合肽段的高效液相色谱(hplc)分离:
a相:2%ch3cn,98%h2o,nh3h2o调ph10.0
b相:98%ch3cn,2%h2o
300μg的混合肽段用80μla相溶解,样品进样量为80μl。混合肽段溶液于c18xbridgebeh-130柱子上根据其亲水性进行分离,流动相梯度设置为:0-3min,100%a相,3-25min,流速始终保持为0.7ml/min。紫外检测器uv设置为214nm,根据样品分离的色谱图,在大约10min时用1.5ml离心管收集液相分离馏分,每管收集1min,即0.7ml,最终收集90个组分,并按照收集的时间顺序对90个组分编号1~90。将90个组分于speedvac中真空干燥。用乙腈水混合液(50%乙腈,50%水)溶解90个组分交叉合并为20个组分,即1,21,41,61和81号五个组分合并为1号组分,2,22,42,62和82号五个组分合并为2号组分,以此类推,最终得到1~20号组分。将最终得到的20个组分于speedvac中真空干燥,于-80℃贮存。
(5)纳流液相色谱-串联质谱分析
纳流液相色谱分离:a相:10%ch3cn,90%h2o,1%甲酸;b相:1%甲酸溶解在90%ch3cn,10%h2o中,每个样品分别用13.5μla相溶解,样品进样量为4μl,纳流液相质谱分析系统为orbitrapelite(thermoscientific)。样品分离之前分别用4μla相平衡自制的预柱和分析柱。预柱和分析柱的规格分别为:预柱(4cm×150μmi.d.,c18填料粒径5μm,
质谱数据采集:350-1800m/z的全扫描,分辨率为60,000(m/z200)。二级图谱扫描时,活化时间为10ms,隔离宽度为2m/z。碎裂方式为诱导碰撞解离(collision-induceddissociation,cid),归一化碰撞能量设定为35%,动态排出时间为90s。
(6)质谱数据分析:利用proteomediscoverer软件把得到的质谱raw数据转换成mgf文件,并利用mascot和maxquant进行uniprothuman数据库搜索。
maxquant搜库参数为,蛋白酶:胰蛋白酶(trypsin);最多允许遗漏酶切位点:2个;固定修饰:半胱氨酸的烷基化;一级谱搜索误差:20ppm;最小肽段长度:7个氨基酸;肽段、蛋白和蛋白修饰fdr设置为1%。
maxquant得到的蛋白数据过滤掉污染蛋白和反库蛋白信息进行如下分析:maxquant搜库得到的蛋白数据以检测特异肽段数(uniquepeptides>3)进行初筛,然后以bsa蛋白信号强度为标准,计算每个样本中蛋白的相对检测丰度。将正常与患病组的蛋白按照其相对检测丰度的t检验(p<0.05)和比值(ratio>2)进行筛选,从而得到差异蛋白。然后利用spss软件作出差异蛋白roc曲线,并计算其曲线下面积(auc),进而判断其诊断价值。
实验结果
经过质谱数据分析,acat1蛋白检测特异肽段数15条,蛋白可信度高,经比较发现这一蛋白在少弱精样本中显著下调3.1倍,p值为1.3e-15<<0.05。
图1中roc分析显示acat1蛋白的auc为0.941>0.7,说明具有较好的诊断效果,在相对检验丰度为0.030时,灵敏度为84.1%,特异度为90.5%。当进行个体检测时,相对检验丰度小于0.030时,被判为少弱精患者(假阳性率为90.5%)。
下面比较了acat1蛋白在健康和少弱精样本的检测相对丰度(图2),可以看出这一蛋白在健康人样本中相对检测丰度为0.052而在病理样本中为0.017(图中实线),并且其中位数(虚线)相差较远,说明在少弱精样本中这一蛋白有较大程度地丢失。
鉴于上述结果,acat1蛋白可以作为少弱精子症的潜在特异蛋白标志物,从而对这一病症进行预测。
临床检测验证
根据实例1的方法首先对收集到的10组少弱精子症患者精子进行蛋白提取和纳流液相色谱-串联质谱分析,然后对质谱数据进行分析。表1示出了分析结果,利用上述方法10人被检测出少弱精子症。本组数据准确率高达100%。
表1
续表
续表
续表
续表
续表
应注意的是,以上实施例仅用于说明本发明的技术方案而非对其进行限制。尽管参照所给出的实施例对本发明进行了详细说明,但是本领域的普通技术人员可根据需要对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!