一种定量麻痹性贝类毒素检测试纸的制作方法及应用与流程
本发明涉及生物检测领域,尤其涉及一种定量麻痹性贝类毒素检测试纸的制作方法及应用。
背景技术:
麻痹性贝毒(paralyticshellfishpoisoning,psp)是全球分布最广、危害最大的一类海洋生物毒素,主要由海洋中的单细胞甲藻产生,现已证实多种亚历山大藻(alexandrium)、链状裸甲藻(gymnodiniumcatenatum)和巴哈马梨甲藻(pyrodiniumbahamense)等可以产生麻痹性贝毒,贝类滤食有毒藻后,藻毒素在其体内积累,进而通过食物链的传递危害人类健康。psp在弱酸和低温条件下比较稳定,通常的烹调方法不能改变其结构及降低其毒性,主要污染滤食性贝类,污染的贝类被人类食用后,会产生四肢面部肌肉麻痹、头痛恶心等症状,严重时可窒息死亡。
如下式为麻痹性贝毒的结构:
麻痹性贝类毒素根据r4基团的不同,可以分为4类,1)高毒性的氨基甲酸酯类毒素(carbamatetoxins),包括石房蛤毒素(saxitoxin,stx)、新石房蛤毒素(neo-saxitoxin,neo-stx)、膝沟藻毒素l~4(gtx1-4);2)低毒性的n-磺基氨甲酰基类毒素(n-sulfocarbamoyltoxins),包括b1、b2、c1~c4;3)脱氨甲酰基类毒素(decarbamoyltoxins),包括dcstx、dcneostx、dcgtx1-4;4)脱氧脱氨甲酰基类毒素(deoxydecarbamoyltoxins),包括dostx、dogtx2、dogtx3。根据国家标准(gb5009.213—2016食品安全国家标准贝类中麻痹性贝类毒素的测定)要求,psp主要检测的成分包括stx、gtx1,4、gtx2,3、dcgtx2,3、gtx5、neostx、dcstx,贝类可以通过滤食性把赤潮藻内的毒素富集,并能转化为stx的形式保存在体内,stx占麻痹性贝毒主要成份的80%以上。
我国是贝类养殖大国,近年来对部分海区贝类毒素的调查显示,我国沿海从南到北均受到psp污染。自20世纪70年代以来,随着我国贝类养殖规模的不断扩大,近岸水体富营养化水平的上升,有毒藻类数量增加,因误食染毒贝类而引起的中毒事件也不断增多。
由于psp分布广泛、危害严重,因此建立快速、灵敏、有效地毒素检测方法显得十分迫切。目前国内外上普遍使用的贝毒监测方法主要是生物小鼠法和高效液相色谱法(hplc),但生物法存在误差性大、重现性差,且存在不能分析样品中具体组分的缺点;而hplc法能够精确地测定毒素的种类和含量,但需要对样品进行繁琐的前处理和购买昂贵的设备。因此,海洋生物样品中麻痹性贝毒的监测就受到了严重的限制。
技术实现要素:
本发明的目的在于解决现有技术中的上述问题,提供一种定量麻痹性贝类毒素检测试纸的制作方法及应用。
为达到上述目的,本发明采用如下技术方案:
一种定量麻痹性贝类毒素检测试纸的制作方法:首先将载体垫置于最底层,载体垫上铺设硝酸纤维素膜,然后将样品组合垫和吸水垫分别设置于硝酸纤维素膜的两端,且样品组合垫和吸水垫的一端分别与硝酸纤维素膜部分重叠,样品组合垫的一端上方覆盖有胶带层,硝酸纤维素膜上的检测线靠近样品组合垫的一端,质控线靠近吸水垫的一端;所述检测线包括t1线和t2线,分别由氨基端包被人工抗原和胍基端包被人工抗原形成,所述质控线由羊抗鼠二抗形成;所述样品组合垫上喷有标记有胶体金的胍基端人工抗原制备单克隆抗体和氨基端人工抗原制备单克隆抗体。
胍基端人工抗原的制备方法如下:通过甲醛偶联石房蛤毒素(stx)与牛血清蛋白或血蓝蛋白,制备胍基端的包被人工抗原和免疫人工抗原。
石房蛤毒素分子结构如下式所示:
所述胍基端人工抗原制备单克隆抗体的制备方法如下:用胍基端免疫人工抗原免疫过小鼠的脾细胞与骨髓瘤细胞融合培养,筛选阳性杂交瘤细胞体外培养,克隆扩大培养后冻存,选用balb/c小鼠或其亲代小鼠,先用降植烷或液体石蜡进行小鼠腹腔注射,6~8天后将杂交瘤细胞接种到小鼠腹腔中,接着在5~12天后,收集腹水6~8天后将杂交瘤细胞接种到小鼠腹腔中,接着在5~12天后收集腹水,收集饱合度为30%~50%硫酸铵的沉淀即为纯化后的抗体,用eu微球标记,pbs溶解后,真空干燥备用;通过竞争抑制筛选只与stx结合的单克隆抗体。
氨基端人工抗原的制备的制备方法如下:通过1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs),偶联石房蛤毒素(stx)与牛血清蛋白或血蓝蛋白制备胺基端的包被人工抗原和免疫人工抗原。
所述氨基端人工抗原制备单克隆抗体的制备方法如下:用氨基端免疫人工抗原免疫过小鼠的脾细胞与骨髓瘤细胞融合培养,筛选阳性杂交瘤细胞体外培养,克隆扩大培养后冻存,选用balb/c小鼠或其亲代小鼠,先用降植烷或液体石蜡进行小鼠腹腔注射,6~8天后将杂交瘤细胞接种到小鼠腹腔中,接着在5~12天后,收集腹水6~8天后将杂交瘤细胞接种到小鼠腹腔中,接着在5~12天后收集腹水,收集饱合度为30%~50%硫酸铵的沉淀即为纯化后的抗体,用eu微球标记,pbs溶解后,真空干燥备用;通过竞争抑制筛选可以与stx、gtx1,4、gtx2,3、dcgtx2,3、gtx5、neostx、dcstx结合的单克隆抗体。
所述样品组合垫的制备方法如下:首先将胍基端人工抗原制备单克隆抗体和氨基端人工抗原制备单克隆抗体用pbs溶解成抗体溶液,然后用k2co3溶液调节胶体金溶液的ph值,并加入上述抗体溶液混合,完成抗体的胶体金标记,最后把标记有胶体金的抗体均匀的喷到样品组合垫上。
所述抗体溶液的制备方法如下:胍基端人工抗原制备单克隆抗体和氨基端人工抗原制备单克隆抗体分别用pbs溶解成相同浓度的溶液,然后以1:1的体积混合即可,两种抗体的量相等,均为5~20μg;所述胶体金溶液ph值为7.0~8.5,k2co3溶液的浓度为0.1~1.0mol/l,喷金量为1~5μl/cm。
所述硝酸纤维素膜的加工方法如下:用划膜仪将氨基端包被人工抗原、胍基端包被人工抗原与羊抗鼠二抗均匀地划在硝酸纤维素膜中间,进行干燥。
所述胍基端包被人工抗原、胺基端包被人工抗原和羊抗鼠二抗的划膜浓度相等,均为0.5~2.0mg/ml;所述干燥的条件为:在室温,相对湿度小于40%的气氛下进行干燥。
定量麻痹性贝类毒素检测试纸的应用:取麻痹性贝类毒素提取液滴加到检测试纸的加样口,5~15min后观察,当t1线、t2线和质控线都显色时,表明样品不含有麻痹性贝类毒素,包括stx、gtx1,4、gtx2,3、dcgtx2,3、gtx5、neostx、dcstx;当t1线不显色、t2线和质控线显色,表明样品溶液中只含有stx,不含有gtx1,4、gtx2,3、dcgtx2,3、gtx5、neostx、dcstx;当t2线不显色、t1线和质控线显色,表明样品溶液中含有gtx1,4、gtx2,3、dcgtx2,3、gtx5、neostx、dcstxstx,不含有stx;当t1线和t2线都不显色,只有质控线显色时,表明样品有含有stx、gtx1,4、gtx2,3、dcgtx2,3、gtx5、neostx、dcstx多种的贝类毒素。
相对于现有技术,本发明技术方案取得的有益效果是:
1、本发明结合两种抗体、两种抗原制作一种麻痹性贝毒检测试纸,可以检测stx及gtx1,4、gtx2,3、dcgtx2,3、gtx5、neostx、dcstx等贝类毒素,stx和gtx是贝类毒素的主要成份,目前的检测抗体一般只与stx结合,与gtx交叉反应比较差。本发明创新的采用edc、nhs作为中间体,制备氨基端结合蛋白的抗原,进一步制备可以与胍基端结合的单克隆抗体,由于gtx1,4、gtx2,3、dcgtx2,3、gtx5、neostx、dcstx等贝类毒素在胍基端的结构相似度高,因此本发明制备的抗体与stx、gtx1,4、gtx2,3、dcgtx2,3、gtx5、neostx、dcstx都有较好的交叉反应,可以应用于贝类毒素总毒素的分析。结合胍基端结合抗原制备的专一与stx反应的单克隆抗体,可以检测阳性贝类毒素中的stx和gtx的相对含量高低。对快速判定贝类毒素的性质有重要的作用。
2、本发明结合抗原分子偶联、单克隆抗体制备和免疫层析等技术,开发麻痹性贝类毒素免疫层析检测试剂盒,该方法与生物检测法和理化检测法相比,具有特异性好,灵敏度高,操作技术简单的特点,符合产业化发展趋势,具有广泛推广的潜力。本产品的推广对监管部门加强贝类毒素监测,尤其是赤潮高峰期应急监测有重要的作用,对于减少贝类毒素中毒和贝类产品的食用安全监控有重要的意义。
附图说明
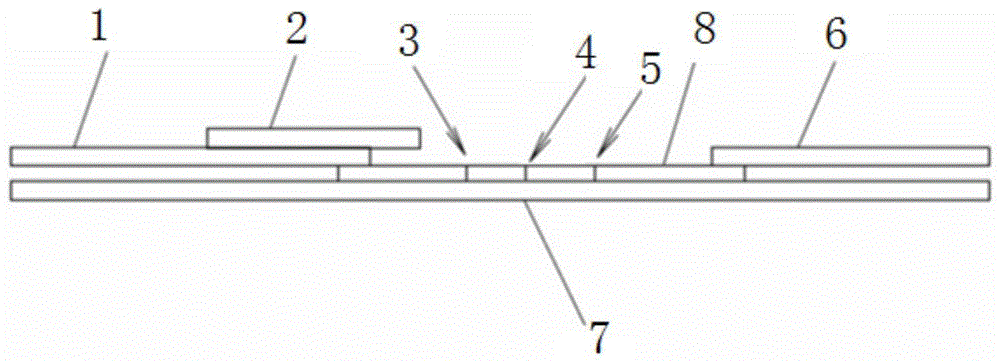
图1为本发明检测试纸的结构示意图;
图2为检测试纸组装成检测卡的俯视结构示意图。
附图标记:样品组合垫1,胶带层2,t1线3,t2线4,质控线5,吸水垫6,载体垫7,硝酸纤维素膜8,卡式外壳9,点样窗口10,显示窗口11。
具体实施方式
为了使本发明所要解决的技术问题、技术方案及有益效果更加清楚、明白,以下结合附图和实施例,对本发明做进一步详细说明。
如图1所示,一种定量麻痹性贝类毒素检测试纸的制作方法如下:
将载体垫7、硝酸纤维素膜8、样品组合垫1、胶带层2以及吸水垫6拼接成层状结构:首先将载体垫7置于最底层,载体垫7上铺设硝酸纤维素膜8,然后将样品组合垫1和吸水垫6分别设置于硝酸纤维素膜8的两端,且样品组合垫1和吸水垫6的一端分别与硝酸纤维素膜8部分重叠,样品组合垫1的一端上方覆盖有胶带层2,胶带层2可避免由于滴加样品过多使样品漫过硝酸纤维膜,硝酸纤维素膜8上的检测线靠近样品组合垫1的一端,质控线5靠近吸水垫6的一端;所述检测线包括t1线3和t2线4,分别由氨基端包被人工抗原和胍基端包被人工抗原形成,所述质控线5由羊抗鼠二抗形成;所述样品组合垫1上喷有标记有胶体金的胍基端人工抗原制备单克隆抗体和氨基端人工抗原制备单克隆抗体。
如图2所示,可将检测试纸条组装在卡式外壳9内构成检测卡,检测卡还设有点样窗口10和显示窗口11。
胍基端人工抗原的制备方法如下:通过甲醛偶联石房蛤毒素(stx)与牛血清蛋白或血蓝蛋白,制备胍基端的包被人工抗原和免疫人工抗原。
所述胍基端人工抗原制备单克隆抗体的制备方法如下:用胍基端免疫人工抗原免疫过小鼠的脾细胞与骨髓瘤细胞融合培养,筛选阳性杂交瘤细胞体外培养,克隆扩大培养后冻存,选用balb/c小鼠或其亲代小鼠,先用降植烷或液体石蜡进行小鼠腹腔注射,6~8天后将杂交瘤细胞接种到小鼠腹腔中,接着在5~12天后,收集腹水6~8天后将杂交瘤细胞接种到小鼠腹腔中,接着在5~12天后收集腹水,收集饱合度为30%~50%硫酸铵的沉淀即为纯化后的抗体,用eu微球标记,0.01mpbs溶解后,真空干燥备用;通过竞争抑制筛选只与stx结合的单克隆抗体。
氨基端人工抗原的制备的制备方法如下:通过1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs),偶联石房蛤毒素(stx)与牛血清蛋白或血蓝蛋白制备胺基端的包被人工抗原和免疫人工抗原。
所述氨基端人工抗原制备单克隆抗体的制备方法如下:用氨基端免疫人工抗原免疫过小鼠的脾细胞与骨髓瘤细胞融合培养,筛选阳性杂交瘤细胞体外培养,克隆扩大培养后冻存,选用balb/c小鼠或其亲代小鼠,先用降植烷或液体石蜡进行小鼠腹腔注射,6~8天后将杂交瘤细胞接种到小鼠腹腔中,接着在5~12天后,收集腹水6~8天后将杂交瘤细胞接种到小鼠腹腔中,接着在5~12天后收集腹水,收集饱合度为30%~50%硫酸铵的沉淀即为纯化后的抗体,用eu微球标记,0.01mpbs溶解后,真空干燥备用;通过竞争抑制筛选可以与stx、gtx1,4、gtx2,3、dcgtx2,3、gtx5、neostx、dcstx结合的单克隆抗体。
所述样品组合垫1的制备方法如下:首先将胍基端人工抗原制备单克隆抗体和氨基端人工抗原制备单克隆抗体分别用0.01mpbs溶解成相同浓度的溶液,然后以1:1的体积混合即可得到抗体溶液,两种抗体的量相等,均为10μg;然后用浓度为0.2mol/lk2co3溶液调节胶体金溶液的ph值为7.8,并加入上述抗体溶液混合,完成抗体的胶体金标记,最后以3μl/cm的喷金量把标记有胶体金的抗体均匀的喷到样品组合垫1上。
所述硝酸纤维素膜8的加工方法如下:用划膜仪将氨基端包被人工抗原、胍基端包被人工抗原与羊抗鼠二抗均匀地划在硝酸纤维素膜8中间,在室温,相对湿度小于40%的气氛下进行干燥。
所述氨基端包被人工抗原和胍基端包被人工抗原形成检测线,分别为t1线3和t2线4,羊抗鼠二抗形成质控线5,其中胍基端包被人工抗原、胺基端包被人工抗原和羊抗鼠二抗的划膜浓度相等,均为0.5mg/ml,所述t1线3和t2线4之间的间距为0.3cm,所述靠近质控线5的检测线与质控线5的间距为0.3cm。
定量麻痹性贝类毒素检测试纸的检测方法如下:
取麻痹性贝类毒素提取液3滴加到检测试纸的加样口,5min后观察,当t1线3、t2线4和质控线5都显色时,表明样品不含有麻痹性贝类毒素,包括stx、gtx1,4、gtx2,3、dcgtx2,3、gtx5、neostx、dcstx;当t1线3不显色、t2线4和质控线5显色,表明样品溶液中只含有stx,不含有gtx1,4、gtx2,3、dcgtx2,3、gtx5、neostx、dcstx;当t2线4不显色、t1线3和质控线5显色,表明样品溶液中含有gtx1,4、gtx2,3、dcgtx2,3、gtx5、neostx、dcstxstx,不含有stx;当t1线3和t2线4都不显色,只有质控线5显色时,表明样品有含有stx、gtx1,4、gtx2,3、dcgtx2,3、gtx5、neostx、dcstx多种的贝类毒素。
- 还没有人留言评论。精彩留言会获得点赞!