一种基于ISET原理的循环肿瘤细胞IHC抗原修复方法与流程
本发明属于生物医学领域,具体涉及一种基于iset原理的循环肿瘤细胞ihc抗原修复方法。
背景技术:
由于石蜡切片标本多数使用甲醛固定,甲醛在组织中所形成的醛键、羧甲基等封闭了部分抗原决定簇,或由于蛋白分子之间的交联而使抗原决定簇隐蔽。因此在染色前有些抗原需要先进行抗原修复或暴露才能使组织中的抗原抗体充分结合,出现理想的染色结果。而对于需要进行修复的抗原,需在建立染色程序时确定。常用的方法有加热抗原修复法和酶消化法两种。经大量试验验证.加热抗原修复法优于酶消化法,其机制目前仍不清楚,可能是加热打开了组织抗原因甲醛固定所引起的抗原决定簇的交联,因此使免疫组织化学染色的敏感度大幅度提高。石蜡包埋组织会因固定过程中蛋白抗原活性的丢失而导致染色变浅,造成检测结果的假阴性,此外,固定剂的类型等也会影响到染色结果,而抗原修复为了弥补固定过程中抗原活性的丢失,但是,抗原的修复也会造成一定程度的非特异性染色,导致检测结果的假阳性。现有技术中,尚未有针对循环肿瘤细胞进行修复的相关记载。
技术实现要素:
针对现有技术中存在的问题,本发明提供了一种基于iset原理的循环肿瘤细胞ihc抗原修复方法。
本发明为了实现上述目的所采用的技术方案为:
本发明提供了一种基于iset原理的循环肿瘤细胞ihc抗原修复方法,包括以下步骤:
(1)在水浴锅加入0.01mol/l枸橼酸钠缓冲溶液,加热至95℃,放入用磁铁固定后的一张循环肿瘤细胞玻片加热15分钟;
(2)修复完成后,取出玻片,使用pbs洗2min*3次。
进一步的,所述枸橼酸钠缓冲溶液的ph值为6.0。
本发明还提供了一种利用上述抗原修复方法修复后循环肿瘤细胞的免疫组化检测方法,包括以下步骤:
1)将修复后的循环肿瘤细胞玻片中滴加100μl0.1%tritonx-100,室温孵育15min,di水洗2min×3次;
2)滴加100μl0.3%h2o2,室温下孵育10min,pbs洗2min×3次;
3)滴加100μl一抗工作液,室温下孵育2h,pbs洗2min×3次;
4)滴加100μl山羊抗兔/小鼠igg/hrp,室温下孵育15-30min,pbs洗2min×3次;
5)滴加100μldab显色液,室温下孵育3~10min;
6)显色完成后,弃掉dab显色液,流水冲洗5min,苏木素染色15min;
7)过水漂洗1秒,盐酸酒精分化3-8秒,自来水返蓝15min;
8)75%乙醇(1min),95%乙醇(1min),100%乙醇(1min)梯度乙醇脱水,晾干,中性树脂封片。
9)光学显微镜下镜检。
进一步的,步骤3)中,所述一抗工作液为cd45+cd31。
上述一抗工作液具体制备过程为:取100μlcd45一抗工作液,加入1μlcd31一抗浓缩液混匀即可。
进一步的,所述梯度乙醇具体脱水过程为:75%乙醇脱水1min,95%乙醇脱水1min,100%乙醇脱水1min。
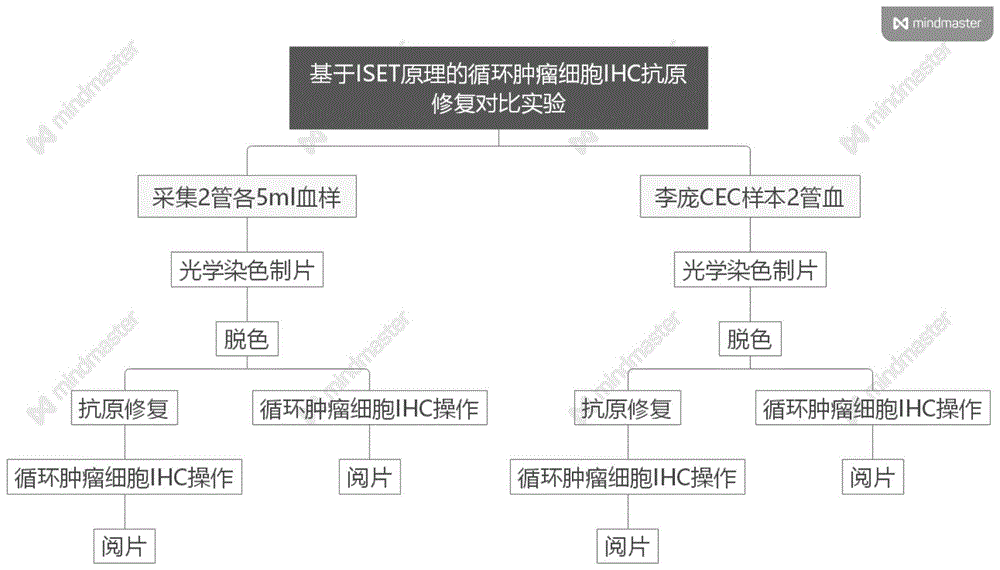
本发明具体的实验路线如图1所示。
本发明的有益效果为:
(1)通过本发明提供的抗原热修复后,对循环肿瘤细胞ihc染色效果好,且能够减少因抗原修复造成的假阳性;
(2)本发明进一步完善循环肿瘤细胞检测鉴定技术体系。
附图说明
图1为基于iset原理的循环肿瘤细胞ihc抗原修复对比试验。
图2为不经机器抗原修复后的免疫组化效果图。
图3为经机器抗原修复后的免疫组化效果图。
图4为抗原修复后对免疫组化的影响结果报告图。
具体实施方式
下面通过具体的实施例对本发明的技术方案作进一步的解释和说明。
(一)ctcs常规检测实验耗材及试剂
表1
(二)抗原修复专属设备及耗材
表2
实施例1
1、采血
1)外周血样本的采集,需由专业的医护人员进行,并使用bdvacutainer®k2e(edta)抗凝真空采血管(其它产品需经过本公司确认);
2)使用bdvacutainer®k2e(edta)10.8mg10.0ml经由静脉采集5ml外周血,2管;
3)样本采集后立即轻柔上下颠倒混匀8次,避免凝血(非常关键)。
2、滤器活化
1)打开滤器上下塞并妥善放置;
2)将滤器放置在滤器润洗架上,并用巴氏管向滤器内加入约2ml的75%医用酒精待其从滤器下口自然滤出;
3)向滤器内加入生理盐水,反复漂洗(4ml×3次),去除滤器内残留酒精;
4)自然滤出生理盐水,留适量生理盐水以保证滤膜湿润即可,装上滤上下塞。
注:如漂洗时酒精无法自然滤出,立即弃用。
3、a10血液样本前处理
1)检查样本质量,记录样本信息(填写病员信息统计表);
2)取15ml离心管并做好标记,每个样本对应一个离心管;
3)向15ml离心管中加入10ml生理盐水,并加入固定剂(8%pfa)375μl,混匀,使用巴氏吸管将5ml血样加入离心管中,上下颠倒8次混匀;
4)室温固定10min;
5)待检测。
注:
步骤3中请勿直接在采血管中颠倒混匀,防止凝集在管壁的血块脱落的可能。如发现有凝血、溶血、体积明显不够或其它异常情况应立即弃用。
步骤3中在血样混匀后可将多余的血取回到对应的采血管内。
步骤4中加样时避免产生气泡,防止血样污染滤器口和上端管壁。
4、a10ctc的分离
1)检查废液桶,打开机器开关;
2)将预处理好的滤器放入滤器仓中,保证下样针刺穿下塞;
3)取下滤器上塞,转移8ml稀释好的样本至滤器中;
4)选择自动/手动模式,点击“开始”按钮,开始过滤;
5)当滤器中还有1ml样本时,将剩余的样本转移至滤器中,直至全部样本完成过滤;
6)4mlpbs漂洗三遍,完成分离,并收集废液。
5、瑞氏吉姆萨染色
1)取下滤器,加入500μl甲醇,室温固定1min;
2)弃甲醇,取膜,将其正面朝上贴于玻片中央,室温晾干2min;
3)用组化笔在滤膜周围画一个比滤膜稍大的封闭的圆圈,等待2min晾干;
4)使用移液器加入300μla染液,染色1min,然后加入300μlpbs将a染液稀释,弃掉稀释的染液;
5)加入300μlb染液,染色1分30秒,弃掉b染液;
6)加入di,将滤膜上的b染色残液清洗干净,保证滤膜上无明显的染液颜色残留,50℃干燥箱烘5min;
7)用移液器取2.5μl贴片剂至洁净的载玻片上,并均匀涂成滤膜大小的面积;
8)将染色的滤膜转移至涂有贴片剂的载玻片上,置于50℃干燥箱中30min;
9)滴加中性树脂,封片;
10)阅片,统计ctc的检出率。
注:
1)以上所使用的染液均来自于d100配套染色液试剂盒。
2)如加入300μl未能完全覆盖滤膜,可增加染色液的用量。
3)如染色过程中滤膜浮起,可使用镊子将滤膜压至液面之下。
4)加入染液时,请缓慢的滴加在滤膜之上。
5)弃残液时,可使用移液器从滤膜边缘吸出。
6、镜检后脱色
1)将载玻片放入pbs或者di水中,待盖玻片自然脱落。
2)放入di水的染色缸内,上下润洗5分钟,充分洗净甘油。
3)将载玻片依次放入100%乙醇(1min),95%乙醇(1min),75%乙醇脱色20分钟以上,待红色染料充分褪去后放入di染色缸内,上下润洗5分钟,晾干。(显微镜下观察染料是否彻底褪去)
7、抗原修复
在水浴锅加入0.01mol/l枸橼酸钠缓冲溶液(ph6.0),加热至95℃左右,放入用磁铁固定后的一张循环肿瘤细胞玻片加热15分钟(最长不超过15分钟),另外一张玻片不做处理;
修复完成后,取出玻片,使用pbs洗2min*3次。
8、免疫组化
1)滴加100μl0.1%tritonx-100,室温孵育15min,di水洗2min×3次。
2)滴加100μl0.3%h2o2,室温(18~26℃)孵育10min,pbs洗2min×3次。
3)滴加100μl(cd45+cd31)一抗工作液(取100μlcd45一抗工作液,加入1μlcd31一抗浓缩液混匀),室温(18~26℃)孵育2h(或4℃过夜,复温30min),pbs洗2min×3次。
4)滴加100μl山羊抗兔/小鼠igg/hrp,室温(18~26℃)孵育15-30min,pbs洗2min×3次。
5)滴加100μldab显色液,室温(18~26℃)孵育并随时在显微镜下观察显色情况(一般为3~10min,时间不能超过10min)。dab显色液按照说明书配制。
6)显色完成后,弃掉dab显色液,流水冲洗5min,苏木素染色15min;
7)过水漂洗1秒,盐酸酒精分化3-8秒,自来水返蓝15min(流水冲洗);
8)75%乙醇(1min),95%乙醇(1min),100%乙醇(1min)梯度乙醇脱水,晾干,中性树脂封片。
9)光学显微镜下镜检。
结果与讨论
(一)天津肿瘤医院在使用罗氏免疫组化设备操作时提出使用机器抗原修复的方法,经课题组对比免疫组化效果,如图2和图3所示,相比常规检测方法,经抗原修复后的血细胞为阳性数量更多(细胞核为蓝色,细胞膜为棕黄色),ctc为阴性(细胞核为蓝色,细胞膜无棕黄色),免疫组化信号表达更强。所以课题组结合研究基础提出本实验,旨在通过水浴锅抗原修复的方法,使免疫组化效果更好表达,完善ctc检测鉴定技术体系。
(二)研究对象
选取山东省肿瘤医院前列腺科样本12例,每个样本采集2管外周血;提供cec样本12例,每例样本采集2管外周血。
对照两张玻片组化染色效果进行分析评价,通过染色结果进行判定经过抗原修复的ctc玻片是否着色效果好,具体结果见表3。
表3
(三)试验例次计算
本发明主要比较肿瘤患者及正常人经热修复后对免疫组化的影响;要求两组例数相同n1=n2=0.5,α=0.05,1-β=0.9,通过对比天津肿瘤患者样本察觉经热修复后免疫组化有效率为100%,正常人热修复后免疫组化有效率为50%,使用pass11软件进行计算,所得结果报告如图4所示。
- 还没有人留言评论。精彩留言会获得点赞!