基于双头光亲和探针的生物活性分子结合靶标鉴定方法
本发明涉及医药技术领域,涉及生物活性分子结合靶标鉴定方法,尤其涉及基于双头光亲和探针的生物活性分子结合靶标鉴定方法。
背景技术:
光亲和标记技术(pal)是结合现代分子生物学、细胞生物学、药物化学、分析化学等多学科的优势,运用合成的光亲和探针分子,在特定波长光的照射下产生高活性的中间体,其可以直接与药物分子特异性结合的蛋白质进行不可逆共价交联从而实现对药物靶标蛋白分子的捕获。运用光亲和标记技术,大量与疾病相关的靶点被发现、多种小分子与生物大分子作用的模式被确定,这些信息对合理药物设计具有非常重要的意义,比如新的药物靶点的发现,或者对一个已知蛋白的功能作新的阐述,这对于从分子水平阐明疾病的发生、发展及治疗的意义不言而喻。
光亲和标记探针设计对光亲和标记技术的实施起着决定性作用,但在使用经典常见连接骨架(如赖氨酸、聚乙二醇、烷基链骨架等)分析部分生物活性小分子的结合靶标时,因探针整体结构骨架呈支链型,故其灵敏度有限,并存在非特异性结合,无法全面、准确鉴定其靶标(salisbury,c.m.andb.f.cravatt(2008)."optimizationofactivity-basedprobesforproteomicprofilingofhistonedeacetylasecomplexes."jamchemsoc130(7):2184-2194;smith,e.andi.collins(2015)."photoaffinitylabelingintarget-andbinding-siteidentification."futuremedchem7(2):159-183)。
为了解决上述技术问题,发明人发展并对现有探针进行改进,(wang,d.y.,y.cao,l.y.zheng,l.d.chen,x.f.chen,z.y.hong,z.y.zhu,x.liandy.f.chai(2017)."targetidentificationofkinaseinhibitoralisertib(mln8237)byusingdna-programmedaffinitylabeling."chemistry23(45):10906-10914.)提供了一种光亲和探针组,由结合探针和捕获探针组成,两个探针之间碱基互补配对或特异性结合,结合探针的一侧结合生物活性分子,捕获探针的一侧结合光亲和分子。进行靶标鉴定时,将结合探针与捕获探针分别杂交,取一定浓度的探针与样品共孵,并将其置于光亲和分子激发光源下照射,激发光交联反应,使捕获探针有效锚定相关靶标蛋白,形成“探针-蛋白”复合物。
与当前探针分子对比,单头探针由于结构骨架集中且为柔性结构,故存在如下优点:灵敏度显著增加,并提高了对低丰度和低亲和力靶标蛋白对的识别能力。然而,细胞中充满了疏水作用和静电作用,和成千上万种具有不同生物物理特性和丰度的蛋白质,因此,作用较弱或者瞬时的非特异性的相互作用普遍存在,且随着蛋白质组学及蛋白质谱鉴定技术的发展,鉴定到的潜在生物活性小分子结合蛋白的数量显著增加,逐一验证难度大、效率低。由此可知,如何优化单头探针靶标分析方法,在保证灵敏度的同时降低非特异性,对小分子靶标分析具有重要意义。
技术实现要素:
本发明的目的在于针对单头探针的缺陷,对双头光亲和探针进行研究,并由此提供了基于双头光亲和探针的生物活性分子结合靶标鉴定方法,具体方案如下:
本发明提供的基于双头光亲和探针的生物活性分子结合靶标鉴定方法,包括如下步骤:
s1、双头光亲和探针制备
以组为单位,每组均由双头结合探针和双头捕获探针组成;双头结合探针的探针骨架与双头捕获探针的探针骨架碱基互补配对或特异性结合;双头结合探针的探针骨架两侧结合相同的生物活性分子,双头捕获探针的探针骨架两侧结合相同的光亲和分子。
探针骨架两端经氨基修饰后与生物活性分子或光亲和分子的活化酯反应,分别得到双头结合探针和双头捕获探针,经纯化、表征后备用;
s2、蛋白样品制备
从生物样本中提取蛋白样品,测试含量和纯度后富集;
s3、生物活性小分子结合靶标的捕获、分离与鉴定
3.1捕获:
将双头结合探针与双头捕获探针分别杂交,取一定浓度的双头光亲和探针与蛋白样品共孵,并将其置于光亲和分子激发光源下照射,激发光交联反应,使捕获探针有效锚定相关靶标蛋白,双头结合探针与双头捕获探针特异性结合,形成“蛋白-探针-蛋白”共价复合物;
3.2提取:
上述混合样品初步去除未结合的游离蛋白后,将所得沉淀干燥溶解;纯化、富集“蛋白-探针-蛋白”复合物后,去除游离探针;
3.3分离与鉴定:
将步骤3.2中的样品溶解后,采用一定方法对生物活性小分子结合靶标进行分离,并对靶标进行鉴定,得到生物活性分子结合靶标。
优选的,s1中,探针骨架为dna骨架、rna骨架或多肽骨架;生物分子包含小分子、适配体、多糖类、多肽类或蛋白质;光亲和分子包括芳香族叠氮类、重氮甲烷类或二苯甲酮类;双头捕获探针上连接有生物反应放大系统,该生物反应放大系统可选择常用的生物素化碱基t,该生物素化碱基t利用click反应合成。
优选的,s1中,
双头结合探针的制备过程如下:首先,制备生物活性小分子的羧基或磺基衍生物,并利用edc/nhs耦合反应制备上述衍生物的活化酯;其次,在探针骨架两端进行氨基修饰,进一步利用氨基与活化酯缩合反应,合成双头结合探针。
双头捕获探针的制备过程如下:首先,制备光亲和分子的羧基或磺基衍生物,并利用edc/nhs耦合反应制备上述衍生物的活化酯;其次,在探针骨架两端进行氨基修饰,进一步利用氨基与活化酯缩合反应,合成双头捕获探针。
双头光亲和探针的纯化采用乙醇沉淀以及色谱分离相结合的步骤进行:
乙醇沉淀:测量混合溶液的体积,先加入十分之一体积的ph为5.0、浓度为3mol/l醋酸钠,后加入十分之一体积的7.5mg/ml的糖原,再加入2~3倍体积的无水乙醇,混合均匀后置于-80℃,放置至少2h;将样品取出,于4℃下,17000g离心,弃上清,向沉淀中加入70%预冷乙醇,震荡洗涤,于4℃下,17000g离心;将所得沉淀干燥后使用醋酸三乙胺缓冲液溶解,进行制备色谱纯化处理,
制备色谱:采用制备型高效液相色谱;流动相:a相:0.1mol/l醋酸三乙胺缓冲液;b相:乙腈;色谱柱:agilentzorbaxxdbc18色谱柱;检测波长:210~400nm;洗脱后使用真空冻干后,使用超纯水复溶后利用超微量荧光分光光度计测定其浓度,
纯化后的探针进行纯度和分子量测定表征后备用。
优选的,s2中,蛋白样品来源于培养的细胞、动物组织或人体样本。蛋白样品提取方法包括裂解液提取、反复冻融法或超声提取法。
优选的,s3中,生物活性小分子结合靶标的分离方法包含电泳分离或高效液相色谱分离;生物活性小分子结合靶标的鉴定包括免疫印迹技术或蛋白质谱鉴定技术;生物活性小分子结合靶标的验证包含表面等离子体共振测试、等温滴定量热测试、细胞热转变分析测试或药物亲和靶标稳定测试。
本发明的有益保障及效果如下:
通过实验,根据本发明方法制备得到的双头光亲和探针纯度高且实测分子量与理论分子量接近,满足实际检测需求。
本发明发现利用双头光亲和探针,给予全细胞提取蛋白复合物,经紫外光捕获,聚丙烯酰胺凝胶电泳分离技术可见特异性结合靶标,大大降低靶标鉴定得非特异性,可用于生物活性小分子得结合靶标鉴定研究,并有助于发现全新疾病结合靶标,具有良好的应用前景。
通过以生物小分子mln8237的靶标鉴定进行验证,本发明方法能够有效鉴定出mln8237的特异性结合靶标和非特异性结合靶标;与单头光亲和探针对比,本发明双头光亲和探针靶标鉴定的灵敏度和准确度更优。
附图说明
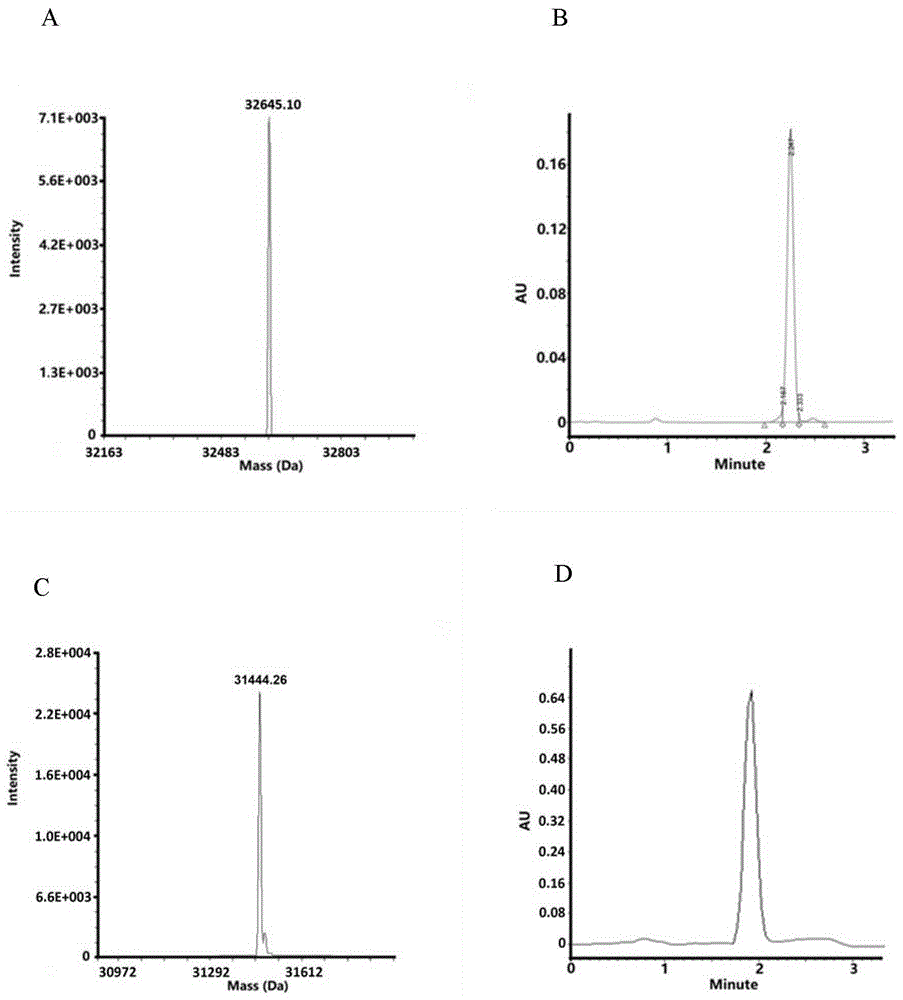
图1为双头dna光亲和探针的表征结果:a为双头结合探针质谱鉴定结果,b为双头结合探针纯度检测结果,c为双头捕获探针质谱鉴定结果,d为双头捕获探针纯度检测结果。
图2为mln8237单头与双头dna光亲和探针对细胞全蛋白提取液中的auroraa、tubulin、hsp60的捕获比较:a为两种探针形式示意图,b为16bp碱基长度的单头与双头dna光亲和探针,c为100bp碱基长度的单头与双头dna光亲和探针。
图3是mln8237的靶标验证结果,a为tubulin结合表面等离子共振鉴定结果,b为hsp60结合表面等离子共振鉴定结果。
具体实施方式
现结合实施例和附图,对本发明作详细描述,但本发明的实施不仅限于此。
本发明所用试剂和原料均市售可得或可按文献方法制备。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按体积计算。
下以靶标相对明确的生物小分子mln8237的靶标鉴定过程为例,对本发明中的鉴定过程进行描述。
实施例1:双头光亲和探针制备、纯化及表征
1.双头光亲和探针的制备
双头光亲和探针以组为单位,由双头结合探针与双头捕获探针共同组成。双头结合探针与双头捕获探针的结构形式类似,参见图2a,均包括位于中间的探针骨架以及结合在骨架两侧的活性分子和生物反应放大系统。
双头结合探针的探针骨架两侧结合相同的生物活性分子,双头捕获探针的探针骨架两侧结合相同的光亲和分子,并且双头结合探针的探针骨架与双头捕获探针的探针骨架碱基互补配对或特异性结合。
本实施例中,探针骨架包含并不局限于dna骨架、rna骨架、多肽骨架等;生物分子包含并不局限于小分子、适配体、多糖类、多肽类、蛋白质等。
(1)双头结合探针的制备:
首先制备生物活性小分子mln8237的羧基或磺基衍生物,并利用edc/nhs耦合反应制备上述衍生物的活化酯;其次在dna结合链的5’端与3’端进行氨基修饰,其中5’端使用5’氨基tfa(cas号:133975-85-6,英文名称5’-amino-modifier-c6-tfacep),3’端直接使用c7氨基固相载体(cb号:cb8356712,英文名称3’-dmt-tc6(nh-fmoc)-cpg),按照常规引物合成即可;进一步利用氨基与活化酯缩合反应,合成双头结合探针。
生物活性小分子mln8237的结合探针的合成路线如下:
(2)双头捕获探针的制备:
首先利用click反应合成生物素化碱基t,作为生物反应放大系统。
其次,在dna捕获链5’端与3’端进行氨基修饰,其次利用edc/nhs耦合反应制备4-叠氮苯甲酸活化酯,进一步利用氨基与活化酯缩合反应进行合成。
捕获探针的合成路线具体如下:
实际合成应用中,生物活性小分子结合靶标的捕获包含并不局限于上述苯基叠氮紫外光自由基交联捕获,包含且不局限于芳香族叠氮类、重氮甲烷类、二苯甲酮类等。
(3)探针的纯化:先乙醇沉淀后使用制备色谱
乙醇沉淀:测量混合溶液的体积,先加入十分之一体积的3mol/l的醋酸钠(ph5.0),后加入十分之一体积的7.5mg/ml的糖原,再加入2.5倍体积的无水乙醇,混合均匀后置于-80℃,放置至少2h;将样品取出,于4℃下,17000g离心15min,弃上清,向沉淀中加入70%预冷乙醇,震荡洗涤,于4℃下,17000g离心5min;将所得沉淀干燥后使用醋酸三乙胺缓冲液溶解,进行制备色谱纯化处理。
制备色谱:系统:agilent1200制备型高效液相色谱。流动相:a相:0.1mol/l醋酸三乙胺缓冲液(triethylamineacetate,teaa);b相:乙腈。色谱柱:agilentzorbaxxdbc18色谱柱(4.6mm×250mm,5μm)。检测器:多波长紫外检测器(210nm至400nm)。洗脱后使用真空冻干后,使用超纯水复溶后利用超微量荧光分光光度计测定其浓度。
(4)探针的表征:
纯度测定:采用高效液相色谱技术来测定探针的纯度,0.1%甲酸水和0.1%甲酸乙腈为流动相,采用0-15min,有机相比例5%-95%大梯度洗脱,紫外全波长检测,根据色谱图中色谱峰面积计算探针纯度,纯度应大于95%。
分子量测定:采用基质辅助激光解吸电离飞行时间质谱仪来测定探针的分子量分布,进行表征鉴定,其使用基质为a:b=8:1的混合溶液,其中a为50mg/ml的3-羟基丙醛乙腈水溶液(乙腈与水体积比为1:1),b为50mg/ml柠檬酸铵水溶液。
本实施例中,通过氨基羧基耦合反应,合成了100bp碱基数目的mln8237-双头dna光亲和探针,并进一步利用质谱技术进行了分子量测定,利用反相色谱技术进行了纯度检测。mln8237光亲和探针中结合探针和捕获探针的相关信息汇总于表1:
表1mln8237光亲和探针信息
结合探针的质谱鉴定结果参见图1a,结合探针实测分子量为32645.10,与理论分子量极其接近,纯度检测结果参见图1b,根据色谱图中色谱峰面积计算探针纯度,纯度为97.3%;捕获探针的质谱鉴定结果参见图1c,实测分子量为31444.26,纯度检测结果参见图1d,纯度为98.2%,均满足大于95%的要求。
实施例2靶标鉴定及验证
1、全细胞蛋白样品的提取
(1)细胞培养及预处理:
人肝癌细胞hep3b于37℃恒温、5%co2细胞培养箱中,培养于含10%胎牛血清、0.1mg/ml链霉素、100u/ml青霉素的dmem高糖培养基中,待生长约80%汇合时,使用0.25%胰酶消化细胞,加入适量含血清培养基终止消化,1000g离心3min,弃上清,使用pbs重悬1000g离心3min,洗涤一次。
(2)蛋白提取:
将上述细胞使用western及ip细胞裂解液重悬,液氮放置3min后,37℃水浴放置5min,重复3次,12000g离心5min,取上清。观察并比较蛋白提取前、后显微镜下台盼蓝染色情况。
(3)含量与纯度测定:
含量测定:蛋白浓度测定使用商品化bca浓度测定试剂盒,按说明操作。将稀释的标准品及待测样品加入96孔板中,另加入等量bca反应试剂后,37℃孵育20min,于562nm波长处酶标仪读取96孔板吸光度值,并根据标准曲线计算。
纯度测定:取等量蛋白,按照上述乙醇沉淀的方法,加入醋酸钠、糖原、无水乙醇,离心得到核酸沉淀,加入适量超纯水溶解,并使用thermonanodrop测定其浓度,计算并比较核酸含量的高低,进一步利用商品化deae吸附柱室温平衡2min,12000g离心5min,去除dna杂质。
蛋白富集:使用0.3kda截断参数的超滤管,12000g离心2min,洗脱即可。
2、生物活性小分子结合靶标的捕获、分离与鉴定
(1)捕获:
将结合探针与捕获探针分别杂交,取一定浓度的双头dna光亲和探针与蛋白样品在4℃摇床孵育。将其置于紫外点光源下照射,照射波长为365nm,照射温度为4℃,激发光交联反应,使探针有效锚定相关靶标蛋白,形成“蛋白-dna-蛋白”共价复合物。
(2)提取:
将上述混合样品利用乙醇沉淀方法初步去除未结合的其他游离蛋白,将所得沉淀干燥后使用磷酸缓冲液或超纯水溶解;利用“生物素-链霉亲和素”磁珠方法,纯化、富集“蛋白-dna-蛋白”复合物,优化洗脱方法;经超滤法去除游离探针,将所得液体真空冻干,用于后续研究。
(3)分离与鉴定:
将上述样品加入适量超纯水,按照其1/4体积加入5×蛋白上样缓冲液后煮沸。采用聚丙烯酰胺凝胶电泳法进行,经分离、转膜、孵育抗体、扫描成像等步骤,实验步骤详见现有技术相关文献。
3、生物活性小分子结合靶标的验证
表面等离子体共振法验证生物活性小分子与其结合靶标间的结合:采用biacoretmt200仪器(gehealth公司)。
蛋白偶联:用氨基偶联方法将蛋白偶联到cm5芯片上,工作缓冲液为pbs,偶联蛋白用10mmnaac稀释至终浓度为200μg/ml。芯片表面用0.2medc和50mmnhs以1:1混合以10μl/min的流速处理7分钟,注射蛋白溶液7分钟,并以ph8.5、1methanolamine进样7分钟封闭活化的芯片表面。
初筛:样品用pbs稀释为含5%dmso的500μm化合物,再稀释为50μm化合物。样品以流速30μl/min进样30s,观察化合物与蛋白的结合状态。
动力学实验:制备含5%dmso的50μm高浓度化合物,之后以2倍比稀释得到系列浓度梯度,工作缓冲液为含5%dmso的pbs缓冲液。样品以流速30μl/min进样60s或120s,解离300s进行动力学实验,得到的数据用biacoret200evaluationsoftware中的动力学模型或稳定结合模型进行拟合分析。信号响应值越大,kd值越低,表示活性组分与其靶标蛋白间物理学结合越强。
4、实验结果
4.1靶标鉴定结果
mln8237又称阿立塞替,因可特异性抑制极光激酶a(aurorakinasea)而成为临床候选药物,两者结合于激酶类蛋白共有的atp结合区域,因此mln8237理论上可结合其他多种激酶或蛋白。前期利用原单头旧方法已鉴定到mln8237的结合靶标,分别是aurorakinasea(auroraa)属于特异性结合,α-tubulin8(tubulin)和heatshockprotein(hsp60)属于非特异性结合。
mln8237单头与双头dna光亲和探针对细胞全蛋白提取液中的auroraa、tubulin、hsp60的捕获比较:其中探针工作浓度为0.1μm,细胞总蛋白500mg,孵育2h,紫外光照30s,光照交联后,加入蛋白上样缓冲液,95℃金属浴10min,免疫印迹法检测上述三种蛋白。
结果如图2所示,在16bp序列中,现双头新方法与原单头旧方法没有差别,捕获样品中仅含有“auroraa-dna”、“tubulin-dna”、“hsp60-dna”,可能是由于空间位阻作用使短链探针两端无法同时与蛋白锚定(图2b);但在100bp序列为100t(mw约为30kda)中,现对比原单头旧方法与现双头新方法,免疫印迹结果显示,含有“auroraa-dna-auroraa”复合物,而不含有“tubulin-dna-tubulin”以及“hsp60-dna-hsp60”,但存在“auroraa-dna”、“tubulin-dna”、“hsp60-dna”复合物(图2c),说明双头新方法可以通过两端蛋白的异同快速确定生物活性小分子的结合靶标,当两端相同时,为特异性结合靶标,当两端不同时,为非特异性结合靶标。
4.2靶标验证
根据图3,表面等离子共振测试显示,tubulin(图3a)和hsp60(图3b)与mln8237的结合响应随着mln8237的浓度升高而升高,呈现线性关系,为非特异性结合,与其他方式的靶标鉴定结果相同。
上述实施例仅通过个别方法对整体实验流程进行说明,但实际应用时,不限于此,如蛋白样品的制备方法不局限于使用western及ip细胞裂解液提取,包含且不局限于使用多种裂解液裂解(ripa、np-40、sds和1%tritonx-100等)、使用反复冻融法、使用超声提取法等。蛋白样品的来源包含但不局限于使用培养的细胞、动物组织、人体样本等。
生物活性小分子结合靶标的分离包含并不局限于上述电泳技术和高效液相色谱技术等分离,包含且不局限于纸电泳、聚丙烯酰胺凝胶电泳、十二烷基硫酸钠聚丙烯酰胺凝胶电泳、醋酸纤维素电泳、琼脂糖凝胶电泳、等点聚焦电泳、毛细管电泳、离子交换高效液相色谱、分子排阻色谱、反相高效液相色谱、正相高效液相色谱、亲水高效液相色谱等。
生物活性小分子结合靶标的鉴定包含并不局限于上述免疫印迹技术,包含且不局限于蛋白质谱鉴定技术。
生物活性小分子结合靶标的验证包含并不局限于上述表面等离子体共振测试,包含并不局限于等温滴定量热测试、细胞热转变分析测试、药物亲和靶标稳定测试等。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可作出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 还没有人留言评论。精彩留言会获得点赞!