一种测定血小板抗体检测的板式免疫荧光试剂盒及其制备方法与流程
1.本发明涉及体外检测技术领域,具体涉及一种基于板式免疫荧光反应
‑
pcr仪检测的技术平台,提供一种测定血小板抗体检测的板式免疫荧光试剂盒及其制备方法。
背景技术:
2.随着输血医学研究的不断深入和成分输血广泛地应用于临床,作为一种重要的临床输血治疗手段,输注血小板对治疗血小板缺乏引起的出血倾向、血小板功能性障碍具有重要价值。然而血小板输注效果不好甚至无效是当前常常面临的问题,患者体内产生的大量血小板抗体对外来血小板的破坏可能是其主要原因。其中长期多次输血治疗的患者更容易产生血小板相关抗体,进而导致许多并发症的发生,比如血小板输血性紫癜(pttp)、血小板输注无效等,造成血液资源的浪费和临床治疗的难度加大。因此,为了改善输血效果以及提高血小板输注效果,输血前进行血小板抗体检测显得尤为重要。
3.近年来,随着科学技术的发展,国内临床使用比较多的主要包括免疫荧光法、微柱凝胶技术以及固相凝集法三类。微柱凝胶技术是利用传统抗原抗体结合反应,若血小板上结合了血小板抗体,则红细胞上抗igg结合血小板抗体,导致凝胶介质中央有明显滞留,反之则在离心后沉降与凝胶介质底部。固相凝集法是血小板经过离心后与反应板中的血小板单抗结合并形成血小板单层。加入样本在板中经过孵育后,若血清中不含有血小板抗体,则经过洗涤可去除,若含有血小板抗体,则此抗体与反应板中的血小板结合,加入抗人igg 及指示细胞,经离心后指示细胞结合到血小板单层上。因为阳性反应为指示细胞铺满反应孔底部,而阴性反应为指示细胞在反应孔底部中间形成红细胞聚集。以上两种方法虽然快速、简便,但是国产试剂盒的抗原谱不明,无法进行进一步分型判定,结果判断相对主观容易造成判读误差。免疫荧光法是利用样本中的血小板抗体与生物载片上的血小板抗原结合,加入荧光标记的抗人igg,通过仪器进行结果测定。该方法实验室要求较高,配套专用仪器。
技术实现要素:
4.本发明的目的是克服现有技术的不足,建立板式免疫荧光反应
‑
pcr仪检测的技术平台,提供一种测定血小板抗体检测的板式免疫荧光试剂盒及其制备方法,灵敏度高、特异性和重复性好,检测因子覆盖面更广,涵盖引发血小板抗体的全部因素,通过荧光数值可以更直观鲜明的对比各孔之间的结果,避免错读误读,减少漏诊误诊。
5.本发明的技术方案如下:
6.本发明是建立板式免疫荧光反应
‑
pcr仪检测的技术平台,提供一种测定血小板抗体检测的板式免疫荧光试剂盒及其制备方法,所述的板式免疫荧光试剂盒的检测仪器为荧光定量pcr仪,所述的板式免疫荧光试剂盒,包括包被有抗原、抗体的96孔板和荧光素标记的抗体。
7.其中,所述96孔分为反应孔、阳性质控孔和阴性质控孔。
8.所述的反应孔中分别包被有如下成分:
9.1)针对hla
‑
i类抗体的hla
‑
i类混合抗原的编码基因的特征性优势序列的表达蛋白;所述的hla
‑
i类抗原类型如表1所示;所述的hla
‑
i类混合抗原的编码基因的特征性优势序列的核苷酸序列如下表2中seq id no.1
‑
seq id no.11所示;
10.2)针对hpa抗体的抗原蛋白gp iib/iiia、gp ib/iia和gp ia/iia;
11.3)cd36抗原;
12.4)针对血小板的cd41单克隆抗体;
13.5)针对单核细胞的cd14单克隆抗体;
14.所述的阳性质控孔中分别包被有人igg和cd36抗原;
15.所述的阴性质控孔中包被有白蛋白;
16.表1 hla
‑
i类混合抗原表
[0017][0018][0019]
所述hla
‑
i类混合抗原蛋白的编码基因是从imgt/hla检索得到。
[0020]
针对hla
‑
i类抗体的hla
‑
i类混合抗原的编码基因的特征性优势序列的选择思路如下:通过dnastar
‑
protean预测各个抗原蛋白的抗原决定簇反应表位,排除无反应表位的基因片段。再通过netoglyc和netnglyc对各个抗原蛋白的编码基因预测n
‑
糖基化位点和o
‑
糖基化位点,排除含有n
‑
糖基化位点和o
‑
糖基化位点的反应表位的片段。由于hla
‑
i 类各个抗原之间具有很高的同源性,在剩下的各个抗原蛋白的编码基因中选择抗原决定簇反应表位同源性较高的片段作为hla
‑
i类混合抗原的特征性优势序列,如表2所示:
[0021]
表2 hla
‑
i类混合抗原的特征性序列
[0022][0023][0024]
其中,所述的荧光素标记抗体为兔抗人igg多克隆抗体和兔抗人cd36单克隆抗体。
[0025]
其中,所述的荧光素为alexafluor
‑
647荧光素。相比于传统荧光素,亮度与信号更强,光稳定性更强,ph敏感性更弱,以及良好的水溶性。
[0026]
其中,所述检测仪器为荧光定量pcr仪为目前国内实验室普遍配备的仪器,荧光检测数据稳定可靠,避免错读误读,减少漏诊误诊。
[0027]
其中,96孔盘中包被的抗原蛋白都是哺乳类细胞表达产物,相比于传统的原核表达出来的蛋白未经修饰,可能没有天然活性的缺点,哺乳动物细胞翻译后再加工修饰产生的外源蛋白质,在活性方面远胜于原核表达系统,更接近于天然蛋白质,可以更好的结合样本中对应的抗体,因此有更好的特异性、灵敏度。
[0028]
其中,96孔盘中包被的与试剂中的抗体都为兔源抗体,相比于传统的鼠源抗体,由于其独特的免疫亲和成熟过程,所以具有更高的亲和力、更强的结果特异性,也使得应用兔源抗体的检测试剂更灵敏。rossi等人应用兔抗对肿瘤和正常组织切片的雌激素受体、黄体酮受体、ki
‑
67、cyclind1、cd3、cd5以及cd23靶标进行免疫组化染色后,兔源抗体在不降低特异性的前提下,进一步提高检测灵敏度。兔源抗体的更强的特异性能够增加对某些特殊抗原表位的识别能力,可识别更多的表位。
[0029]
本发明具有如下技术效果:由于hla
‑
i类的抗原较多,所需检测的因子也非常多,全部进行表达后混合包被、反应,包被抗原蛋白过多可能造成相互干扰,影响抗体正常结合抗原的反应表位,可能造成hla
‑
i类假阴性。且由于hla
‑
i类和hla
‑
ii类之间有一定同源性,可能也会造成交叉反应,造成hla
‑
i类假阳性。通过筛选使用特征性优势序列,更准确的检出出hla
‑
i类抗体的反应。本发明板式免疫荧光反应
‑
pcr仪检测血小板抗体的试剂盒,灵敏度高、特异性和重复性好,涵盖引发血小板抗体的诸多因素,通过荧光数值可以更直观鲜明的对比各孔之间的结果,避免错读误读,减少漏诊误诊。
附图说明
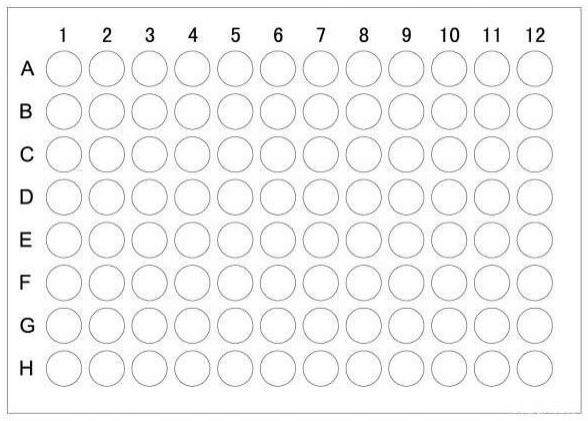
[0030]
图1为96孔板各孔编号示意图。
具体实施方式
[0031]
以下对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
[0032]
实施例1 hla
‑
i类混合抗原的编码基因的特征性优势序列的选择
[0033]
hla
‑
i类抗原的编码基因是从imgt/hla检索得到。
[0034]
通过dnastar
‑
protean预测各个抗原蛋白的抗原决定簇反应表位,排除无反应表位的基因片段。再通过netoglyc和netnglyc对各个抗原蛋白的编码基因预测n
‑
糖基化位点和o
‑
糖基化位点,排除含有n
‑
糖基化位点和o
‑
糖基化位点的反应表位的片段。由于hla
‑
i 类各个抗原之间具有很高的同源性,在剩下的各个抗原蛋白的编码基因中选择抗原决定簇反应表位同源性较高的片段作为hla
‑
i类混合抗原的特征性优势序列,如表11所示:
[0035]
表11 hla
‑
i类混合抗原的特征性序列
[0036][0037][0038]
实施例2
[0039]
特征性优势序列的蛋白表达具体过程如下:
[0040]
将设计好的特征性优势序列,由通用生物系统有限公司设计并合成引物,并在引物设定中加入bamh i和xho i(takara公司)的酶切位点,进行pcr扩增反应,扩增产物使用
1.5%琼脂糖凝胶电泳鉴定。使用bamh i和xho i酶切纯化的pcr产物和pcdna3.1,将凝胶电泳回收分离的目的基因和质粒pcdna3.1(百欧博伟生物技术有限公司)经t4 dna连接酶(takara公司)16℃过夜连接反应,取少量连接物转化感受态细胞dh5α培养过夜,转化菌涂布与100μg/ml氨苄西林的lb固体培养基(10g/l胰蛋白胨、5g/l酵母提取物、10g/l氯化钠,ph=7.4)平板上,37℃孵育。随机挑取单菌落扩大培养后提取重组质粒,经过双酶切鉴定正确后进行序列测定。将重组质粒转染hek293细胞,同时以空载体质粒pcdna3.1转染hek293细胞,37℃、5%co2条件下,恒温培养箱摇速120rpm 培养三天。4℃、2000r/min离心收集细胞培养上清。表达上清经过sds
‑
page电泳分离后,以空载体转染的细胞培养上清作为阴性对照,对表发产物进行western印迹鉴定。将表达产物使用ni
‑
nta柱(ge公司)纯化,纯化后的表达产物使用bradford法进行定量。
[0041]
各个特征性优势序列seq id no.1
‑
11的蛋白表达具体过程均与上述过程基本相同,具体操作方法属于本领域技术人员应该掌握的现有方法,在此不一一详述。
[0042]
实施例3
[0043]
将seq id no.1
‑
11表达纯化后的蛋白样品倍比稀释至4μg/ml分别包被至elisa酶标板中,每个蛋白样品包被两个反应孔和对照孔,100μl/孔,4℃包被18h,200μl/孔洗液清洗两遍,120μl/孔封闭液37℃封闭1h,倒去封闭液,拍干。反应孔中依次加入100μl对应蛋白的hla抗体阳性样本(seq id no.1:a1阳性样本,seq id no.2:a25阳性样本, seq id no.3:a68阳性样本,seq id no.4:b7阳性样本,seq id no.5:b18阳性样本, seq id no.6:c1阳性样本,seq id no.7:c4阳性样本,seq id no.8:c5阳性样本, seq id no.9:c7阳性样本,seq id no.10:c17阳性样本,seq id no.11:c18阳性样本,样本稀释液稀释三倍),对照孔中加入100μl的样本稀释液,室温(22
‑
28℃),300rpm,孵育30分钟。每孔加入200μl洗涤工作液,静置1分钟,拍干,重复5次后拍干。加入 100μl5000倍稀释hrp标记的羊抗人igg(通用生物系统有限公司),室温(22
‑
28℃), 300rpm,孵育30分钟。每孔加入200μl洗涤工作液,静置1分钟,拍干,重复5次后拍干。每孔加入100μltmb显色液,室温下显色10min后加入100μl的2m的硫酸终止液终止显色。结果如表3所示:
[0044]
表3纯化后蛋白样品的反应性
[0045][0046][0047]
通过以上结果得知,seq id no.1
‑
11表达纯化后的蛋白样品与对应的hla抗体阳
性样本反应的信号较强,背景值低,具有良好的反应性。
[0048]
本实施例中,
[0049]
洗液成分(3m磷酸盐缓冲液(ph7.5),0.05%tween
‑
20);
[0050]
样本稀释液成分(100mm tris
‑
hcl、1500mm nacl、0.05%tween
‑
20)。
[0051]
实施例4
[0052]
本发明的测定血小板抗体板式免疫荧光试剂盒,包括如下独立包装的成分:
[0053]
(1)包被有抗原、抗体的96孔板,96孔分为反应孔、阳性质控孔和阴性质控孔。
[0054]
参照图1,96孔包被物分别如下:
[0055]
1a
‑
12a、1b
‑
12b、1c
‑
12c为反应孔,孔中包被了hpa糖蛋白,其中1a
‑
12a包被 gp iib/iiia,1b
‑
12b包被gp ib/iia,1c
‑
12c包被gp ia/iia(gp iib/iiia、gp ib/iia、gp ia/iia, 250倍稀释,abcam);
[0056]
1d
‑
12d为反应孔,孔中包被了实施例2的方法制备的纯化后的hla
‑
i类混合抗原的编码基因的特征性优势序列的表达蛋白(特征性优势序列如seq id no.1
‑
seq id no.11 所示,浓度各为4μg/ml);
[0057]
1e
‑
12e为反应孔,孔中包被了cd36抗原(200倍稀释,acrobiosystems);
[0058]
1f
‑
12f为反应孔,孔中包被了针对血小板的cd41单克隆抗体(500倍稀释,爱博泰克生物科技有限公司);
[0059]
1g
‑
12g为反应孔,孔中包被了针对单核细胞的cd14单克隆抗体(500倍稀释,爱博泰克生物科技有限公司);
[0060]
1h
‑
3h为阳性质控孔,孔中包被了4μg/ml人igg(菲鹏生物股份有限公司)
[0061]
4h
‑
6h为阳性质控孔,孔中包被了cd36抗原(200倍稀释,acrobiosystems)
[0062]
7h
‑
12h为阴性质控孔,孔中包被了4μg/ml白蛋白(sigma
‑
aldrich)。
[0063]
包被方法如下:将96孔板置于37℃恒温包被2h。平衡至室温,洗液100μl清洗两次,每孔中加入100μl5%bsa封闭液,37℃封闭0.5小时。甩干拍干后置于电子干燥箱中27℃干燥18h,真空抽干封存于装有干燥剂的铝箔袋中备用。
[0064]
(2)含有alexafluor
‑
647荧光素标记抗体的磷酸缓冲液试剂,抗体分为兔抗人igg 多克隆抗体和兔抗人cd36单克隆抗体(500倍稀释,通用生物系统有限公司);
[0065]
(3)浓缩磷酸盐洗液(3m磷酸盐缓冲液(ph7.5),0.05%tween
‑
20);
[0066]
(4)tbst样本稀释液(100mm tris
‑
hcl、1500mm nacl、0.05%tween
‑
20)。
[0067]
实施例5采用实施例4的试剂盒进行检测
[0068]
(一)实验前样本处理
[0069]
(1)取2ml新鲜抗凝全血(edta、枸橼酸钠或肝素抗凝均可),用等体积的平衡盐溶液稀释全血;
[0070]
(2)在离心管管壁缓缓加入4mlficoll
‑
paque plus分离液(当稀释后血液体积小于 3ml时,加入3ml分离液;大于等于3ml,加入等体积分离液。但二者的总体积不能超过离心管的三分之二,否则会影响分离效果),将稀释后的血液平铺到分离液液面上方,注意保持两液面界面清晰;
[0071]
(3)室温,水平转子500g,离心20min。离心管中分为三层,上层为血浆与血小板,下层主要为红细胞、嗜碱性粒细胞、中性粒细胞和嗜酸性粒细胞。中层为部分淋巴细胞以及少
量嗜碱性粒细胞分离液。在上、中层界面处有一以单核细胞为主的白色狭窄带,含有部分淋巴细胞与少量的血小板。
[0072]
(4)使用无菌移液管移除含有血浆和血小板的上层,备用。小心的吸取单核细胞层至另一支无菌离心管中,加入至少3倍体积的平衡盐溶液至离心管中,500g,离心20min。弃上清,加入至少3倍体积的平衡盐溶液至离心管中,500g,离心20min,去除上清液,得到单核细胞的样本,用于cd36抗原分型检测。
[0073]
(5)含有血浆和血小板的上层移至另一支无菌离心管中,加入至少3倍体积的平衡盐溶液至离心管中,500g,离心20min。弃上清,加入至少3倍体积的平衡盐溶液至离心管中,500g,离心20min,去除上清液,得到富含血小板的样本,用于hla
‑
i类抗体、 hpa抗体、cd36抗体以及cd36抗原分型检测。
[0074]
(二)重复性实验方法及结果
[0075]
(1)用样本稀释液3倍稀释待测样本,反应孔中加入25μl稀释后的同一阳性样本,阴性质控孔和阳性质控孔中加入25μl的样本稀释液,室温(22
‑
28℃),300rpm,孵育 30分钟;
[0076]
(2)如用手动洗板,吸弃孔内液体,每孔加入100μl洗涤工作液,静置1分钟,拍干,重复5次后拍干。如用全自动洗板机,自动洗板5次,完成后拍干。避免微孔间交叉污染;
[0077]
(3)包被了hpa糖蛋白(gp iib/iiia、gp ib/iia、gp ia/iia)、hla
‑
i类的混合抗原、cd36抗原的检测反应孔、阳性质控孔(1h
‑
3h)和阴性质控孔(7h
‑
9h)中加入25μl的 alexafluor荧光素标记的兔抗人igg多克隆抗体,包被了cd41抗体以及cd14抗体的检测反应孔、阳性质控孔(4h
‑
6h)和阴性质控孔(10h
‑
12h)中加入25μl的alexafluor 荧光素标记的兔抗人cd36单克隆抗体,室温(22
‑
28℃),300rpm,孵育30分钟;
[0078]
(4)重复(2)洗板;
[0079]
(5)将96孔板置于荧光定量pcr仪的样品架中,进行测定,读取荧光信号值。
[0080]
本发明实施案例中的实施例2的结果如表4所示:
[0081]
表4检测结果
[0082] 123456789101112a265264286148279251272951297647279777284834268476290854283422269310255810b236970238003242499233063240588242317225309240745246794227062234573205459c216814192497224173215405216594191929212876226094193291213608199116200464d339453354517340569343933336945353362364674350888329600335107322968360053e141033128254137530138394134367130875129253129881122936126473145478143173f707727310376232797507998876784768987585079182760417961370485g10362198991103630105556107589103753996241044169969098533109356102590h143545156839142915569905707257515864683717924255536453200
[0083]
对以上同一样本不同孔间结果进行分析,分析结果如表5所示:
[0084]
表5重复性结果分析
[0085]
[0086]
从这一结果可以看出,基于板式免疫荧光反应
‑
pcr仪检测的技术平台,测定血小板抗体检测的板式免疫荧光试剂盒具有很好的重复性。
[0087]
(三)符合性实验方法及结果
[0088]
(1)用样本稀释液3倍稀释待测样本,在反应孔中加入25μl稀释后的参照阴阳性样本,阴性质控孔和阳性质控孔中加入25μl的样本稀释液,室温(22
‑
28℃),300rpm,孵育30分钟;
[0089]
(2)如用手动洗板,吸弃孔内液体,每孔加入100μl洗涤工作液,静置1分钟,拍干,重复5次后拍干。如用全自动洗板机,自动洗板5次,完成后拍干。避免微孔间交叉污染;
[0090]
(3)在包被了hpa糖蛋白(gp iib/iiia、gp ib/iia、gp ia/iia)、hla
‑
i类的混合抗原、cd36抗原的检测反应孔、阳性质控孔(1h
‑
3h)和阴性质控孔(7h
‑
9h)中加入25μl 的alexafluor荧光素标记的兔抗人igg多克隆抗体,包被了cd41抗体以及cd14抗体的检测反应孔、阳性质控孔(4h
‑
6h)和阴性质控孔(10h
‑
12h)中加入25μl的alexafluor 荧光素标记的兔抗人cd36单克隆抗体,室温(22
‑
28℃),300rpm,孵育30分钟;
[0091]
(4)重复(2)洗板;
[0092]
(5)将96孔板置于荧光定量pcr仪的样品架中,进行测定,读取荧光信号值,结果如表6
‑
10所示:
[0093]
表6对比结果
[0094][0095]
通过以上结果可以得出,对照试剂pakplus assay的60例阳性样本,本试剂盒检测出 57例阳性,阳性符合率为95%。对照试剂pakplus assay的60例阴性样本,本试剂盒检测出58例阴性,阴性符合率为96.7%。其中阴阳性样本检测结果不相符的阳性样本为3份,阴性样本为2份,合计5份,总符合率为95.83%。
[0096]
表7对比结果
[0097][0098]
通过以上结果可以得出,对照试剂pakplus assay的40例阳性样本,本试剂盒检测出 38例阳性,阳性符合率为95%。对照试剂pakplus assay的40例阴性样本,本试剂盒检测出39例阴性,阴性符合率为97.5%。其中阴阳性样本检测结果不相符的阳性样本为2份,阴性样本为1份,合计3份,总符合率为96.25%。
[0099]
表8对比结果
[0100][0101]
通过以上结果可以得出,对照试剂pakplus assay的50例阳性样本,本试剂盒检测出 49例阳性,阳性符合率为98%。对照试剂pakplus assay的50例阴性样本,本试剂盒检测出48例阴性,阴性符合率为96%。其中阴阳性样本检测结果不相符的阳性样本为1份,阴性样本为2份,合计3份,总符合率为97%。
[0102]
表9对比结果
[0103][0104]
通过以上结果可以得出,流式细胞仪的30例阳性样本,本试剂盒检测出28例阳性,阳性符合率为93.33%。流式细胞仪的30例阴性样本,本试剂盒检测出30例阴性,阴性符合率为100%。其中阴阳性样本检测结果不相符的阳性样本为2份,阴性样本为0份,合计2份,总符合率为96.67%。
[0105]
表10对比结果
[0106][0107]
通过以上结果可以得出,流式细胞仪的40例阳性样本,本试剂盒检测出40例阳性,阳性符合率为100%。流式细胞仪的40例阴性样本,本试剂盒检测出39例阴性,阴性符合率为97.5%。其中阴阳性样本检测结果不相符的阳性样本为0份,阴性样本为1份,合计1份,总符合率为98.75%。
[0108]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1