多层膜及其制备方法
多层膜及其制备方法
1.相关申请的引用
2.本技术要求2019年11月12日提交的新加坡申请号10201910574r的优先权,其公开内容通过引用并入本技术。
技术领域
3.本发明一般地涉及一种用于分离水性样品中的组分的多层膜。本发明还涉及制备该多层膜的方法。本发明还涉及从全血样品中分离血浆的方法。本发明还涉及用于从全血样品中分离血浆的诊断装置。
背景技术:
4.干血斑(dbs)是一种微创采血技术,其中从刺穿的手指远程采集几滴毛细血管全血到滤纸上,干燥并运输以供将来分析。随着有效dbs流的部署,公众在家收集自己的生物样品并将其送往国有医院进行集中分析将是一个更简单、更便宜的过程。历史上,dbs在简单的纤维素纸上处理干全血。
5.与传统的静脉采血相比,dbs具有优势。其提供了更简单的样品采集、储存和转移,降低了各种病原体的感染风险。此外,dbs采集相对无痛,更适合静脉受损/改变的患者、老年人或婴儿。dbs的使用也将患者的采血量降至最低。虽然dbs是一种可行且广泛应用的采血技术,但dbs也存在局限性。首先,dbs的小样品量和检测灵敏度意味着其需要高样品质量才能提供准确的结果。这个问题可以通过诸如质谱法的最新技术进步来解决。第二,尽管大多数分析物在dbs上是稳定的,但一些不稳定的化合物由于其与酶抑制剂相互作用而在储存中非常具有挑战性。血液诊断中存在血细胞也可能干扰诊断量化,导致灵敏度低、结果不可靠或假阴性。红细胞压积水平(通过压积红细胞所占体积与全血体积的比来测量的)也是影响dbs卡性能的可变因素。因此,优选将血浆与全血分离,以避免血细胞的干扰,促进干血斑(dps)卡的开发,其是dbs卡的一种流行替代品。
6.dps的目标是血浆,而不是采集全血。在全血的组成中,血浆几乎占血容量的55%。血浆主要由水组成;然而,其他化合物,例如血蛋白、营养素、激素等,对人类至关重要,因为其可以用于临床诊断。在临床上,无细胞血浆始终是优选。许多护理标准基于通过离心提取的血浆。然而,dbs应用中可能不期望离心,因为通常在现场少量采集样品。此外,还缺乏能够同时分离血细胞和吸收血浆的dps装置。
7.因此,需要一种改善上述一个或多个缺点的dps装置。需要提供一种用于此类dps装置的膜,其改善上述一个或多个缺点。需要提供一种形成此类膜的方法,其改善上述一个或多个缺点。
技术实现要素:
8.在一个方面,提供了一种用于分离水性样品中的组分的多层膜,包括多孔层和吸收层,所述多孔层用于从所述水性样品中分离至少一种组分或保留其中的至少一种组分;
所述吸收层包括用于从所述多孔层去除或保留液体的超吸收材料或吸收材料。
9.水性样品可以是生物样品,例如全血样品或血浆样品。
10.有利地,多层膜可显示至少95%、或约100%的血细胞保留,从而消除分离的血浆中的血细胞的存在,使得血浆诊断的灵敏度更高且更可靠。
11.更有利地,多层膜可增强血浆渗透性,从而实现更高的血浆回收率,进而提高临床试验的准确性。
12.更有利地,多层膜可使血浆回收率为总血容量的约10%至约40%。
13.更有利地,多层膜可提高诸如氨基酸和血蛋白的生物分子的渗透速率,从而实现更高的生物分子回收率,进而提高临床试验的准确性。
14.仍更有利地,分离的血浆是脱水的(或至少具有最少量的水),因为吸收层从样品中吸收大部分液体(如果不是全部的话)。分离的血浆的脱水有助于稳定和保存血浆样品。
15.在另一方面,提供了一种制备包括多孔层和吸收层的多层膜的方法,该方法包括以下步骤:
16.(a)提供在溶剂中的多孔层材料的涂料溶液(dope solution);
17.(b)通过选自由静电纺丝、非溶剂诱导相分离(nips)、热诱导相分离(tips)、蒸汽诱导相分离(vips)、nips和tips的组合(n-tips)及其组合组成的组的方法,浇铸涂料溶液以形成多孔层;以及
18.(c)通过物理相互作用或化学处理并入与多孔层相邻的吸收层,其中吸收层包括用于从所述多孔层去除或保留液体的超吸收材料或吸收材料。
19.在另一方面,提供了一种从全血样品中分离血浆的方法,包括将所述全血样品施加到多层膜上,其中所述多层膜包括多孔层和吸收层,所述吸收层包括用于从所述多孔层去除或保留液体的超吸收材料或吸收材料。
20.有利地,该方法可允许同时从全血中分离血浆和将分离的血浆脱水。这种同时的方法可以提供一种简单的样品收集、储存和转移方法,降低病原体感染的风险。
21.更有利地,该方法可能是一种简单且廉价的方法,患者可以在家中方便地收集自己的生物样品,并将生物样品发送到国家医院进行集中分析。
22.在另一方面,提供了一种用于从全血样品中分离血浆的诊断装置,包括含多孔层和吸收层的多层膜,吸收层包括用于从所述多孔层去除液体的超吸收或吸收材料。
23.定义
24.本文中使用的以下词语和术语应具有指出的含义。
25.术语“多层”应广义地解释为包括双层、三层等。
26.如本文所用,术语“多孔”是指具有在0.1μm至大于30μm范围内的有效孔径和在40%至95%范围内的孔密度的孔。
27.术语“血浆回收率”是指血液样品中透过多孔层到达吸收层的血浆的百分比。当吸收层为一张滤纸时,血浆回收率的计算公式为血浆回收率(%)=(吸收后滤纸重量-吸收前滤纸重量)/(血浆密度
×
总进料血容量)。
28.术语“上表面”是指形成时面朝上的膜的表面,其包括如本文所述的多孔结构。
29.术语“下表面”是指形成时面朝下的膜的表面,其包括如本文所述的多孔结构。在不对称膜中,“下表面”与“上表面”的区别在于,与“上表面”相比,“下表面”具有更大的孔,
其中更大的孔的孔径可能大于30μm。
30.词语“基本上”并不排除“完全”,例如,“基本上不含”y的组合物可以完全不含y。必要时,可以从本发明的定义中省略词语“基本上”。
31.除非另有规定,否则术语“包括(comprising)”和“包括(comprise)”及其语法变体旨在代表“开放式”或“包含式”语言,使得其包括引用的元素,但也允许包含其他未引用的元素。
32.在整个本公开中,某些实施方案可以范围形式公开。应当理解,范围形式的描述仅仅是为了方便和简洁,不应理解为对所公开范围的范围的硬性限制。因此,应该认为对范围的描述已经具体公开了所有可能的子范围以及该范围内的单个数值。例如,对诸如1至6的范围的描述应视为具有具体公开的子范围,例如1至3、1至4、1至5、2至4、2至6、3至6等,以及该范围内的单个数字,例如1、2、3、4、5和6。无论范围的广度如何,这都适用。
33.某些实施方案也可在本文中广泛且一般地描述。落入一般公开范围内的每一个较窄的类别和亚类分组也构成本公开的一部分。这包括从所述类别中移除任何主题的附带条件或否定限制来对实施方案的一般描述,,无论在本文是否特别列举了被移除的材料。
34.实施方案的详细公开
35.现在将公开用于分离水性样品中的组分的多层膜的示例性、非限制性实施方案。
36.多层膜包括多孔层和吸收层,所述多孔层用于从所述水性样品中分离至少一种组分或在保留其中的至少一种组分;所述吸收层包括用于从所述多孔层去除液体的超吸收材料或吸收材料。
37.在多层膜中,多孔层可包含通常具有以下范围的有效孔径的孔:约0.1μm至大于约30μm、约0.1μm至约25μm、约0.1μm至约10μm、约0.1μm至约5μm、约0.1μm至约2μm、约0.1μm至约1μm、约1μm至约3μm、约2μm至约3μm、约0.25μm至约3μm、约0.1μm至约3μm、约1μm至大于约30μm、约3μm至大于约30μm、约5μm至大于约30μm、约10μm至大于约30μm、约15μm至大于约30μm、约20μm至大于约30μm、或约25μm至大于约30μm。
38.在多层膜中,多孔层可具有在以下范围内的孔密度:约40%至约95%、约40%至约90%、约40%至约80%、约40%至约70%、约40%至约60%、约40%至约50%、约50%至约95%、约60%至约95%、约70%至约95%、约80%至约95%、或约90%至约95%。
39.多孔层可包括对称或不对称的膜基质。
40.包括对称膜基质的多孔层在其所有表面上和在多孔层本身内可具有相同的孔径和孔密度范围,如上述定义的那些。包括不对称膜基质的可剥离基质层在不同表面上可具有不同范围的孔径和孔密度。因此,多孔层下表面上的孔的孔径可以大于30μm,而多孔层上表面上的孔的孔径可以在约0.1μm至约3μm的范围内(包括其中的子范围和离散值)。在多孔层本身内,在从上表面到下表面观察时,孔径的值可在形成梯度的值范围内,因此,多孔层内的孔的孔径可在约0.1μm至大于约30μm(包括其中的子范围和离散值)的范围内,取决于其是更接近上表面还是更接近下表面。多孔层内的孔可以从上表面到下表面是连续的,或者可以是不连续的,而是在多孔层内形成袋状。
41.在多层膜中,多孔层可被进一步改性以防止血液凝结并减少自由基。此类改性可包括涂层、表面改性或向多孔层添加抗凝结剂或聚合物(视情况而定),这将在本领域技术人员的已知范围内。
42.多孔层可以是亲水性多孔层、疏水性多孔层或其组合。
43.在多层膜中,多孔层的材料没有特别限制,且示例性材料可以是聚丙烯腈(pan)、聚醚砜(pes)、醋酸纤维素(ca)、磺化聚砜(spsf)、磺化聚醚砜(spes)、醋酸丁酸纤维素、乙基纤维素、羟丙基纤维素、聚氨酯、泊洛沙姆多元醇、聚乙烯醇、聚(氯乙烯)、聚四氟乙烯(ptfe)、聚偏二氟乙烯(pvdf)、或其组合。
44.分离或保留步骤包括在多层膜上添加水性样品液滴。然后,水性样品在重力作用下流过多层膜中的孔。因此,小于多孔层的孔的组分保留在表面上或多孔层的内部,并且与小于多孔层的孔的组分分离,所述小于多孔层的孔的组分可以流过孔并被吸收层吸收。
45.水性样品没有特别限制,示例性样品可以是血液、血浆、尿液、唾液或其组合。
46.分离或保留步骤可将水性样品中的分析物与杂质分离或保留。分析物可进行用于检测疾病的分析。
47.水性样品可包括大于多孔层的孔的组分和小于多孔层的孔的组分。
48.大于多孔层的孔的组分没有特别限制,示例性组分可以是红细胞、白细胞、血小板或其组合。
49.小于多孔层的孔的组分没有特别限制,示例性组分可以是小分子、抗原、抗体、dnas、蛋白质或其组合。
50.在多层膜中,多孔层可置于吸收层之上。
51.多孔层和吸收层可以彼此物理接触。
52.多孔层和吸收层可通过重力、粘结剂、胶带、钉书钉、磁力、热压、液压、使用自粘层(self-adhesive cover)或其组合在适当位置。
53.多孔层可具有在约0.5μm至约500μm、约5μm至约500μm、约50μm至约500μm、约0.5μm至约50μm、或约0.5μm至约5μm的范围内的厚度。
54.多孔层可具有在约1cm2至约10000cm2、约10cm2至约10000cm2、约100cm2至约10000cm2、约1000cm2至约10000cm2、约1cm2至约1000cm2、约1cm2至约100cm2、或约1cm2至约10cm2的范围内的面积。
55.吸收层可具有在约10μm至约1000μm、约100μm至约1000μm、约500μm至约1000μm、约10μm至约500μm、或约10μm至约100μm的范围内的厚度。
56.吸收层可具有在约0.05cm2至约100cm2、约1cm2至约100cm2、约10cm2至约100cm2、约50cm2至约100cm2、约0.05cm2至约1cm2、约0.05cm2至约10cm2、或约0.05cm2至约5cm2的范围内的面积。吸收层可具有至少与多孔层相同的面积,以吸收穿过多孔层的水性样品中的所有组分。
57.在多层膜中,所使用的超吸收材料或吸收材料没有特别限制,示例性材料可以是聚丙烯酸钠、聚丙烯酸、海藻酸、淀粉、羟乙基淀粉、改性淀粉、α-纤维素、改性纤维素、壳聚糖、羧甲基纤维素、蒙脱土、聚乙烯醇、聚氧化乙烯、聚丙烯酰胺、水解聚丙烯腈、葡聚糖、羧甲基葡聚糖、碳纳米管、二氧化硅、棉花、人造丝、纤维素浆、合成浆、竹丝、沸石、玻璃纤维、聚酯纤维、聚乙烯纤维、羊毛、及其混合物。
58.多层膜还可包括顶层,顶层包括可剥离基质层。
59.可剥离基质层和多孔层可以彼此物理接触。
60.可剥离基质层和多孔层可通过重力、胶粘剂、胶带、钉书钉、磁力、热压、液压、自粘
层或其组合保持在适当位置。
61.可剥离基质层可保留水性样品中大于其孔的组分。可剥离带有保留的组分的可剥离基质层,以对组分进行分析。
62.可剥离基质层可包含通常具有以下范围的有效孔径的孔:约0.1μm至大于约30μm、约0.1μm至约25μm、约0.1μm至约10μm、约0.1μm至约5μm、约0.1μm至约2μm、约0.1μm至约1μm、约1μm至约3μm、约2μm至约3μm、约0.25μm至约3μm、约0.1μm至约3μm、约1μm至大于约30μm、约3μm至大于约30μm、约5μm至大于约30μm、约10μm至大于约30μm、约15μm至大于约30μm、约20μm至大于约30μm、或约25μm至大于约30μm。
63.可剥离基质层可具有在以下范围内的孔密度:约40%至约95%、约40%至约90%、约40%至约80%、约40%至约70%、约40%至约60%、约40%至约50%、约50%至约95%、约60%至约95%、约70%至约95%、约80%至约95%、或约90%至约95%。
64.可剥离基质层可包括对称或不对称膜基质。
65.包括对称膜基质的可剥离基质层在其所有表面上的孔径和孔密度范围可以相同。包括不对称膜基质的可剥离基质层在不同表面上可具有不同范围的孔径和孔密度。因此,可剥离基质层下表面上的孔的孔径可以大于30μm,而可剥离基质层上表面上的孔的孔径可以在约0.1μm至约3μm的范围内(包括其中的子范围和离散值)。在可剥离基质层本身内,在从上表面到下表面观察时,孔径的值可在形成梯度的值范围内,因此,可剥离基质层内的孔的孔径可在约0.1μm至大于约30μm(包括其中的子范围和离散值)的范围内,取决于其是更接近上表面还是更接近下表面。可剥离基质层内的孔可以从上表面到下表面是连续的,或者可以是不连续的,而是在可剥离基质层内形成袋状。
66.可剥离基质层可以是亲水性可剥离基质层、疏水性可剥离基质层或其组合。
67.在多层膜中,可剥离基质层的材料没有特别限制,且示例性材料可以是聚丙烯腈(pan)、聚醚砜(pes)、醋酸纤维素(ca)、磺化聚砜(spsf)、磺化聚醚砜(spes)、醋酸丁酸纤维素、乙基纤维素、羟丙基纤维素、聚氨酯、泊洛沙姆多元醇、聚乙烯醇、聚(氯乙烯)、聚四氟乙烯(ptfe)、聚偏二氟乙烯(pvdf)、或其组合。
68.可剥离基质层可具有在约0.5μm至约500μm、约5μm至约500μm、约50μm至约500μm、约0.5μm至约50μm、或约0.5μm至约5μm的范围内的厚度。
69.可剥离基质层可具有在约0.1cm2至约100cm2、约10cm2至约50cm2、约50cm2至约100cm2、约0.1cm2至约1cm2、约1cm2至约100cm2、约1cm2至约10cm2、或约0.1cm2至约1cm2的范围内的面积。可剥离基质层可具有至多与多孔层相同的面积,因此,穿过可剥离基质层的水性样品的所有组分都可进入多孔层。
70.现在将公开制备包含多孔层和吸收层的多层膜的方法的示例性非限制性实施方案。
71.该方法包括以下步骤:(a)提供在溶剂中的多孔层材料的涂料溶液;(b)通过选自静电纺丝、非溶剂诱导相分离(nips)、热诱导相分离(tips)、蒸汽诱导相分离(vips)、nips和tips的组合(n-tips)及其组合的方法,浇铸涂料溶液以形成多孔层;以及(c)通过物理相互作用或化学处理并入与多孔层相邻的吸收层,其中所述吸收层包括用于从所述多孔层去除液体的超吸收材料或吸收材料。该方法可用于制备如上所述的多层膜,其中所述多层膜包括多孔层和吸收层,所述吸收层包括用于从所述多孔层去除液体的超吸收材料或吸收材
料。
72.步骤(a)可用多孔层材料浓度在约3.0重量%至约10.0重量%、约3.0重量%至约9.0重量%、约3.0重量%至约7.0重量%、约3.0重量%至约5.0重量%、约5.0重量%至约10.0重量%、约7.0重量%至约10.0重量%或约9.0重量%至约10.0重量%的范围内的涂料溶液进行。
73.在步骤(a)中,所使用的溶剂没有特别限制,示例性溶剂可为n-甲基吡咯烷酮(nmp)、二甲基甲酰胺(dmf)、二甲基乙酰胺(dmac)、二甲基亚砜(dmso)、六氟异丙醇及其组合。
74.步骤(a)中的涂料溶液可还包括添加剂。步骤(a)中的涂料溶液可以是溶剂和添加剂的组合。
75.所使用的添加剂没有特别限制,示例性添加剂可以是甲醇、乙醇、异丙醇、丙酮、四氢呋喃、水、甘油、乙二醇及其组合。
76.添加剂可用于调整形成的膜的孔径、孔隙率和结构。
77.步骤(a)可用组合溶剂和添加剂的浓度在约90.0重量%至约97.0重量%、约90.0重量%至约95.0重量%、约90.0重量%至约93.0重量%、约90.0重量%至约91.0重量%、约91.0重量%至约97.0重量%、约93.0重量%至约97.0重量%或约95.0重量%至约97.0重量%的范围内的涂料溶液进行。
78.在步骤(a)中,所使用的多孔层材料可以是亲水性材料、疏水性材料或其组合。
79.在步骤(a)中,所使用的多孔层材料没有特别限制,示例性材料可以是聚丙烯腈(pan)、聚醚砜(pes)、磺化聚砜(spsf)、磺化聚醚砜(spes)、醋酸纤维素(ca)、醋酸丁酸纤维素、乙基纤维素、羟丙基纤维素、聚氨酯、泊洛沙姆多元醇、聚乙烯醇、聚氯乙烯、聚四氟乙烯(ptfe)、聚偏二氟乙烯(pvdf)及其组合。
80.在步骤(a)中,通过将多孔层材料与溶剂(任选地与添加剂)混合来提供涂料溶液。
81.在一个实施方案中,可通过将多孔层材料添加到溶剂中并将其搅拌一段时间和温度来进行混合步骤。搅拌速度可在约50rpm至约150rpm的范围内,在约50℃至约100℃范围内的温度下,并持续约6小时至约18小时的时间。然后可将涂料溶液冷却至室温以添加添加剂。可在室温下进一步搅拌涂料溶液,直到获得均匀溶液,其中搅拌速度可在约50rpm至约150rpm的范围内。
82.在一个实施方案中,可通过将多孔层材料添加到溶剂和添加剂的混合物中来进行混合步骤。然后将涂料溶液搅拌一段时间和温度,直到获得均匀溶液。搅拌速度可在约50rpm至约150rpm的范围内,在约50℃至约100℃范围内的温度下,并持续约2小时至约6小时的时间。通过这种方法制备的涂料溶液可用于n-tips。
83.浇铸步骤(b)可通过静电纺丝方法进行。
84.在静电纺丝法中,将涂料溶液装入注射器,然后以一定的流速从针头中推出。通过在针尖添加高压,当来自高压的静电斥力克服涂料溶液的表面张力时,被推出的涂料溶液可以被拉伸,从而形成纳米纤维。通过延长纤维收集时间后收集纳米纤维,可以将其制成膜。
85.可以使用接地的收集器进行收集步骤。所使用的收集器没有特别限制,示例性收集器可以是滚筒、金属板、平行电极或其组合。
86.收集步骤可使用滚筒以辊速进行。可以调整辊速,以改变收集的纳米纤维的物理特性。
87.浇铸步骤(b)可通过静电纺丝法进行,纤维收集时间在约15分钟至约120分钟、约15分钟至约90分钟、约15分钟至约60分钟、约15分钟至约30分钟、约30分钟至约120分钟、约60分钟至约120分钟、或约90分钟至约120分钟的范围内。收集时间可为约30分钟。
88.浇铸步骤(b)可通过静电纺丝方法进行,辊速在约70rpm至约1000rpm、约70rpm至约800rpm、约70rpm至约600rpm、约70rpm至约400rpm、约70rpm至约200rpm、约200rpm至约1000rpm、约400rpm至约1000rpm、约600rpm至约1000rpm、或约800rpm至约1000rpm的范围内。
89.浇铸步骤(b)可通过nips、tips、vips或n-tips方法进行。
90.在nips、tips、vips和n-tips方法中,涂料溶液可在高温下倾倒在浇铸板上,然后使用浇铸刀在浇铸板上铺展。铺展的涂料溶液可随后分别通过用于nip、tips、vip或n-tips的添加处理、冷却处理、蒸汽处理或添加处理和冷却处理的组合转化为固体膜。
91.浇铸板没有特别限制,示例性浇铸板可以是玻璃、皮带、金属或其组合。
92.在铺展步骤中,浇铸刀可保持在浇铸板上方的一定高度处。可以调整浇铸刀的高度,以改变形成的固体膜的厚度。
93.浇铸步骤(b)可通过nips、tips或n-tips法进行,浇铸刀的高度在约50μm至约500μm、约50μm至约400μm、约50μm至约300μm、约50μm至约200μm、约50μm至约100μm、约100μm至约500μm、约200μm至约500μm、约300μm至约500μm、或约400μm至约500μm的范围内。
94.浇铸步骤(b)可通过静电纺丝法进行,溶剂和添加剂的重量百分比在约100:1至约3:1、约100:1至约9:1、约100:1至约20:1、约100:1至约50:1、约50:1至约3:1、约20:1至约3:1、或约9:1至约3:1的范围内。
95.浇铸步骤(b)可通过tips法进行,并通过vips工艺进行部分涂料相分离。
96.浇铸步骤(b)可通过tips法进行,多孔层材料为pan,溶剂为体积百分比为85/15的二甲基亚砜dmso/水的混合溶剂。
97.在浇铸步骤(b)中,多孔层材料的浓度可在约40.0mg/ml至约120.0mg/ml、约40.0mg/ml至约100.0mg/ml、约40.0mg/ml至约80.0mg/ml、约40.0mg/ml至约60.0mg/ml、约60.0mg/ml至约120.0mg/ml、约80.0mg/ml至约120.0mg/ml、约100.0mg/ml至约120.0mg/ml、约60.0mg/ml至约70.0mg/ml、或约60.0mg/ml至约65.0mg/ml的范围内。
98.浇铸步骤(b)可通过n-tips法进行,涂料溶液的冷却处理和添加剂处理在25℃下于添加剂中冷却。添加剂可任选地以与溶剂的混合物形式提供。所使用的溶剂没有特别限制,示例性溶剂可为n-甲基吡咯烷酮(nmp)、二甲基甲酰胺(dmf)、二甲基乙酰胺(dmac)、二甲基亚砜(dmso)、六氟异丙醇及其组合。
99.混合物的添加剂和溶剂的体积比可在约1:9至约5:5、约2:8至约5:5、约3:7至约5:5、约4:6至约5:5、约1:9至约4:6、约1:9至约3:7、或约1:9至约2:8的范围内。
100.浇铸步骤(b)可通过n-tips法进行,多孔层材料为pan。
101.多孔层材料的浓度可在约3.60重量%至约6.50重量%、约3.60重量%至约6.00重量%、约3.60重量%至约5.00重量%、约3.60重量%至约4.00重量%、约4.00重量%至约6.50重量%、约5.00重量%至约6.50重量%、或约6.00重量%至约6.50重量%的涂料溶液
的范围内。
102.多孔层可以进一步进行物理或化学修饰,以包含期望的分子的特定结合位点。
103.在步骤(c)中,保持吸收层和多孔层彼此相邻的物理相互作用可包括重力、胶带、订书钉、磁力、热压、液压、自粘封盖或其组合。
104.在步骤(c)中,保持吸收层和多孔层彼此相邻的化学相互作用可包括形成交联聚合物、形成氢键或其组合。
105.现在将公开从全血样品中分离血浆的方法的示例性、非限制性实施方案。该方法包括将全血样品施加到多层膜上。
106.多层膜可包括多孔层和吸收层。吸收层可包括用于从多孔层去除液体的超吸收材料或吸收材料。
107.在施加步骤中,大于多孔层的孔的全血样品的组分可以保留在多孔层的上方或内部。小于多孔层的孔的全血样品的组分可穿过孔,随后被吸收层吸收。
108.在该方法中,全血样品可施加在多孔层的下表面,其中与多孔层的上表面相比,该下表面存在孔径大于30μm的较大孔。
109.当将全血样品施加到下表表面时,上表面和吸收层之间的接触可提供额外的毛细管力,以改善全血样品通过膜的流动。
110.当将全血样品施加到下表面时,由于下表面的较大孔径,全血样品可具有提高的扩散,从而增加改善全血样品通过膜的流动。
111.多层膜可如上所定义。
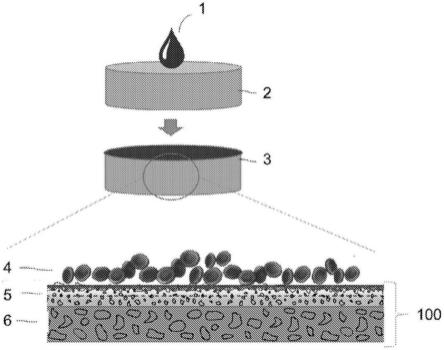
112.现在将公开用于从全血样品分离血浆的诊断装置的示例性、非限制性实施方案。诊断装置包括多层膜。
113.多层膜可包括多孔层和吸收层。吸收层可包括用于从多孔层去除液体的超吸收材料或吸收材料。多层膜可如上所定义。
114.诊断装置还可包括多层膜上方的血液过滤器。
115.血液过滤器可以去除采集全血样品时形成的血块和血小板小团块。这可能会使全血样品带有分离的血细胞和更小的组分,从而提高诊断装置的准确性和寿命。
116.血液过滤器可包括生物相容性聚合物的多孔膜。
117.多孔膜可具有平均有效直径在约10μm至约300μm、约100μm至约300μm、约200μm至约300μm、约10μm至约200μm或约10μm至约100μm范围内的孔。
118.多孔膜可具有在约0.5mm至约2mm、约1mm至约2mm、约1.5mm至约2mm、约0.5mm至约1.5mm、或约0.5mm至约1mm的范围内的厚度。
119.生物相容性聚合物没有特别限制,示例性生物相容性聚合物可以是聚酯、聚碳酸酯、聚丙烯酰胺或其组合。
120.当诊断装置用于从血细胞中分离血浆并使其脱水时(如图1所示),血液样品被滴到装置表面上,由于尺寸排阻,血细胞可能被保留并阻止进入多层膜。在重力的驱动下,液体血浆将与小于多孔层的孔的组分一起渗透到多层膜中。为了防止样品降解,特别地并入位于底部的吸收层以使血浆完全脱水。
附图说明
121.附图示出了所公开的实施方案,并用于解释所公开的实施方案的原理。然而,应当理解,设计附图仅用于说明目的,而不是作为限制本发明的定义。
122.图1
123.[图1]是用于血浆分离和血细胞脱水的诊断装置100的示意图。诊断装置100包括多层膜3。诊断装置还可包括血液过滤器2。多层膜3(如从圆形区域展开)包括多孔层5和吸收层6。血液样品1可由该装置分离成保留的血细胞4和血浆,血浆被吸收到吸收层6中。
[0124]
图2
[0125]
[图2]是用于评估所形成的多层膜3的性能的方法的示意图。在血液1的样品中,只有血浆7可透过多孔层5以被吸收层6吸收。在图2中标记了上表面8和下表面9。
[0126]
图3
[0127]
[图3]是显示纤维收集时间对形成的多孔层的形态、血滴外观、血浆回收率和红细胞保留的影响的大量图像。第(a)行是膜的场发射扫描电子显微镜(fesem)图像;第(b)行是其中施加血液样品的膜上表面8的照片图像;第(c)行是吸收层6的照片图像。纤维收集时间为(i)15分钟,(ii)30分钟,(iii)60分钟,(iv)90分钟或(v)120分钟。血浆回收率为(i)11.45
±
0.47%,(ii)10.30
±
0.53%,(iii)10.71
±
3.05%,(iv)2.69
±
0.51%或(v)0.94
±
0.23%。
[0128]
图4
[0129]
[图4]是显示溶剂和溶剂/添加剂比例对通过静电纺丝法形成的多孔层的血浆回收率和膜形态的影响的大量图像,其中图4a显示了多孔层形态的fesem图像,图4b显示了吸收层的相机图像。所使用的溶剂为(a)n-甲基吡咯烷酮(nmp)、(b)二甲基甲酰胺(dmf)或(c)二甲基乙酰胺(dmac)。使用丙酮作为添加剂,溶剂/添加剂比例为(i)100/0,(ii)19/1,(iii)9/1或(iv)8/2。血浆回收率为(ia)6.67
±
0.31%、(ib)9.96
±
0.84%、(ic)6.94
±
0.31%、(iia)7.27
±
0.81%、(iib)11.64
±
1.11%、(iic)5.32
±
1.11%、(iiia)9.63
±
1.22%、(iiib)21.54
±
2.68%、(iiic)13.33
±
1.21%、(iva)10.30
±
0.53%、(ivb)21.07
±
0.31%或(ivc)27.94
±
1.76%。在图4b的(iiib)、(ivb)和(ivc)上观察到红细胞。
[0130]
图5
[0131]
[图5]是显示聚合物浓度对多孔层的(i)上表面、(ii)下表面和(iii)垂直截面的形态的影响的大量fesem图像,该多孔层由使用(a)87.0mg/ml,(b)63.8mg/ml或(c)41.7mg/ml聚丙烯腈(pan)的热诱导相分离(tips)制成。
[0132]
图6
[0133]
[图6]是显示聚合物浓度对多孔层的(i)上表面和(ii)下表面的血浆回收率和红细胞保留的影响的大量相机图像,该多孔层由使用(a)87.0mg/ml,(b)63.8mg/ml或(c)41.7mg/ml的pan的tips制成。吸收层的图像在第(iii)列中提供。通过第(a)行的条件形成的膜的血浆回收率为1.81%,而红细胞已穿过第(b)行和第(c)行的条件形成的膜。
[0134]
图7
[0135]
[图7]提供了多孔层的(i)上表面、(ii)下表面和(iii)垂直截面的一系列fesem图像,该多孔层由使用87.0mg/ml的pan通过tips制成。(a)在从90℃冷却的热板上,(b)在室温下或(c)在水中将膜于空气中冷却1小时。膜形成还包括在水中冷却时的添加剂诱导的相分
离(nips)步骤,由n-tips制成。
[0136]
图8
[0137]
[图8]是显示冷却方法对多孔层的(i)上表面和(ii)下表面的血浆回收率和红细胞保留的影响的一系列相机图像,该多孔层(a)在从90℃冷却的热板上,(b)在室温下,(c)和(d)在水中冷却。吸收层的图像在第(iii)列中提供。在第(a)至(c)行中,将血液样品施加在多孔层的上表面8上,而在第(d)行中,将血液样品施加在多孔层的下表面9上,将该多孔层在使用前垂直翻转。血浆回收率为(a)1.61%,(b)1.81%,(c)2.83%或(d)10.84%。
[0138]
图9
[0139]
[图9]是显示聚合物浓度对多孔层的(i)上表面和(ii)下表面的血浆回收率和红细胞保留的影响的一系列相机图像,该多孔层由使用(a)87.0mg/ml,(b)63.8mg/ml或(c)41.7mg/ml的pan的n-tips制成。吸收层的图像在第(iii)列中提供。血浆回收率为(a)10.84%或(b)33.76%。红细胞已经穿过第(c)行的膜。
[0140]
图10
[0141]
[图10]提供了由使用87.0mg/ml的pan通过n-tips制成的多孔层的(i)上表面,(ii)垂直截面,(iii)下表面,(iv)放大下表面的形态的大量fesem图像。使用的凝结剂为(a)水,(b)水中的70重量%的nmp或(c)水中的70重量%的异丙醇(ipa)。
[0142]
图11
[0143]
[图11]提供了使用后的多层膜的(a)多孔层和(b)吸收层的一系列相机图像。多孔层是用(a)水,(b)水中的70重量%的nmp或(c)水中的70重量%的ipa的凝结剂制备的。
实施例
[0144]
本发明的非限制性实施例和比较实施例将通过参考特定实施例进一步更详细地描述,这些实施例不应解释为以任何方式限制本发明的范围。
[0145]
实施例1
–
诊断装置的结构
[0146]
膜在dps装置中非常重要。一个好的膜应该对血细胞有100%的排斥,但对有用的分析物没有保留。由于仍然缺乏适合该应用的膜,主要目标是开发和优化通过重力进行脱细胞所需的膜。对几种膜材料,例如聚丙烯腈(pan)、聚醚砜(pes)和醋酸纤维素(ca)进行研究;并向涂料溶液中添加不同的添加剂,以调整所形成的膜的孔径和性能。
[0147]
此外,膜通过几种方法形成,如非溶剂诱导的相分离(nips)、静电纺丝和热诱导的相分离(tips)。
[0148]
如图1所示,提供了一种用于血浆分离和血细胞脱水的诊断装置100。诊断装置100包括多层膜3。诊断装置还可包括血液过滤器2。多层膜3(如从圆形区域展开)包括多孔层5和吸收层6。血液样品1可由该装置分离成保留的血细胞4和血浆,血浆被吸收到吸收层6中。
[0149]
然后,用图2所示的方法对膜进行测试。测试前,用滤纸或吸收剂将膜保持在一起。然后,将血液滴到膜的顶部上。如果血浆可以透过膜并被滤纸吸收,则可以在滤纸上观察到水印。如果水印变为红色,则表明红细胞已穿过膜,且膜并不是所期望的。
[0150]
血浆回收率可由以下公式得出:
[0151]
血浆回收率(%)=(吸收后滤纸重量-吸收前滤纸重量)/(血浆密度
×
总进料血容量)。
[0152]
通过静电纺丝和tips两种方法对膜进行优化。tips可进一步与nip结合成n-tips,以形成膜。
[0153]
实施例2
–
通过静电纺丝制造多孔层的工艺
[0154]
第一种膜是通过静电纺丝过程形成的。在静电纺丝中,聚合物涂料溶液以一定的流速从充满溶液的注射器中推出。通过在针尖处添加高压,当静电斥力克服溶液的表面张力时,从针头流出的溶液液滴可以被拉伸,从而形成纳米纤维。通过长时间收集纳米纤维结构,可以形成纳米纤维膜。膜的物理性能可以通过几个因素来调节,例如电位、涂料流速、纤维收集时间和涂料配方。通过选择合适的静电纺丝条件,随后可以获得优化性能的膜。
[0155]
由于pan具有中等亲水性并且已经应用于肾透析,因此本公开选择其来形成膜分离器。聚合物(从中国台湾省中坜32023,中原大学化学工程系薄膜技术研发中心获得)的浓度为9重量%。n-甲基吡咯烷酮(nmp,99.5%,购自merck,德国)和丙酮(ace,≥99.8%,ar级,购自fisher chemical)分别用作溶剂和添加剂,以8:2(重量%)的比例制备用于静电纺丝的聚合物溶液。这两种溶剂占总涂料重量的91重量%。首先研究了纤维收集时间对膜性能的影响,因为其决定了形成的膜的厚度,从而决定了形成的膜的渗透性。
[0156]
图3描述了结果。在15分钟的收集时间时,形成的膜太薄且多孔。红细胞可以从缺陷点穿过滤膜,污染吸收滤纸。通过增加收集时间,滤纸上存在的红细胞消失。然而,也观察到血浆渗透作用的降低。当收集120分钟时,膜仅具有低于1%的血浆回收率,表明延长收集时间可能会产生太厚的膜,无法进行脱细胞应用。最佳收集时间可为30分钟。选择30分钟的收集时间,因为(1)与60分钟收集的膜相比,30分钟收集的膜具有相似的性能;(2)该膜可排斥100%的血细胞;以及(3)在制造过程中其节省材料和时间。
[0157]
在确定合适的收集时间后,随后研究了涂料配方的影响,结果如图4所示。由于涂料溶液既含有溶剂又含有添加剂,因此对其采用两种方式进行操作:(1)在静电纺丝中将nmp替换为其他常用溶剂,如二甲基甲酰胺(dmf,≥99.9%,hplc级,购自vwr chemicals)或二甲基乙酰胺(dmac,≥99.5%,hplc级,购自vwr chemicals);和(2)改变添加剂(丙酮)与溶剂(nmp)比例。nmp、dmf和dmac是溶解pan的良好溶剂。然而,其在许多物理性质方面是不同的,例如沸点、粘度等。通过使用不同的溶剂,聚合物溶液的粘度和表面张力可能改变,这反过来影响溶剂的蒸发速率。
[0158]
如图4所示,与nmp和dmac制成的膜相比,dmf制成的膜具有更高的血浆回收率。这很容易理解,因为dmf的沸点低于dmac和nmp。通过增加丙酮与溶剂比例,发现较高的血浆回收率。这是由于丙酮的快速蒸发形成了更多孔的层。当膜由高丙酮含量的dmf或dmac制成时,红细胞甚至可以通过膜。基于图4中的膜形态,形成的膜具有高度多孔性,且静电纺丝膜的孔分布均匀,使得形成的膜的孔径可在0.25至3.00μm的范围内。
[0159]
由静电纺丝制备的最佳膜的血浆回收率为13.33
±
1.21%,对大分子如人白蛋白蛋白(mw:66.5kda)的保留率几乎为零。其还有几乎100%的氨基酸渗透,例如谷氨酰胺、组氨酸等。
[0160]
实施例3
–
通过相分离的多孔层的制造工艺
[0161]
膜也可以通过热诱导的相分离(tips)方法形成。在这个方法中,聚合物溶解到溶剂混合物中,并在高温下浇铸。浇铸聚合物溶液将在较低温度下经历沉淀过程,从而形成膜。通过改变例如涂料配方和成膜过程中的冷却条件,可以通过多种方式调整由tips制成
的膜。
[0162]
首先通过改变涂料配方中的聚合物浓度,研究涂料配方对膜形态和血浆回收率的影响。将聚合物溶解在100ml的二甲基亚砜(dmso,99.9%,acs试剂,购自sigmaaldrich)/去离子水(di水)(体积百分比为85/15)混合溶剂中。
[0163]
图5和图6分别显示了聚合物浓度对所形成的膜的形态和性能的影响。通过将聚合物浓度从87.0mg/ml降低到63.8mg/ml,膜变得更加多孔,在膜的上表面和下表面上都观察到大孔。
[0164]
在图6中,增加的膜的孔也可以通过血液在膜上的铺展得到支撑。血滴可在由63.8mg/ml的pan制成的膜上快速铺展,而其在由87.0mg/ml的pan制成的膜上保持其形状。此外,对于由63.8mg/ml的pan制成的膜,还可以在膜的下表面和膜下方的滤纸上观察到血液,这表明膜具有更大的孔径。然而,通过进一步将膜的聚合物浓度从63.8mg/ml降低到41.7mg/ml,fesem图像中的膜孔径减小。这可能是由41.7mg/ml的pan制成的膜的机械性能较弱造成的,这导致了真空干燥过程中膜的收缩和形态损失。血浆回收率结果再次确认,pan浓度为41.7mg/ml可能太低,无法在dps应用中形成良好的膜,因为滤纸上的血浆斑点很小,并且含有红细胞。由于由87.0mg/ml的pan制成的膜具有良好的血浆渗透和红细胞的完全保留,因此随后使用该涂料配方来研究冷却条件对膜性能的影响。
[0165]
图7和图8相应地表示冷却条件对所形成膜的形态和性能的影响。选择三种冷却条件;即:(1)在热板上逐渐冷却,(2)在室温下冷却;和(3)在室温下于水中冷却。与在热板上逐渐冷却相比,在室温下冷却制成的膜可能具有稍微更多的多孔结构,因为其血浆回收率略有增加。尽管在热板上逐渐冷却制成的膜上观察到较大的孔,但由于溶剂在高温下快速蒸发,膜仍可能相对致密。在室温下在水中冷却制成的膜的血浆回收率进一步提高。与其他两种膜相比,在水中冷却制成的膜涉及两相转换机制,即tips和非溶剂诱导的相分离(nips)。形成的膜具有相对致密的选择层和更多的多孔下表面。其横截面也含有手指状的大孔隙,这是由nips工艺过程中添加剂(水)侵入造成的。存在大孔隙可降低血浆的渗透阻力,从而提高血浆回收率。然而,用于dps应用的膜的血浆回收率仍然很低,为2.82%。需要更有效的方法来提高膜血浆回收率。
[0166]
膜的选择层(上表面)是将血细胞与血液分离的屏障,尤其是由tips和nip(n-tips)组合制成的不对称膜。支撑层(下表面)的存在将成为选择层和膜下方的吸收剂之间的屏障,减弱吸收剂吸收血浆的功能。如果膜垂直翻转,支撑层面朝上,则选择层将与滤纸接触。这种接触有助于在血液运输和分离中,除了重力之外,还提供额外的毛细管力,从而促进吸收剂对血浆的吸收。通过翻转膜并将血液滴到膜下表面上,可以实现10.84%的高血浆回收率,这几乎是最初放置时的血浆回收率的4倍。此外,在膜的多孔下表面可以观察到血液的良好铺展。这可能增加血斑和吸收剂之间的接触面积,其反过来进一步提高了膜的血浆回收率。
[0167]
其余两种涂料配方采用水冷却法,两种涂料配方由41.7mg/ml和63.8mg/ml的pan制成,结果如图9所示。所有制造的膜都被翻转,血液滴在膜的下表面上。通过将聚合物浓度从87.0mg/ml降至63.8mg/ml,制造的膜具有几乎三倍的血浆回收率。然而,通过将膜聚合物浓度从63.8mg/ml进一步降至41.7mg/ml,红细胞开始渗透穿过膜。因此,63.8mg/ml的聚合物浓度是n-tips膜形成方法的最佳聚合物浓度。由该方法制成的膜可具有高达33.76
±
4.53%的血浆回收率。
[0168]
由于由n-tips制成的膜可具有高达33.76
±
4.53%的令人印象深刻的血浆回收率,因此假设通过将凝结剂从水改为溶剂混合物可以形成更好的膜。通过使用能够诱导涂料溶液缓慢分层的凝结剂,可以获得具有大孔的多孔层。因此,研究中使用了两种溶剂混合物,即nmp/水和异丙醇(ipa,99.5%,购自fisher chemical)/水。
[0169]
图10显示了通过使用水、nmp/水或ipa/水作为凝结剂,由tips/nip组合制成的膜的形态。可以发现,通过使用nmp/水和ipa/水作为凝结剂,所形成的膜具有含清晰可见的孔的更多孔的上表面。
[0170]
图11描述了不同凝结剂对膜的血浆回收率和红细胞保留的影响。令人惊讶的是,由ipa/水和nmp/水作为凝结剂制成的膜的血浆回收率甚至低于由水作为凝结剂制成的膜。膜的血浆回收率不仅与选择层的孔径有关,还对应于膜与吸收剂之间的亲和力以及血液在膜下表面上的铺展。由nmp/水的凝结剂产生的膜起皱,导致膜与吸收剂之间的无效接触。因此,可将较少的血浆吸引到吸收剂上。由ipa/水的凝结剂制成的膜具有相对致密的下表面。因此,血液在膜底面的铺展可能不如由nmp/水或水作为凝结剂制成的膜好。在切片中制造的所有膜具有几乎100%氨基酸渗透,例如谷氨酸、组氨酸等。基于图10中的膜形态,由tips和nips的组合制成的膜的孔径分布不均匀。所形成的膜的孔径可在0.10至1.00μm的范围内。
[0171]
工业适用性
[0172]
多层膜可用作诊断装置,并可用于多种应用,例如生物传感器,以及体液样品中的细胞或液体的提取器。其可以在广泛的应用中用作具有可调节渗透性的膜。
[0173]
显然,在不脱离本发明的精神和范围内,本发明的各种其他修改和改变对本领域技术人员在阅读前述公开内容后将是显而易见的,并且所有此类修改和改变都应在所附权利要求书的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1