碳青霉烯类抗生素耐药病原菌株的直接检测方法与流程
1.本发明涉及一种通过自上而下质谱法直接检测体内活性形式的碳青霉烯酶kpc、oxa、ndm、imp、vim和/或ges,而无需对样品进行预处理的方法。
背景技术:
2.在抗生素耐药菌不断增加导致商品化抗生素治疗效率迅速下降的情况下,通过同时对病原体感染患者进行适当的抗生素给药和减少抗生素耐药菌来提高治疗效率的策略正被积极研究。最低抑菌浓度(mic)测试正被用于鉴定是否存在抗生素耐药性,但培养微生物需要18小时以上,这是必不可少的步骤,并且缺乏准确性,因此无法在感染早期快速识别和选择最佳抗生素。使用实时pcr等的基因诊断技术,应用于快速准确的高通量诊断也有局限性,因为它们在基因提取和扩增过程中需要复杂且昂贵的样品预处理,目标基因的核苷酸序列的先验信息是必不可少的,并且由于检测已经失去抗生素降解活性的酶基因,包含了不准确的耐药信息。
3.与基于pcr的测序方法相比,包括maldi-tof在内的质谱方法是低成本和高效率的鉴定系统,并且可以为微生物的快速鉴定提供重要手段。此外,使用这些方法,可以在10分钟内实现菌种培养和染色鉴定后的样品处理,并通过将未知菌种的质量数据与通过质谱数据建立的数据库中的质量数据进行比较,快速鉴定出具有相同质量值的菌株。
4.然而,传统的质谱分析方法无法准确确定抗生素耐药蛋白的类型,且繁琐,因为它们涉及使用蛋白酶将目标耐药蛋白降解成肽片段,然后通过这些片段的质量值间接推断耐药蛋白的类型。此外,这些方法在可靠性方面存在许多问题。
5.因此,本发明人努力提供了一种快速准确的耐碳青霉烯类菌株感染诊断方法,通过选择与对β-内酰胺类抗生素,特别是碳青霉烯类抗生素的抗性直接相关的蛋白质,并测量在这些选定蛋白质的体内活性形式的确切质量值,以建立准确的参考数据,以确定是否存在耐碳青霉烯类菌株。
6.在整个说明书中,参考和引用了许多出版物和专利文件。所引用的出版物和专利文件的公开内容通过引用整体并入本文以更清楚地描述相关技术和本发明的状态。
技术实现要素:
7.技术问题
8.本发明人进行了深入的研究努力,开发了一种有效的诊断方法,该方法能够通过以简单且高度可靠的方式检测样品中涉及内酰胺类抗生素抗性的抗生素分解酶来快速确定抗生素抗性菌株的感染。作为结果,本发明人新发现降解β-内酰胺抗生素碳青霉烯类的酶(特别是kpc、oxa、ndm、imp、vim和ges蛋白)由于一些n末端残基的截短而以活性形式存在于体内,并发现,当通过质谱直接鉴定在抗生素抗性菌株分泌的碳青霉烯分解酶中占大部分的这些蛋白质的活性形式,可以通过快速准确地确定病原菌株是否对抗生素产生抗性,以及抗性相关的蛋白质类型,在感染的早期建立适当的抗生素给药策略,在此基础上,完成
了本发明。
9.因此,本发明的一个目的是提供一种在生物样品中检测对碳青霉烯类抗生素具有抗性的病原菌株,特别是表达kpc、oxa、ndm、imp、vim和/或ges的病原菌株的方法。
10.本发明的其他目的和优点将通过以下对本发明、权利要求和附图的详细描述而更加明显。
11.技术方案
12.根据本发明的一个方面,提供了一种用于检测生物样品中对碳青霉烯类抗生素具有抗性的病原菌株的方法,包括:
13.(a)在分离自受试者的生物样品中分离由病原菌株表达的蛋白质;和
14.(b)对分离的蛋白质进行自上而下的质谱分析,
15.其中,当质谱分析结果检测出与去除了n末端的21或22个氨基酸残基的肺炎克雷伯菌碳青霉烯酶(kpc)或oxa碳青霉烯酶具有相同质量的蛋白质,或,当质谱分析结果检测出具有与选自下组的至少一种碳青霉烯酶相同质量的蛋白质:n末端的18、19、20、21或26个氨基酸残基已被去除的新德里金属-β-内酰胺酶(new delhi metallo-beta-lactamase,ndm)、亚胺青霉烯酶(imipenemase,imp)、维罗纳整合子编码的金属-β-内酰胺酶(verona integron-borne metallo-β-lactamase,vim)和圭亚那超广谱β-内酰胺酶(guiana extended spectrumβ-lactamase,ges),则认为生物样品中存在对碳青霉烯类抗生素耐药的病原菌株。
16.本发明人进行了深入的研究努力,开发了一种有效的诊断方法,该方法能够通过以简单且高度可靠的方式检测样品中涉及内酰胺类抗生素抗性的抗生素分解酶来快速确定抗生素抗性菌株的感染。作为结果,本发明人新发现降解β-内酰胺抗生素碳青霉烯类的酶(特别是kpc、oxa、ndm、imp、vim和ges蛋白)由于一些n末端残基的截短而以活性形式存在于体内,并发现,当通过质谱直接鉴定在抗生素抗性菌株分泌的碳青霉烯分解酶中占大部分的这些蛋白质的活性形式,可以通过快速准确地确定病原菌株是否对抗生素产生抗性,以及抗性相关的蛋白质类型,在感染的早期建立适当的抗生素给药策略。
17.如本文所用,术语“病原菌株”是指充当感染或疾病原因的任何细菌,包括例如但不限于金黄色葡萄球菌(staphylococcus aureus)、链球菌(streptococcus)、大肠杆菌(escherichia coli)、肺炎克雷伯菌(klebsiella pneumoniae)、铜绿假单胞菌(pseudomonas aeruginosa)、中耳假单胞菌(pseudomonas otitidis)、黄微球菌(micrococcus luteus)、科氏柠檬酸杆菌(citrobacter koseri)、奇异变形杆菌(proteus mirabilis)和溃疡分枝杆菌(mycobacterium ulcerans)。
18.如本文所用,表述“对抗生素具有抗性”是指特定病原微生物甚至可以在其中针对该微生物的抗生素以高浓度或有效量存在的环境中生长。病原微生物是否具有抗生素抗性可以通过检测是否存在酶蛋白来确定,该酶蛋白由病原微生物分泌并通过降解抗生素去除或降低抗生素的活性。例如,抑制细菌细胞壁合成的β-内酰胺类抗生素(如青霉素、头孢菌素、单环内酰胺和碳青霉烯类)被β-内酰胺酶灭活,因此它们不能抑制表达β-内酰胺酶的病原体。因此,术语“抗性”可与术语“低治疗反应性”和“低预防反应性”互换使用。
19.如本文所用,术语“治疗”是指(a)抑制疾病、病症或症状的进展;(b)减轻疾病、病症或症状;(c)消除疾病、病症或症状。因此,术语“治疗反应性”是指当β-内酰胺类抗生素包
括碳青霉烯类)以治疗有效量施用于感染病原菌株的患者时,在体内起到上述作用的程度。
20.如本文所用,术语“预防”是指抑制从未被诊断为患有疾病或病症但可能患有疾病或病症的受试者中疾病或病症的发生。因此,“预防反应性”是指当β-内酰胺类抗生素(包括碳青霉烯类)以预防有效量施用于感染尚未证实的正常人时,在体内抑制感染的程度。
21.如本文所用,术语“生物样品”是指任何样品,包括,例如,但不限于血液、组织、器官、细胞或细胞培养物,所述样品获取自包括人类在内的哺乳动物,并且含有或可能含有可被β-内酰胺类抗生素(包括碳青霉烯类)抑制的病原菌株。
22.如本文所用,术语“受试者”是指提供样品以检查待用β-内酰胺抗生素(例如碳青霉烯类)抑制的致病菌株的存在或该菌株是否对抗生素具有抗性的对象,并且最终指,待分析是否发生了对抗生素具有抗性的病原菌株的感染的对象。受试者的例子包括但不限于人、小鼠、大鼠、豚鼠、狗、猫、马、牛、猪、猴、黑猩猩、狒狒或恒河猴,特别是人。由于本发明的组合物提供的信息不仅可以预测治疗反应,还可以预测对β-内酰胺类抗生素(如碳青霉烯类)的预防反应,本发明中的受试者可以是感染该菌株的患者,也可以是尚未确认感染的健康受试者。
23.如本文所用,术语“自上而下质谱法”是指直接测量全长蛋白质的质量值而不执行将蛋白质片段化成肽片段的过程的分析,具体而言,是指在将蛋白质样品注入质谱仪之前不进行目标蛋白质的片段化的分析。本发明的另一个特征是,通过对全长蛋白质进行直接质谱分析,无需使用胰蛋白酶等蛋白酶随机降解蛋白质,简化了该过程,并且,与通过收集片段的大量信息和收集有关各种蛋白质的片段化趋势的大量信息进行的传统的间接鉴定蛋白质的方法相比,可以在更短的时间内以非常高的可靠性确定目标蛋白质的存在。
24.在本说明书中,“蛋白质的质量相同”的表述是指通过本发明的质谱分析方法测得的质量值与参考质量值基本相同,例如对应于已知氨基酸序列和分子量并且已经去除了n末端的18、19、20、21、22或26个氨基酸残基的碳青霉烯酶的质量的值。“基本相同”是指例如测定的da值或m/z
×
z值在参考质量值
±
10的范围内,更具体而言,在参考质量值
±
7的范围内,更具体而言在参考质量值
±
5的范围内,特别是在参考质量值
±
3的范围内。碳青霉烯类分解酶的质量值,是确定质量值是否与参考质量值基本相同的标准,包括其中1至3个甲硫氨酸残基以氧化状态存在(即从已知质量值增加16、32或48)或其中两半胱氨酸残基之间形成二硫键(即,从已知质量值减少2)的状态的质量值。
25.根据本发明的一个具体实施方式,本发明的方法还包括对步骤(a)中分离的蛋白质进行离子交换色谱的步骤。
26.如本文所用,术语“离子交换色谱法”是指利用离子或带电化合物通过静电力与离子交换树脂结合的现象从非均相混合物中分离带电目标物质的分离和纯化方法。离子交换色谱具有结合各种官能团的离子交换树脂,其中阴离子交换树脂具有带正电荷的官能团,因此通过静电引力与混合物中带负电荷的目标物质结合,阳离子交换树脂与带正电的目标物质特异性结合。
27.根据本发明的一个具体实施方式,离子交换色谱是选自下组的任意一种:阴离子交换色谱、阳离子交换色谱及其顺序组合。
28.本发明中使用的阴离子交换树脂可以具有,例如,二乙氨基乙基(deae)或季铵官能团,但不限于此,任何为载体提供正电荷的常规阳离子官能团可以可以不受限制地使用。
强碱性阴离子交换基团包括,例如,快流速q琼脂糖凝胶(q sepharose fast flow)、高性能q琼脂糖凝胶(q sepharose high performance)、resource q、source 15q、source 30q、mono q、mini q、capto q、capto q impres、q hypercel、q cermic hyperd f、nuvia q、unosphere q、macro-prep high q、macro-prep 25q、fractogel emd tmae(s)、fractogel emd tmae hicap(m)、fractogel emd tmae(m)、eshmono q、toyopearl qae-550c、toyopearl superq-650c、toyopearl gigacap q-650m、toyopearl q-600c ar、toyopearl superq-650m、toyopearl superq-650s、tskgel superq-5pw(30)、tskgel superq-5pw(20)和tskgel superq-5pw,但不限于此,并且可以使用本领域已知的任何阴离子交换树脂。
29.本发明中使用的阳离子交换树脂可以具有例如砜基或羧基,但不限于此,可以无限制地使用为载体提供负电荷的任何常规阳离子官能团。例如,阳离子交换树脂可以选自下组:fractogel、cm(羧甲基)、se(磺乙基)、sp(磺丙基)、p(磷酸盐)、s(磺酸盐)、propac wcx-10tm(dionex)、capto s、s-琼脂糖ff(s-sepharose ff)、fractogel emd so3m、toyopearl megacap ii sp 550c、poros 50hs、poros xs和sp-琼脂糖(sp-sepharose)基质,但不限于此。具体地,可以使用sp(磺丙基)树脂。作为柱缓冲液,可以使用本领域已知的平衡缓冲液、洗涤缓冲液和洗脱缓冲液,例如磷酸钠缓冲液、柠檬酸盐缓冲液和乙酸缓冲液。
30.根据要分离/纯化的蛋白质的电荷和要分离的蛋白质的顺序,可以适当地进行这种离子交换色谱。例如,为了依次分离带正电荷的蛋白质和带负电荷的蛋白质,可以进行阳离子交换色谱,然后进行阴离子交换色谱。
31.根据本发明的一个具体实施方式,本发明的步骤(a)通过向生物样品中添加表面活性剂来进行。
32.如上所述,在本发明中,可以通过自上而下质谱法对全长蛋白质进行直接质谱法,而无需使用蛋白酶的片段化过程。本发明人已经发现,当将表面活性剂添加到待分析的生物样品中时,存在于细胞膜或细胞质中的完整的全长蛋白质可以被包封,这样就可以快速准确地识别出目标蛋白,而不需要用酶随机降解。
33.在本发明中,离子、非离子和两性离子表面活性剂都可以不受限制地使用,只要它们是能够形成足以包封全长蛋白质的胶束的通用表面活性剂。具体地,本发明中使用的表面活性剂为离子型表面活性剂或非离子型表面活性剂。
34.可用于本发明的离子表面活性剂的例子包括但不限于脱氧胆酸钠(doc)、美迪兰a(medialan a)、季铵盐-60(quaternium-60)、十六烷基氯化吡啶、溴化十六烷基吡啶、氯化十六烷基三甲基铵、溴化十六烷基三甲基铵和格敌诺(gardinol)。
35.可用于本发明的非离子表面活性剂的例子包括但不限于正辛基-β-d-吡喃葡萄糖苷(og)、正辛基-β-d-硫代吡喃葡萄糖苷(otg)、辛基葡萄糖新戊二醇(ogng)、正十二烷基-β-d-吡喃麦芽糖苷(ddm)和正十二烷基-β-d-吡喃硫代麦芽糖苷(ddtm)。
36.更具体地,步骤(a)可以通过额外向生物样品中添加裂解缓冲液来进行。即,本发明的表面活性剂可以在裂解细胞的步骤中与裂解缓冲液一起使用,以分离由病原菌株表达的蛋白质。具体而言,裂解缓冲液可以是挥发性缓冲液。
37.可用于本发明的挥发性缓冲剂的例子包括但不限于碳酸氢铵、乙酸、甲酸、氨、碳酸铵和吡啶/三乙醇胺。此外,可以使用由于其低沸点而容易蒸发到大气中,同时将样品中
的氢离子浓度保持在一定范围内的任何缓冲液。
38.根据本发明的一个具体实施方案,本发明的方法进一步包括在步骤(a)和步骤(b)之间的超声处理步骤。
39.根据本发明的一个具体实施方案,步骤(b)使用质谱法进行,所述质谱法选自下组:基质辅助激光解吸/电离飞行时间(maldi-tof)质谱、表面增强激光解吸/电离飞行时间(seldi-tof)质谱、电喷雾电离飞行时间(esi-tof)质谱、液相色谱-质谱(lc-ms)和液相色谱-质谱/质谱(lc-ms/ms)。更具体而言,使用maldi-tof质谱法进行。
40.maldi-tof质谱法是一种方法,其中由基质支撑的样品通过激光照射解吸和离子化,然后通过测量离子到达检测器所需的时间(飞行时间)来分析生成离子的分子量。根据该方法,由于不会发生目标物质的碎片化,因此能够快速且准确地测定蛋白质等生物大分子的质量。当电离分子被电场加速并测量飞行时间时,会产生质荷比(m/z),通过这个m/z值可以确定目标材料的分子量。例如,当m/z=30,000(z=+1)或15,000(z=+2)时,分子量为m/z
×
z=30,000。
41.根据本发明的一个具体实施方案,所述碳青霉烯类分解酶是kpc蛋白,当质谱分析的结果为,检测到与去除了n末端21个氨基酸残基的kpc蛋白具有相同质量的蛋白质,则认为生物样品中存在对碳青霉烯类抗生素具有抗性的病原菌株。
42.根据本发明的一个具体实施方案,所述碳青霉烯类分解酶是oxa蛋白,当质谱分析的结果为,检测到与除去了n末端22个氨基酸残基的oxa蛋白具有相同质量的蛋白质时,认为生物样品中存在对碳青霉烯类抗生素具有抗性的病原菌株。
43.根据本发明的一个具体实施方案,所述碳青霉烯类分解酶为ndm蛋白,当质谱分析的结果为,检测到与n末端19或20个氨基酸残基已被去除的ndm蛋白具有相同质量的蛋白时,认为生物样品中存在对碳青霉烯类抗生素具有抗性的致病菌株。
44.根据本发明的一个具体实施方案,所述碳青霉烯类分解酶为imp蛋白,当质谱分析的结果为,检测出与除去了n末端18~21个氨基酸残基的imp蛋白质量相同的蛋白质时,认为生物样品中存在对碳青霉烯类抗生素具有抗性的病原菌株。
45.根据本发明的一个具体实施方案,所述碳青霉烯类分解酶为vim蛋白,当质谱分析的结果为,检测到与去除了n末端25或26个氨基酸残基的vim蛋白质量相同的蛋白质时,认为生物样品中存在对碳青霉烯类抗生素具有抗性的病原菌株。
46.根据本发明的一个具体实施方案,所述碳青霉烯类分解酶是ges蛋白,当质谱分析的结果为,检测到与除去了n末端18个氨基酸残基的ges蛋白具有相同质量的蛋白质时,认为生物样品中存在对碳青霉烯类抗生素具有抗性的病原菌株。
47.根据本发明,本发明人发现,为了使碳青霉烯酶在体内具有降解碳青霉烯的活性,碳青霉烯酶应以n末端的一些氨基酸残基已被去除的状态(活性形式)存在,为维持活性而去除的n末端残基的长度因酶的种类而异。因此,为了准确确定感染受试者的菌株实际上对碳青霉烯类具有抗性,应根据是否检测到了与去除了n末端21个氨基酸残基的kpc蛋白和/或去除了n末端22个氨基酸残基的oxa蛋白相同的质量值来确定,以及如下所述,根据是否检测到与以下蛋白质相同的质量值来确定:n末端19或20个氨基酸残基已去除的ndm蛋白质,n末端18至21个氨基酸残基已去除的imp蛋白质、n末端的25或26个氨基酸残基已去除的vim蛋白,和/或n末端的18个氨基酸残基已去除的ges蛋白。与机械检测这些已知碳青霉烯
酶的全长氨基酸质量值的常规技术相比,本发明提供显著提高的准确性和诊断可靠性。
48.根据本发明的一个具体实施方案,当质谱分析的结果为,检测到选自下组的一个或多个质量值(m/z
×
z):28720、28746、28737、28780、28678、28728、28704、28806、28736、28738、28688、28562、28877、28676、28686、28733、28690、28557、28718、28963、28716、28588、29105、28795、28825、28769、29631、28760、28656、28776、28975、29086、28748、30433、28730、和这些值的
±
5内的值,则认为生物样品中存在对碳青霉烯类抗生素具有抗性的病原菌株。更具体地,在这种情况下,样品中存在的致病菌株是产生kpc蛋白的菌株。
49.根据本发明,以上列出的质量值是n末端21个氨基酸残基已被去除的kpc亚型蛋白质的质量值。如上所述,本发明人发现kpc(一种碳青霉烯酶)的所有亚型蛋白质仅在体内n末端的21个氨基酸残基已被去除时才保持碳青霉烯降解活性。因此,当质谱的结果检测到任何一个或多个与其对应的质量值时,认为受试者已经感染了表达一种或多种kpc亚型蛋白的菌株,即,对碳青霉烯类抗生素具有抗性的致病菌株。
50.根据本发明的具体实施方式,质量值(m/z
×
z)还包括从每个质量值增加16或32的质量值。
51.更具体地,质量值(m/z
×
z)还包括从每个质量值减少2的质量值。
52.如以下实施例所示,本发明人发现kpc蛋白中的三个甲硫氨酸残基(第49位甲硫氨酸、第116位甲硫氨酸和第151位甲硫氨酸)之一可能以氧化状态存在。因此,即使当测量到从上面列出的质量值增加一个氧原子的分子量(+16)时,也可以确定表达kpc蛋白的菌株存在于样品中。此外,本发明人还发现,kpc蛋白可以以第68位半胱氨酸和第237位半胱氨酸之间存在二硫键的状态存在。因此,即使当测量到由于二硫键从上面列出的质量值中脱离两个氢原子而降低(-2)的分子量时,也可以确定表达kpc蛋白的菌株存在于样品,从而可以更准确地检测抗生素抗性菌株的存在。
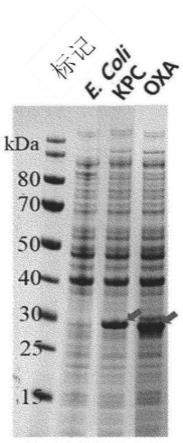
53.根据本发明的一个具体实施方案,当质谱分析的结果为,检测到选自下组的一个或多个质量值(m/z
×
z):28147、28098、28117、27679、28172、28158、28282、28032、28048、28252、27673、28190、28260、27718、28126、27900、27653、28002、28175、28149、27877、28161、27955、28151、28131、28215、28191、27978、和这些值的
±
5内的值,则认为生物样品中存在对碳青霉烯类抗生素具有抗性的病原菌株。更具体地,在这种情况下,样品中存在的致病菌株是产生oxa蛋白的菌株。
54.根据本发明,上述质量值是去除了n末端22个氨基酸残基的oxa亚型蛋白质的质量值。本发明人已发现oxa亚型蛋白仅当体内n末端的22个氨基酸残基已被去除时才保持碳青霉烯降解活性。因此,当作为质谱的结果检测到任何一个或多个与其对应的质量值时,认为受试者已经感染了表达一种或多种oxa亚型蛋白的菌株,即,对碳青霉烯类抗生素具有抗性的致病菌株。
55.根据本发明的具体实施方式,质量值(m/z
×
z)还包括从每个质量值增加16、32或48的质量值。
56.如以下实施例所示,本发明人发现oxa蛋白中的6个甲硫氨酸残基(第115位甲硫氨酸、第138位甲硫氨酸、第195位甲硫氨酸、第237位甲硫氨酸、第239位甲硫氨酸和第241位甲硫氨酸)中的1-3个可能以氧化状态存在。因此,即使当测量到上述质量值增加一个氧原子(+16)、两个氧原子(+32)或三个氧原子(+48)的分子量,也可以确定样品中存在表达oxa蛋
白的菌株,从而可以更准确地诊断出抗生素耐药菌株的感染。
57.根据本发明的一个具体实施方案,当质谱分析的结果为,检测到选自下组的一个或多个质量值(m/z
×
z):26439、26413、26438、26421、26435、26467、26420、26363、26587、26407、26479、26381、26449、26434、27043、26448、26416、26465、26453、26455、26466、26510、26484、26509、26492、26506、26538、26491、26434、26658、26478、26550、26452、26520、26505、27114、26519、26487、26536、26524、26526、26537、和这些值的
±
5内的值,则认为生物样品中存在对碳青霉烯类抗生素具有抗性的病原菌株。更具体地,在这种情况下,样品中存在的病原菌株是产生ndm蛋白的菌株。
58.根据本发明,上述质量值是n末端19个氨基酸残基被去除后的ndm亚型蛋白质的质量值。当这些质量值中的任何一个或多个质量值作为质谱法的结果被检测到时,可以认为,受试者已经感染了表达一种或多种ndm亚型蛋白的菌株,即,对碳青霉烯类抗生素具有抗性的病原菌株。
59.如本文所用,术语“质量值(m/z
×
z)”是指待检测蛋白质的平均分子量或代表平均分子量的道尔顿值。然而,当使用可以通过该质量值(m/z
×
z)推断的其他参考质量值(例如,单一同位素质量值)检测相同的蛋白质时,该检测被认为与本发明中进行的检测相同。例如,当基于ndm-1的单同位素质量(26493.16)鉴定是否存在表达ndm的菌株的感染时,所述鉴定与使用26510m/z
×
z鉴定是否存在表达ndm的菌株的感染相同,所述的26510m/z
×
z是本领域技术人员可以容易地从作为参考值的单同位素质量值推断出的。
60.根据本发明的一个具体实施方案,质量值(m/z
×
z)还包括从每个质量值增加16或32的质量值。
61.如下方的实施例所示,本发明人发现ndm蛋白中的7个甲硫氨酸残基(第39、67、126、129、245、248和265位)中的1个或2个甲硫氨酸残基以氧化状态存在。因此,即使当测量的分子量从上述质量值增加一个氧原子(+16)或两个氧原子(+32)时,也可以确定样品中仍存在表达ndm蛋白的菌株,从而可以更准确地检测抗生素抗性菌株的存在。
62.更具体地,质量值(m/z
×
z)还包括从每个质量值增加14、28或42的质量值。
63.如下所述,本发明人发现ndm蛋白可以以其中已经发生1个、2个或3个甲基化的状态存在。因此,即使测量到从上述质量值增加1个甲基化(+14)、2个甲基化(+28)或3个甲基化(+42)的分子量时,也可以确定样品中仍存在表达ndm蛋白的菌株。
64.更具体地,质量值(m/z
×
z)还包括从每个质量值增加238的质量值。
65.如以下实施例所示,在ndm蛋白质中观察到对应于棕榈酰化蛋白质类型的峰。因此,即使当测量到由棕榈酰化引起的质量值增加(+238)的分子量时,也可以确定表达ndm蛋白的菌株也存在于样品中,从而可以更准确地诊断出抗生素耐药菌株的感染。
66.根据本发明的一个具体实施方案,当质谱分析的结果为,检测到选自下组的一个或多个质量值(m/z
×
z):25113、25151、25011、25080、25020、25083、25025、24952、25192、25161、24973、24988、25078、25365、25268、25006、25186、24994、25043、24945、25208、25000、24980、25128、25216、24983、25115、25112、25116、25414、25205、25041、25139、25254、25050、24910、25101、25021、25212、25073、24961、25105、24831、25353、25234、24995、25071、25094、25351、25174、25156、25199、25129、24981、25018、25335、25232、24872、24982、25204、24796、25259、25214、25085、25135、25131、25141、25145、25172、
25126、24990、和这些值的
±
5内的值,则认为生物样品中存在对碳青霉烯类抗生素具有抗性的病原菌株。更具体地,在这种情况下,样品中存在的致病菌株是产生imp蛋白的菌株。
67.根据本发明,上述质量值是n末端去除了18、19、20或21个氨基酸残基的imp亚型蛋白质的质量值。当作为质谱结果检测到这些质量值中的一个或多个时,可以认为受试者已经感染了表达一种或多种imp亚型蛋白的菌株。
68.根据本发明的一个具体实施方案,当质谱分析的结果为,检测到选自下组的一个或多个质量值(m/z
×
z):25322、25515、25488、25391、25339、25516、25464、25485、25527、25531、25414、25455、25421、25499、25542、25129、25405、25534、25446、25472、25444、25298、25338、25367、25355、25508、25264、25306、25336、25352、25543、25407、25268、25419、25514、25501、25487、25445、25341、25364、25424、25458、25491、25513、25348、25518、25350、和这些值的
±
5内的值,则认为生物样品中存在对碳青霉烯类抗生素具有抗性的病原菌株。更具体地,在这种情况下,样品中存在的致病菌株是产生vim蛋白的菌株。
69.根据本发明,上述质量值是去除了n末端25或26个氨基酸残基的vim亚型蛋白质的质量值。当质谱的结果检测到这些质量值中的一个或多个时,可以认为受试者已经感染了表达一种或多种vim亚型蛋白的菌株。
70.根据本发明的一个具体实施方案,当质谱分析的结果为,检测到选自下组的一个或多个质量值(m/z
×
z):29217、29274、29186、29216、29247、29246、29259、29203、29231、29201、29273、29261、29237、29248、29230、29213、29275、29278、29221、29194、29338、29232、29227、29251、29202、29175、29369、29661、和这些值的
±
5内的值,则认为生物样品中存在对碳青霉烯类抗生素具有抗性的病原菌株。更具体地,在这种情况下,样品中存在的致病菌株是产生ges蛋白的菌株。
71.根据本发明,上述质量值是ges亚型蛋白质在n末端去除了18个氨基酸残基后的质量值。当作为质谱的结果检测到这些质量值中的一个或多个时,可以认为受试者已经感染了表达一种或多种ges亚型蛋白的菌株。
72.根据本发明的一个具体实施方案,质量值(m/z
×
z)还包括从每个质量值增加16或32的质量值。更具体地,质量值(m/z
×
z)还包括从每个质量值减少2的质量值。
73.如下所述,本发明人发现ges蛋白中的六个甲硫氨酸残基(第62、95、112、143、164和181位)中的一个或两个可以以氧化状态存在。因此,即使当测量从上面列出的质量值增加一个氧原子(+16)或两个氧原子(+32)的分子量时,也可以确定样品中存在表达ges蛋白的菌株。此外,本发明人还发现ges蛋白可以以第63位半胱氨酸和第233位半胱氨酸之间存在二硫键的状态存在。因此,即使当测量由于二硫键而从上述质量值中脱离两个氢原子而降低(-2)的分子量时,也可以确定样品中存在表达ges蛋白的菌株,从而可以更准确地诊断出抗生素耐药菌株的感染。
74.有利效果
75.本发明的特点和优点总结如下:
76.(a)本发明提供了一种在生物样品中检测对碳青霉烯类抗生素具有抗性的病原菌株的方法。
77.(b)根据本发明,可以通过质谱法直接鉴定碳青霉烯酶,特别是kpc、oxa、ndm、imp、vim和/或ges蛋白,从而不仅可以快速鉴定病原菌株是否对抗生素具有抗性,还可以快速鉴
定与抗性有关的蛋白质类型。
78.(c)根据本发明,鉴定了每种碳青霉烯酶在体内的物理和化学性质,例如每种碳青霉烯酶中独特的n末端截短长度、甲硫氨酸残基氧化和二硫键形成,并反映在参考质量值上。因此,能够以高可靠性更准确地检测抗生素抗性菌株的存在,因此本发明可以有利地用于在感染早期快速建立适当的抗生素施用策略。
79.附图简述
80.图1显示了来自抗生素抗性菌株的kpc和oxa蛋白的表达和大小的sds-page分析结果(图1a),并显示了金属-β-内酰胺酶(以下称为mbl)家族三种蛋白质(ndm、imp和vim)和a类碳青霉烯酶ges蛋白的表达和大小的sds-page分析结果(图1b)。图1c至1h分别显示了kpc、oxa、ndm、imp、vim和ges亚型蛋白的表达和大小的sds-page分析结果。
81.图2显示了来自临床菌株的kpc和oxa蛋白(图2a)、mbl蛋白ndm(图2b)、imp(图2c)和vim(图2d)、ges-5蛋白(图2e)的表达和大小的sds-page分析结果。
82.图3显示了取决于硫酸锌(znso4)浓度的mbl蛋白的表达和大小的sds-page分析结果。
83.图4显示了样品预处理后粗提物和粗酶溶液的蛋白质差异比较结果。对于kpc和oxa蛋白,分别使用非离子表面活性剂(图4a)、离子表面活性剂(图4b)和挥发性缓冲液(图4c)破坏细胞,通过sds-page凝胶分析法分析每种蛋白质的表达和溶解度。此外,通过sds-page凝胶分析分析了在使用非离子表面活性剂破坏的细胞中mbl蛋白的表达和溶解度(图4d),以及在使用挥发性缓冲液破坏的细胞中ges蛋白的表达和溶解度(图4e)。
84.图5显示了使用离子色谱分离和纯化目标蛋白的结果。使用阴离子交换树脂柱分离纯化kpc(图5a)、oxa(图5b)、ndm(图5c)、imp(图5d)、vim(图5e)和ges-5(图5f)。
85.图6显示了比较显示kpc蛋白、oxa蛋白、三种mbl蛋白和ges蛋白以及氧化甲硫氨酸残基(粗体和下划线)(图6a至6f)的代表性覆盖率(灰色)的比对结果。
86.图7显示了在每种蛋白质中鉴定为n末端肽的肽的串联质谱结果。图7a为kpc肽的分离色谱图,图7b为kpc n末端肽的鉴定结果。图7c为oxa肽的分离色谱图,图7d为oxa n末端肽的鉴定结果。图7e为ndm肽的分离色谱图示例,图7f为ndm n末端肽的鉴定结果。图7g为imp肽的分离色谱图示例,图7h为imp n末端肽的鉴定结果。图7i为vim肽的分离色谱图示例,图7j为vim n末端肽的鉴定结果。图7k为ges肽的分离色谱图示例,图71为ges n末端肽的鉴定结果。图7m至7t显示了每种肽的代表性亚型的示例性n末端鉴定结果,并显示了kpc-3(图7m)、kpc-17(图7n)、oxa-181(图7o)、imp-1(图7p)、imp-4(图7q)、vim-1(图7r)、vim-4(图7s)和ges-1(图7t)的n末端鉴定结果。
87.图8显示了使用clustalw程序对kpc(图8a)、oxa(图8b)、mbl(图8c至8e)蛋白和ges蛋白(图8f)的氨基酸序列进行多重比对分析的结果示例,保守氨基酸序列的鉴定结果。黑框表示n末端序列区域。
88.图9显示了kpc(图9a)、oxa(图9b)、ndm(图9c)、imp(图9d)、vim(图9e)和ges(图9f)蛋白质的系统发育分析结果。
89.图10显示了使用高分辨率质谱仪进行的kpc、oxa、ndm、imp、vim和ges蛋白的鉴定结果。图10a显示了多电荷kpc蛋白的质谱(单同位素质量:28,700.69m/z
×
z,平均分子量:28,718.13m/z
×
z),图10b显示了+17电荷态的kpc蛋白离子的串联质谱,以及第22-293位的
氨基酸的序列的识别结果(e=1.8e-9)。图10c显示了多电荷oxa蛋白的质谱(单同位素质量:28,129.28m/z
×
z,平均分子量:28,146.69m/z
×
z),图10d显示了+24电荷态的oxa蛋白离子的串联谱,以及第23-265位的氨基酸的序列的识别结果(e=3.47e-42)。图10e为多电荷ndm蛋白的质谱图,图10f为带+25电荷态的ndm蛋白离子的串联谱图,以及第20-270位的氨基酸的序列的鉴定结果。图10g为多电荷imp蛋白的质谱图,图10h为电荷态为+30的imp蛋白离子的串联谱图,以及第19-246位的氨基酸的序列的鉴定结果(e=2.99e-76)氨基酸序列。图10i显示了多电荷vim蛋白的质谱图,图10j显示了电荷态为+20的vim蛋白离子的串联质谱图,以及第27-266位的氨基酸的序列的鉴定结果(e=4.76e-49)。图10k为多电荷imp蛋白的质谱图,图10l为电荷态为+20的ges蛋白离子的串联质谱图,以及第19-287位的氨基酸的序列的鉴定结果(e=7.12e-8)。
90.图11显示了ndm蛋白的修饰质量值,通过高分辨质谱自上而下质谱获得。图11a显示了棕榈酰化蛋白类型的质量值,图11b显示了ndm蛋白的甲基化蛋白的结果以及由此产生的洗脱时间差。
91.图12显示了通过高分辨率质谱仪通过自上而下质谱法获得的kpc(图12a)、oxa(图12b)、ndm(图12c)、imp(图12d)、vim(图12e)和ges(图12f)蛋白质的序列覆盖率。
92.图13显示了使用低分辨率质谱仪(maldi-tof)获得的kpc蛋白(图13a)、oxa蛋白(图13b)、mbl蛋白ndm(图13c)、imp(图13d)和vim(图13e)以及ges蛋白(图13f)的质谱图示例。
93.发明实施方式
94.在下文中,将参考实施例更详细地描述本发明。这些实施例仅用于更详细地说明本发明,并且对于本领域技术人员显而易见的是,根据本发明主题的本发明的范围不受这些实施例的限制。
实施例
95.实验方法
96.实施例1.β-内酰胺类抗生素耐药基因的克隆及耐药菌株的构建
97.基于从碳青霉烯酶的基因中获得的基因序列信息(欧洲分子生物学实验室(embl)核苷酸序列数据库登录号:kpc=cp026395.1,882nt,oxa=ay236073.2,798nt,ndm=caz39946.1,813nt,vim=ay884050.1,801nt,imp=ab616660.2,741nt,ges=dq236171.1,864nt),通过合成制备所需的基因序列(表1)。使用合成基因制备以下引物。
98.1)kpc
99.引物1:5`-aactgcaggatgtcactgtatcgccgtcta-3`(30聚体)
100.引物2:5`-ggaattcttactgcccgttgacgcc-3`(25聚体)
101.2)oxa
102.引物1:5`-aactgcaggatgcgtgtattagccttatcgg-3`(31聚体)
103.引物2:5`-ggaattcctagggaataattttttcctgtttga-3`(33聚体)
104.3)ndm
105.引物1:5`-aac tgc agg atg gaa ttg ccc aat att atg ca-3`(32聚体)
106.引物2:5`-gga att ctc agc gca gct tgt cgg-3`(24聚体)
107.4)imp
108.引物1:5`-aac tgc agg atg agc aag tta tct gta ttc ttt ata t-3`(37聚体)
109.引物2:5`-gga att ctt agt tgc ttg gtt ttg atg gtt ttt-3`(33聚体)
110.5)vim
111.引物1:5`-aac tgc agg atg ttc aaa ctt ttg agt aag tta ttg-3`(36聚体)
112.引物2:5`-gga att cct act caa cga ctg agc gat t-3`(28聚体)
113.6)ges
114.引物1:5`-aac tgc agg atg cgc ttc att cac gca cta t-3`(31聚体)
115.引物2:5`-cgg aat tcc tat ttg tcc gtg ctc agg at-3`(29聚体)
116.将用于克隆的限制性酶位点添加到引物中,并创建开放阅读框(orf)以直接在克隆载体中诱导表达。
117.通过pcr从三种模板dna扩增每个靶基因。对于pcr,使用3μl模板dna、1.25μl 5'引物、1.25μl 3'引物、1μl dntps、10μl 5x缓冲液和5x gc增强缓冲液制备总共50μl pcr反应溶液,然后在以下条件下进行pcr:1)变性-98℃10秒;2)退火-在57℃下30秒;3)延伸-在72℃下持续30秒。用于构建包含每个目标基因的重组质粒的克隆如下进行:1)对于插入基因和载体,使用限制性内切酶将dna的两端切割成粘性末端,以及2)使用dna连接酶将插入基因连接到载体中。3)此后,将载体转化大肠杆菌(e.coli top10),4)通过白/蓝筛选法筛选重组大肠杆菌。5)从筛选到的菌株中提取重组质粒,6)将提取的质粒用限制性内切酶处理,测定dna大小。7)最后,通过dna测序确认插入的基因。
118.[表1]
[0119]
[0120]
[0121]
[0122]
[0123][0124]
实施例2.每种靶蛋白的表达和大小分析
[0125]
(1)目标蛋白生产与鉴定
[0126]
将含有各靶基因的质粒转化的大肠杆菌接种到含有50mg/l氨苄青霉素抗生素的luria-bertani液体培养基中,37℃培养16小时或以上。为了分析每种靶蛋白的表达和大小,将培养物以4,000rpm离心15分钟,通过去除上清液收获细胞。将收获的细胞添加到sds样品缓冲液中,在95℃下加热5分钟,并以15,000rpm的转速离心5分钟。使用制备的样品,通过sds-page凝胶分析分析每种靶蛋白的表达和大小(图1)。
[0127]
(2)临床菌株来源的kpc和oxa基因型的确认和蛋白质的确认
[0128]
为了确认来自临床菌株的kpc和oxa,收集确认为超广谱β-内酰胺酶(esbl)阳性的菌株。使用用于kpc和oxa基因扩增的引物对收集的菌株进行菌落pcr。将得到的扩增pcr产物进行琼脂凝胶电泳以确认靶基因的大小。对大小已确认的pcr产物进行dna测序,以确认kpc和oxa基因的确切基因型。
[0129]
将已确认基因型的菌株在lb液体培养基中培养,进行sds-page凝胶分析以检查kpc和oxa蛋白是否会表达。此外,通过与包含含有kpc和oxa基因的载体的现有重组菌株相同的方法,构建了含有来自临床菌株的kpc和oxa基因的重组菌株,并且将该重组菌株也以与临床菌株同样的方法进行了sds-page凝胶分析,以确认实际表达的kpc和oxa蛋白的大小(图2)。
[0130]
来自临床菌株的kpc和oxa蛋白均通过q-tof ms方法鉴定。对于kpc,已确认所鉴定肽的序列覆盖率在全长蛋白质序列中为62.46%(183/293),在不含n末端的活性形式中为67.28%(183/272)。此外,对于oxa,已确认所鉴定肽的序列覆盖率在全长蛋白质氨基酸序列中为16.98%(45/265),在活性形式序列中为18.52%(45/243)。
[0131]
(3)mbl蛋白生产与鉴定
[0132]
将含有目标mbl基因的质粒转化的大肠杆菌接种到含有50mg/l氨苄青霉素抗生素和硫酸锌(0.01mm至1mm znso4)的luria-bertani液体培养基中,37℃培养16小时或更久。为了分析目标蛋白的表达和大小,将培养物以4,000rpm离心15分钟,通过去除上清液收获细胞。将收获的细胞添加到sds样品缓冲液中,在95℃下加热5分钟,并以15,000rpm的转速离心5分钟。使用制备的样品,通过sds-page凝胶分析分析靶蛋白的表达和大小(图3)。
[0133]
实施例3.样品预处理方法及粗酶液中目标蛋白的鉴定
[0134]
(1)用非离子表面活性剂预处理样品
[0135]
对于样品预处理,将培养物以4,000rpm离心15分钟,通过去除上清液收获细胞。为
了获得粗提物,将细胞用缓冲溶液(0.25mm tris-hcl,2%og)处理并在室温下孵育10分钟。将制备的粗提取物通过在4℃下以15,000rpm离心10分钟分离成上清液(以下称为粗酶溶液)和沉淀物。从粗酶溶液中,通过sds-page分析分析靶蛋白的表达和大小(图4)。
[0136]
(2)用离子型表面活性剂预处理样品
[0137]
通过以下步骤进行样品预处理:1)将100ml表达的细胞培养物离心回收细胞,2)去除上清液,然后将含有2%脱氧胆酸钠(doc)作为非离子表面活性剂的缓冲溶液(0.25mm tris-hcl,ph 8.0和2%doc)添加到细胞中。3)将悬浮液在室温下孵育10分钟,4)在4℃以15,000rpm离心10分钟以获得粗酶溶液。
[0138]
从用离子表面活性剂(doc)处理获得的粗提物和粗酶溶液中,通过sds-page凝胶分析分析蛋白质的表达和大小(图4b)。
[0139]
(3)用挥发性缓冲液预处理样品
[0140]
样品预处理方法如下:1)将50mm碳酸氢铵(以下简称abc)溶液加入收获的细胞中,2)通过移液器将细胞重悬,然后3)将悬浮液在4℃以12,000rpm离心10分钟以回收上清液。从处理获得的粗提物和粗酶溶液中,通过sds-page凝胶分析分析蛋白质的表达和大小(图4c和4e)。
[0141]
(4)通过超声预处理样品
[0142]
将通过上述方法(1)至(3)处理的悬浮液中的细胞通过使用声波浴(jac 2010,hansol tech,韩国)以40hz和200w声波处理5至10分钟进行破碎,和15,000rpm离心10min,回收上清液。
[0143]
实施例4.目标蛋白的分离/纯化
[0144]
离子交换色谱用于分离/纯化每种目标蛋白。对于阴离子交换色谱,使用含有q-树脂的柱,对于阳离子交换色谱,使用含有sp-树脂的柱。
[0145]
(1)阴离子交换树脂色谱
[0146]
将粗酶溶液加载到含有q-树脂的柱中,然后收集洗脱溶液。用1ml 20mm tris-hcl(ph 8.0)缓冲液洗涤柱子,将缓冲液中分别含有100mm nacl、200mm nacl、300mm nacl、400mm nacl和500mm nacl 1m的洗脱溶液依次上柱250μl,各区收集洗脱液。
[0147]
(2)阳离子交换树脂色谱
[0148]
使用含有sp-树脂的柱,以与(1)阴离子交换树脂色谱相同的方式分离/纯化每种目标蛋白。
[0149]
最后,通过上述离子交换色谱法分离/纯化了六种所需的目标蛋白(图4)。最后,使用与上述相同的方法从细胞裂解物中分离/纯化每种高纯度蛋白质。
[0150]
实施例5.每种目标蛋白的表达和大小分析
[0151]
使用凝胶内消化法和纳米lc-ms/ms法鉴定了在sds-page凝胶上表达和大小得到确认的蛋白质,从而确定了菌株中实际表达的抗生素抗性蛋白的类型(图7)。
[0152]
(1)凝胶内消化
[0153]
只得到与sds-page凝胶上各目标蛋白大小相对应的条带部分,对染色后的凝胶进行脱色。对脱色的凝胶进行还原/烷基化处理,然后使用胰蛋白酶选择性消化蛋白质。使用dk-tip(c18 tip)回收消化的肽并脱盐。
[0154]
(2)纳米lc-ms/ms
[0155]
为了确认菌株中表达的活性蛋白的序列和覆盖率,进行了纳米液相色谱和高分辨率质谱(q-exactive hf-x质谱系统)。将脱盐的肽样品用0.1%甲酸溶液溶解,然后装入柱中。使用c18柱(75μm
×
70cm)和纳流液相色谱分离肽样品。在这种情况下,用于样品加载和分离的梯度条件示例如下:
[0156]-缓冲液a:0.1%甲酸水溶液/缓冲液b:0.1%甲酸乙腈溶液
[0157]-样品加载:从0到5分钟,5%(b),5μl/min流速
[0158]-分离浓度梯度:
[0159]
从5到7分钟,从5%到10%(b),300nl/min流速
[0160]
从7到38分钟,从10%到40%(b),300nl/min流速
[0161]
从38到38.5分钟,从40%到80%(b),300nl/min流速
[0162]
从38.5到39.5分钟,80%(b),300nl/min流速
[0163]
从39.5到40分钟,从80%到5%(b),300nl/min流速
[0164]
从40到60分钟,5%(b),300nl/min流速
[0165]
在这种情况下,使用的质谱仪参数的例子如下:
[0166]-分辨率:全ms 60,000,ms2 30,000
[0167]-全ms:350至2,000m/z,100毫秒
[0168]-ms2:50毫秒,nce 28,1,带电状态》6的电离材料被排除在ms2分析之外
[0169]“proteome discoverer(v2.4)”软件(赛默科技(thermo scientific))用于根据自下而上的数据识别肽和蛋白质,蛋白质/肽识别基于1%的fdr(错误发现率)。在来自大肠杆菌、kpc、oxa、mbl蛋白或ges蛋白的蛋白质中,鉴定到了kpc蛋白的200个肽(表2),oxa的177个肽(表3),ndm蛋白的109个肽(表4),imp(表5)的146个肽(表5)、vim蛋白的159个肽(表6)和ges的111个肽(表7)。
[0170]
[表2]被鉴定为kpc蛋白的每个肽的位置和序列信息
[0171]
[0172]
[0173]
[0174]
[0175]
[0176]
[0177]
[0178]
[0179][0180]
[表3]每个被鉴定为oxa蛋白的肽的位置和序列信息
[0181]
[0182]
[0183]
[0184]
[0185]
[0186]
[0187][0188]
[0189]
[表4]鉴定为ndm蛋白的每个肽的位置和序列信息
[0190]
[0191]
[0192]
[0193]
[0194]
[0195]
[0196][0197]
[表5]每个被鉴定为ipm蛋白肽段的位置和序列的肽段信息,
[0198]
[0199]
[0200]
[0201]
[0202]
[0203]
[0204]
[0205]
[0206][0207]
[0208]
[表6]鉴定为vim蛋白的每个肽的位置和序列信息
[0209]
[0210]
[0211]
[0212]
[0213]
[0214]
[0215]
[0216]
[0217][0218]
[表7]鉴定为ges蛋白的每个肽的位置和序列信息
[0219]
[0220]
[0221]
[0222]
[0223]
[0224]
[0225][0226]
对于kpc蛋白,鉴定了其中三个甲硫氨酸残基(49、116和151)中的一个甲硫氨酸处于氧化形式的肽(图6a)。对于oxa,鉴定了其中六个甲硫氨酸残基(115、138、195、237、239和241)中的一个甲硫氨酸或两个或三个甲硫氨酸残基为氧化形式的肽(图6b)。
[0227]
具体地,对于kpc蛋白,未检测到由残基1-21组成的n末端序列肽,并且对于oxa蛋白,未检测到由残基1-22组成的n末端序列肽。对于该kpc,当考虑除残基1-21以外的序列时,识别出覆盖整个序列的肽段,序列覆盖率从92.8%(272/293)增加到100%(272/272)。对于oxa,当考虑除残基1-22之外的序列时,序列覆盖率从91.7%(243/265)增加到100%(243/243)。
[0228]
对于ndm蛋白,鉴定到了其中七个甲硫氨酸残基(39、67、126、129、245、248和265)中的一个甲硫氨酸处于氧化形式的肽(图6e)。对于ges,鉴定到了其中六个甲硫氨酸残基(62、95、112、143、164和181)中的一个或两个甲硫氨酸残基为氧化形式的肽(图6f)。对于imp和vim,没有鉴定出其中甲硫氨酸处于氧化形式的肽(图6d和6e)。
[0229]
对于imp和vim蛋白,未检测到分别由残基1-18和残基1-26组成的n末端序列肽,而对于ges,由残基1-18组成的n末端序列肽没有检测到。当考虑不包括n末端的靶蛋白序列时,识别的序列覆盖率为ndm 97.2(243/250)、imp 97.8%(223/228)、vim 100%(240/240)和ges 98.5%(265/269)。
[0230]
(3)n末端序列的鉴定(图7)
[0231]
kpc
[0232]-n末端序列:(s)/ataltnlvaepfak(l)(半胰蛋白酶(semi-tryptic))
[0233]
kpc-3
[0234]-n末端序列:(s)/ataltnlvaepfak(l)(半胰蛋白酶)
[0235]
kpc-17
[0236]-n末端序列:(s)/ataltnlvaepfak(l)(半胰蛋白酶)
[0237]
oxa
[0238]-n末端序列:(a)/kewqenk(s)(半胰蛋白酶)
[0239]
oxa-181
[0240]-n末端序列:(a)/kewqenkswnahftehk(s)(半胰蛋白酶)
[0241]
ndm
[0242]-n末端序列:(m)pgeirptigqqmetgdqr(f)(半胰蛋白酶)
[0243]
imp
[0244]-n末端序列:(a)aeslpdlk(i)(半胰蛋白酶)
[0245]
imp-1
[0246]-n末端序列:(a)/aeslpdlk(i)(半胰蛋白酶)
[0247]
imp-4
[0248]-n末端序列:(a)/aeslpdlk(i)(半胰蛋白酶)
[0249]
vim
[0250]-n末端序列:(s)/vdssgeyptvseipvgevr(l)(半胰蛋白酶)
[0251]
vim-1
[0252]-n末端序列:(s)/gepsgeyptvneipvgevr(l)(半胰蛋白酶)
[0253]
vim-4
[0254]-n末端序列:(s)/gepsgeyptvneipvgevr(l)(半胰蛋白酶)
[0255]
ges
[0256]-n末端序列:(a)sekltfk(t)(半胰蛋白酶)
[0257]
ges-1
[0258]-n末端序列:(a)/sekltfk(t)(半胰蛋白酶)
[0259]
实施例6.每种蛋白质的氨基酸测序和表征
[0260]
基于实施例5中获得的ms2结果,对迄今为止在国家生物技术信息中心(ncbi)数据库中已知的总共43个kpc亚型蛋白(图8a)、660个oxa亚型蛋白(图8b)、27个ndm亚型蛋白(图8c)、79种imp亚型蛋白(图8d)、66种vim亚型蛋白(图8e)和43种ges亚型蛋白(图8f)进行多重比对分析。
[0261]
kpc和oxa蛋白
[0262]
已证实,包括kpc-2在内的42种蛋白质的全长氨基酸序列的97.3%或以上是保守的,而对于oxa蛋白,包括对碳青霉烯类抗生素具有抗性的oxa-48在内的30种蛋白质的全长氨基酸序列的91.3%或以上是保守的。为了鉴定每种蛋白质的特征,通过mega x程序进行kpc和oxa的系统发育树分析(图9a和9b)。具体而言,43个kpc亚型蛋白均含有相同的n末端肽(第1至第21个氨基酸),其中包括kpc-2在内的35个亚型蛋白均由293个氨基酸组成的序列组成。对于oxa,鉴定到了30种包含相同n末端肽(第1至第22个氨基酸)的oxa蛋白,并且23种oxa蛋白的特征在于与由265个氨基酸组成的序列组成的oxa-48相同的序列。
[0263]
mbl蛋白和ges蛋白
[0264]
确认序列相似性为90.9%(ndm)、44.8%(imp)、63.5%(vim)和86.5%(ges)。作为具有相同n末端的亚型蛋白,鉴定出27个ndm亚型蛋白、23个imp亚型蛋白(89.4%)、26个vim亚型蛋白(92.1%)和35个ges亚型蛋白(87.9%)。作为具有与n末端序列相同肽数和相同全长氨基酸序列的亚型蛋白,鉴定出26个ndm亚型蛋白(92.6%)、23个imp亚型蛋白(89.4%)、25个vim亚型蛋白(93.6%)、和34种ges亚型蛋白(88.9%)。为了鉴定每种蛋白质的特征,通过mega x程序对mbl蛋白和ges蛋白的亚型蛋白进行系统发育树分析(图9c至9f)。结果可以确认每个包含ndm-1、imp-6、vim-2和ges-5的亚组在系统发育树分析中被分组,与在多重比对分析中确认的结果一样。
[0265]
实施例7.使用质谱法鉴定靶蛋白(自上而下方法)
[0266]
为了确定在菌株中表达的活性蛋白的质量值,进行自上而下的质谱法。为了确认蛋白质的准确质量值,使用了从菌株来源的粗蛋白质提取物中部分纯化获得的样品,和能够进行自上而下分析的lc-ms/ms系统(nano-lc和q-exactive hf-x质谱系统)。
[0267]
(1)纯化蛋白质的质谱
[0268]
注入约0.5μg的部分纯化的蛋白质样品。使用不带柱的直接注入方法并使用纳流泵进行分析。在这种情况下使用的样品分析条件如下。
[0269]
–
缓冲液a:0.1%甲酸水溶液
[0270]
–
样品分析:从0到10分钟,100%固定缓冲液(a)100%,4μl/min固定流速
[0271]
(2)使用高分辨率质谱法对靶蛋白进行质谱分析
[0272]
使用q-exactive hf-x质谱仪的蛋白质模式分析方法,获得并鉴定了完整蛋白质的质量值和蛋白质的串联质谱。在这种情况下使用的参数如下。
[0273]-分辨率:使用完全ms 120,000、ms2 60,000或120,000
[0274]-全ms:620至2,400m/z,100毫秒
[0275]-ms2:使用1或2次微扫描,1,000毫秒,nce 50;ms2分析中排除了带电状态为1至8的电离材料。
[0276]
使用由美国pnnl(太平洋西北国家实验室)开发的基于自上而下数据识别蛋白质的软件“蛋白质组学信息(informed proteomics)”。
[0277]
kpc和oxa蛋白
[0278]
出现了几个多电荷kpc蛋白(z=+13至+20)或oxa蛋白(z=+22至+37)峰(图10a和10b),并确认通过峰解卷积获得的代表性质量值为28,718.13m/z
×
z的平均分子量,对应于28,700.69m/z
×
z的单同位素质量。确定的代表质量值表示在第68位半胱氨酸和第237位半胱氨酸之间存在二硫键的状态下kpc蛋白的质量值。此外,观察到由甲硫氨酸氧化引起的其他峰(例如,具有一个氧化甲硫氨酸的多肽显示平均分子量为28,718+16m/z
×
z)。它们与通过凝胶内消化(自下而上的方法)获得的kpc或oxa蛋白质序列中的氧化甲硫氨酸残基的位置(kpc的第49、116和151位,oxa的第115、138、195、237、239和241位)部分重合。即使在基于自上而下方法的分析中,也未观察到包括由kpc的第1-21位残基或oxa的第1-22位残基组成的n末端序列的多肽。当排除各自的n末端序列时,kpc(第22-293位氨基酸)和oxa(第23-265位氨基酸)都显示出100%的序列覆盖率(图12a和12b)。
[0279]
mbl蛋白和ges蛋白
[0280]
出现多个带电荷的mbl蛋白或ges蛋白的峰(图10c、10e、10g和10i),并且证实,对于ndm,通过峰的去卷积获得的代表性质量值是平均分子量26,724m/z
×
z,对应于26,707m/z
×
z的单一同位素质量。经证实,imp的平均分子量为25082.68m/z
×
z,对应的单同位素质量为25,067.19m/z
×
z,vim的平均分子量为25,515.42m/z
×
z,对应的单同位素质量25,499.92m/z
×
z,ges的平均分子量为29,245.15m/z
×
z,对应的单同位素质量为29,226.92m/z
×
z。已证实,鉴定的ndm代表性质量值对应于棕榈酰化蛋白质类型(图11a)。此外,还观察到由甲硫氨酸氧化和甲基化引起的其他峰(例如,具有一个氧化甲硫氨酸的多肽的平均分子量为26724+16m/z
×
z,具有一个甲基化的多肽的平均分子量为26724+14m/z
×
z)(图11b)。另一方面,对于imp和vim,没有发现特定的蛋白质修饰。对于ges,在第63位半胱氨酸和第233位半胱氨酸之间发现了二硫键,并且还观察到了由甲硫氨酸氧化引起的其他峰。它们部分与通过凝胶内消化(自下而上方法)获得的ndm或ges蛋白质序列中的氧化甲硫氨酸残基的位置(ndm的第39、67、126、129、245、248和265位,ges的第62、95、112、143、164、181位)一致。即使在基于自上而下方法的分析中,也未观察到包括由ndm的第1-19位或第1-20位残基、imp的第1-18位残基、vim的第1-26位残基或ges的第1-18残基组成的n末端序列的多肽。当排除各自的n末端序列时,在ndm蛋白的第21-270位残基(图12c)、imp蛋白的第19-246位残基(图12d)和vim的第27-266位残基(图12e)中鉴定出100%的序列覆盖率蛋白质。此外,对于ges蛋白,在第19-287位残基中鉴定出100%的序列覆盖率(图12f)。
[0281]
(3)使用低分辨率质谱法对靶蛋白进行质谱分析
[0282]
使用低分辨率质谱仪(1,sciex 4800;2,布鲁克生物分型仪(bruker biotyper)maldi-tof ms系统)获得每种蛋白质的质谱图谱。首先,将1μl芥子酸(sa,在0.1%tfa/50%乙腈中以10mg/ml存在)基质和约100ng的每种蛋白质置于板点上,完全干燥,并进行质谱分析。蛋白质样品可以使用所有固体培养中培养的菌落、液体培养中收获的细胞、细胞裂解后的粗提物和粗酶溶液以及纯化后获得的纯化蛋白。在这种情况下,使用的最大能量为30%,
进行随机位置获取,总共照射2000次激光(每次40次),并累积获得每个光谱数据。获得了10,000至40,000m/z(kpc和oxa)或35,000m/z(mbl和ges)范围内的质谱图,同时检测电荷态为+1的每种靶蛋白和电荷态为+2的每种靶蛋白(图13)。作为低分辨率质谱分析的结果,对于所有三种mbl蛋白和ges蛋白,均检测到+1和+2的电荷状态。特别地,对于作为锚定在细胞膜上的蛋白质的ndm蛋白,鉴定了对应于棕榈酰化的分子量(平均质量=238.4136,单同位素质量=238.22966)和对应于非棕榈酰化的分子量。
[0283]
(4)蛋白质亚型质量值的比较
[0284]
kpc、oxa、mbl和ges蛋白的准确质量值通过上述方法确认,并且可以根据确认的质量值来确认去除了n末端肽的活性蛋白质的质量值。因此,对于在ncbi中发现的所有kpc、oxa、mbl和ges蛋白,活性蛋白的确切质量值可以通过高分辨率或低分辨率质谱来确认,并且可以通过质谱快速准确地鉴定各种类型的亚型蛋白质(表8至13)。
[0285]
[表8]kpc蛋白的质量数据
[0286]
[0287]
[0288]
[0289]
[0290][0291]
[表9]oxa蛋白的质量数据
[0292]
[0293][0294]
[表10]ndm蛋白的质量数据
[0295]
[0296][0297]
[表11]imp蛋白的质量数据
[0298]
[0299]
[0300][0301]
[表12]vim蛋白的质量数据
[0302]
[0303]
[0304][0305]
[表13]ges蛋白的质量数据
[0306]
[0307]
[0308]
[0309]
[0310][0311]
实施例8.源自临床菌株的mbl蛋白和ges的基因型鉴定和蛋白鉴定
[0312]
为了鉴定来自临床菌株的ndm、imp和vim(mbl蛋白)和ges(a类碳青霉烯蛋白),收集确认为cre(耐碳青霉烯类肠杆菌科)阳性的菌株。使用pcr方法对收集的菌株进行每个基因的基因分型。
[0313]
使用lb液体培养基培养确认基因型的菌株,通过sds-page凝胶分析分析mbl蛋白(ndm、imp和vim)和ges蛋白是否表达(图2)。
[0314]
临床菌株来源的mbl蛋白和ges蛋白通过凝胶内消化法消化,并使用q-exactive hf-x plus系统通过自下而上法鉴定。已证实,对于ndm,已鉴定肽的序列覆盖率在全长蛋白质序列中为61.11%(165/270),在去除n末端的活性形式中为65.74%(165/251)。经证实,对于imp和vim,在全长蛋白质序列中,已识别肽的序列覆盖率分别为22.76%(56/246)和44.74%(119/266),在去除n末端的活性形式中,序列覆盖率分别为24.56%(56/228)和49.58%(119/240)。此外,经证实,对于ges,所鉴定肽段的全长氨基酸序列覆盖率为67.25%(193/287),活性蛋白序列覆盖率为71.75%(193/269)。
[0315]
尽管已经参照具体特征对本发明进行了详细描述,但对于本领域技术人员来说显而易见的是,该描述仅是其优选实施方案,并不限制本发明的范围。因此,本发明的实质范围将由所附权利要求及其等同物来定义。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1