一种土壤生物有效态汞的检测方法
本发明涉及土壤检测技术领域,尤其涉及一种土壤生物有效态汞的检测方法。
背景技术:
汞是一种具有高度毒性的重金属元素,是全球广泛关注的污染物之一。国内外很多地方的土壤都受到不同程度的汞污染。土壤中的汞污染具有潜伏性,可通过食物链对人体健康产生威胁,如肌萎缩性脊髓侧索硬化症,老年痴呆症和帕金森症等多种疾病,甲基汞更是会对神经系统和心血管系统造成威胁。土壤中的汞以多种形态存在,其中植物能吸收的有效态的汞含量(包括水溶性、代换性和螯合的汞)对农产品安全至关重要。研究已经证实,土壤重金属总量指标难以评价土壤污染状况及其对农产品安全的影响,而土壤有效态重金属含量指标能更好地反映土壤实际污染状况及其对农产品的生物吸收量,很多学者提出了用土壤有效态重金属来评价土壤的受污染程度及治理修复效果评估。对有效态汞检测更为重要的意义在于,能够在我国耕地资源有限的条件下,更大限度的利用总量呈现中轻度污染而有效态含量低的耕地,使耕地资源利用率最大化。
当前在研究土壤中各种重金属的有效性方面,cu、pb、zn、cd等元素已有较好的浸提剂和分析方法,但对汞的有效性检测方法研究还很少,迄今为止国内外尚无统一的土壤有效态汞的检测方法。目前较为常用的土壤有效态汞参考提取方法有hcl法、dtpa法、中性盐法等,但是各种方法对土壤有效汞的提取条件不一致,所获得结果差异较大,对作物的有效性评估结果不理想。因此,土壤有效态汞含量的检测方法成为当前亟需的技术。有效态汞检测方法的建立,可以有效评估土壤汞的生物有效性和农产品生产的安全性。
技术实现要素:
为了解决上述技术问题,本发明提供了一种土壤生物有效态汞的检测方法,本发明通过特制的与作物吸收显著相关的土壤有效态汞提取剂,确保了土壤生物有效态汞提取的有效、准确和稳定性,可有效解决土壤生物有效态汞的检测困难问题,帮助解决判断土壤种植作物的安全性。本发明方法可靠,前处理简单,检测时间短,灵敏度高、精密度高,稳定性好。
本发明的具体技术方案为:一种土壤生物有效态汞的检测方法,包括以下步骤:
1)土壤样品的采集;
2)土壤样品的风干;
3)土壤样品前处理:称取土壤样品于容器中,按固液比5g/(40-60ml)加入以水为溶剂且含有0.02-0.04%硫氢基乙酸和0.08-0.12mol/lcacl2的提取剂,在温度25±2℃下振荡1-3h,过滤,取上清液,加入上清液质量4-6%的盐酸,得到待测样品;
4)标准曲线的绘制;
5)样品检测:对步骤3)所得待测样品进行检测,得到待测样品的荧光强度,代入标准曲线后得到汞浓度值;若汞浓度值超出标准曲线范围,则采用提取剂进行稀释后再检测;将所得汞浓度值代入公式计算得到土壤样品中生物有效态汞的含量;所述公式如下:
c为待测样品的汞浓度值,单位为微克每升(μg/l);
c0为空白标准工作液的测定汞浓度,单位为微克每升(μg/l);
v为待测样品体积,单位为ml;
f为稀释倍数;
m为土壤质量,单位为g。
本发明可有效提取出土壤中与作物吸收显著相关的有效态汞含量,可有效解决土壤生物有效态汞的检测困难问题,帮助解决判断土壤种植作物的安全性。本发明方法可靠,前处理简单,检测时间短,灵敏度高、精密度高,稳定性好。
本发明方法的核心是研发了一种新的土壤生物有效态汞提取剂,提取的土壤有效态汞与作物吸收相关性显著,可以很好地表征土壤对作物种植汞污染程度。以往关于有效态汞提取剂方面的研究,包括有hcl、dtpa、cacl2、nh4oac等,但存在缺陷,一是提取能力弱,提取出的有效态汞量很低,检测定值困难;二是提取的土壤有效态汞与作物的相关性不强。
土壤中的汞以多种形态存在,其中植物能吸收的有效态的汞包括水溶性、代换性和螯合的汞,本发明提取剂通过土壤交换反应可提取出以上形态的土壤有效态汞。本发明团队通过土壤作物一一对应检测分析,发现本发明提取剂提取得到的汞与现有的提取剂相比相关性更为显著。
本发明方法有以下关键点:(1)提取剂与土壤样品的固液比为5g/(40-60ml)。我们在研究过程中发现,汞有效态的提取,只有在上述特定比例下进行提取,才能够提取获得与作物相关性好的有效态汞,提取剂用量过高或多低都会带来负面影响。(2)步骤3)样品完成提取后,必须按4-6%的比例加入盐酸保存,保证样品提取液汞的稳定性。若不加盐酸,低浓度下汞的含量变化很大,从而带来不利结果(详见实施方式中的对照试验)。(3)标准工作液以提取液为溶剂进行稀释,原因是在于我们发现用水稀释结果不稳定,随时间结果变异大(详见实施方式中的对照试验)。
作为优选,步骤1)中,土壤样品的采集具体为:在农产品生产基地采集土壤样品,取样点至少为5个,每点取土样量一致,混合为一个土壤样品。
作为优选,步骤1)中,所述土壤样品采集于在作物生长对应的土壤部位。
作为优选,步骤2)中,土壤样品的风干具体为:将土壤样品平铺,阴凉环境下自然风干,风干过程中分离杂质,风干后过筛备用。
作为优选,步骤2)中,所述过筛为过2mm筛。
作为优选,步骤3)中,所述振荡速度为180±10r/min。
作为优选,步骤4)中,标准曲线的绘制具体为:采用提取剂配制不同含汞浓度的标准工作液,以硼氢化钾溶液为还原剂,硝酸溶液为载流,由低浓度到高浓度顺次测定校准标准工作液的原子荧光强度;以扣除零浓度空白的标准工作液的原子荧光强度为纵坐标,以汞浓度为横坐标,绘制标准曲线。
作为优选,所述标准工作液的浓度设置为0.00μg/l、0.25μg/l、0.50μg/l、1.00μg/l、1.50μg/l、2.00μg/l。
作为优选,步骤2)中,所述盐酸为优级纯。
作为优选,步骤3)中,所述硝酸溶液为优级纯,体积百分比浓度为4-6%;硼氢化钾溶液为分析纯,浓度为0.08-0.12g/l。
作为优选,步骤3)中,所述待测样品在当天完成检测。
与现有技术相比,本发明具有以下技术效果:本发明通过特制的与作物吸收显著相关的土壤有效态汞提取剂,确保了土壤生物有效态汞提取的有效、准确和稳定性,可有效解决土壤生物有效态汞的检测困难问题,帮助解决判断土壤种植作物的安全性。本发明方法可靠,前处理简单,检测时间短,灵敏度高、精密度高,稳定性好。
附图说明
图1为两种不同提取剂提取所得提取液的稳定性结果图;
图2为两种不同提取剂提取所得提取液的对比照片;
图3为不同配方标准工作液的检测结果比较图;
图4为采用硫氢基乙酸+cacl2提取土壤有效态汞与农产品汞含量的相关性图;
图5为采用硫氢基乙酸取土壤有效态汞与农产品汞含量的相关性图。
具体实施方式
下面结合实施例对本发明作进一步的描述。
总实施例
一种土壤生物有效态汞的检测方法,包括以下步骤:
1)土壤样品的采集:在农产品生产基地采集作物生长对应部位的土壤样品,取样点至少为5个,每点取土样量一致,混合为一个土壤样品。
2)土壤样品的风干:将土壤样品平铺,阴凉环境下自然风干,风干过程中分离杂质,风干后过2mm尼龙筛备用。
3)土壤样品前处理:称取土壤样品于容器中,按固液比5g/(40-60ml)加入以水为溶剂且含有0.02-0.04%硫氢基乙酸和0.08-0.12mol/lcacl2的提取剂,以180±10r/min的振荡速度,在温度25±2℃下振荡1-3h,过滤,取上清液,加入上清液质量4-6%的盐酸(优级纯),得到待测样品;待测样品在当天完成检测。
4)标准曲线的绘制:采用提取剂配制不同含汞浓度的标准工作液(浓度设置为0.00μg/l、0.25μg/l、0.50μg/l、1.00μg/l、1.50μg/l、2.00μg/l),以硼氢化钾溶液(分析纯,浓度为0.08-0.12g/l)为还原剂,硝酸溶液(优级纯,体积浓度为4-6%)为载流,由低浓度到高浓度顺次测定校准标准工作液的原子荧光强度;以扣除零浓度空白的标准工作液的原子荧光强度为纵坐标,以汞浓度为横坐标,绘制标准曲线。
5)样品检测:对步骤3)所得待测样品进行检测,得到待测样品的荧光强度,代入标准曲线后得到汞浓度值;若汞浓度值超出标准曲线范围,则采用提取剂进行稀释后再检测;将所得汞浓度值代入公式计算得到土壤样品中生物有效态汞的含量;所述公式如下:
c为待测样品的汞浓度值,单位为微克每升(μg/l);
c0为空白标准工作液的测定汞浓度,单位为微克每升(μg/l);
v为待测样品体积,单位为ml;
f为稀释倍数;
m为土壤质量,单位为g。
实施例1:不同提取剂提取效果对比
选取现有常用提取剂盐酸、氯化钙、醋酸铵、二乙基三胺五乙酸,以及硫氢基乙酸+磷酸氢二钠和本发明的提取剂硫氢基乙酸+氯化钙进行提取效果试验。
1、土壤样品前处理:
选取低中高8个浓度样品,准确称取过2mm孔径尼龙筛的土壤样品5.00g,置于干燥的250ml的塑料瓶中,各加入0.1mol/l盐酸、0.1mol/l氯化钙、1mol/l醋酸铵、0.005mol/l二乙基三胺五乙酸、0.03%硫氢基乙酸+1/15mol·l-1磷酸氢二钠、0.03%硫氢基乙酸+0.1mol/lcacl2提取剂50ml,将瓶塞盖紧,在25℃±2℃的温度下以180±20rpm/min的振荡速度下振荡2h,立即离心过滤,取上清液按5wt%比例加入盐酸(优级纯),备测。各处理重复三次。
2、标准工作液配制:
将具有标准物质证书的汞标准溶液1000mg/l,用5%盐酸逐级稀释到10.0μg/l标准工作液。移取汞标准工作液0.00、2.5、5.00、10.0、15.0、20.0ml于100ml容量瓶中,用提取剂定容至标线,混匀,溶液为含汞0.00、0.25、0.50、1.00、1.50、2.00μg/l的标准溶液系列。
3、样品测定
标准曲线制作:按照仪器说明书设定并调试仪器最佳条件,以5%硝酸溶液进样,稳定10min~20min,待读数稳定基本回零,开始测量。以0.1g/l硼氢化钾溶液为还原剂,5%硝酸溶液做载流,由低浓度到高浓度顺次测定系列标准溶液的原子荧光强度。用扣除零浓度空白的校准系列原子荧光强度为纵坐标,溶液中相对应的元素浓度(μg/l)为横坐标,绘制校准曲线。
样品测定:以0.1g/l硼氢化钾溶液为还原剂,5%硝酸溶液做载流,测定样品空白、试样的荧光强度。溶液当天完成测定。
计算结果:
基于公式1计算得到土壤样品中生物有效态汞含量(μg/kg):
其中:
c——样品汞测定浓度,单位为微克每升(μg/l);
c0——试剂空白液测定浓度,单位为微克每升(μg/l);
v——浸提液体积,单位为毫升(ml);
f——稀释倍数;
m——称取的土壤质量,单位为克(g)。
各提取剂提取检测结果见表1,可见,盐酸、氯化钙、醋酸铵、二乙基三胺五乙酸提取有效态汞含量太低,检测结果低且不稳定,检测难度大。硫氢基乙酸+磷酸氢二钠和硫氢基乙酸+氯化钙提取有效态汞含量较高。
表1不同提取剂提取效果试验结果(μg/kg)
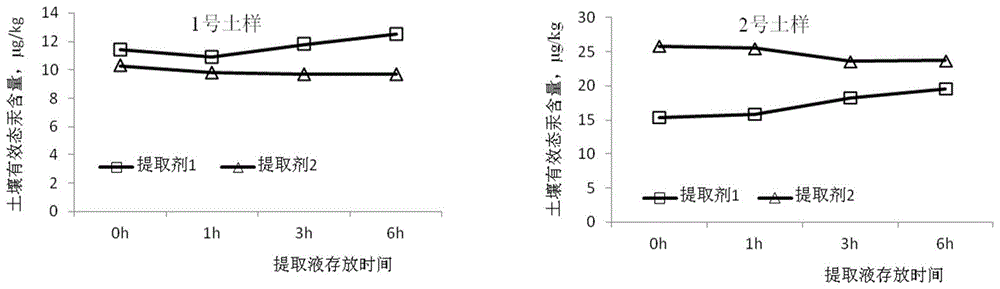
选取中低浓度各1个土壤样品(中浓度1号土样、高浓度2号土样),按照本检测方法进行硫氢基乙酸+磷酸氢二钠(提取剂1)、硫氢基乙酸+氯化钙(提取剂2)进行稳定性试验,分别在提取后0h、1h、3h、6h测定提取液汞含量,结果见图1。可见硫氢基乙酸+磷酸氢二钠提取在0-6h内提取液测定结果不稳定,变异系数为11.5%。而本发明的提取剂在6h内结果稳定,变异系数为4.7%。分析表明,由硫氢基乙酸+磷酸氢二钠提取液体呈黄色(图2,左),可能导致结果存在不一致,而硫氢基乙酸+氯化钙提取液清澈透明(图2,右),结果稳定。
实施例2:提取液加盐酸保存试验
1、土壤样品前处理:
选取低高二个浓度样品(1号土和2号土),准确称取过2mm孔径尼龙筛的土壤样品5.00g,置于干燥的250ml的塑料瓶中,加入含0.03wt%硫氢基乙酸、0.1mol/lcacl2水提取剂50ml,将瓶塞盖紧,在25℃±2℃的温度下以180±20rpm/min的振荡速度下振荡2h,立即离心过滤,取上清液分别按5wt%比例加入盐酸(优级纯)和不加盐酸检测。
2、标准工作液配制:
将具有标准物质证书的汞标准溶液1000mg/l,用5%盐酸逐级稀释到10.0μg/l标准工作液。移取汞标准工作液0.00、2.5、5.00、10.0、15.0、20.0ml于100ml容量瓶中,用提取剂定容至标线,混匀,溶液为含汞0.00、0.25、0.50、1.00、1.50、2.00μg/l的标准溶液系列。
3、样品测定
标准曲线制作:按照仪器说明书设定并调试仪器最佳条件,以5%硝酸溶液进样,稳定10min~20min,待读数稳定基本回零,开始测量。以0.1g/l硼氢化钾溶液为还原剂,5%硝酸溶液做载流,由低浓度到高浓度顺次测定系列标准溶液的原子荧光强度。用扣除零浓度空白的校准系列原子荧光强度为纵坐标,溶液中相对应的元素浓度(μg/l)为横坐标,绘制校准曲线。
样品测定:以0.1g/l硼氢化钾溶液为还原剂,5%硝酸溶液做载流,测定样品空白、试样的荧光强度。溶液当天完成测定。
计算结果:
基于公式1计算得到土壤样品中生物有效态汞含量(μg/kg):
其中:
c——样品汞测定浓度,单位为微克每升(μg/l);
c0——试剂空白液测定浓度,单位为微克每升(μg/l);
v——浸提液体积,单位为毫升(ml);
f——稀释倍数;
m——称取的土壤质量,单位为克(g)。
结果见表2。可见在低浓度样品,提取液加盐酸保存,检测结果在12h内稳定,变异系数<5%,12h内检测结果与即时(0h)检测结果相差不大,相对偏差<10%,而不加盐酸的提取液变异系数在14.05~31.88%,相对偏差最大为14.13%。而高浓度样品相对变异较小,加盐酸和不加盐酸差异不明显。因此为保证低浓度样品检测结果的稳定准确,在提取液中加入盐酸保存。
表2提取液保存处理试验结果
同样检测方法,另取2个样品开展采用水、提取液定容标准工作液比较试验,结果见图3。可见,以提取剂定容标准工作液,结果随时间变化影响不大,两种含量样品变异系数分别为4.26%和6.21%,而用水稀释变异系数分别达17.43%和30.57%,说明标准工作液以提前剂配制较好。分析原因可能是提取剂溶液对汞离子具有保护作用。
实施例3:检测方法精密度实验
1、土壤样品前处理:
选取低中高三个浓度样品,准确称取过2mm孔径尼龙筛的土壤样品5.00g,置于干燥的250ml的塑料瓶中,加入含0.03wt%硫氢基乙酸、0.1mol/lcacl2水提取剂50ml,将瓶塞盖紧,在25℃±2℃的温度下以180±20rpm/min的振荡速度下振荡2h,立即离心过滤,取上清液按5wt%比例加入盐酸(优级纯),备测。
2、标准工作液配制:
将具有标准物质证书的汞标准溶液1000mg/l,用5%盐酸逐级稀释到10.0μg/l标准工作液。移取汞标准工作液0.00、2.5、5.00、10.0、15.0、20.0ml于100ml容量瓶中,用提取剂定容至标线,混匀,溶液为含汞0.00、0.25、0.50、1.00、1.50、2.00μg/l的标准溶液系列。
3、样品测定
标准曲线制作:按照仪器说明书设定并调试仪器最佳条件,以5%硝酸溶液进样,稳定10min~20min,待读数稳定基本回零,开始测量。以0.1g/l硼氢化钾溶液为还原剂,5%硝酸溶液做载流,由低浓度到高浓度顺次测定系列标准溶液的原子荧光强度。用扣除零浓度空白的校准系列原子荧光强度为纵坐标,溶液中相对应的元素浓度(μg/l)为横坐标,绘制校准曲线。
样品测定:以0.1g/l硼氢化钾溶液为还原剂,5%硝酸溶液做载流,测定样品空白、试样的荧光强度。溶液当天完成测定。
表3精密度试验仪器检测结果
计算结果:
基于公式1计算得到土壤样品中生物有效态汞含量(μg/kg):
其中:
c——样品汞测定浓度,单位为微克每升(μg/l);
c0——试剂空白液测定浓度,单位为微克每升(μg/l);
v——浸提液体积,单位为毫升(ml);
f——稀释倍数;
m——称取的土壤质量,单位为克(g)。
表4精密度试验样品检测结果及相对标准偏差
由以上表4可见,采用本检测方法,样品相对标准偏差小于5%,说明该方法平行性良好。
实施例4:实际样品检测
1、土壤样品前处理:
在农产品生产基地,在作物生长点一一对应采集土壤样品20个,经风干后过2mm孔径尼龙筛,为待测样品。准确称取过待测土壤样品5.00g,置于干燥的250ml的塑料瓶中,加入含0.03wt%硫氢基乙酸、0.1mol/lcacl2水提取剂50ml,将瓶塞盖紧,在25℃±2℃的温度下以180±20rpm/min的振荡速度下振荡2h,立即离心过滤,取上清液按5%比例加入盐酸溶液,备测。
2、标准工作液配制:
将具有标准物质证书的汞标准溶液1000mg/l,用5%盐酸逐级稀释到10.0μg/l标准工作液。移取汞标准工作液0.00、2.5、5.00、10.0、15.0、20.0ml于100ml容量瓶中,用0.03%硫氢基乙酸-0.1mol/lcacl2提取剂定容至标线,混匀,溶液为含汞0.00、0.25、0.50、1.00、1.50、2.00μg/l的标准溶液系列。
3、样品测定
标准曲线制作:按照仪器说明书设定并调试仪器最佳条件,以5%硝酸溶液进样,稳定10min~20min,待读数稳定基本回零,开始测量。以0.1g/l硼氢化钾溶液为还原剂,5%硝酸溶液做载流,由低浓度到高浓度顺次测定系列标准溶液的原子荧光强度。用扣除零浓度空白的校准系列原子荧光强度为纵坐标,溶液中相对应的元素浓度(μg/l)为横坐标,绘制校准曲线。
样品测定:以0.1g/l硼氢化钾溶液为还原剂,5%硝酸溶液做载流,测定样品空白、试样的荧光强度。溶液当天完成测定。
计算结果:
基于公式1计算得到土壤样品中生物有效态汞含量(μg/kg):
其中:
c——样品汞测定浓度,单位为微克每升(μg/l);
c0——试剂空白液测定浓度,单位为微克每升(μg/l);
v——浸提液体积,单位为毫升(ml);
f——稀释倍数;
m——称取的土壤质量,单位为克(g)。
表5实际样品检测结果及相对偏差
由以上表3可见,采用本检测方法,样品标准偏差小于10%,检测方法准确可靠。土壤有效态汞与作物汞含量相关性见图4,相关系数r2=为0.546,pearson相关性显著正相关(p<0.01)。采用硫氢基乙酸+磷酸氢二钠提取相关性见图5,土壤-作物系统汞含量相关性不显著。
本发明中所用原料、设备,若无特别说明,均为本领域的常用原料、设备;本发明中所用方法,若无特别说明,均为本领域的常规方法。
以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制,凡是根据本发明技术实质对以上实施例所作的任何简单修改、变更以及等效变换,均仍属于本发明技术方案的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!