一种血液细胞检测方法及分析系统与流程
1.本技术涉及血液细胞检测技术领域,特别是涉及一种血液细胞检测方法及分析系统。
背景技术:
2.人血液中含有红细胞、白细胞、血小板等各种细胞。其中血小板是直径为2-3微米的无核细胞,正常人的血液中每微升含有15万-35万个血小板。
3.众所周知,血小板的常用测定方法之一是电阻抗法。该方法是测定待测血液样本从两个电极间通过时的电阻脉冲,将其绘制成直方图进行分析。原则上,电阻脉冲的强度与待测血液样本中细胞的体积相关;因此可以通过分析电阻脉冲的直方图判断待测血液样本中是否含有血小板,从而实现血小板检测。然而,电阻抗法在测试某些特殊样本时会影响血小板的测试准确性和精确度;例如,含大血小板和小红细胞的样本,这种样本中大血小板的体积与小红细胞体积类似,因此难以通过电阻抗法进行区分。
4.针对电阻抗法无法进行区分的情况,有研究提出用对血小板的表面抗原有特异性的标记抗体对血小板进行计数的方法,例如美国临床病理学杂志(2001):115,p460-464。但是,这种方法在测试过程中需要使用抗原抗体反应,一般需要花很长时间才能得到结果;因此,该方法不能满足临床上需要紧急检测血小板进行判断的使用需求,例如判断是否需要输血等需紧急情况。
5.流式细胞技术可以迅速测定血液中的细胞,已广泛用于血液细胞的检测,比如美国专利6114173号、4882284号及5891731号都公开了在非溶血条件下,利用染料对血细胞进行染色区分,然后采用流式细胞技术进行血小板或其它血细胞检测。但是,在血液中有时会出现破碎红细胞和脂质等,其大小与血小板类似,因此会在测定时作为杂质影响血小板测定,特别是在测定需要输血的血小板低的样本,这些杂质的影响会更大。
6.针对以上问题,sysmex公司的专利cn 101173921公开了一种能够有效的从血细胞和脂质颗粒等血液中的杂质中区分出血小板加以测定的技术,其中记述了一类对血小板具有较好特异性的染料,能够在荧光方向有效的区分血小板和血细胞中的杂质。但这种方法需要在单独的测试通道中进行,并且其对红细胞碎片和血小板不能够有效的区分,在临床上检验一些红细胞易碎样本就会产生较大的干扰。因此在检验血小板时,有效的区分血小板和红细胞碎片及其它可能的杂质就显得尤为重要。
7.综上所述,开发一种便捷、快速、准确的血小板检测技术,仍然是临床检验的迫切需要。
技术实现要素:
8.本技术的目的是提供一种新的血液细胞检测方法,以及相应的血液细胞分析系统。
9.为了实现上述目的,本技术采用了以下技术方案:
10.本技术的一方面公开了一种血液细胞检测方法,包括将待测血液样本、第一试剂和第二试剂混合,进行溶血和染色处理,其中,第一试剂为溶血试剂,用于裂解待测血液样本中的红细胞,第二试剂为糖蛋白特异性染料,用于对待测血液样本中细胞粒子进行染色;使经过溶血和染色处理的待测血液样本中的细胞粒子,逐个通过光学检测系统的检测区,获得待测血液样本的光学信息,光学信息包括荧光强度信息;根据荧光强度信息从待测血液样本的细胞粒子中区分出血小板;根据血小板的光学信息获取待测血液样本中血小板的检测结果。
11.需要说明的是,本技术的血液细胞检测方法,直接采用糖蛋白特异性染料对溶血后的血液样本进行染色和检测,通过一种光学信号,即荧光强度信息,就能够区分红细胞碎片、白细胞与血小板,实现血小板的全区分和计数。
12.本技术的一种实现方式中,根据血小板的光学信息获取待测血液样本中血小板的检测结果,包括:根据血小板的光学信息获取待测血液样本中血小板的计数。
13.本技术的一种实现方式中,根据血小板的光学信息获取待测血液样本中血小板的检测结果,包括:根据血小板的荧光强度信息获取待测血液样本中血小板的计数。
14.本技术的一种实现方式中,本技术的血液细胞检测方法还包括获取待测血液样本的散射光强度信息,根据血小板的光学信息获取待测血液样本中血小板的检测结果,包括:根据血小板的荧光强度信息和散射光强度信息获取待测血液样本中血小板的计数。
15.本技术的一种实现方式中,本技术的血液细胞检测方法还包括根据荧光强度信息从待测血液样本的细胞粒子中区分出白细胞;根据白细胞的光学信息获取待测血液样本中白细胞的检测结果。
16.本技术的一种实现方式中,根据白细胞的光学信息获取待测血液样本中白细胞的检测结果,包括:根据白细胞的光学信息获取待测血液样本中白细胞的计数。
17.本技术的一种实现方式中,根据白细胞的光学信息获取待测血液样本中白细胞的检测结果,包括:根据白细胞的荧光强度信息获取待测血液样本中白细胞的计数。
18.本技术的一种实现方式中,本技术的血液细胞检测方法还包括获取待测血液样本的散射光强度信息,根据白细胞的光学信息获取待测血液样本中白细胞的检测结果,包括:根据白细胞的荧光强度信息和散射光强度信息获取待测血液样本中白细胞的计数。
19.本技术的一种实现方式中,本技术的血液细胞检测方法还包括获取待测血液样本的散射光强度信息,根据散射光强度信息和荧光强度信息对白细胞进行分类,并对分类的白细胞分别进行计数。
20.需要说明的是,本技术的血液细胞检测方法,采用糖蛋白特异性染料,不仅能够实现血小板的区分和计数,还能够根据荧光强度信息区分白细胞并对其进行计数。因此,本技术的血液细胞检测方法能够在一个通道内通过一次测试、且只采用一种光学信号同时区分并检测血小板和白细胞。
21.本技术中,散射光强度信息包括前向散射光强度信息和侧向散射光强度信息中的至少一种或两种。
22.需要说明的是,虽然本技术的血液细胞检测方法,仅采用一种荧光强度信息就能够实现白细胞的区分和计数;但是,如果进一步的需要对白细胞进行分类,并分别对各类白细胞进行计算,则需要结合散射光强度信息和荧光强度信息。可以理解,在结合散射光强度
信息和荧光强度信息的情况下,同样也可以实现血小板的区分和计数。
23.本技术的一种实现方式中,待测血液样本的体积与第一试剂和第二试剂的总体积之比为1:40至1:60。
24.本技术的一种实现方式中,溶血染色处理的反应时间为15-100秒,优选为40-80s。
25.本技术的一种实现方式中,溶血染色处理的反应温度为40℃-60℃。
26.需要说明的是,原则上,较高的反应温度和较长的反应时间,可以使细胞进行更深程度的裂解;本技术的方法主要是为了裂解红细胞,并是血小板和白细胞保持细胞形态;因此,优选在40℃-60℃的反应温度反应15-100秒。
27.本技术的一种实现方式中,糖蛋白特异性染料包括麦胚芽素荧光标记染料。
28.任选地,麦胚芽素荧光标记染料选自fitc-wheat germ agglutinin、rb-wheat germ agglutinin、cy3-wheat germ agglutinin和cy5-wheat germ agglutinin中的至少一种。
29.需要说明的是,本技术采用糖蛋白特异性染料对血细胞进行染色,能够通过荧光强度将血小板与其他粒子(红细胞碎片和白细胞)区分开,从而实现血小板的准确检测;可以理解,麦胚芽素荧光标记染料只是比较常见的一类糖蛋白特异性染料,理论上来说,其它类似功能的糖蛋白特异性染料同样可以用于本技术。同样的,fitc-wheat germ agglutinin、rb-wheat germ agglutinin、cy3-wheat germ agglutinin和cy5-wheat germ agglutinin也是四种常规的麦胚芽素荧光标记染料,理论上来说,其它类似功能的麦胚芽素荧光标记染料也可以用于本技术。
30.本技术的一种实现方式中,第一试剂包括阳离子表面活性剂、非离子表面活性剂、阴离子表面活性剂、两性离子表面活性剂中的至少一种。
31.本技术的一种实现方式中,阳离子表面活性剂可选自十二烷基三甲基氯化铵和氯化铵等中的一种或多种。两性离子表面活性剂例如可以是氨基酸型两性离子表面活性剂和/或甜菜碱型两性离子表面活性剂。
32.本技术的一种实现方式中,第一试剂包括非离子表面活性剂,非离子表面活性剂任选地为烷基糖苷、三萜皂苷和甾族皂苷中的至少一种。
33.本技术的一种实现方式中,烷基糖苷为通式i的糖苷类化合物;
34.r-(ch2)
n-ch3ꢀꢀꢀ(i)35.其中,r为单糖、去氧单糖和多糖中的至少一种,n为5~17的整数。
36.本技术的一种实现方式中,第一试剂还包括通式ii所示结构中的至少一种非离子表面活性剂。
37.r
1-r
2-(ch2ch2o)
m-h
ꢀꢀꢀꢀ
(ii)
38.其中,r1为c8-c23的烷基,r2为-o-、或-coo-,m为10~50的整数。
39.本技术的一种实现方式中,非离子表面活性剂(如脂肪酸甘油酯类、多元醇类、聚氧乙烯型)具体可选自由脂肪酸单甘油酯、脂肪酸二甘油酯、蔗糖脂肪酸酯、山梨醇脂肪酸酯、聚山梨酯、聚氧乙烯脂肪酸脂、聚氧乙烯(40)硬脂酸脂、聚氧乙烯(20)油酸脂、聚氧乙烯(23)十二烷基醇醚、聚氧乙烯(20)十六烷基醇醚、聚氧乙烯脂肪醇醚、聚氧乙烯酚醚、聚氧乙烯聚氧丙烯共聚物、壬基酚聚氧乙烯醚、普朗尼克68、司盘类(spans)、吐温类(tweens)、
triton类(如triton x-100)、卖泽类(myri)、苄泽类(brij)和皂素组成的组中的一种或多种。
40.任选地,第一试剂还包括至少一种有机酸和/或至少一种有机酸盐,有机酸为具有至少一个羧基或磺酸基的有机酸,有机酸盐为具有至少一个羧基或磺酸基的有机酸的碱金属的盐。
41.需要说明的是,本技术采用糖蛋白特异性染料,在溶血情况下进行血小板检测;至于具体的溶血剂可以参考现有使用的溶血剂,例如,阳离子表面活性剂、非离子表面活性剂、阴离子表面活性剂、两性离子表面活性剂等。
42.本技术的另一方面公开了一种血液细胞分析系统,包括采样部、试剂供应部、反应部、光学检测系统、数据处理模块;采样部,包括用于获取待测血液样本,并将待测血液样本输送到反应部;试剂供应部包括用于存储第一试剂和第二试剂,并将第一试剂和第二试剂输送到反应部;第一试剂为溶血试剂,第二试剂为糖蛋白特异性染料;反应部,包括混合室,用于混合采样部输送的待测血液样本和试剂供应部输送的第一试剂和第二试剂,并对待测血液样本进行溶血和染色处理;光学检测系统,包括流动室和荧光检测器,流动室用于接收溶血和染色处理的待测血液样本,并使待测血液样本中的粒子逐个通过流动室到达检测区,荧光检测器用于采集通过检测区的经溶血和染色处理后的血液样本中粒子的荧光强度信息;数据处理模块包括处理器和编程有计算机应用程序的非暂时性计算机可读存储介质,其中,处理器与荧光检测器可操作地连接,当计算机应用程序被处理器执行时,使处理器根据荧光强度信息区分血小板和/或对血小板进行计数。
43.本技术的一种实现方式中,当计算机应用程序被处理器执行时,进一步使得处理器根据荧光强度信息区分白细胞和/或对白细胞进行计数。
44.本技术的一种实现方式中,光学检测系统还包括散射光检测器,散射光检测器用于采集通过检测区的经溶血和染色处理的血液样本中粒子的散射光强度信息,处理器与散射光检测器可操作地连接,当计算机应用程序被处理器执行时,进一步使得处理器根据散射光强度信息和荧光强度信息对白细胞进行分类,并对分类的白细胞分别进行计数。
45.由于采用以上技术方案,本技术的有益效果在于:
46.本技术的血液细胞检测方法,在溶血情况下进行血小板检测,能够根据荧光强度信息有效区分溶血后的红细胞碎片与血小板,从而提高了血小板检测的准确性。并且,在溶血情况下,在同一通道的一次测试中,还能够同时实现白细胞的区分和检测,从而简化了血液检测、降低了检测成本。
附图说明
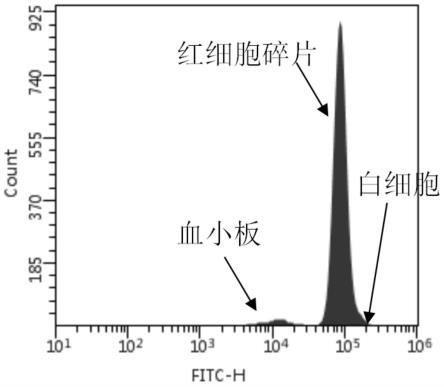
47.图1是本技术实施例一中待测血液样本的粒子荧光信号分布图;
48.图2是本技术实施例一中待测血液样本的白细胞分类的散点图;
49.图3是本技术实施例二中待测血液样本的粒子荧光信号分布图;
50.图4是本技术实施例二中待测血液样本的白细胞分类的散点图;
51.图5是本技术实施例三中待测血液样本的粒子荧光信号分布图;
52.图6是本技术实施例三中待测血液样本的白细胞分类的散点图;
53.图7是本技术实施例四中待测血液样本的粒子荧光信号分布图;
54.图8是本技术实施例四中待测血液样本的白细胞分类的散点图;
55.图9是本技术实施例五中血小板浓度检测结果相关性分析结果图。
具体实施方式
56.本领域技术人员熟知,目前常规使用的血小板检测方法是电阻抗法,虽然也有研究显示可以采用血小板特异性的染料进行血小板检测;但是,这些检测都是在非溶血的情况下进行,并且,对于红细胞易碎样本,难以有效区分红细胞碎片和血小板;从而影响血小板检测的准确性。
57.本技术发明人采用糖蛋白特异性染料可以在溶血情况下仅通过荧光强度信息,这一个光学信号有效的区分血小板和其他粒子,实现血小板的区分和计数;在同一次测试中还能同时实现对白细胞的区分和计数。进一步的,结合散射光强度信息,根据两种光学信号可以实现白细胞的分类,并对分类后的各种白细胞进行计数。
58.根据以上研究和发现,本技术研发了一种新的血液细胞检测方法,包括将待测血液样本、第一试剂和第二试剂混合,进行溶血和染色处理,其中,第一试剂为溶血试剂,用于裂解待测血液样本中的红细胞,第二试剂为糖蛋白特异性染料,用于对待测血液样本中细胞粒子进行染色;使经过溶血和染色处理的待测血液样本中的细胞粒子,逐个通过光学检测系统的检测区,获得待测血液样本的光学信息,光学信息包括荧光强度信息;根据荧光强度信息从待测血液样本的细胞粒子中区分出血小板;根据血小板的光学信息获取待测血液样本中血小板的检测结果。
59.在本技术的一种实现方式中,本技术的方法还能够根据荧光强度信息区分白细胞和/或对白细胞进行计数。本技术的方法能够在一个溶血通道在一次测试中,使用一种染料检测一种光学信号就完成血小板和白细胞的分类和计数,节约了检测时间、简化了操作流程、降低了仪器的复杂程度。进一步的,结合荧光强度信息和散射光强度信息,可以进行白细胞分类,例如白细胞三分类、四分类等,并对各类白细胞进行计数。
60.本技术的方法中,待测血液样本是指采集自人的血液样本,优选全血样本。实际上,本技术的方法不仅限于人血液样本检测,也可以是其它哺乳纲动物,尤其是灵长目动物的血液样本检测。
61.本技术中,糖蛋白特异性染料是指能够对细胞膜上的糖蛋白进行特异性染色的荧光染料,这类染料能够对血小板、红细胞和白细胞的细胞膜进行染色;本技术创造性的发现,这类染料在对血小板和红细胞碎片进行染色时,两者的荧光强度存在区分,从而实现血小板的准确准确检测。同样的,染色后白细胞的荧光强度也与血小板和红细胞碎片有所不同,因此,也能够实现白细胞的区分和计数。其中,糖蛋白特异性染料,例如可为麦胚芽素荧光标记染料,可选自fitc-wheat germ agglutinin、rb-wheat germ agglutinin、cy3-wheat germ agglutinin和cy5-wheat germ agglutinin中的一种或多种的组合,可以商业化购买获得的,都可以用于本技术,实现血小板和白细胞的区分和计数。
62.本技术的方法中,第一试剂和第二试剂可以存在于同一包装中,也可以分别单独包装;但是,在使用时,为了使用方便本技术是将第一试剂和第二试剂混合,制成溶血染色反应液,然后再一起与待测血液样本混合,进行溶血和染色处理。第一试剂和第二试剂单独包装时,第一试剂可以配制为水溶液形式,第二试剂可配制为非水溶液形式。本技术中,作
为第二试剂的糖蛋白特异性染料,在溶血染色反应液中的浓度为50-500mg/l,例如100mg/l、200mg/l等。
63.可以理解,虽然本技术的实现方式中具体采用的是四种商业化的麦胚芽素荧光标记染料;但是,理论上,只要是以麦胚芽素为母体或者类似的糖蛋白特异性结合的分子为母体进行荧光标记,又或者与母体近似性质、能实现与母体相似效果的其它分子的荧光标记物,都能够用于本技术,属于本技术发明构思的保护范围。
64.也就是说,本技术染料的变形结构包括商业化的变形结构或非商业化的变形结构,根据染料的名称、结构等,本领域技术人员能够从现有技术中确认出已知染料为母体的变形结构或衍生结构;同时,能够根据母体结构和/或已知的变形结构来得到非商业化的变形结构或衍生结构,并可以合理预期这些变形结构都能够实现与其母体类似的染色效果。这些变形结构都属于本技术保护范围。
65.本技术第一试剂采用的溶血剂是指用来破坏红细胞膜,便于进行血小板和白细胞区分的试剂。对于溶血剂,本技术没有特别限制,原则上,任何本领域已知的溶血剂,只要能够达到常规的溶血效果都可以用于本技术。
66.本技术的一种实现方式中,第一试剂包括烷基糖苷、三萜皂苷和甾族皂苷中的至少一种;还可以包括通式ii的非离子型表面活性剂、有机酸和/或有机酸盐等。
67.其中,烷基糖苷作为溶血剂时,在溶血染色反应液中的浓度通常为0.025-10g/l;通式ii的非离子表面活性剂的浓度没有特别限定,可为0.03-1.5g/l;有机酸或有机酸盐的浓度通常为0.05-2g/l。本技术的有机酸及其盐具体可以为甲酸、乙酸、苯甲酸、柠檬酸、苹果酸、苯二甲酸、苯磺酸、α-萘磺酸、牛磺酸等及它们的碱金属盐,例如钠盐、钾盐等。
68.此外,本技术的第一试剂还可以根据需求添加各种常规的添加剂,例如缓冲剂、金属螯合剂、渗透压调节剂、防腐剂等。这些试剂均为本领域常用的试剂,只要不妨碍本技术的溶血剂和糖蛋白特异性染料发挥各自的作用即可。缓冲剂,例如可以采用磷酸及其盐、柠檬酸及其盐、tris等。金属螯合剂,用作抗凝剂,例如edta。渗透压调节剂,通常为无机盐,例如氯化钠、硫酸钠、硫酸钾、硼酸钠等。防腐剂,例如异噻唑啉酮、叠氮钠、咪唑烷基脲。
69.为了实现本技术的血液细胞检测方法,本技术研发并提供了一种血液细胞分析系统,包括采样部、试剂供应部、反应部、光学检测系统、数据处理模块;采样部,包括用于获取待测血液样本,并将待测血液样本输送到反应部;试剂供应部,包括用于存储第一试剂和第二试剂,并将第一试剂和第二试剂输送到反应部;第一试剂为溶血试剂,第二试剂为糖蛋白特异性染料;反应部,包括混合室,用于混合采样部输送的待测血液样本和试剂供应部输送的第一试剂和第二试剂,并对待测血液样本进行溶血和染色处理;光学检测系统,包括流动室和荧光检测器,流动室用于接收溶血和染色处理后的待测血液样本,并使待测血液样本中的粒子逐个通过流动室到达检测区,荧光检测器用于对待测血液样本中的粒子进行检测,获得待测血液样本中各种粒子的荧光强度信息;数据处理模块,包括处理器和编程有计算机应用程序的非暂时性计算机可读存储介质,其中,处理器与荧光检测器可操作地连接,当计算机应用程序被处理器执行时,使处理器根据荧光强度信息区分血小板和/或对血小板进行计数。
70.本技术的一种实现方式中,当计算机应用程序被处理器执行时,进一步使得处理器根据荧光强度信息区分白细胞和/或对白细胞进行计数。
71.本技术的一种改进方案中,光学检测系统还包括散射光检测器,散射光检测器用于采集通过检测区的经溶血和染色处理后的血液样本中粒子的散射光强度信息,处理器与散射光检测器可操作地连接,当计算机应用程序被处理器执行时,使得处理器根据散射光强度信息和荧光强度信息区分血小板和/或对血小板进行计数。可以理解,本技术仅采用荧光强度信息即可区分血小板和/或对血小板进行计数;采用散射光强度信息和荧光强度信息,当然也能够进行区分血小板和/或对血小板进行计数。其中,散射光强度信息包括前向散射光强度信息和/或侧向散射光强度信息。
72.本技术的一种实现方式中,当计算机应用程序被处理器执行时,还可以使得处理器根据散射光强度信息和荧光强度信息区分白细胞和/或对白细胞进行计数。同样的,本技术仅采用荧光强度信息即可区分白细胞和/或对白细胞进行计数;采用散射光强度信息和荧光强度信息,当然也可以进行区分白细胞和/或对白细胞进行计数。
73.进一步的,当计算机应用程序被处理器执行时,还可以使得处理器根据散射光强度信息和荧光强度信息对白细胞进行分类,并对分类的白细胞分别进行计数。可以理解,本技术仅采用荧光强度信息即可区分血小板和/或对血小板进行计数,和/或,区分白细胞和/或对白细胞进行计数;再结合增加散射光强度信息,可以进一步的实现白细胞的分类,例如三分类、四分类,并对分类后的各种白细胞分别进行计数。其中,散射光强度信息包括前向散射光强度信息和/或侧向散射光强度信息,本技术的一种实现方式中采集的是侧向散射光强度信息,具体为90度的侧向散射光强度信息。
74.本技术的一种方案中,光学检测系统还包括光学子系统;光学子系统包括激光器、前光组件和后光组件,前光组件包括光隔离器;激光器配置为发射激光光束;前光组件配置为对激光光束进行前光处理,使经过前光处理的激光光束在第一方向上汇聚于流动室,用于照射溶血染色处理后的待测血液样本中的粒子,以产生荧光信息;后光组件沿激光光束的传播方向设置于流动室之后,配置为对待测血液样本的粒子产生的荧光信息进行后光处理,使得经过后光处理的荧光信息进入检测器进行光强度检测;光隔离器配置为将反射光与激光器隔离,反射光为激光光束经过流动室所产生。
75.其中,本技术的一种实现方式中,激光器为半导体激光器,实际实施时,可以为p线偏振激光器。在实际应用中,激光器发射激光光束的波长决定了光路主要参数的设计,例如透镜的选型、信号收集角度的选择等。且激光光束的波长也和检测中用到的试剂如荧光染料有关,例如激光器可发出蓝光或红光,发出的红色激光光束的波长可为630-640nm,本技术的一种实现方式中激发波长为633nm。
76.本技术的一种实现方式中,光隔离器由相互连接的分光棱镜和偏振态转换组件构成;分光棱镜配置为反射入射的激光光束的s偏振分量,透射入射的激光光束的p偏转分量;偏振态转换组件配置为改变经分光棱镜透射的p偏振分量的偏振态,使p偏振分量从线偏振光变成圆偏振光,并改变圆偏振光反射后的偏振态为s偏振光而被分光棱镜反射。
77.以偏振态转换组件为1/4玻片为例,当激光光束(tm模)垂直射入分光棱镜时,激光光束中的p偏振光(即平行纸面的偏振分量)能够通过分光棱镜,而激光光束中的s偏振光(即垂直纸面的偏振分量)被分光棱镜的45
°
斜面反射出去。继而,p偏振光透过1/4玻片后的偏振态发生改变,由线偏振光变成圆偏振光。圆偏振光的反射光(被后级光路反射形成的反射光)再次经过1/4玻片,然后偏振态发生改变,由圆偏振光转换成s偏振光,而s偏振光会被
分光棱镜的45
°
斜面反射出去,不会回馈到激光器,从而实现对光路反射光的隔离。
78.在实际应用中,当激光光束垂直入射光隔离器时,分光棱镜的第一入射面的反射率不大于0.5%,或者不大于0.1%,或者不大于0.05%。第一入射面的反射率可以由第一入射面的镀膜设计和工艺实现。
79.本技术的一种实现方式中,光隔离器还可以由相互连接的检偏器和偏振态转换组件组成;检偏器配置为仅允许激光光束的p偏振分量通过;偏振态转换组件配置为改变经检偏器的p偏振分量的偏振态,使p偏振分量从线偏振光变成圆偏振光,并改变圆偏振光反射后的偏振态为s偏振光而被检偏器隔离。
80.以偏振态转换组件为磁光晶体为例进行说明,当激光光束入射检偏器时,仅激光光束中的p偏振光能够通过检偏器,经过检偏器的p偏振光进入磁光晶体,经过磁光晶体的p偏振光的偏振态发生改变,其偏振方向旋转45
°
,形成与原p偏振光的偏振态垂直的s偏振光而被检偏器隔离,不会回馈到激光器。
81.在实际应用中,偏振态转换组件还可以为旋光晶体,在实际应用中,分光棱镜、检偏器可以和1/4玻片、磁光晶体、旋光晶体中任一个进行组合实现光路中反射光的隔离。
82.本技术的一种实现方式中,隔离器由相互连接的带通滤光片和倍频晶体组成;带通滤光片配置为使波长为λ的激光光束通过;倍频晶体配置为对带通滤光片的激光光束进行倍频,并对倍频后的激光光束的反射光再次进行倍频,而被带通滤光片滤除。
83.在本技术的一种实现方式中,光隔离器的光隔离度不小于30db。
84.本技术的一种实现方式中,前光组件还包括准直透镜,准直透镜沿激光光束的传播方向设置于激光器与光隔离器之间,配置为对激光光束进行准直处理,使激光光束成为平行光束。
85.本技术的一种实现方式中,后光组件还包括挡直光阑;前光组件还配置为对激光光束进行前光处理,使得经前光处理的激光光束在第二方向上汇聚于挡直光阑处。
86.本技术的一种实现方式中,前光组件还包括第一光汇聚组件和第二光汇聚组件;第一光汇聚组件配置为对激光光束进行第一聚焦,使激光光束在第一方向上汇聚于流动室用于照射溶血染色处理后的待测血液样本中的粒子,以产生荧光信息。第二光汇聚组件配置为对激光光束进行第二聚焦,使激光光束在第二方向上汇聚于后光组件的挡直光阑处。
87.在实际应用中,第二方向为横向,即与血细胞被检测样本的流动方向垂直的方向。第一方向为纵向,即与血细胞被检测样本的流动方向相同的方向。第一光汇聚组件和第二光汇聚组件可以为光学参数(如焦距等)不同的柱面镜,如第一光汇聚组件由第一柱面镜实现,第二光汇聚组件由第二柱面镜实现。
88.以第二光汇聚组件由第二柱面镜为例进行说明,激光光束经过第二柱面镜,第二柱面镜在纵向上不对激光光束进行处理,经第二柱面镜的激光光束在横向上被压缩,激光光束在横向(垂直于血细胞被样本的流动方向)上聚集,在本技术中聚焦于挡直光阑处。
89.照射到流动室中血细胞样本处的激光光束发生散射,产生的散射光被挡直光阑收集,在实际应用时,挡直光阑对低角度散射信号的收集角度进行约束;同时,挡直光阑在第二方向上汇聚于挡直光阑处的激光光束进行阻挡。在本技术的一种实现方式中,挡直光阑的光收集角度为1-10
°
。
90.本技术的一种实现方式中,后光组件还包括第三汇聚组件和小孔光阑;第三汇聚
组件配置为对荧光信息进行第三聚焦,使荧光信息汇聚于小孔光阑处,并经小孔光阑的小孔进入检测器,以进行荧光强度检测。
91.在本技术的一种实现方式中,第三汇聚组件可以为以下之一:
92.至少一个平凸透镜与至少一个双凸透镜构成的透镜组;
93.至少两个平凸透镜构成的透镜组;
94.至少两个双凸透镜构成的透镜组;
95.至少两个球面镜构成的透镜组;
96.非球面镜。
97.本技术的血液细胞分析系统,在使用时,待测血液样本中的粒子,例如血小板,从流动室穿过,被检测,例如荧光强度检测或散射光强度检测,进行计数;在本技术中,血小板粒子的流动方向为垂直于纸面方向,激光器发射的激光光束的传播方向为平行于纸面方向。激光器发出的激光光束经准直透镜的准直处理,形成平行激光光束,然后透过光隔离器,经第一柱面镜在纵向(垂直于纸面方向)上聚集于流动室中心处作为检测光斑,激光光束的传播方向与流动室的光入射面之间的夹角呈直角,聚焦于流动室的激光光束照射到流动室中的血小板粒子产生光散射,经第一柱面镜在纵向的压缩,激光光束在纵向上的尺寸与血小板粒子的尺寸相匹配,经第一柱面镜的激光光束,进入第二柱面镜,在横向(平行于纸面方向)上被压缩,在横向上汇聚于挡直光阑处。
98.其中,照射到流动室中的血小板粒子产生的散射光经挡直光阑的收集,进而被平凸透镜、双凸透镜组成的透镜组聚集,汇聚于小孔光阑处,经小孔光阑的小孔进入散射光检测器。侧向散射光检测器及荧光检测器沿与激光光束的传播方向垂直的方向设置;测序散射光检测器配制为对与激光光束的传播垂直的散射光进行光强检测;荧光检测器沿与激光光束的传播方向垂直的方向设置,配置为对荧光强度进行检测。
99.在本技术的一种实现方式中,激光光束的传播方向与流动室的光入射面之间的夹角可以为非直角,即对流动室的位置在x-y平面即纸面进行一定角度的偏转,使得流动室倾斜放置。此时,激光光束的传播方向与流动室的光入射面之间的夹角θ为锐角;在本技术的一种实现方式中,θ角的范围为80
°‑
90
°
,如此,当激光光束照射到流动室内部时,光束在流动室内部表面发生反射后,反射光偏离光轴(激光光束传播方向),从而减少进入激光器的反射光的光通量。本领域技术人员可以知晓,只要能使流动室光入射面的反射光不进入前光组件的θ角都可以适用于本技术。深入研究发现,虽然流动室倾斜放置可能会使荧光和散射光的收集角度发生变化;但是,可以通过调整后光组件在光路中的位置弥补;经过大量的研究实验证明对荧光和侧向散射光的检测可以接受,不影响最终的检测结果。
100.本技术的血液细胞分析系统,可以直接采用荧光强度进行血小板和白细胞的区分和计数;进一步的,结合散射荧光强度可以实现白细胞分类,以及各类白细胞的计数。仅仅从血小板的检测来说,本技术的血液细胞分析系统只需要采用一种光学信号检测器就能够实现血小板的准确检测。并且,在改进方案中,血液细胞分析系统采用的光隔离器能够很好的隔离激光光束在光路中传播时产生的反射光,使得激光器能够稳定输出激光光束,避免了反射光进入激光器产生的功率尖峰,以及由此产生的小脉冲,从而避免了该小脉冲和血小板粒子形成的小脉冲的相互混淆和干扰,极大的提高了检测精度。
101.下面通过具体实施例结合附图对本技术作进一步详细说明。以下实施例仅对本申
请进行进一步说明,不应理解为对本技术的限制。
102.本技术中,除非另有特别说明,所有使用的技术和科学术语都应理解为本领域技术人员一般理解的含义;若存在不一致,以本技术说明为准。除非另有特别说明,所有试剂和设备都可以通过常规途径购买获得。
103.实施例一
104.本例的试剂包括第一试剂和第二试剂,其中,第一试剂为溶血试剂,包括溶血剂、通式ii所示结构的非离子型表面活性剂和有机酸盐,采用tris缓冲液;第二试剂为糖蛋白特异性染料,本例采用的是麦胚芽素荧光标记染料,具体为fitc-wheat germ agglutinin。
105.本例的溶血剂可以是常规的具有溶血功能的试剂,例如常规的阳离子表面活性剂、非离子表面活性剂、阴离子表面活性剂、两性离子表面活性剂。其中,作为溶血剂的非离子表面活性剂是指除通式ii所示结构的非离子型表面活性剂以外的其它非离子表面活性剂。本例具体采用的溶血剂是三萜皂苷。
106.本例采用的通式ii所示结构的非离子型表面活性剂,其通式结构如下:
107.r
1-r
2-(ch2ch2o)
m-h
ꢀꢀꢀ
(ii)
108.其中,r1为c8-c23的烷基,r2为-o-、或-coo-,m为10~50的整数。
109.本例具体采用的通式ii所示结构的非离子型表面活性剂为聚氧乙烯(23)十六烷基醚。本例具体采用的有机酸盐为柠檬酸钠。
110.本例将第一试剂和第二试剂混合制成溶血染色反应液,直接用于待测血液样本处理。
111.本例的溶血染色反应液中,各组分浓度如下:
[0112][0113]
将新鲜血20微升加入到上述溶血染色反应液1ml中,在45℃条件下孵育60秒后用流式细胞仪(迈瑞bricyte e6)收集数据(激发波长633nm)设置增益为500,采集90度侧向荧光信号收集荧光染色信息,根据荧光强度信息区分血小板和白细胞。进一步的,还可同时采集90度的侧向散射光强度信息,结合荧光强度信息,获得散点图,从散点图中划分血小板区域和白细胞区域,并对白细胞进行分类和各类白细胞的计数。
[0114]
作为对比,本例采用常规的人工镜检计数统计血小板浓度。
[0115]
结果如图1和图2所示,其中,图1为粒子荧光信号分布图,图2为白细胞分类的散点图。从图表1可以看出,红细胞碎片、血小板(plt)及白细胞的区分度较大,结合流式细胞仪的进样量,可以计算出该样本的plt的浓度分别为166
×
109/l;而利用参考方法,通过人工镜检计数得出其plt的浓度为171
×
109/l,与流式细胞仪中的计算数值具有较好的一致性。同时结合散射光信号,可以实现对白细胞(wbc)的分类与计数,如图2所示,结合流式细胞仪
的进样量,可以计算出该样本的wbc的浓度分别为4.3
×
109/l,淋巴细胞、单核细胞、中性粒细胞及嗜酸性细胞的比例分别为30.1%、6.5%、46.5%、16.9%;而利用参考方法,通过人工镜检计数得出其wbc的浓度为4.1
×
109/l,淋巴细胞、单核细胞、中性粒细胞及嗜酸性细胞的比例分别为29%、7%、46.2%、17.8%。
[0116]
由此可见,本例的试剂能够在溶血情况下可以仅仅通过荧光强度信息有效的区分红细胞碎片、血小板和白细胞,实现血小板和白细胞的区分和计数。此外,结合散射光强度信息还能够实现白细胞的分类和分类后的各种白细胞的计数。
[0117]
实施例二
[0118]
本例的试剂包括第一试剂和第二试剂,其中,第一试剂为溶血试剂,包括溶血剂、通式ii所示结构的非离子型表面活性剂和有机酸盐,采用tris缓冲液;第二试剂为糖蛋白特异性染料,本例采用的是麦胚芽素荧光标记染料,具体为rb-wheat germ agglutinin。
[0119]
本例的溶血剂可以是常规的具有溶血功能的试剂,例如常规的阳离子表面活性剂、非离子表面活性剂、阴离子表面活性剂、两性离子表面活性剂。其中,作为溶血剂的非离子表面活性剂是指除通式ii所示结构的非离子型表面活性剂以外的其它非离子表面活性剂。本例具体采用的溶血剂是烷基糖苷(apg0810)。
[0120]
本例采用的通式ii所示结构的非离子型表面活性剂,其通式结构如下:
[0121]r1-r
2-(ch2ch2o)
m-h
ꢀꢀꢀꢀ
(ii)
[0122]
其中,r1为c8-c23的烷基,r2为-o-、或-coo-,m为10~50的整数。
[0123]
本例具体采用的通式ii所示结构的非离子型表面活性剂为聚氧乙烯(23)十六烷基醚。本例具体采用的有机酸盐为柠檬酸钠。
[0124]
本例将第一试剂和第二试剂混合制成溶血染色反应液,直接用于待测血液样本处理。
[0125]
本例的溶血染色反应液中,各组分浓度如下:
[0126][0127]
将新鲜血20微升加入到上述配制的溶血染色反应液1ml中,在45℃条件下孵育60秒后用流式细胞仪(迈瑞bricyte e6)收集数据(激发波长633nm)设置增益为500,采集90度侧向荧光信号收集荧光染色信息,根据荧光强度信息区分血小板和白细胞。进一步的,还可同时采集90度的侧向散射光强度信息,结合荧光强度信息,获得散点图,从散点图中划分血小板区域和白细胞区域,并对白细胞进行分类和各类白细胞的计数。
[0128]
作为对比,本例采用常规的人工镜检计数统计血小板浓度。
[0129]
结果如图3和图4所示,其中,图3为粒子荧光信号分布图,图4为白细胞分类的散点图。从图表3可以看出,红细胞碎片、血小板(plt)及白细胞的区分度较大,结合流式细胞仪
的进样量,可以计算出该样本的plt的浓度分别为231
×
109/l;而利用参考方法,通过人工镜检计数得出其plt的浓度为228
×
109/l,与流式细胞仪中的计算数值具有较好的一致性。同时结合散射光信号,可以实现对白细胞(wbc)的分类与计数,如图4所示,结合流式细胞仪的进样量,可以计算出该样本的wbc的浓度分别为7.1
×
109/l,淋巴细胞、单核细胞、中性粒细胞及嗜酸性细胞的比例分别为35%、6%、46%、13%;而利用参考方法,通过人工镜检计数得出其wbc的浓度为7
×
109/l,淋巴细胞、单核细胞、中性粒细胞及嗜酸性细胞的比例分别为36%、7%、46%、11%。
[0130]
由此可见,本例的试剂能够在溶血情况下可以仅仅通过荧光强度信息有效的区分红细胞碎片、血小板和白细胞,实现血小板和白细胞的区分和计数;结合散射光强度信息还能够实现白细胞的分类和分类后的各种白细胞的计数。
[0131]
实施例三
[0132]
本例的试剂包括第一试剂和第二试剂,其中,第一试剂为溶血试剂,包括溶血剂、通式ii所示结构的非离子型表面活性剂和有机酸盐,采用tris缓冲液;第二试剂为糖蛋白特异性染料,本例采用的是麦胚芽素荧光标记染料,具体为cy3-wheat germ agglutinin。
[0133]
本例的溶血剂可以是常规的具有溶血功能的试剂,例如常规的阳离子表面活性剂、非离子表面活性剂、阴离子表面活性剂、两性离子表面活性剂。其中,作为溶血剂的非离子表面活性剂是指除通式ii所示结构的非离子型表面活性剂以外的其它非离子表面活性剂。本例具体采用的溶血剂是十二烷基麦芽糖苷。
[0134]
本例采用的通式ii所示结构的非离子型表面活性剂,其通式结构如下:
[0135]r1-r
2-(ch2ch2o)
m-h
ꢀꢀꢀ
(ii)
[0136]
其中,r1为c8-c23的烷基,r2为-o-、或-coo-,m为10~50的整数。
[0137]
本例具体采用的通式ii所示结构的非离子型表面活性剂为聚氧乙烯(23)十六烷基醚。本例具体采用的有机酸盐为柠檬酸钠。
[0138]
本例将第一试剂和第二试剂混合制成溶血染色反应液,直接用于待测血液样本处理。
[0139]
本例的溶血染色反应液中,各组分浓度如下:
[0140][0141]
将新鲜血20微升加入到上述配制的溶血染色反应液1ml中,在45℃条件下孵育60秒后用流式细胞仪(迈瑞bricyte e6)收集数据(激发波长633nm)设置增益为500,采集90度侧向荧光信号收集荧光染色信息,根据荧光强度信息区分血小板和白细胞。进一步的,还可同时采集90度的侧向散射光强度信息,结合荧光强度信息,获得散点图,从散点图中划分血小板区域和白细胞区域,并对白细胞进行分类和各类白细胞的计数。
[0142]
作为对比,本例采用常规的人工镜检计数统计血小板浓度。
[0143]
结果如图5和图6所示,其中,图5为粒子荧光信号分布图,图6为白细胞分类的散点图。从图表5和图6可以看出,红细胞碎片、血小板(plt)及白细胞的区分度较大,结合流式细胞仪的进样量,可以计算出该样本的plt的浓度分别为154
×
109/l;而利用参考方法,通过人工镜检计数得出其plt的浓度为161
×
109/l,与流式细胞仪中的计算数值具有较好的一致性。同时结合散射光信号,可以实现对白细胞(wbc)的分类与计数,如图6所示,结合流式细胞仪的进样量,可以计算出该样本的wbc的浓度分别为4.1
×
109/l,淋巴细胞、单核细胞、中性粒细胞及嗜酸性细胞的比例分别为41%、6.6%、44%、8.4%;而利用参考方法,通过人工镜检计数得出其wbc的浓度为4.5
×
109/l,淋巴细胞、单核细胞、中性粒细胞及嗜酸性细胞的比例分别为43%、7%、43%、7%。
[0144]
由此可见,本例的试剂能够在溶血情况下可以仅仅通过荧光强度信息有效的区分红细胞碎片、血小板和白细胞,实现血小板和白细胞的区分和计数;结合散射光强度信息还能够实现白细胞的分类和分类后的各种白细胞的计数。
[0145]
实施例四
[0146]
本例的试剂包括第一试剂和第二试剂,其中,第一试剂为溶血试剂,包括溶血剂、通式ii所示结构的非离子型表面活性剂和有机酸盐,采用tris缓冲液;第二试剂为糖蛋白特异性染料,本例采用的是麦胚芽素荧光标记染料,具体为cy5-wheat germ agglutinin。
[0147]
本例的溶血剂可以是常规的具有溶血功能的试剂,例如常规的阳离子表面活性剂、非离子表面活性剂、阴离子表面活性剂、两性离子表面活性剂。其中,作为溶血剂的非离子表面活性剂是指除通式ii所示结构的非离子型表面活性剂以外的其它非离子表面活性剂。本例具体采用的溶血剂是八烷基麦芽糖苷。
[0148]
本例采用的通式ii所示结构的非离子型表面活性剂,其通式结构如下:
[0149]r1-r
2-(ch2ch2o)
m-h
ꢀꢀꢀꢀ
(ii)
[0150]
其中,r1为c8-c23的烷基,r2为-o-、或-coo-,m为10~50的整数。
[0151]
本例具体采用的通式ii所示结构的非离子型表面活性剂为聚氧乙烯(23)十六烷基醚。本例具体采用的有机酸盐为柠檬酸钠。
[0152]
本例将第一试剂和第二试剂混合制成溶血染色反应液,直接用于待测血液样本处理。
[0153]
本例的溶血染色反应液中,各组分浓度如下:
[0154][0155][0156]
将新鲜血20微升加入到上述配制的溶血染色反应液1ml中,在45℃条件下孵育60秒后用流式细胞仪(迈瑞bricyte e6)收集数据(激发波长633nm)设置增益为500,采集90度
侧向荧光信号收集荧光染色信息,根据荧光强度信息区分血小板和白细胞。进一步的,还可同时采集90度的侧向散射光强度信息,结合荧光强度信息,获得散点图,从散点图中划分血小板区域和白细胞区域,并对白细胞进行分类和各类白细胞的计数。
[0157]
作为对比,本例采用常规的人工镜检计数统计血小板浓度。
[0158]
结果如图7至图8所示,其中,图7为粒子荧光信号分布图,图8为白细胞分类的散点图。从图表7可以看出,红细胞碎片、血小板(plt)及白细胞的区分度较大,结合流式细胞仪的进样量,可以计算出该样本的plt的浓度分别为132
×
109/l;而利用参考方法,通过人工镜检计数得出其plt的浓度为128
×
109/l,与流式细胞仪中的计算数值具有较好的一致性。同时结合散射光信号,可以实现对白细胞(wbc)的分类与计数,如图8所示,结合流式细胞仪的进样量,可以计算出该样本的wbc的浓度分别为5.3
×
109/l,淋巴细胞、单核细胞、中性粒细胞及嗜酸性细胞的比例分别为35%、7.6%、42.5%、14.9%;而利用参考方法,通过人工镜检计数得出其wbc的浓度为5.2
×
109/l,淋巴细胞、单核细胞、中性粒细胞及嗜酸性细胞的比例分别为34%、8.1%、43%、14.9%。
[0159]
由此可见,本例的试剂能够在溶血情况下可以仅仅通过荧光强度信息有效的区分红细胞碎片、血小板和白细胞,实现血小板和白细胞的区分和计数;结合散射光强度信息还能够实现白细胞的分类和分类后的各种白细胞的计数。
[0160]
实施例五
[0161]
本例采用实施例四的试剂和检测方法,对15支新鲜血样本进行检测;将相同的样本放置于迈瑞6800仪器中测试(使用6800仪器配套的试剂),记录仪器给出的plt浓度;计算实施例四的检测方法获得的plt浓度与迈瑞6800仪器给出的plt浓度的相关性。
[0162]
具体的,选取15支新鲜血样本,每支血样分别取20微升加入到上述实施例四配制的溶血染色反应液1ml中,在45℃条件下孵育60秒后用流式细胞仪收集数据(迈瑞bricyte e6,激发波长633nm)设置增益为500,采集90度侧向荧光信号收集荧光染色信息,根据荧光强度信息区分血小板和白细胞。通过手动划分plt的比例,以及流式细胞仪的进样量,计算出各样本的plt浓度的浓度。将相同的样本放置于迈瑞6800仪器中测试,记录仪器给出的plt浓度,分别作出plt的相关性图。结果如图9所示。
[0163]
图9的结果显示,与6800仪器测试结果相比,染料在溶血状态下,能够对plt进行区分染色,并能够对相关粒子进行计数,其计数结果与6800的测试结果具有很好的相关性。
[0164]
以上内容是结合具体的实施方式对本技术所作的进一步详细说明,不能认定本技术的具体实施只局限于这些说明。对于本技术所属技术领域的普通技术人员来说,在不脱离本技术构思的前提下,还可以做出若干简单推演或替换。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1