肝癌诊断装置的制作方法
1.本发明属于生物领域,具体涉及一种用于肝癌诊断的装置,所述装置以受试体生物样本中的生物标志物水平作为检测指标;本发明还涉及一组可用于肝癌诊断的生物标志物。
背景技术:
2.肝细胞癌(hcc)是肝脏原发性恶性肿瘤,主要发生于慢性肝病和肝硬化患者。hcc目前是全球第三大癌症死亡原因,其中,亚洲和非洲的hcc发病率最高,乙型肝炎和丙型肝炎在该区域内的高流行性使得慢性肝病极易发生并继而发展成为hcc。过去,hcc患者一般呈现右上象限疼痛,体重减轻和肝脏失代偿的晚期症状才被确诊。目前,临床上常用的肝癌诊断金标准为穿刺活检,而此种手段有很大的局限性,如:侵入性检验,抽样误差,病理医师操作和读片误差,等等。其他预测肝癌的方法有:在常规筛查中测量血清甲胎蛋白含量(afp)以提高hcc的早期诊断率。然而,此类技术也有明显的局限性,如敏感性低,特异性差。预计未来几年hcc的威胁将持续增长,因此,探索其他生物学标记物作为早期肝癌的筛选指标,或联合多种生物学标记物进行诊断以提高早起肝癌诊断的敏感性和特异性并减轻患者的穿刺痛苦,势在必行。
技术实现要素:
3.本发明提供一种肝癌诊断装置,所述诊断装置以受试体生物样本中生物标志物水平作为检测指标,可用于多种目的的与肝癌和肝硬化有关的风险评估、筛查和诊断。本发明肝癌诊断装置可采用多种产品形式。本发明还提供所述肝癌诊断装置的使用方法。本发明还提供一组对肝癌和肝硬化具有预测和诊断能力的生物标志物及其应用。
4.以下对本发明所用名词和缩写进行说明:
5.本发明所用名词“诊断”以利于表述目的而使用,但应理解并不限于按照临床标准所定义的“诊断”行为;本发明所述“诊断”,除包括临床标准所定义的“诊断”行为,还包括通过评估本发明所提供的诊断指标从而带来有价值结论的所有过程和行为,包括但不限于以下目的和使用方式:用于评估受试体患有肝癌或肝硬化的风险等级,例如应用于体检中一般筛查;用于高危群体的定期监测;用于评估肝硬化或肝癌治疗药物、或潜在地用于肝硬化或肝癌治疗药物的疗效评价;用于可能导致肝硬化或肝癌风险的物质或治疗手段的评价等,以上以示例目的列举,均包括在本发明所述“诊断”的范围。
6.相应地,本发明所述诊断装置,其使用目的可以包括但不限于受试体肝癌或肝硬化早期评估、体检中一般筛查、临床诊断和药物评价,可以单独使用得出相应结论,也可与其他检测设备或检测指标(如甲胎蛋白)相结合进行诊断。有实施例表明,本发明诊断装置与甲胎蛋白联合使用时,可提高临床诊断的精确度和可靠性。
7.本发明中诊断指标包括经过对原始数据进行计算得到的比值,在本说明书中以“/”表示,例如,牛磺鹅去氧胆酸/甘氨鹅去氧胆酸表示牛磺鹅去氧胆酸和甘氨鹅去氧胆酸
的比值,按照本领域一般技术人员的理解,其应是两种物质基于相同样本、相同检测方法和相同单位的值的比值。
8.除非本说明书其他部分另有定义,在本说明书中使用的所有技术和科学术语均具有与本发明所属技术领域的一般技术人员通常理解一样的含义。如本说明书及所附权利要求中使用的,单数形式“一”及“该”包括多于一个的所提及对象,除非内容明确指示不同于此的含义。例如,提及“组分”时包括一个或一个以上的组分的组合等。
9.除非本说明书其他部分另有定义,本发明中所采用的缩写具有以下含义:hcc:肝细胞癌
10.cld:慢性肝病
11.hbv:乙型肝炎病毒
12.ca:胆酸
13.tca:牛磺鹅胆酸
14.tcdca:牛磺鹅去氧胆酸
15.gca:甘氨胆酸
16.dca:去氧胆酸
17.lca:石胆酸
18.cdca:鹅去氧胆酸
19.udca:熊去氧胆酸
20.gcdca:甘氨鹅去氧胆酸
21.本发明通过以下技术方案实现:
22.本发明第一方面提供一种肝癌诊断装置,所述装置以测定受试体生物样本中的生物标志物水平作为诊断指标,所述生物标志物水平选自牛磺胆酸、牛磺鹅去氧胆酸、甘氨胆酸、甘氨鹅去氧胆酸、反亚油酸(c18:2n6t)、麦芽三糖、麦芽糖和/或乳糖、α-亚麻酸、
23.β-丙氨酸、葵二酸、2-甲基戊酸、戊酸、异戊酸、己酸中之一种或多种的水平;和/或次级胆汁酸和初级胆汁酸的比值、和/或甘氨酸结合初级胆汁酸和牛磺酸结合初级胆汁酸的比值;所述初级胆汁酸选自胆酸、鹅去氧胆酸,所述次级胆汁酸包括去氧胆酸、石胆酸、熊去氧胆酸。
24.以上诊断指标可以单独或组合使用,例如:作为具体实施例,所述生物标志物水平选自牛磺胆酸、牛磺鹅去氧胆酸、甘氨胆酸、甘氨鹅去氧胆酸、反亚油酸(c18:2n6t)之一种或多种的水平;作为具体实施例,所述次级胆汁酸和初级胆汁酸的比值可以选自去氧胆酸/胆酸,石胆酸/鹅去氧胆酸,熊去氧胆酸/鹅去氧胆酸;作为具体实施例,甘氨酸结合初级胆汁酸和牛磺酸结合初级胆汁酸的比值可以选自牛磺鹅去氧胆酸/甘氨鹅去氧胆酸。
25.本发明的诊断指标可进一步包括甲胎蛋白,在本发明实施例中证明,当本发明诊断指标与甲胎蛋白联合使用时,在预测和区分健康人、慢性肝病、肝硬化和肝癌时,取得了比单独使用甲胎蛋白具有更好的诊断效果。
26.本发明肝癌诊断装置可选择哺乳动物作为受试体,例如人类;所采用的生物样本可以是尿液样本和血液样本,当采用血液样本时,可采用外周血的全血、血浆或血清。在本发明中选择受试体的外周血的血清作为检测样本。
27.所述生物标记物水平的测定以定量检测为目的,可包括以下步骤:对受试者的生
物样本进行处理后,以色谱质谱联用代谢组学分析方法对生物样本中的生物标志物组合进行定量检测,所述色谱质谱联用代谢组学分析方法包括液相色谱质谱联用代谢组学分析方法和气相色谱质谱联用代谢组学分析方法。
28.本发明所述诊断装置可采用多种产品形式,作为示例目的,可选自试剂盒、医疗器械、具有诊断模块的计算机系统和具有诊断模块的检测装置。所述医疗器械、试剂盒等,如本领域一般技术人员所知,其定义与当地政府相关法律法规和政策的规定有关,其在不同国家地区有不同分类方法和含义。本发明所述医疗器械、试剂盒等名词,仅为说明本发明诊断标志物的应用形式,并非严格的法律法规定义之下的含义;只要与本发明目的相一致,所述医疗器械、试剂盒可以为经相关政府部门注册的医疗产品,也可以是本领域一般技术人员以临时应用的方式和形式进行使用的产品或产品组合。
29.作为具体实施例,本发明所述诊断装置包括以及模块:
30.(1)用于接收检测对象的检测样品的模块;
31.(2)检测诊断标志物表达水平的数据的模块;
32.(3)基于向数据库输入作为诊断指标的生物标志物的表达水平来产生风险评分的模块,所述数据库包含与检测样本和检测方法相关的对照表达谱;所述对照表达谱根据检测样本和检测方法而事先得出,可表达为检测的诊断标志物的截断值;进行风险评估是将测试样本中生物标志物的表达水平与预先设定的截断值相比较,高于截断值可认为是检测对象具有相应风险。
33.以下以试剂盒和计算机系统为例对本发明诊断装置进行举例目的的说明。
34.(一)试剂盒
35.作为具体实施例,本发明诊断装置可采用试剂盒形式,所述试剂盒包含检测诊断指标的定量检测试剂。作为示例目的,例如实施例中所述的定量检测试剂,以及进一步还可包括内标物、生物样本提取试剂,以及进一步包括可用于统计和评估检测结果的软件。所述软件可内置于计算机内运行。
36.(二)计算机系统
37.作为具体实施例,本发明诊断装置可以是具有诊断模块的计算机系统和具有诊断模块的检测装置,所述诊断模块包括信息获取模块和肝癌诊断模块;其中,所述信息获取模块至少用于获取诊断指标信息;所述肝癌诊断模块至少用于执行以下操作:根据所述信息获取模块获取的诊断指标信息,评估受试者体是否患有肝癌或肝硬化。
38.本发明第二方面提供用于肝癌诊断的生物标志物组合,包括牛磺胆酸、牛磺鹅去氧胆酸、甘氨胆酸、甘氨鹅去氧胆酸、反亚油酸(c18:2n6t)、麦芽三糖、麦芽糖和/或乳糖、α-亚麻酸、β-丙氨酸、葵二酸、2-甲基戊酸、戊酸、异戊酸、己酸中之一种或多种。这些生物标志物或其组合可以任选地与甲胎蛋白联合使用,可以提高诊断效果。
39.本发明还提供了上述可用于肝癌诊断的生物标志物的定量检测方法。
40.本发明有益的技术效果
41.本发明提供了具有特定检测指标的肝癌检测装置,通过对其检测指标的检测可以预测和诊断肝癌和肝硬化患者。本发明检测装置所采用的检测指标具有优良的区分能力,可以单独使用,或通过多个指标联合检测,提高检测效果的可靠性;并且可区分肝硬化和肝癌。当与临床常用肝癌检测指标甲胎蛋白联合使用时,显著提高了甲胎蛋白的诊断效果。
42.为使本发明的目的、技术方案及效果更加清楚、明确,以下结合附图并通过实施例对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
附图说明
43.附图1为实施例五诊断图
44.附图2为实施例六诊断图
具体实施例
45.下面将结合本发明具体实施例及附图,对本发明的技术方案进行详细地描述。显然,本部分所描述的具体实施例仅仅是实现本发明技术方案的一部分实施例,而不应理解为全部的实施方式。应当理解,本部分所描述的具体实施例仅用以解释本发明,并不用于限定本发明。基于本部分实施例,本领域一般技术人员可基于其启示,在没有进行创造性劳动前提下所能够获得的所有其他实施方式,都应属于本发明保护的范围。
46.实施例一 生物标志物研究
47.本实施例共入组1755名受试者。在训练集和测试集中,使用超高效液相色谱技术检测了422例健康人,433例经肝穿刺活检确诊的慢性肝病(cld)患者和900例经肝组织病理确诊的hcc患者空腹(12小时)血清/血浆标本中包括胆汁酸、脂肪酸、有机酸、糖类和氨基酸等代谢物的含量,以及相应临床指标的检测。本发明中的试验样本得到本地伦理委员会的批准并获得所有受试者的知情同意书。
48.(一)血清样本的采集和制备
49.采集空腹静脉血5ml置塑料离心管中。
50.血清制备:
51.1)缓慢颠转血清制备管5次。
52.2)在室温下(大约25摄氏度),将试管垂直置于试管架上1.5小时。
53.3)将试管在2500rpm转速下离心10分钟(4摄氏度)。
54.4)将上清(约2.5毫升)用移液器分装到塑料离心管(eppendorf,1.5ml离心管)中,每只冻存管0.5ml血清。
55.5)在离心管上标好样品号码。
56.6)迅速放入-80摄氏度冰箱。
57.(二)血清临床指标检测:
58.使用lh750血液学分析仪和synchron dxc800临床系统(beckman coulter,美国)根据制造商的试验方案进行血液学和生物化学检测;使用化学发光免疫分析仪(lumo,shinova systems,上海,中国)进行血液透明质酸和层粘连蛋白的检测;使用凝血功能测量仪(stago compact,diagnostica stago,法国)进行凝血功能的检测;使用实时聚合酶链式反应系统(lightcycler 480,roche,美国)进行血液hbv-dna检测。
59.(三)血清样本的胆酸检测:
60.样本制备:取100μl血清于1.5ml的离心管中,加入150μl甲醇(含内标,50nm氘代-ca(胆酸),氘代-udca(熊去氧胆酸),氘代-lca(石胆酸))。漩涡震荡混匀10分钟,静置10分
钟,然后4度13500转离心20分钟,取上清液进行uplc-tqms(超高效液相色谱-三重四级杆质谱)分析。
61.分析仪器测试:uplc-tqms:采用沃特斯超高效液相色谱系统(沃特斯公司,美国),配备二元溶剂控制器和样本控制室。采用沃特斯xevo三重四级杆质谱仪(沃特斯公司,美国),配备双电喷雾离子源。
62.色谱条件:采用uplc beh c18色谱柱(100mm
×
2.1mm,1.7μm);柱温45℃;流动相a:水(0.1%甲酸),b:乙腈(0.1%甲酸,);流速为0.4ml/min;进样量为5ul;梯度洗脱条件:0-1min(5%b),1-5min(5-25%b),5-15.5min(25-40%b),15.5-17.5min(40-95%b),17.5-19min(95%b),19-19.5min(95-5%b),19.6-21min(5%b)。质谱条件:电喷雾离子源采用负离子扫描模式(esi-),具体条件如下:毛细管电压1.2kv,锥孔电压55v,萃取锥孔电压4v,离子源温度150℃,脱溶剂气温度550℃,反向锥孔气流50l/h,脱溶剂气650l/h,低质量区分辨率4.7,高质量区分辨率15,多反应检测模式采集数据。
63.(四)血清样本游离脂肪酸的检测:
64.样本制备:取血清30μl,加入异丙醇/正己烷/2m磷酸(40:10:1)500微升及同位素标记的c19:0-d37内标溶液(5ug/ml)10微升,涡旋2min,室温静置20min。加入正己烷400微升,水300微升,涡旋2min,12000rpm离心5min,取上清400微升;剩余液中加入正己烷400微升,涡旋2min,12000rpm离心5min,取上清400微升。合并上清,室温下真空干燥。在干燥后的离心管中加入80微升甲醇复溶后分析。
65.分析仪器测试:uplc-tqms:采用沃特斯超高效液相色谱系统(沃特斯公司,美国),配备二元溶剂控制器和样本控制室。采用沃特斯xevo三重四级杆质谱仪(沃特斯公司,美国),配备双电喷雾离子源。
66.色谱条件:采用uplc beh c18色谱柱(100mm
×
2.1mm,1.7um);柱温40℃;流动相a为水,流动相b为乙腈/异丙醇(体积比为8:2);流速为0.4ml/min;进样量为5ul;梯度洗脱条件:0-2min:70%b,2-5min:70%-75%b,5-10min:75%-80%b,10-13min:80%-90%b,13-16min:90%-100%b,16-21min:100%b,21-22.5min:100%-70%b,22.5-24min:70%b。总分析时间为24min。
67.质谱条件:电喷雾离子源采用负离子扫描模式(esi-),具体条件如下:毛细管电压2.5kv,锥孔电压55v,萃取锥孔电压4v,离子源温度120℃,脱溶剂气温度450℃,反向锥孔气流50l/h,脱溶剂气650l/h,低质量区分辨率4.7,高质量区分辨率15,检测器电压2390v,扫描时间0.35s,扫描时间间隔0.02s,质荷比范围:m/z 50-1000。锁定质量数为554.2615。
68.(五)血清样本的氨基酸检测:
69.样本制备:取血清40μl,加入500μl甲醇乙腈混合溶剂(1:9,v:v),涡旋振荡2min;置离心管于-20℃放置10min以促进蛋白沉淀,12000rpm4℃离心15min。取上清20μl,室温下真空干燥。在干燥后的离心管中加入100μl甲醇水混合溶剂(1:1,v:v,含1μg/ml二氯苯丙氨酸作为内标)复溶后分析。
70.分析仪器测试:uplc-tqms:采用沃特斯超高效液相色谱系统(沃特斯公司,美国),配备二元溶剂控制器和样本控制室。采用沃特斯xevo三重四级杆质谱仪(沃特斯公司,美国),配备双电喷雾离子源。
71.色谱条件:采用uplc beh c18色谱柱(100mm
×
2.1mm,1.7μm);柱温40℃;流动相a:
水(0.1%甲酸),b:乙腈(0.1%甲酸,);流速为0.4ml/min;进样量为5ul;梯度洗脱条件:0-0.5min(1%b),0.5-9min(1-20%b),9-11min(20-75%b),11-16min(75-99%b),16-16.5min(99%b)。
72.质谱条件:电喷雾离子源采用负离子扫描模式(esi-),具体条件如下:毛细管电压3.0,锥孔电压55v,萃取锥孔电压4v,离子源温度150℃,脱溶剂气温度450℃,反向锥孔气流50l/h,脱溶剂气800l/h,低质量区分辨率4.7,高质量区分辨率15,多反应检测模式采集数据。
73.(六)血清样本甘油三酯的检测:
74.血清甘油三酯的检测采用酶比色法测定。
75.(七)肝脏活检
76.所有患者都实施了超声引导下肝脏穿刺活检。采用“7点”基线取材法,在肿瘤的12点、3点、6点和9点位置上于癌与癌旁肝组织交界处取材按1:1取材;在肿瘤内部至少取材1块;对距肿瘤边缘≤1cm(近癌旁)和>1cm(远癌旁)范围内的肝组织分别取材1块,用10%福尔马林固定12~24小时,石蜡包埋,组织切片用苏木精-伊红染色和masson染色。病理评估由复旦大学上海医学院三位病理专家分别盲法独立评估,结果用kappa检验验证一致性。当评估结果未通过kappa检验时,重新分析样本以达成一致的结果。
77.(八)生物信息学方法
78.本发明将422例健康人,433例cld患者和900例hcc患者按70%和30%的比例随机分为训练集和测试集。在训练集中,为了区分健康人和hcc患者、cld患者和hcc患者,我们使用单因素wilcoxon秩和检验和lasso来挑选和鉴定候选的生物标记物,并用随机森林模型来评价候选变量并建立模型,后在测试集和独立验证集中分别验证以上模型。
79.通过以上研究,发现一组生物标志物包括牛磺胆酸、牛磺鹅去氧胆酸、甘氨胆酸、甘氨鹅去氧胆酸、反亚油酸(c18:2n6t)、麦芽三糖、麦芽糖和/或乳糖、α-亚麻酸、β-丙氨酸、葵二酸、2-甲基戊酸、戊酸、异戊酸、己酸中之一种或多种的水平具有预测和诊断能力;以及次级胆汁酸和初级胆汁酸的比值、和/或甘氨酸结合初级胆汁酸/牛磺酸结合初级胆汁酸的比值也具有预测和诊断能力;所述初级胆汁酸选自胆酸、鹅去氧胆酸,所述次级胆汁酸包括去氧胆酸、石胆酸、熊去氧胆酸。
80.实施例二 诊断标志物浓度的定量检测
81.以待测诊断标志物的标准品溶液的浓度与对应的待测诊断标志物以及与待测诊断标志物一样的稳定同位素内标面积比绘制标准曲线,采用同位素内标定量测定。同时通过样品添加同位素内标对样品检测过程进行质量控制。
82.检测方法参照实施例一。
83.实施例三 区分健康对照和hcc
84.训练集中630例hcc患者和296例健康人,测试集中270例hcc患者和126例健康人,利用在实施例一中得到的生物标志物,在训练集中训练的生物标记物组合随机森林模型,可输出上述受试者患hcc的可能性,并通过roc分析中的约登最优点找到最佳截断值,可评估该模型对于区分hcc患者和健康人的总能力。对测试集进行测试,结果见表1和表2。
85.表1 roc曲线下面积和置信区间
86.87.[0088][0089]
表2
[0090]
[0091]
[0092][0093]
实施例四 区分肝硬化和hcc
[0094]
训练集中630例hcc患者和303例肝硬化患者,测试集中270例hcc患者和130例肝硬化患者,利用在实施例一获得的生物标志中,训练集中训练的生物标记物组合随机森林模型,可输出上述受试者患hcc的可能性,并通过roc分析中的约登最优点找到最佳截断值,可评估该模型对于区分hcc患者和健康人的总能力。对测试集进行测试,结果见表3和表4。
[0095]
表3
[0096]
[0097]
[0098][0099]
表4
[0100]
[0101]
[0102][0103]
实施例五:生物标记物组合牛磺胆酸、牛磺鹅去氧胆酸、甘氨胆酸、反亚油酸(c18:2n6t)区分健康组和hcc组
[0104]
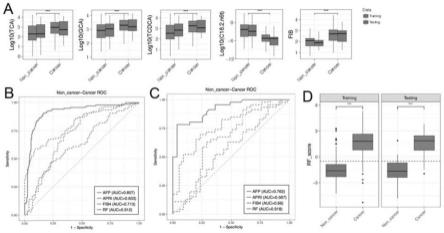
训练集中例630hcc患者和296例健康人,测试集中例270hcc患者和126例健康人,利用在训练集中训练的上述生物标记物组合随机森林模型,可输出上述受试者患hcc的可能性,并通过roc分析中的约登最优点找到最佳截断值,可评估该模型对于区分hcc患者和健康人的总能力。结果见附图1和表5。训练集中roc曲线下面积和95%置信区间为1.000(95%ci 0.999-1.000),最佳截断值为0.078,最佳截断值处的灵敏度和特异性百分比分别为99.7%和100%;测试集中roc曲线下面积和95%置信区间为1.000(95%ci 0.999-1.000),最佳截断值为0.078,最佳截断值处的灵敏度和特异性百分比分别为99.2%和100%。如所述对象测定标志物水平,将这些测定值带入随机森林模型后,如果个体得分阈值大于0.078,表明此个体具有较高的患hcc风险;如果个体得分阈值小于0.078,表明此个体具有较低的患hcc风险。
[0105]
表5:生物标记物组合的诊断能力
[0106][0107][0108]
实施例六:生物标记物组合牛磺胆酸、牛磺鹅去氧胆酸、甘氨胆酸、反亚油酸(c18:2n6t)区分cld组和hcc组
[0109]
训练集中例630hcc患者和303例cld患者,测试集中例303hcc患者和130例cld患者,利用在训练集中训练的生物标记物组合随机森林模型,可输出上述受试者患hcc的可能性,并通过roc分析中的约登最优点找到最佳截断值,可评估该模型对于区分hcc患者和cld患者的总能力。结果见附图2和表6。训练集中roc曲线下面积和95%置信区间为0.912(95%ci 0.874-0.946),最佳截断值为-0.502,最佳截断值处的灵敏度和特异性百分比分别为83.6%和90.6%;测试集中roc曲线下面积和95%置信区间为0.918,最佳截断值为-0.502,最佳截断值处的灵敏度和特异性百分比分别为81.8%和80.4%。如所述对象测定标志物水平,将这些测定值带入随机森林模型后,如果个体得分阈值大于-0.502,表明此个体具有较高的患hcc风险;如果个体得分阈值小于-0.502,表明此个体具有较低的患hcc风险。
[0110]
表6:生物标记物组合的诊断能力
[0111]
[0112]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1